Использование полимеразной цепной реакции для детекции вируса алеутской болезни норок
Автор: Мартыненко М.В.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Методика
Статья в выпуске: 6 т.39, 2004 года.
Бесплатный доступ
Разрабатывали ПЦР-систему диагностики дальневосточного изолята вируса алеутской болезни норок в образцах сыворотки крови. Оценивали эффективность полимеразной цепной реакции (ПЦР) по сравнению с иммуноэлектроосмофорезом (РИЭОФ) для детекции вируса.
Короткий адрес: https://sciup.org/142133017
IDR: 142133017 | УДК: 578.822.2:577.2:57.088
Текст научной статьи Использование полимеразной цепной реакции для детекции вируса алеутской болезни норок
Промышленное пушное звероводство является высокоприбыльной отраслью животноводства, однако частые эпизоотии значительно снижают рентабельность за счет ухудшения качества меха, снижения плодовитости зверей, высокой смертности молодняка. Например, в одном из лучших зверохозяйств Приморского края ЗАО «Подгородненский» заболеваемость норок составляла в 1997, 1998, 1999, 2000 и 2001 годах соответственно 0,65; 0,83; 1,97; 21,27 и 71,70 %; такая тенденция привела к массовому убою животных (2).
На сегодняшний день известно, что норки практически всех пород восприимчивы к этому вирусу, однако особи с гомозиготным рецессивным геном окраски (алеутские, сапфировые, голубые, жемчужные) заболевают чаще и тяжелее переносят болезнь, чем животные темно-коричневой окраски (3). Заболевание может протекать в острой, хронической или латентной форме. Чаще всего у инфицированных животных снижается прирост живой массы (хотя аппетит может сохраняться, но в фекалиях появляются непереваренные частицы корма), наблюдается вялость, повышение температуры тела, угасание воспроизводительной функции. На прогрессирующей стадии болезни возникают кровотечения из ротовой полости, анемия, нарушение равновесия, паралич. Заболевание заканчивается гибелью зверей в коматозном состоянии. При остром развитии инфекционного процесса смерть наступает в течение первых 2 мес после заражения, тогда как при латентной и хронической форме — в течение 2 лет (4). ВАБН стимулирует пролиферацию плазматических клеток, вырабатывающих антитела, которые неспособны его нейтрализовать, что и является причиной неэффективности традиционных вакцин на основе инактивированного вируса, а, напротив, вызывают поражение почек. Более того, ставится под сомнение целесообразность применения реакции иммуноэлектроосмофореза (РИЭОФ) для диагностики ВАБН у животных, так как поствакцинальные антитела также дают положительный результат (5).
Учитывая тот факт, что в настоящее время отсутствуют вакцины для профилактики алеутской болезни норок, в хозяйствах для оздоровления стада следует производить выбраковку и изоляцию зараженных животных. При этом максимальный положительный эффект достигается при индикации возбудителя на ранних стадиях, что требует применения высокочувствительных диагностических тестов, к которым сегодня относят полимеразную цепную реакцию (ПЦР). Однако до сих пор практической значимости не утратила, не лишенная многих недостатков, реакция иммуно-электроосмофореза (РИЭОФ), предложенная еще в 1978 году для диагностики алеутской болезни норок главным ветеринарным врачом зверосовхоза «Пушкинский» Слугиным (6).
В задачу наших исследований входила разработка ПЦР-системы диагностики дальневосточного изолята ВАБН и оценка ее эффективности по сравнению с
РИЭОФ.
Описание методики. П о с т а н о в к а Р И Э О Ф. Материалом для исследования служили органы и сыворотка крови норок, полученные из сельскохозяйственного научно-производственного центра ЗАО «Подгородненский» (г. Артем, Приморский край), которые хранили при температуре –20 оС. Для отделения сыворотки стеклянный капилляр заполняют кровью, выступающей после срезания ножницами половинки когтя задней лапки норки. Один конец капилляра закрывают пластилином и центрифугируют при 1500 об/мин в течение 10 мин для отделения эритроцитов. После взятия каждой пробы крови инструмент стерилизуют.
Для реакции использовали пластины, содержащие 0,7 % агарозу (Sigma) в 0,03 М барбитал-ацетатном буфере (рН 8,6). Антигеном служила ВАБН-содержащая суспензия диагностикумов производства АО «Ветзвероцентр» (Москва) и ТОО «ИМГЕН» (Новосибирск). Электрофорез проводили в горизонтальной камере в течение 20 мин при напряжении 100 В; результаты оценивали визуально по появлению полос преципитации.
Из 1000 образцов сыворотки крови при постановке РИЭОФ с антигеном производства АО «Ветзвероцентр» 116 дали положительную реакцию. При повторном обследовании через 30 сут у 28 животных с отрицательным результатом была выявлена положительная реакция. При постановке РИЭОФ с антигеном производства ТОО «ИМГЕН» у 14 животных, вакцинированных против вируса энтерита норок (также относится к роду Parvovirus ), выявлены «ложно» положительные результаты. Появление перекрестной реакции связано с тем, что антиген для серологической диагностики ВАБН готовится в той же культуре клеток, что и вакцина. Отмечено также, что титр вирусспецифических антител в контрольной сыворотке этого производителя резко снижается и препарат становится непригодным до истечения гарантийного срока хранения (12 мес).
П о с т а н о в к а П Ц Р. Реакционная смесь объемом 25 мкл содержала буфер (0,01 М трис-HCl, рН 8,4; 0,0015 М MgCl 2 ; 0,05 М KCl; 0,01 % желатин; 0,1 % Тритон Х-100); праймеры (по 5 пМ); дезоксинуклеозидтрифосфаты (по 0,0002 М) и 0,2 е.а. Taq-полимеразы (СибЭнзим, Россия). Амплификацию осуществляли в термоциклере UNO II 48 (Biometra, Германия). Для ПЦР-амплификации использовали праймеры, предложенные Bloom с соавт. (7): RADV — 5 ′ -CTTGTCACGCTACTAGAATGGT-3 ′ и F ADV — 5 ′ -AGCTTAAGGTTAGTTTACATGGTTTACT-3 ′ , располагающиеся в позициях соответственно 2587-2609 и 3251-3279 и комплиментарные наиболее консервативным участкам генома ВАБН.
ПЦР-амплификацию проводили в следующем режиме: денатурация 5 мин при 95 оС (1 цикл), денатурация 1 мин при 95 оС, отжиг праймеров 1 мин при 50 оС, элонгация 1 мин при 72 оС (35 циклов) и заключительный цикл элонгации 10 мин при 72 оС. В качестве отрицательного контроля использовали ДНК сыворотки крови здоровой норки и амплификационную смесь без добавления ДНК (бланк-контроль).
Для оценки пригодности выбранных праймеров для диагностики ВАБН, циркулирующего на Дальнем Востоке России, а также разработки метода в качестве матрицы в ПЦР использовали суммарную клеточную ДНК, полученную методом фенольной депротеинизации в сочетании с протеиназой К из органов инфицированных животных, так как метод обеспечивал получение биопроб высокой чистоты. При ПЦР с ДНК (в количестве 10 нг) инфицированной норки наблюдается амплификация фрагмента, длина которого соответствует расчетной (692 п.н.) (рис.).
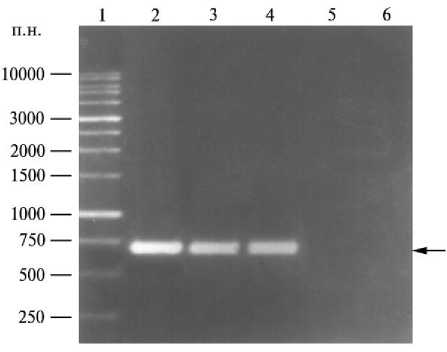
Электрофореграмма препарата различных образцов сыворотки крови норки: 1 — 1 Kb ДНК-маркеры; 2 — фрагмент суммарной ДНК, выделенной из селезенки норки, инфицированной дальневосточным изолятом вируса алеутской болезни норок (ВАБН); 3, 4 — инфицированная ВАБН сыворотка крови, обработанная методом щелочного лизиса; 5 — сыворотка крови здоровой особи; 6 — бланк-контроль. Стрелка указывает на идентификацию ВАБН посредством использования ПЦР-системы.
Однако для массового использования это довольно трудоемкий метод, требующий токсичных реагентов. В связи с этим мы испытывали два метода подготовки биоматериала на основе сыворотки крови норок: термический и щелочной лизис (8, 9). При использовании 2,5 мкл сыворотки, подготовленной посредством термического лизиса (инкубирование 5 мкл сыворотки при 70 оС в течение 45 с), в 25 мкл реакционной смеси нам не удалось получить ни одной по- ложительной реакции. Изменение количества вносимой биопробы от 0,5 до 5 мкл не повлияло на результат. Однако сыворотки крови норок, которые применяли для постановки ПЦР, давали положительную реакцию в РИЭОФ, а у животных наблюдались клинические признаки алеутской болезни. Вероятно, отрицательный результат при выявлении ВАБН испы- танным методом связан с присутствием в пробах потенциальных ингибиторов Taq-
полимеразы: γ -глобулинов, лактоферина и, возможно, гемоглобина (10).
Метод щелочного лизиса (кипячение 5 мкл сыворотки в течение 5 мин с добавлением 17 мкл 0,1 М NaOH и последующим центрифугированием при 10000 g в течение 2 мин) позволял при использовании в ПЦР 5 мкл готовой биопробы идентифицировать специфический фрагмент ДНК вируса. Тестирование метода на чувстви- тельность показало, что при таких условиях вирус успешно выявляется не только в цельной сыворотке, но и при ее разведении до 1:64. При анализе сывороток, обработанных предложенным методом, из 1000 образцов амплификацию целевого фрагмента ДНК регистрировали в 647 случаях.
Сравнение эффективности диагностики ВАБН методами ПЦР и РИЭОФ показало, что чувствительность ПЦР-системы в 5,5 раза выше, чем РИЭОФ. Об успешном использовании ПЦР-систем диагностики ВАБН других штаммов сообщается в работах ряда авторов (7, 8). Так, Bloom с соавт. удавалось обнаружить до 1 фг ДНК ВАБН (около 10 вирусных частиц) в 2,5 мкл сыворотки при использовании ПЦР для диагностики алеутской болезни, вызванной штаммами ADV-Utah и ADV-TR. Более того, диагностическая значимость ПЦР увеличилась, когда стало известно, что метод позволяет «уловить» вирусную ДНК в корме животных, моче и фекалиях, а соответственно, в загрязненных ими подстилке и почве (11).
Постоянный рост заболеваемости подтверждает ограниченные возможности РИЭОФ для ранней диагностики алеутской болезни норок. Метод основан на индикации противовирусных антител, которые, как отмечено выше, трудно обнаружить в течение 30 сут после инфицирования. В опытах по экспериментальному заражению животных показано, что с помощью ПЦР-системы вирус удается выявить уже на 5-е сут после заражения.
Таким образом, результаты наших исследований свидетельствуют о перспективности использования тест-систем на основе полимеразной цепной реакции для ранней диагностики вируса алеутской болезни норок, что позволит предотвратить распространение вируса.
Л И Т Е Р А Т У Р А
-
1. R e g e n m o r t e l M.H.V., F a u q u e t C.M., B i s h o p D.H.L. e.a. Virus taxonomy: classification and nomenclature of viruses: seventh report of the International Committee on Taxonomy of Viruses. San Diego, 2000: 317-323.
-
2. С л у г и н В.С. Алеутская болезнь норок: распространение и перспективы борьбы с ней. Кролиководство и звероводство, 1998, 4: 24-25.
-
3. H a d l o w W.J., R a c e R.E., K e n n e d y R.C. Comparative pathogenicity of four strains of Aleutian disease virus for pastel and sapphire mink. Infect. Immun., 1983, 41, 3: 1016-1023.
-
4. A a s t e d B. Aleutian disease of mink. In: Virology and immunology. Acta Pathol., Microbiol., Immunol., Scand. Suppl., 1985, 287, 1: 1-47.
-
5. B l o o m M.E., K a n n o H., M o r i S. e.a. Aleutian mink disease: puzzles and paradigms. Infect. Agents Dis., 1994, 3, 6: 279-301.
-
6. С л у г и н В.С. Наставление по применению набора антигена и контрольной сывороток в реакции иммуноэлектроосмофореза для серологической диагностики алеутской болезни норок. Ветеринария, 1978, 2: 114-116.
-
7. B l o o m M.E., O i e K.L., W o l f i n b a r g e r J.B. e.a. Evaluation of the polymerase chain reaction as a tool for diagnosing infections with the Aleutian mink disease parvovirus. Scientifur, 1997, 21, 2: 141-146.
-
8. O i e K.L., D u r r a n t G., W o l f i n b a r g e r J.B. e.a. The relationship between capsid protein (VP2) sequence and pathogenicity of Aleutian mink disease parvovirus (ADV): a possible role for raccoons in the transmission of ADV infections. J. Virol., 1996, 70, 2: 852-861.
-
9. I v i n s o n A.J., T a y l o r G.R. PCR in genetic diagnosis. In: Polymerase chain reaction /Ed. M.J. McPherson e.a. N.Y., 1991: 15-27.
-
10. W a l e e d A. Al-S o u d, R a d s t r 0 m P. Purification and characterization of PCR-inhibitory components in blood cells. J. Clin. Microbiol., 2001, 39, 2: 485-493.
-
11. О б у х о в И.Л., Т я л и н а Ю.Ю., М а к о в а В.М. и др. Диагностика и молекулярно-генетическое типирование возбудителя алеутской болезни норок. Ветеринария, 2003, 10: 22-25.
Биолого-почвенный институт ДВО РАН, Поступила в редакцию 27
690022, Владивосток, просп. 100 лет Владивостоку, 159; сентября 2004 года
S u m m a r y
The PCR-system of diagnostic Far East isolate of Aleutian mink disease virus in samples of blood serum was developed. At carrying out PCR with 5 µl of the sample treated by alkaline lysis of the serum from infected mink was determined that size of amplificated fragment is 692 bp. Under existing conditions the virus is successfully reveal not only in whole serum, but also at its dilution till 1:64. At examination of the sera treated by alkaline lysis from 1000 samples model amplification of the fragment dna is recorded in 647 cases . c omparison of efficiency of diagnostic Aleutian mink disease by PCR and counter immune electrophoresis (CIEP) has shown that the sensitivity designed by us of the PCR-system in 5,5 times.


