1,2,4-триазол-3-карбоксамиды вызывают арест клеток рака яичника в G2/M фазе клеточного цикла
Автор: Жидкова Е.М., Гребенкина Л.Е., Максимова В.П., Григорьева Д.Д., Михина Е.А., Матвеев А.В., Якубовская М.Г., Лесовая Е.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 6 т.23, 2024 года.
Бесплатный доступ
Введение. Рак яичника является одной из наиболее распространенных и трудно поддающихся диагностике и терапии форм злокачественных новообразований у женщин. Экспериментальные данные свидетельствуют о перспективности применения противовирусного препарата рибавирина в отношении рака яичника. Однако для этой молекулы описан также ряд недостатков, в том числе мутагенная и генотоксическая активность. С целью снижения негативных эффектов рибавирина был синтезирован ряд производных агликона рибавирина (1,2,4-триазол-3-карбоксамида, TCA), для которых ранее была показана активность в отношении опухолей кроветворной системы. В нашей работе проведена оценка противоопухолевой активности производных агликона рибавирина, содержащих гетероциклические заместители, в отношении клеток рака яичника. Материал и методы. Цитотоксическое и антипролиферативное действия соединений были оценены на двух клеточных линиях рака яичника (OVCAR3 и OVCAR4) с помощью МТТ-теста и прямого подсчета клеток с окрашиванием трипановым синим. Дополнительно с помощью метода проточной цитофлуориметрии с окрашиванием пропидий йодидом и антителами Annexin V-FITC было проанализировано влияние исследуемых производных рибавирина на индукцию апоптоза и клеточный цикл клеток рака яичника.
Рак яичника, рибавирин, химиотерапия, 1, 2, 4-триазол-3-карбоксамид, клеточный цикл, апоптоз
Короткий адрес: https://sciup.org/140308741
IDR: 140308741 | УДК: 618.11-006.6 | DOI: 10.21294/1814-4861-2024-23-6-81-88
Текст научной статьи 1,2,4-триазол-3-карбоксамиды вызывают арест клеток рака яичника в G2/M фазе клеточного цикла
Рак яичника (РЯ) является одной из наиболее распространенных форм злокачественных новообразований среди женщин в России (4,1 % от общего числа диагностированных злокачественных новообразований (ЗНО) у женского населения на 2022 г.) [1]. В настоящее время основным методом лечения РЯ является резекция в комбинации с системной химиотерапией, которая преимущественно включает комбинации препаратов платины (цисплатин, карбоплатин) и таксанов (доцетаксел, паклитаксел) [2, 3]. Также в лечении РЯ, устойчивого к I линии терапии, широко используются аналоги нуклеозидов, такие как гемцитабин и 5-фторурацил [3–5]. Одним из основных механизмов действия аналогов нуклеозидов является возможность их фосфорилирования под действием нуклеозидкиназ с последующим встраиванием фосфорилированной молекулы в последовательность ДНК, что приводит к ингибированию процесса репликации [3].
Несмотря на эффективность используемых в клинической практике препаратов, поиск новых соединений с высоким терапевтическим индексом сохраняет актуальность. Помимо разработки оригинальных молекул, многие исследования направлены на перепрофилирование одобренных лекарственных препаратов для терапии ЗНО [6]. Так, в последние годы были предприняты попытки перепрофилирования рибавирина (RBV) для использования в терапии ЗНО системы крови, рака молочной железы, печени [7–15], рака яичника [16– 18]. RBV (1-β-D-рибофуранозил)-1,2,4-триазол-3-карбоксамид) – противовирусный препарат, аналог нуклеозида гуанина, обладающий антиметаболи-ческими свойствами. Одним из механизмов действия RBV является прямое взаимодействие его триазольного фрагмента с ферментом биосинтеза пуринов инозин-5’-монофосфатдегидрогеназой (IMPDH) [19]. Другой мишенью рибавирина в клетке является фактор инициации трансляции eIF4E [11, 19, 20], гиперэкспрессия которого ассоциирована с неблагоприятным прогнозом и наблюдается в 30 % опухолей, в том числе в раке яичника [21, 22].
Ранее нами были проведены синтез ряда производных агликона рибавирина (1,2,4-триазол-3-карбоксамида, TCA) и оценка их эффектов in vitro на клеточных моделях опухолей системы крови [23]. Особенностью данного ряда соединений является замена углеводного остатка на тетрагидрофуран или тетрагидропиран (рис. 1). Наблюдаемые селективные цитостатические эффекты TCA и его производных в отношении клеток острого
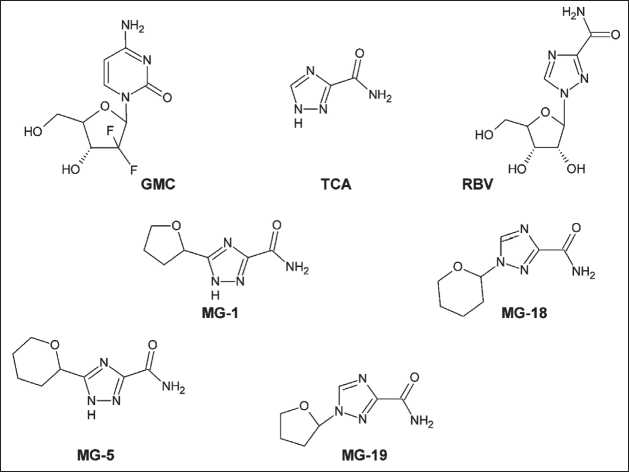
Рис. 1. Структурные формулы исследуемых соединений: гемцитабин (GMC, 2’-дезокси-2’,2’-дифторцитидин); рибавирин (RBV, 1-β-D-рибофуранозил)-1,2,4-триазол-3-карбоксамид); TCA (1,2,4-триазол-3-карбоксамид); MG-1 (5-(тетрагидрофуран-2-ил)-1,2,4-триазол-3-карбоксамид); MG-5 (5-(тетрагидропиран-2-ил)-1,2,4-триазол-3-карбоксамид); MG-18 (1-(тетрагидропиран-2-ил)-1,2,4-триазол-3-карбоксамид); MG-19 (1-(тетрагидро ран-2-ил)-1,2,4-триазол-3-карбоксамид). Примечание: рисунок выполнен авторами
Fig. 1. Chemical structures of compounds: gemcitabine (2’,2’-difluoro 2’deoxycytidine, GMC); ribavirin (1-β-D-ribofuranosyl)-1,2,4-triazole-3-carboxamide, RBV); TCA (1,2,4-triaz-ole-3-carboxamide); MG-1 (5-(tetrahydrofuran-2-yl)-1,2,4-triazole-3-carboxamide); MG-5 (5-(tetrahydropyran-2-yl)-1,2,4-triazole-3-carboxamide); MG-18 (1-(tetrahydropyran-2-yl)-1,2,4-triazol-3-carboxamide) and MG-19 (1-(tetrahydrofuran-2-yl)-1,2,4-triazol-3-carbox-amide). Note: created by the authors лимфобластного и хронического миелоидного лейкозов [23] дают основание полагать, что данное направление химической модификации имеет перспективу в качестве подхода к разработке новых противоопухолевых препаратов. В нашей работе мы провели оценку цитотоксических и антипролиферативных эффектов соединений ряда производных TCA (рис. 1) в отношении клеток рака яичника.
Материал и методы
Культуры клеток
Культуры клеток рака яичника OVCAR3 и OVCAR4 культивировали в среде RPMI-1640 с добавлением 2 мМ L-глутамина, пенициллина (5 ед/мл), стрептомицина (5 мкг/мл) («Панэко», Россия), 10 % фетальной бычьей сыворотки («Bio-west», Франция) и 2 мМ L-глутамина при 37 °С в атмосфере 5 % СО2.
MTT-тест
Клетки высевали в 96-луночные планшеты по 5 000 клеток на лунку, через 24 ч вносили исследуемые соединения в диапазоне концентраций от 16 мкМ до 0,5 мМ или 0,1 % растворителя диметилсульфоксида (DMSO), затем инкубировали 24 ч, после чего вносили 0,25 мг/мл МТТ-реагента («Па-нэко», Россия) и инкубировали еще 3 ч. Затем удаляли культуральную среду, растворяли кристаллы формазана в DMSO и измеряли оптическую плотность на микропланшетном ридере Multiskan FC («Thermo Fisher Scientific», USA) при длине волны 560 нм. Процент клеток в лунках, обработанных растворителем DMSO, принимали за 100 %.
Подсчет жизнеспособных клеток с окрашиванием трипановым синим
Клетки высевали в 24-луночные планшеты по 10 тыс. клеток на лунку. После прикрепления клеток к подложке в культуральную среду вносили исследуемые препараты (0,5 мМ в лунке) или
0,1 % DMSO (контроль растворителя). В качестве контроля был использован цитостатический препарат группы аналогов нуклеозидов гемцитабин (GMC, 10 нМ в лунке). Инкубировали в течение 72 ч при 37 °С в атмосфере 5 % СО2. Затем клетки снимали с подложки раствором трипсина, окрашивали 1:1 раствором трипанового синего (0,4 % в PBS). Количество живых клеток регистрировали с помощью автоматического счетчика ТС-20 («Bio-Rad», США). Число живых клеток в обработанных DMSO образцах принимали за 100 %. Каждая экспериментальная точка была проанализирована в 2 технических и 3 биологических повторах.
Анализ клеточного цикла методом проточной цитофлуориметрии с окрашиванием PI
Клетки высевали в 24-луночные планшеты и обрабатывали, как описано выше. Далее инкубировали в течение 72 ч, снимали с подложки, центрифугировали в охлажденном PBS (1800 об/мин, 4 °C, 5 мин), проводили фиксацию 70 % этиловым спиртом 1–2 ч при 4 °С. Фиксированные клетки отмывали от спирта центрифугированием (2 000 об/мин, 4 °C, 10 мин), промывали PBS (1 800 об/мин, 4 °C, 5 мин) и ресуспендировали осадок в PI-буфере: 0,1 % Тритон-Х100, 0,5 ед./мл Рибонуклеазы А («Биолабмикс», Россия), 50 мг/мл йодида пропи-дия (PI, «Macklin», Китай). Полученные образцы анализировали на проточном цитофлуориметре FACSCalibur (не менее 20 тыс. событий на экспериментальную точку). Эксперименты были проведены в 2 технических и 3 биологических повторах.
Анализ индукции клеточной гибели методом проточной цитофлуориметрии с окрашиванием Annexin V-FITC и PI
Клетки высевали в 24-луночные планшеты и обрабатывали, как описано выше, инкубировали в течение 24 ч. В качестве положительного контроля были использованы клетки, инкубированные в 3 % формалине (FA) 30 мин при 4 °C. Затем клетки снимали с подложки, центрифугировали в холодном PBS (1 800 об/мин, 4 °C, 5 мин) и проводили анализ на проточном цитофлуориметре FACSCalibur с помощью набора Annexin V-FITC Apoptosis Detection kit («Sigma», США) в соответствии с протоколом производителя. Эксперименты были проведены в 2 технических и 3 биологических повторах.
Статистическая обработка данных
Нормальность полученных выборок определяли по критерию Колмогорова–Смирнова. Данные представляли в формате M ± SEM. Статистические различия вычисляли с помощью пакета программ GraphPad Prizm 8 с применением t-теста.
Результаты
В предварительной оценке цитотоксичности соединений при кратковременной (24 ч) обработке с помощью МТТ-теста был показан цитотоксический эффект в отношении клеток линии OVCAR3
у RBV, MG-5 и MG-19, для которых значения IC50 составили 455 ± 30, 436 ± 52 и 491 ± 22 мкМ соответственно. В отношении линии OVCAR4 цитотоксическое действие проявили RBV и TCA. Значения IC50 составили 483 ± 24 и 485 ± 28 мкМ соответственно.
Оценка антипролиферативного действия исследуемых соединений была проведена после 72-часовой инкубации клеток методом прямого подсчета с окрашиванием трипановым синим. Было показано, что линия OVCAR4 в целом более чувствительна к цитостатическому действию исследуемых препаратов (рис. 2). В частности, RBV, TCA, MG-1, MG-5, MG-18 и MG-19 снижали пролиферацию клеток линии OVCAR4 на 44 ± 6, 64 ± 8, 71 ± 8, 71 ± 11, 47 ± 9, 66 ± 9 % соответственно (рис. 2А). Действие TCA и его производных было сравнимо с эффектом GMC, под влиянием которого пролиферация клеток OVCAR4 за 72 ч снижалась на 79 ± 1 %. В то же время TCA снижал пролиферацию клеток линии OVCAR3 на 22 ± 4 %. Снижение
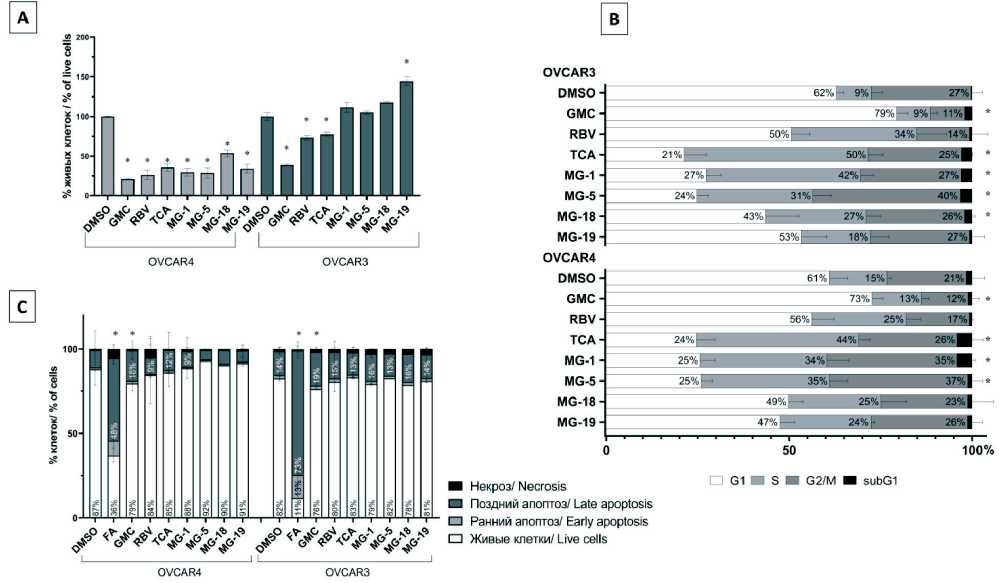
Рис. 2. Антипролиферативные эффекты исследуемых препаратов в клетках рака яичника. А – подсчет клеток. Клетки инкубировали с 500 мкМ RBV, TCA производных серии MG, 0,1 % DMЅO или 10 нМ GMC в течение 72 ч. Затем проводили подсчет доли живых клеток с использованием красителя трипанового синего на автоматическом счетчике ТС-20. Результаты представлены в виде процента от числа клеток в контрольных образцах. В – оценка распределения клеток по фазам клеточного цикла. Клетки инкубировали с исследуемыми препаратами 72 ч. Затем фиксировали в этаноле, проводили отмывку центрифугированием в PBЅ, ресуспендировали в PI-буфере и анализировали на проточном цитофлуориметре. С – оценка индукции апоптоза. Клетки инкубировали с исследуемыми препаратами 24 ч. Затем проводили окрашивание PI и Annexin V-FITC и анализ на проточном цитофлуориметре. Примечания: * – различия статистически значимы по сравнению с группой контроля (р<0,05); рисунок выполнен авторами
Fig. 2. Antiproliferative effects of RBV, TCA and MGs in ovarian cancer cells. А – Viable cells counting. Cells were cultured with 0.1 % DMЅO, 10 nM GMC, RBV, TCA or its derivatives (500 µM). After 72 h of treatment cells were stained with trypan blue and counted. В – Cell cycle analysis. Cells were cultured with solvent, 10 nM GMC, RBV, TCA and MGs (500 µM). Cell cycle phases were detected by flow cytometry with PI staining after the 72 h of treatment. C – Apoptosis induction. Cells were cultured with solvent, 10 nM GMC, RBV, TCA and MGs (500 µM) for 24 h. Then cells were stained with PI and Annexin V-FITC, cell condition were detected by flow cytometry.
Notes: * – (р<0.05); created by the authors
пролиферативной активности клеток OVCAR3 под действием остальных исследуемых соединений было несущественным.
Поскольку действие ксенобиотиков часто проявляется в нарушении регуляции клеточного цикла клеток, мы проанализировали распределение клеток модельных линий рака яичника по фазам клеточного цикла после 72-часовой инкубации с исследуемыми препаратами (рис. 2В). Основание TCA и его производные, замещенные по 5-му положению триазольного кольца (MG-1 и MG-5), проявляют схожее действие на обе линии клеток рака яичника. Суммарная доля клеток линий OVCAR3 и OVCAR4 в фазах S и G2/M при действии TCA, MG-1 и MG-5 увеличивалась в среднем в 2 раза за счет снижения доли клеток в фазе G1.
Дополнительно проведена оценка индукции клеточной гибели. Было показано, что 24-часовая инкубация с препаратами не приводит к активации апоптоза в клетках рака яичника (рис. 2С). При этом стоит отметить, что, несмотря на отсутствие значимых различий между контрольными и экспериментальными образцами, наблюдалась тенденция к активации раннего апоптоза в клетках рака яичника при действии RBV, MG-1 и MG-18.
Обсуждение
В последнее десятилетие предпринят ряд попыток перепрофилирования противовирусного препарата RBV для терапии ЗНО. Однако цитотоксические эффекты данного соединения достигаются в экспериментах in vitro при использовании концентраций, в 10–50 раз превышающих концентрацию препарата в плазме крови при приеме в рекомендуемых дозах. Одним из подходов к расширению терапевтического интервала и снижению эффективной концентрации может быть химическая модификация молекулы. Агликон рибавирина TCA представляет интерес в качестве основы для создания таких более эффективных и безопасных противоопухолевых препаратов. В настоящей работе мы исследовали активность TCA и его производных, несущих гетероциклические заместители в 1-м и 5-м положении триазольного кольца, в отношении модельных клеток рака яичника. Впервые было проведено сравнение действия RBV, TCA и новых синтетических производных в отношении моделей рака яичника in vitro. Было показано, что данные соединения в концентрациях, близких к эффективным концентрациям RBV (500 мкМ), проявляют антипролиферативное действие, а также вызывают накопление клеток в фазах S и G2/M клеточного цикла. Стоит отметить, что анти-пролиферативное действие агликона рибавирина в отношении клеток рака яичника также показано нами впервые. Схожесть в активности TCA и 5-замещенных производных (MG-1 и MG-5), не являющихся истинными аналогами рибавирина, позволяет сделать вывод о том, что именно TCA фрагмент опосредует взаимодействие с биологи- ческими мишенями. Также необходимо упомянуть, что в отличие от химиотерапевтического препарата GMC обладает способностью индуцировать апоптоз в линиях клеток рака яичника.
Учитывая полученные нами ранее данные об отсутствии токсичности в отношении нормальных клеток (моноцитов здоровых доноров), продемонстрированные ранее [23], а также приняв во внимание полученные данные о снижении пролиферации клеток рака яичника под действием исследуемых препаратов, мы можем предположить, что механизм действия данных соединений схож с эффектом цитостатических препаратов, которые, действуя в быстропролиферирующих клетках, останавливают синтез ДНК и РНК в фазе S клеточного цикла [4]. Арест в фазе S чаще опосредован одно- и двуцепочечными разрывами ДНК и запуском системы репарации [24]. В случае невозможности репарации поврежденного участка ДНК клетки погибают. В данной работе мы наблюдали накопление клеток в фазе S одновременно со снижением количества жизнеспособных клеток модельных линий рака яичника при инкубации с ТСА и производными MG-1 и MG-5. Полученные результаты свидетельствуют о том, что данные соединения способны вызывать репликативный стресс в клетках рака яичника.
Одним из основных регуляторов клеточной пролиферации является эукариотический фактор инициации трансляции 4E (eIF4E), который является мишенью RBV в различных клетках [10, 12, 15, 16, 19, 20, 25]. Ингибирование пролиферации клеток РЯ исследуемыми производными TCA может быть опосредовано снижением фосфорилированной (активной) формы eIF4E в этих клетках. Поскольку соединения вызывают накопление клеток в фазах G2/M и S, можно предположить, что уменьшение доли жизнеспособных клеток при длительной инкубации с исследуемыми соединениями может быть также объяснено ингибированием циклинов А и В или циклин-зависимой киназы CDK2, которые являются драйверами продвижения клеток по фазам S и G2/M [25]. Также индуцируемый исследуемыми соединениями клеточный арест может быть опосредован активацией белка р53 и последующей регуляцией взаимодействия киназы CDC2 с циклином В1 [26–27]. Выявленные эффекты позволяют нам определить вектор для дальнейших химических модификаций молекулы TCA по 5-му положению триазольного кольца для создания более эффективных препаратов с противоопухолевыми свойствами.
Заключение
Полученные результаты свидетельствуют о перспективности разработки синтетических производных 1,2,4-триазол-3-карбоксамида и аналогов рибавирина для применения в качестве противоопухолевых препаратов для терапии рака яичников.
Список литературы 1,2,4-триазол-3-карбоксамиды вызывают арест клеток рака яичника в G2/M фазе клеточного цикла
- Sostoyanie onkologicheskoĭ pomoshchi naseleniyu Rossii v 2022 godu. Pod red. A.D. Kaprina, V.V. Starinskogo, A.O. Shakhzadovoi. M., 2023. 252 s.
- Ozols R.F., Bundy B.N., Greer B.E., Fowler J.M., Clarke-Pearson D., Burger R.A., Mannel R.S., DeGeest K., Hartenbach E.M., Baergen R.; Gynecologic Oncology Group. Phase III trial of carboplatin and paclitaxel compared with cisplatin and paclitaxel in patients with optimally resected stage III ovarian cancer: a Gynecologic Oncology Group study. J Clin Oncol. 2003; 21(17): 3194-200. https://doi.org/10.1200/JCO.2003.02.153.
- Gorodnova T.V., Sokolenko A.P., Kuligina E., Berlev I.V., Imyanitov E.N. Principles of clinical management of ovarian cancer. Chin Clin Oncol. 2018; 7(6): 56. https://doi.org/10.21037/cco.2018.10.06.
- Galmarini C.M., Mackey J.R., Dumontet C. Nucleoside analogues and nucleobases in cancer treatment. Lancet Oncol. 2002; 3(7): 415-24. https://doi.org/10.1016/s1470-2045(02)00788-x.
- Pfisterer J., Plante M., Vergote I., du Bois A., Hirte H., Lacave A.J., Wagner U., Stähle A., Stuart G., Kimmig R., Olbricht S., Le T., Emerich J., Kuhn W., Bentley J., Jackisch C., Lück H.J., Rochon J., Zimmermann A.H., Eisenhauer E.; AGO-OVAR; NCIC CTG; EORTC GCG. Gemcitabine plus carboplatin compared with carboplatin in patients with platinum-sensitive recurrent ovarian cancer: an intergroup trial of the AGO-OVAR, the NCIC CTG, and the EORTC GCG. J Clin Oncol. 2006; 24(29): 4699-707. https://doi.org/10.1200/JCO.2006.06.0913.
- Savinkova A.V., Zhidkova E.M., Tilova L.R., Lavrova M.D., Lylova E.S., Kuzin K.A., Portyannikova A.Yu., Maksimova V.P., Kholodova A.V., Vlasova O.A., Fetisov T.I., Kirsanov K.I., Belitskiĭ G.A., Yakubovskaya M.G., Lesovaya E.A. Varianty i perspektivy pereprofilirovaniya lekarstvennykh preparatov dlya ispol'zovaniya v terapii onkologicheskikh zabolevanii. Sibirskii onkologicheskii zhurnal. 2018; 17(3): 77-87. https://doi.org/10.21294/1814-4861-2018-17-3-77-87.
- Huq S., Casaos J., Serra R., Peters M., Xia Y., Ding A.S., Ehresman J., Kedda J.N., Morales M., Gorelick N.L., Zhao T., Ishida W., Perdomo-Pantoja A., Cecia A., Ji C., Suk I., Sidransky D., Brait M., Brem H., Skuli N., Tyler B. Repurposing the FDA-Approved Antiviral Drug Ribavirin as Targeted Therapy for Nasopharyngeal Carcinoma. Mol Cancer Ther. 2020; 19(9): 1797-808. https://doi.org/10.1158/1535-7163.MCT-19-0572.
- Chen J., Xu X., Chen J. Clinically relevant concentration of antiviral drug ribavirin selectively targets pediatric osteosarcoma and increases chemosensitivity. Biochem Biophys Res Commun. 2018; 506(3): 604-10. https://doi.org/10.1016/j.bbrc.2018.10.124. Erratum in: Biochem Biophys Res Commun. 2023; 686. https://doi.org/10.1016/j.bbrc.2023.09.081.
- Teng L., Ding D., Chen Y., Dai H., Liu G., Qiao Z., An R. Anti-tumor effect of ribavirin in combination with interferon-α on renal cell carcinoma cell lines in vitro. Cancer Cell Int. 2014; 14: 63. https://doi.org/10.1186/1475-2867-14-63.
- Pettersson F., Yau C., Dobocan M.C., Culjkovic-Kraljacic B., Retrouvey H., Puckett R., Flores L.M., Krop I.E., Rousseau C., Cocolakis E., Borden K.L., Benz C.C., Miller W.H. Jr. Ribavirin treatment effects on breast cancers overexpressing eIF4E, a biomarker with prognostic specificity for luminal B-type breast cancer. Clin Cancer Res. 2011; 17(9): 2874-84. https://doi.org/10.1158/1078-0432.CCR-10-2334. Erratum in: Clin Cancer Res. 2011; 17(21): 6952. Retrouvay, Hélène [corrected to Retrouvey, Hélène].
- Casaos J., Huq S., Lott T., Felder R., Choi J., Gorelick N., Peters M., Xia Y., Maxwell R., Zhao T., Ji C., Simon T., Sesen J., Scotland S.J., Kast R.E., Rubens J., Raabe E., Eberhart C.G., Jackson E.M., Brem H., Tyler B., Skuli N. Ribavirin as a potential therapeutic for atypical teratoid/rhabdoid tumors. Oncotarget. 2018; 9(8): 8054-67. https://doi.org/10.18632/oncotarget.23883.
- Shen X., Zhu Y., Xiao Z., Dai X., Liu D., Li L., Xiao B. Antiviral Drug Ribavirin Targets Thyroid Cancer Cells by Inhibiting the eIF4E-β-Catenin Axis. Am J Med Sci. 2017; 354(2): 182-89. https://doi.org/10.1016/j.amjms.2017.03.025.
- Ochiai Y., Sano E., Okamoto Y., Yoshimura S., Makita K., Yamamuro S., Ohta T., Ogino A., Tadakuma H., Ueda T., Nakayama T., Hara H., Yoshino A., Katayama Y. Efficacy of ribavirin against malignant glioma cell lines: Follow-up study. Oncol Rep. 2018; 39(2): 537-44. https://doi.org/10.3892/or.2017.6149.
- Dominguez-Gomez G., Cortez-Pedroza D., Chavez-Blanco A., Taja-Chayeb L., Hidalgo-Miranda A., Cedro-Tanda A., Beltran-Anaya F., Diaz-Chavez J., Schcolnik-Cabrera A., Gonzalez-Fierro A., Dueñas-Gonzalez A. Growth inhibition and transcriptional effects of ribavirin in lymphoma. Oncol Rep. 2019; 42(3): 1248-56. https://doi.org/10.3892/or.2019.7240.
- Urtishak K.A., Wang L.S., Culjkovic-Kraljacic B., Davenport J.W., Porazzi P., Vincent T.L., Teachey D.T., Tasian S.K., Moore J.S., Seif A.E., Jin S., Barrett J.S., Robinson B.W., Chen I.L., Harvey R.C., Carroll M.P., Carroll A.J., Heerema N.A., Devidas M., Dreyer Z.E., Hilden J.M., Hunger S.P., Willman C.L., Borden K.L.B., Felix C.A. Targeting EIF4E signaling with ribavirin in infant acute lymphoblastic leukemia. Oncogene. 2019; 38(13): 2241-62. https://doi.org/10.1038/s41388-018-0567-7.
- Kökény S., Papp J., Weber G., Vaszkó T., Carmona-Saez P., Oláh E. Ribavirin acts via multiple pathways in inhibition of leukemic cell proliferation. Anticancer Res. 2009; 29(6): 1971-80.
- Li W., Shen F., Weber G. Ribavirin and quercetin synergistically downregulate signal transduction and are cytotoxic in human ovarian carcinoma cells. Oncol Res. 1999; 11(5): 243-7.
- Wambecke A., Laurent-Issartel C., Leroy-Dudal J., Giffard F., Cosson F., Lubin-Germain N., Uziel J., Kellouche S., Carreiras F. Evaluation of the potential of a new ribavirin analog impairing the dissemination of ovarian cancer cells. PLoS One. 2019; 14(12). https://doi.org/10.1371/journal.pone.0225860.
- De la Cruz-Hernandez E., Medina-Franco J.L., Trujillo J., Chavez-Blanco A., Dominguez-Gomez G., Perez-Cardenas E., Gonzalez-Fierro A., Taja-Chayeb L., Dueñas-Gonzalez A. Ribavirin as a tri-targeted antitumor repositioned drug. Oncol Rep. 2015; 33(5): 2384-92. https://doi.org/10.3892/or.2015.3816.
- Kentsis A., Topisirovic I., Culjkovic B., Shao L., Borden K.L. Ribavirin suppresses eIF4E-mediated oncogenic transformation by physical mimicry of the 7-methyl guanosine mRNA cap. Proc Natl Acad Sci U S A. 2004; 101(52): 18105-10. https://doi.org/10.1073/pnas.0406927102.
- Pettersson F., Del Rincon S.V., Miller W.H. Jr. Eukaryotic translation initiation factor 4E as a novel therapeutic target in hematological malignancies and beyond. Expert Opin Ther Targets. 2014; 18(9): 1035-48. https://doi.org/10.1517/14728222.2014.937426.
- Zheng J., Li X., Zhang C., Zhang Y. eIF4E Overexpression Is Associated with Poor Prognoses of Ovarian Cancer. Anal Cell Pathol (Amst). 2020. https://doi.org/10.1155/2020/8984526.
- Zhidkova E., Stepanycheva D., Grebenkina L., Mikhina E., Maksimova V., Grigoreva D., Matveev A., Lesovaya E. Synthetic 1,2,4-triazole-3-carboxamides Induce Cell Cycle Arrest and Apoptosis in Leukemia Cells. Curr Pharm Des. 2023; 29(43): 3478-87. https://doi.org/10.2174/0113816128275084231202153602.
- da Costa A.A.B.A., Chowdhury D., Shapiro G.I., D'Andrea A.D., Konstantinopoulos P.A. Targeting replication stress in cancer therapy. Nat Rev Drug Discov. 2023; 22(1): 38-58. https://doi.org/10.1038/s41573-022-00558-5.
- Tan H., He L., Cheng Z. Inhibition of eIF4E signaling by ribavirin selectively targets lung cancer and angiogenesis. Biochem Biophys Res Commun. 2020; 529(3): 519-25. https://doi.org/10.1016/j.bbrc.2020.05.127.
- Lim S., Kaldis P. Cdks, cyclins and CKIs: roles beyond cell cycle regulation. Development. 2013; 140(15): 3079-93. https://doi.org/10.1242/dev.091744.
- Taylor W.R., DePrimo S.E., Agarwal A., Agarwal M.L., Schönthal A.H., Katula K.S., Stark G.R. Mechanisms of G2 arrest in response to overexpression of p53. Mol Biol Cell. 1999; 10(11): 3607-22. https://doi.org/10.1091/mbc.10.11.3607.


