35 лет после аварии на Чернобыльской АЭС: методы ретроспективной дозиметрии в оценке последствий крупномасштабных неконтролируемых радиационных воздействий, их последующее развитие и применение в онкорадиологии (опыт МРНЦ им. А.Ф. Цыба)
Автор: Степаненко В.Ф., Каприн А.Д., Иванов С.А., Шегай П.В., Колыженков Т.В., Богачва В.В., Яськова Е.К., Петухов А.Д., Карякин О.Б., Киселва М.В., Крикунова Л.И., Борышева Н.Б., Бирюков В.А., Рухадзе Г.А., Кучеров В.В., Коротков В.А., Иванников А.И., Хайлов А.М., Жарова Е.П., Жумадилов К.Ш., Эндо С., Хоши М.
Рубрика: Научные статьи
Статья в выпуске: 2 т.30, 2021 года.
Бесплатный доступ
Разработанные в МРНЦ им. А.Ф. Цыба методы индивидуальной ретроспективной дозиметрии были применены на загрязнённых радионуклидами территориях Калужской и Брянской областей для оценки и анализа последствий аварии на Чернобыльской АЭС в рамках международных радиационно-эпидемиологических исследований по технологии «случай-контроль». На индивидуальном уровне был установлен факт достоверной дозовой зависимости заболеваемости раком щитовидной железы у детей и подростков, находившихся в этом возрасте на момент аварии и проживающих на радиоактивно загрязнённых территориях Брянской области с момента аварии. Была обнаружена дозовая зависимость заболеваемости раком молочной железы (МЖ) у женщин в возрасте ≤55 лет на момент постановки первого диагноза инвазивного рака МЖ в период с октября 2008 г. по февраль 2013 г. и проживающих в этой области с момента аварии до постановки диагноза. Также было установлено отсутствие радиационной зависимости заболеваемости лейкозом у детей до 5 лет на момент аварии. Разработанные методы ретроспективной дозиметрии были усовершенствованы и использованы в пилотных исследованиях для инструментальной верификации консервативных расчётных доз облучения населения после ядерных испытаний на Семипалатинском ядерном полигоне, для верификации расчётных доз внешнего облучения после аварии на АЭС Фукусима-1, а также для оценки доз облучения населения от остаточной радиоактивности после атомной бомбардировки Хиросимы и Нагасаки. Исследования в этом направлении продолжаются в рамках двусторонних международных соглашений с ведущими исследовательскими центрами Японии и Казахстана. С 2016 г. опыт использования явления радиационно-обусловленной стимулированной люминесценции в ретроспективных оценках доз после аварии на ЧАЭС применяется для разработки и клинического внедрения инновационных технологий « ин виво » дозиметрии. МРНЦ им. А.Ф. Цыба приступил к практическому применению явления радиационно-обусловленной стимулированной люминесценции синтетических и природных материалов для измерения пространственного распределения доз внутри полостных органов риска пациентов при брахитерапии (БТ) рака простаты, опухолей гинекологической сферы, рецидивных опухолей малого таза, а также при локальных измерениях доз облучения кожи МЖ при БТ рака МЖ. 35-летний опыт разработки и применения ретроспективных методов дозиметрии после аварии на ЧАЭС послужил базисом для определения перспективных направлений дальнейших исследований и практического использования явления радиационно-обусловленной стимулированной люминесценции в ситуациях неконтролируемых радиационных воздействий, а также для « ин виво » дозиметрии в онкорадиологии. В области ретроспективной дозиметрии - это изучение возможности использования в качестве естественных дозиметров элементов одежды или специальных вставок в повседневной и рабочей одежде (пуговицы, застёжки и др.), элементов носимых электронных устройств; разработка методов ретроспективной дозиметрии нейтронного облучения. В области « ин виво » дозиметрии в онкорадиологии - это разработка технологий использования микродозиметров в составе миниатюрных сборок, обеспечивающих возможность их внутриартериального размещения в областях интереса при артериальной радиоэмболизации; исследование дозиметрических характеристик люминесцентных микродозиметров из различных материалов при воздействии ионизирующего излучения с высокой ЛПЭ в широком диапазоне доз (от долей мГр до 60 Гр и более); разработка гибких планарных сборок микродозиметров для получения более детальной картины возможных расхождений между распределениями планируемых и фактических доз облучения пациентов при лучевой терапии.
Ретроспективная дозиметрия, авария на чаэс, авария на аэс фукусима-1, семипалатинск, ядерные испытания, хиросима и нагасаки,
Короткий адрес: https://sciup.org/170179218
IDR: 170179218 | УДК: 614.876:539.1.074 | DOI: 10.21870/0131-3878-2021-30-2-7-24
Текст научной статьи 35 лет после аварии на Чернобыльской АЭС: методы ретроспективной дозиметрии в оценке последствий крупномасштабных неконтролируемых радиационных воздействий, их последующее развитие и применение в онкорадиологии (опыт МРНЦ им. А.Ф. Цыба)
Прошло 35 лет после крупнейшей в истории человечества радиологической катастрофы – аварии на Чернобыльской АЭС, произошедшей в 01 ч 23 мин 26 апреля 1986 г. и приведшей к разрушению активной зоны четвёртого энергоблока АЭС и части здания, в котором он располагался [1]. В результате обширные территории СССР и северного полушария Земли подверглись различным уровням радиоактивного загрязнения. В Российской Федерации наибольшие уровни загрязнения имели место на части территорий Брянской, Калужской, Тульской и Орловской областей [2].
С 18 мая 1986 г. были начаты крупномасштабные программы по реконструкции индивидуальных доз облучения населения загрязнённых территорий Калужской области, а затем – на территориях Брянской области [3]. Эти программы выполнялись сотрудниками МРНЦ в сотрудничестве с коллегами из областных медицинских и санитарно-эпидемиологических учреждений, а в более отдалённый период после аварии – в сотрудничестве с другими научными и медицинскими центрами России [4], коллегами из Японии [5, 6], Европейского Сообщества [7-11] и США [12-18].
В процессе и после выполнения программ по ретроспективной оценке доз, по мере накопления медицинских данных, проведена оценка и анализ последствий аварии на Чернобыльской АЭС для загрязнённых радионуклидами территорий Брянской области, выполненных в рамках международных радиационно-эпидемиологических исследований по технологии «случай-кон-троль» [12-17]. Следует отметить, что всесторонние оценки и анализ радиационных рисков для здоровья населения всех загрязнённых радионуклидами территорий РФ, по данным Национального радиационно-эпидемиологического регистра (НРЭР), приведены в монографиях [19-22].
Разработанные методы ретроспективной дозиметрии были усовершенствованы и получили применение в дальнейших пилотных исследованиях по пересмотру консервативных расчётных доз облучения населения после ядерных испытаний на Семипалатинском полигоне [23-25], для верификации расчётных доз после аварии на АЭС Фукусима-1 [26, 27], а также для оценок доз облучения населения от остаточной радиоактивности после атомных бомбардировок Хиросимы и Нагасаки [28]. Исследования в данном направлении были начаты и продолжаются в рамках двусторонних международных соглашений с ведущими научными центрами Японии и Казахстана.
Начиная с 2016 г., накопленный опыт по использованию явления радиационно-обусловленной стимулированной люминесценции при ретроспективных оценках доз после аварии на ЧАЭС был применён для разработки и клинической реализации инновационных технологий «ин виво» дозиметрии (ИВД) [29-34]. В МРНЦ им. А.Ф. Цыба – филиале ФГБУ «НМИЦ радиологии» Минздрава России были начаты исследования и практическое применение явления радиационно-обусловленной стимулированной люминесценции синтетических и природных материалов для ИВД пациентов при брахитерапии (БТ) рака предстательной железы, рака молочной железы (МЖ), опухолей гинекологической сферы, рецидивных опухолей малого таза, а также для инструментального контроля локальных доз облучения медицинского персонала, проводящего высокотехнологичные радиологические процедуры. Эти разработки продолжаются и расширяются в настоящее время [34].
Цель начатых в 1986 г. программ заключалась в дозиметрической поддержке радиационноэпидемиологических исследований, а также в поддержке социально-экономических решений относительно реабилитации загрязнённых территорий. Были обследованы десятки тысяч человек.
С нынешней точки зрения проводимые в этот 35-летний период работы включали в себя задачи по обоснованию, разработке и применению комплекса расчётных и инструментальных физических методов индивидуальной ретроспективной дозиметрии для оценки крупномасштабных радиационных воздействий на население, а в последующем – по развитию и применению разработанных методов в онкорадиологии.
Материалы и методы
Для верификации расчётных методов оценок индивидуальных доз были разработаны и применены инструментальные методы ретроспективной дозиметрии – люминесцентная ретроспективная дозиметрия (ЛРД) с использованием явления радиационно-обусловленной световой (оптической) стимуляции или термической стимуляции люминесценции (ОСЛ или ТЛ соответственно) и ретроспективная дозиметрия с использованием явления электронно-парамагнитного резонанса (ЭПР) [8-11].
При использовании явления радиационно-обусловленной стимулированной люминесценции для « ин виво » дозиметрии в области онкорадиологии и ядерной медицины был осуществлён переход к применению миниатюрных сборок высокоточных микродозиметров для измерений пространственного распределения поглощённых доз в очаге и органах риска при БТ рака предстательной железы, рака МЖ, опухолей гинекологической сферы, рецидивных опухолей малого таза. Были применены: методики термо- и оптико-стимуляции радиационно-обусловленной люминесценции (ТЛ, ОСЛ) синтетических и природных микрокристаллов с регистрацией интенсивности люминесцентного излучения в режиме считывания единичных фотонов. Разработанные в экспериментальных условиях технологии « ин виво» дозиметрии пациентов используются в клинике МРНЦ им. А.Ф. Цыба при высокомощностной БТ источником 129Ir злокачественных новообразований различной локализации (137 пациентов).
Результаты
Результаты разработки и применения методов ретроспективной дозиметрии после аварии на ЧАЭС
Детальное описание разработанных в этот период методов ретроспективной дозиметрии (РД) приведено в относительно недавней публикации [3]. Здесь перечислены лишь самые основные результаты их применения после аварии на ЧАЭС. Необходимо подчеркнуть, что разработанные модели для ретроспективных расчётных доз были верифицированы инструментальными методами ретроспективной дозиметрии (ЛРД и ЭПР), а инструментальные методы ЛРД и ЭПР успешно прошли международное интерсличение. В результате была достигнута чувствительность применяемых инструментальных методов РД по величине накопленной дозы, равная 30 мГр.
Результаты разработки и применения методов РД после аварии на ЧАЭС были реализованы в виде баз данных индивидуальных доз облучения обследованного населения (суммарно
– около 245000 человек), представлены в областные органы здравоохранения, в Министерство здравоохранения для принятия решений о проведении медико-профилактических мероприятий, копии первичных протоколов измерений активности 131I в щитовидной железе (около 30000 человек) переданы в НРЭР для оценки рисков влияния радиационного воздействия на здоровье населения. По полученным данным разработан и издан ряд инструктивных, методических и технических документов Минздрава [3]. Следует отметить международное использование полученных результатов (документы ВОЗ, МАГАТЭ, НКДАР ООН, стандарт Международной организации по стандартам – ISO, учения ВОЗ по преодолению последствий крупномасштабных радиологических аварий) [3].
Применение разработанного комплекса методов ретроспективной оценки индивидуальных доз облучения щитовидной железы, красного костного мозга, молочной железы и всего тела позволило установить факт чрезвычайно неравномерного распределения индивидуальных доз облучения: при наличии большого количества лиц с очень малыми дозами облучения выявлены группы лиц с поглощёнными дозами, многократно превышающими средние и медианные значения доз (рис. 1). Следовательно, в условиях крупномасштабной радиологической аварии, такой как авария на ЧАЭС, использование оценок только средних или медианных доз скрывает группы лиц с повышенными дозами облучения, на которые в первую очередь и должны быть направлены адресные защитные и профилактические мероприятия. Этот вывод послужил импульсом для последующей инициации радиационно-эпидемиологических исследований по технологии «случай-контроль».
Факт существенной неравномерности индивидуальных доз облучения при крупномасштабной радиологической аварии может быть объяснён тем, что имеет место большая неравномерность радиоактивного загрязнения не только на уровнях регионов или районов, но даже в пределах отдельных небольших населённых пунктов. Дополнительными значимыми факторами неравномерности распределения индивидуальных доз облучения, как показали результаты систематических индивидуальных опросов обследуемых лиц, является вариабельность поведения людей, находящихся на загрязнённых территориях (перемещения, длительность нахождения на открытом воздухе, защитные мероприятия и т.п.), различия в употребления продуктов питания, имеющих разные уровни загрязнения радионуклидами, а также различия в возрасте обследуемых и видах их занятий (учёба, работа и т.п.) [3].
Полученные ретроспективные оценки индивидуальных доз были включены в анализ результатов международных радиационно-эпидемиологических исследований заболеваемости злокачественными новообразованиями щитовидной железы, крови (лейкозы) и молочной железы, проводимых на загрязнённых радионуклидами территориях Брянской области.
В результате реализации разработанной методологии ретроспективной оценки доз для дозиметрической поддержки радиационно-эпидемиологических исследований по технологии «слу-чай-контроль», на индивидуальном уровне выявлен факт достоверной дозовой зависимости частоты заболеваемости раком щитовидной железы у детей и подростков, находившихся в этом возрасте на момент аварии и проживавших на радиоактивно загрязнённых территориях Брянской области с момента аварии [12, 14, 17], при этом у взрослых лиц эта зависимость не имеет места. Установлена также дозовая зависимость частоты заболеваемости раком МЖ у женщин в возрасте ≤55 лет на момент первого диагноза инвазивного рака груди в период с октября 2008 г. по февраль 2013 г. и проживавших в Брянской области с момента аварии и до постановки диагнозов [15, 16]. В то же время радиационная обусловленность частоты заболеваемости лейкозами у детей в возрасте до 5 лет на момент аварии отсутствует [13].
Разработанная методология индивидуальной ретроспективной дозиметрии индивидуальных доз облучения населения может быть применена в условиях иных потенциально возможных при крупномасштабных неконтролируемых радиационных воздействиях на население, включая ситуации, которые могут возникнуть при возможных актах ядерного терроризма.
Развитие методов люминесцентной ретроспективной дозиметрии и их применение к иным крупномасштабным неконтролируемым радиационным воздействиям на население
Разработанные инструментальные технологии ретроспективной дозиметрии получили дальнейшее развитие и применение для пилотного исследования по пересмотру консервативных расчётных доз облучения населения после ядерных испытаний на Семипалатинском полигоне [23-25] и верификации расчётных доз после аварии на АЭС Фукусима-1 [26, 27], а также для оценок доз облучения населения от остаточной радиоактивности после атомных бомбардировок Хиросимы и Нагасаки [28].
Исходная технология ЛРД была реализована в варианте измерений радиационно-обусловленной оптико-стимулированной люминесценции (ОСЛ) единичных кристаллов кварца, экстрагированных из кварцсодержащих образцов – «свидетелей» неконтролируемого радиационного воздействия. Применение модифицированной технологии было проведено с использованием документированных кварцсодержащих образцов, переданных в МРНЦ им. А.Ф. Цыба в рамках двусторонних соглашений об академическом сотрудничестве с университетами Японии и Казахстана. Почему возникла необходимость применения способа измерений методом ОСЛ единичных кристаллов кварца? При анализе кварцсодержащих образцов, отобранных на загрязнённых радионуклидами территориях, было обнаружено присутствие большого количества (около 50-70%) тёмных включений неизвестного происхождения. Оказалось невозможным отделить эти включения от кварцевых кристаллов ни с помощью разделения их по плотности, ни с помощью магнитной сепарации или же с использованием химического травления в кислотах. Было сделано предположение, что эти включения являются силикатным минералом «биотитом» {K(Mg,Fe) 3 [(Al,Fe)Si 3 O 10 ](OH,F) 2 }. Этот силикатный минерал является спутником кварца, который широко используется в качестве природного дозиметра в ретроспективной дозиметрии. Но биотит не имеет дозиметрических свойств, его сложно отделить от кристаллов кварца с помощью разделения по плотности или же путём химического травления. Присутствие этого минерала в аликвотах оказывает негативное влияние на радиационную чувствительность анализируемых аликвот микрокристаллов, используемых в качестве естественных дозиметров при люминесцентной ретроспективной дозиметрии.
Избирательная регистрация оптически стимулированной люминесценции от отдельных анализируемых микрочастиц производится с помощью лазера с высокой точностью позиционирования в режиме счёта единичных фотонов. Применение метода избирательной ОСЛ от единичных микрокристаллов позволило не только повысить точность ретроспективной люминесцентной дозиметрии до 20 мГр накопленной дозы, но и обусловило возможность проводить измерения поглощённых доз в очень тонких слоях (до 0,1 мм) анализируемых образцов, что дало возможность ретроспективно измерять вклад короткопробежного бета-излучения в поверхностных слоях кварцсодержащих образцов (см. примеры ниже).
В результате применения этой технологии проведена ретроспективная переоценка доз облучения населения, проживающего в ряде населённых пунктов на территориях Казахстана вокруг Семипалатинского полигона: показано, что дозы облучения существенно ниже, чем ранее оценённые специалистами разных стран консервативные расчётные оценки. Работы в этом направлении продолжаются.
Получены первые результаты по инструментальной РД-дозиметрии с использованием технологии радиационно-обусловленной люминесценции по единичным кристаллам кварца в ареале аварийной АЭС Фукусима-1. Результаты измерений показали наличие существенного вклада бета-излучения в общую дозу облучения от радиоактивного загрязнения в префектуре Фукусима, Япония (рис. 1), что согласуется с результатами расчётов методом стохастического моделирования взаимодействия ионизирующего излучения с веществом [27].
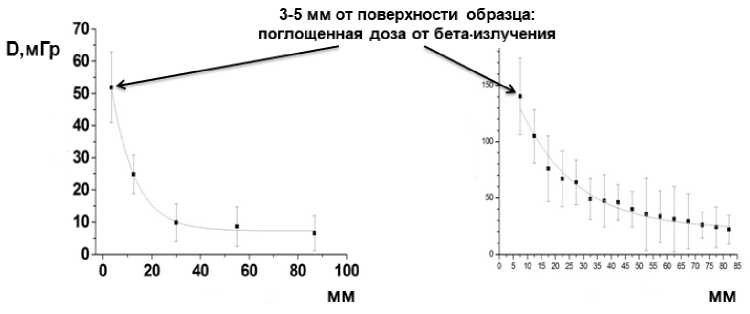
Рис. 1. Пример: распределение измеренной методом ОСЛ накопленной поглощённой дозы, D (мГр), по глубине кварцсодержащих образцов, отобранных в префектуре Фукусима (слева - образец из н.п. Минами-сома, справа - из н.п. Иитате); по горизонтальным осям - глубина от поверхностей кварцсодержащих образцов, мм; доза на глубине 3-5 мм соответствует вкладу бета-излучения, так как вклад гамма-излучения вблизи поверхности образца мал из-за отсутствия электронного равновесия.
Получены первые результаты по ретроспективной оценке доз облучения населения Хиросимы и Нагасаки от остаточной радиоактивности в результате атомной бомбардировки силами ВВС США 6 и 9 августа 1945 г. Так, в результате применения метода ЛРД по кварцевым включениям в образцы-«свидетели» атомной бомбардировки Хиросимы показано наличие существенного вклада бета-излучения от радионуклидов, входящих в состав остаточной радиоактивности после бомбардировки [28] (рис. 2).
."ммарная доза: бетатамма (метод ОСЛ) гамма-компонента ( метод Монте-Карло)
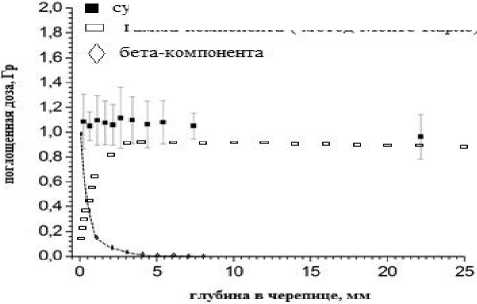
Рис. 2. Распределение измеренной методом ОСЛ накопленной поглощённой дозы, D (мГр), по глубине кварцсодержащего образца черепицы крыши здания в Хиросиме - «свидетеля» атомной бомбардировки 6 августа 1945 г.; заполненные прямоугольники - результаты ретроспективной ОСЛ-дозиметрии с применением технологии измерений единичных кристаллов кварца, незаполненные прямоугольники - результаты расчёта гамма-компоненты накопленной дозы методом Монте-Карло, точки - вклад бета-компоненты. Вклад гамма-излучения вблизи поверхности образца мал из-за отсутствия электронного равновесия.
Радиобиологическая значимость бета-облучения от остаточной радиоактивности в отношении лиц, оказавшихся вблизи эпицентра вскоре после бомбардировки, изучается в настоящее время в ходе проводимых нами с международным участием экспериментов на лабораторных животных, подвергшихся воздействию диспергированного вещества, содержащего короткоживущий нейтрон-активированный бета-излучатель [35, 36].
Разработка технологий и методов «ин виво» дозиметрии на основе явления радиационно-обусловленной стимулированной люминесценции и их применение в онкорадиологии
В последние годы в МРНЦ им. А.Ф. Цыба – филиале ФГБУ «НМИЦ радиологии» Минздрава России явление радиационно-обусловленной стимулированной люминесценции было применено для разработки и клинической реализации инновационных технологий ИВД [29, 31-34]. Эти разработки основаны на опыте предыдущих исследований, проводимых в Центре в течение 35 лет в области ретроспективной дозиметрии.
Кроме того, высокая чувствительность исследованных люминесцентных микродозиметров позволила применять их для измерения локальных доз облучения пальцев, кистей рук и глаз медицинского персонала (ИДК персонала), осуществляющего высокотехнологичные радиологические процедуры. На доказательной инструментальной основе показано соответствие доз облучения персонала нормативам НРБ, что расширяет сферу применения новых технологий ядер-ной медицины в радиологических клиниках страны [30].
Исследованы дозиметрические характеристики люминесцентных микродозиметров (размеры около 100 мкм) из различных синтетических (LiF, Al 2 O 3 ) и природных (NaCl, SiO 2 ) материалов. Достигнута высокая точность измерений (<5%) в терапевтическом диапазоне доз.
Разработана технология изготовления миниатюрных (диаметр 1 мм) гибких герметичных тканеэквивалентных сборок автономных люминесцентных накапливающих микродозиметров (100 мкм), находящихся внутри медицинских катетеров, вводимых по медицинским показаниям в полостные органы риска.
Проведена разработка и апробация оригинальных технологий « ин виво» дозиметрии, заключающихся в размещении минисборок микродозиметров в очаге и органах риска через вводимые по медицинским показаниям медицинские катетеры, что предоставляет уникальную возможность измерений пространственного распределения поглощённых доз в полостных органах риска и не требует кабельных соединений с регистрирующими системами.
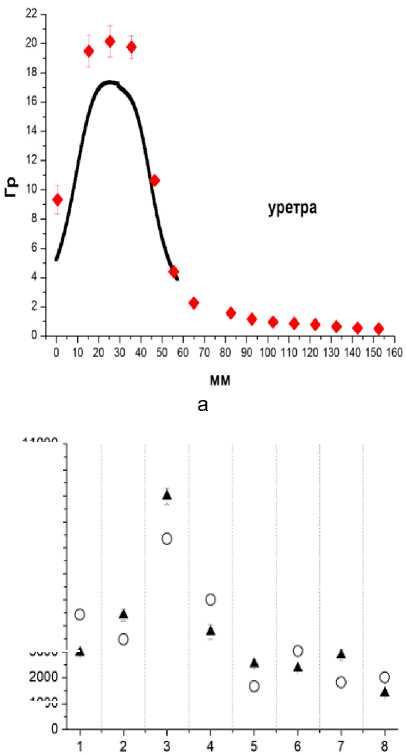
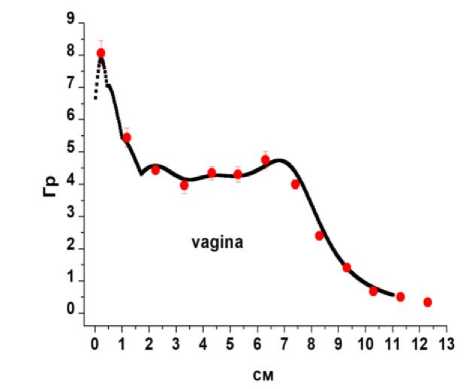
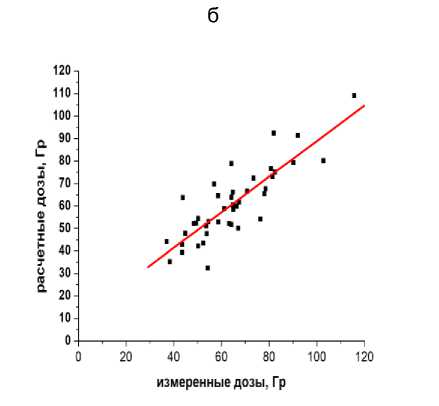
Технологии « ин виво» дозиметрии применены в клинике МРНЦ им. А.Ф. Цыба (137 пациентов) при измерениях пространственных распределений доз облучения в органах риска пациентов (прямая кишка, уретра, мочевой пузырь, вагина, малый таз) при высокомощностной БТ источником 192Ir рака предстательной железы, злокачественных опухолей гинекологической сферы, рецидивных опухолей малого таза, а также для измерений локальных доз облучения кожи МЖ при БТ рака МЖ (рис. 3) [34].
10000-
9000-
8000-
7000 -
6000-
5000 -
4000-
3000 *
1000-1
2 О"
Номера точек с микродозиметрами на коже МЖ
11000-1
в г
Рис. 3. Примеры пространственных распределений измеренных и расчётных (планируемых) поглощённых доз в зонах интереса при высокомощностной брахитерапии рака предстательной железы (а), опухолей гинекологической сферы (б), рака молочной железы (в), а также соотношение между величинами измеренных и расчётных локальных доз в области интереса при брахитерапии рецидивных опухолей малого таза (г), коэффициент корреляции R=0,847 при p<0,001. Величины измеренных доз обозначены заполненными символами, распределения расчётных доз обозначены либо сплошными линиями (а, б), либо незаполненными символами (в). Указанные погрешности измеренных доз соответствуют 2SD. По осям абсцисс: расстояния по глубине полостных органов риска (а, б) – в мм или в см (точка «0» соответствует наибольшей глубине); в – номера точек расположения микродозиметров на коже молочной железы. По осям ординат – дозы в Гр (а, б), или в мГр (в).
Заключение
35-летний опыт, приобретённый при разработках методов ретроспективной дозиметрии после аварии на ЧАЭС, и полученные результаты послужили базисом для определения перспективных направлений дальнейших исследований и практического применения явления радиационно-обусловленной стимулированной люминесценции при неконтролируемых (аварийных) радиационных воздействиях, а также для « ин виво» дозиметрии в области онкорадиологии.
Разработка новых подходов в индивидуальной ретроспективной дозиметрии при неконтролируемых радиационных воздействиях:
-
- Исследование возможности использования в качестве естественных дозиметров элементов одежды (пуговицы, застёжки и т.д.), элементов носимых электронных устройств (чипов электронных гаджетов, пластиковых карт и т.п.), специальных вставок (включений) в элементы повседневной и рабочей одежды (формы).
-
- Исследование возможностей применения ретроспективной дозиметрии нейтронного излучения.
Актуальность дальнейшего развития методов ретроспективной дозиметрии обусловлена их большой востребованностью для корректной оценки последствий неконтролируемого облучения вследствие возможных радиологических аварий, инцидентов, как это отмечается в документах НКДАР ООН (UNSCEAR 2008 Report, Annex D; UNSCEAR 2013 Report. Annex A) и МАГАТЭ (IAEA Report, 2004).
Дальнейшее развитие технологий « ин виво » дозиметрии в онкорадиологии:
-
- Разработка технологий применения микродозиметров в составе миниатюрных сборок, обеспечивающих возможность их внутриартериального подведения к областям интереса, что расширяет потенциал применения ИВД при артериальной радиоэмболизации.
-
- Исследование дозиметрических характеристик люминесцентных микродозиметров из различных материалов при воздействии ионизирующего излучения с высокой ЛПЭ в широком диапазоне доз (от долей мГр до 60 Гр и более), что расширяет потенциальную сферу применения этих технологий метода в ядерной медицине для ИВД при использовании альфа-излучения и тяжёлых заряженных частиц, а также для ИДК персонала.
-
- Разработка гибких планарных сборок люминесцентных микродозиметров для получения более целостной картины возможных расхождений между планируемыми и реальными дозами облучения.
Актуальность применения «ин виво» дозиметрии при радиотерапии подчеркивается в документах и рекомендациях ВОЗ (WHO, Radiotherapy Risk Profile, 2008), МАГАТЭ (IAEA, Human Health Reports, No 8), ESTRO, 2007, МКРЗ (ICRP Publications 86, 97), в которых ИВД рассматривается как существенный элемент гарантий качества радиотерапии.
Список литературы 35 лет после аварии на Чернобыльской АЭС: методы ретроспективной дозиметрии в оценке последствий крупномасштабных неконтролируемых радиационных воздействий, их последующее развитие и применение в онкорадиологии (опыт МРНЦ им. А.Ф. Цыба)
- Абагян Л.А., Асмолов В.Г., Гуськова А.К., Дёмин В.Ф., Ильин Л.А., Израэль Ю.А., Калугин А.К., Конвиз В.С., Кузьмин И.И., Кенцевич Д.Д., Легасов В.А., Малкин С.Д., Мысенков А.И., Павловский О.А., Петров В.Н., Пикалов В.К., Проценко А.Н., Рязанцев Е.П., Сивинцев Ю.В., Сухоручкин В.К., Токаренко В.Ф., Хрулев А.А., Шах О.Я. (Группа экспертов, привлечённая Государственным комитетом по использованию атомной энергии СССР для подготовки доклада на совещании МАГАТЭ, состоявшемся с 25 по 29 августа 1986 г. в Вене). Информация об аварии на Чернобыльской АЭС и её последствиях, подготовленная для МАГАТЭ //Атомная энергия. 1986. Т. 61, № 5. С. 301-320.
- Ильин Л.А., Балонов М.И., Булдаков Л.А., Бурьяк В.Н., Гордеев К.И., Дементьев С.И., Кондрусев А.И., Лягинская А.М., Матюхин В.А., Рамзаев П.В., Савкин М.Н., Константинов Ю.О., Линге И.И., Лихтарев И.А., Цыб А.Ф., Степаненко В.Ф., Иванов В.К. Экологические особенности и медико-биологические последствия аварии на Чернобыльской АЭС //Медицинская радиология. 1989. Т. 34, № 11. C. 58-81.
- Степаненко В.Ф. Дозиметрический мониторинг и ретроспективная дозиметрия населения в ранний и отдалённый периоды после аварии на Чернобыльской АЭС: опыт МРНЦ //Медицинские радиологические последствия Чернобыля: прогноз и фактические данные спустя 30 лет /под общ. ред. чл.-корр. РАН В.К. Иванова, акад. РАН А.Д. Каприна. М.: ГЕОС, 2015. С. 10-53.
- Степаненко В.Ф., Цыб А.Ф., Гаврилин Ю.И., Хрущ В.Т., Шинкарев С.М., Скворцов В.Г., Кондрашов А.Е., Яськова Е.К., Иванников А.И., Паршков Е.М., Шахтарин В.В., Московко Л.И., Петин Д.В., Чеботарева И.В., Прошин А.Д., Рожко Ю.Н., Дорохов В.В., Ривкинд Н.Б., Квитко Б.И., Кузьмин П.С., Лешаков С.Ю., Омельченко В.Н. Дозы облучения щитовидной железы населения России в результате аварии на Чернобыльской АЭС (ретроспективный анализ) //Радиация и риск. 1996. Вып. 7. С. 225-245.
- Hoshi M., Stepanenko V.F., Gavrilin Yu.I., Volkov Yu.M., Makarenkova I.A., Takada J., Shevchuk V.E., Skvortsov V.G., Petin D.G., Iaskova E.K., Kondrashov A.E., Ivannikov A.I., Ermakova N.M., Chunikhin L.N. I-129 and I-131 ground deposition densities are correlated in Belarusian settlements contaminated following the Chernobyl accident //Chernobyl: message for the 21st Century. International Congress Series. 2002. V. 1234. P. 115-120. Amsterdam: Elsevier Science, 2002.
- Takada J., Hoshi M., Endo S., Stepanenko V.F., Kondrashov A.E., Petin D., Skvortsov V., Tikounov D., Gavrilin Y., Snykov V.P. Dosimetry studies in Zaborie village //Appl. Radiat. Isot. 2000. V. 52, N 5. P. 1165-1169.
- Степаненко В.Ф., Цыб А.Ф., Матвеенко Е.Г. Дозы облучения щитовидной железы у населения загрязнённых территорий: методология работы и результаты измерений //Германо-Российская конференция по измерительной программе в РСФСР. М.: ИАЭ им. И.В. Курчатова, 1992. С. 57-63.
- Bailiff I. K., Stepanenko V. Retrospective dosimetry and dose reconstruction. Brussels, Luxembourg, 1996. 120 p. [Электронный ресурс]. URL: https://op.europa.eu/en/publication-detail/-/publication/13fe2c27-5c12-4bf9-ad66-537572fffdc1 (дата обращения 30.12.2020).
- Bailiff I.K., Stepanenko V. F., Goeksu H.Y., Botter-Jensen L., Brodski L., Chumak V., Correcher V., Delgado A., Golikov V., Jungner H., Khamidova L.G., Kolizhenkov T.V., Likhtarev I., Meckbach R., Petrov S.A., Sholom S. Comparison of retrospective luminescence dosimetry with computational modeling in two highly contaminated settlements downwind of the Chernobyl NPP //Health Phys. 2004. V. 86, N 1. P. 25-41.
- Ivannikov A.I., Gaillard-Lecanu E., Trompier F., Stepanenko V.F., Skvortsov V.G., Borysheva N.B., Tikunov D.D., Petin D.V. Dose reconstruction by EPR spectroscopy of tooth enamel: application to the population of Zaborie village exposed to high radioactive contamination after the Chernobyl accident //Health Phys. 2004. V. 86, N 2. P. 121-134.
- Use of electron paramagnetic resonance dosimetry with tooth enamel for retrospective dose assessment. IAEA-TECDOC-CRP 202. Contributors from Russia: Stepanenko V.F., Skvortsov V.G., Ivannikov A.I. Vienna: IAEA, 2002. 57 p. [Электронный ресурс]. URL: https://www-pub.iaea.org/MTCD/Publications/PDF/te_1331_web.pdf (дата обращения 30.12.2020).
- Davis S., Stepanenko V., Rivkind N., Kopecky K.J., Voilleque P., Shakhtarin V., Parshkov E., Kulikov S., Lushnikov E., Abrosimov A., Troshin V., Romanova G., Doroschenko V., Proshin A., Tsyb A. Risk of thyroid cancer in the Bryansk oblast of the Russian Federation after the Chernobyl power station accident //Radiat. Res. 2004. V. 162, N 3. P. 241-248.
- Davis S., Day R.W., Kopecky K.J., Mahoney M.C., McCarthy P.L., Michalek A.M., Moysich K.B., Onstad L.E., Stepanenko V.F., Voilleque P.G., Chegerova T., Falkner K., Kulikov S., Maslova E., Ostapenko V., Rivkind N., Shevchuk V., Tsyb A.F. Childhood leukaemia in Belarus, Russia, and Ukraine following the Chernobyl accident: results from an international collaborative population-based case-control study //Int. J. Epidem. 2006. V. 35, N 2. P. 386-396.
- Kopecky K. J., Stepanenko V., Rivkind N., Voilleque P., Onstad L., Shakhtarin V., Parshkov E., Kulikov S., Lushnikov E., Abrosimov A., Troshin V., Romanova G., Doroschenko V., Proshin A., Tsyb A., Davis S. Childhood thyroid cancer, radiation dose from Chernobyl, and dose uncertainties in Bryansk oblast, Russia: a population-based case-control study //Radiat. Res. 2006. V. 166, N 2. P. 367-374.
- Rivkind N., Stepanenko V., Belukha I., Guenthoer J., Kopecky K.J., Kulikov S. Kurnosova I., Onstad L., Porter P., Shklovskiy-Kordi N., Troshin V., Voilleque P., Davis S. Female breast cancer risk in Bryansk oblast, Russia, following prolonged low dose rate exposure to radiation from the Chernobyl power station accident //Int. J. Epidem. 2020. V. 49, N 2. P. 448-456.
- Rivkind N., Stepanenko V., Belukha I., Guenthoer J., Kopecky K.J, Kulikov S. Kurnosova I., Onstad L., Porter P., Shklovskiy-Kordi N., Troshin V., Voilleque P., Davis S. Breast cancer risk following prolonged low dose rate exposure to radiation from the Chernobyl power station accident. Supplemental Material to: Female breast cancer risk following prolonged low dose rate exposure to radiation from the Chernobyl power station accident //Int. J. Epidem. 2020. V. 49 (Suppl.). P. 1-25.
- Stepanenko V.F., Voilleque P.G., Gavrilin Yu.I., Khrouch V.T., Shinkarev S.M., Orlov M. Yu., Kondrashov A.E., Petin D.V., Iaskova E.K., Tsyb A.F. Estimating individual thyroid doses for a case-control study of childhood thyroid cancer in Bryansk Oblast, Russia //Radiat. Prot. Dosimetry. 2004. V. 108, N 2. P. 143-160.
- Stepanenko V.F., Orlov M. Yu., Voilleque P.G., Snykov V.P., Khvalenskiy Yu.A., Volokitin A.A., Gaziev Ya.I., Kryukova I.G., Endo S., Tanaka S., Hoshi M. 131I and 137Cs fallout in Russia and Belarus following the Chernobyl accident: analysis of archive data relevant to thyroid dose assessment //Indian J. Radiat. Res. 2005. V. 2, N 3. P. 18-37.
- Иванов В.К., Цыб А.Ф. Медицинские радиологические последствия Чернобыля для населения России: оценка радиационных рисков. М.: Медицина, 2002. 392 с.
- Ivanov V., Tsyb A., Ivanov S., Pokrovsky S. Medical radiological consequences of the Chernobyl catastrophe in Russia: estimation of radiation risks. St. Petersburg: Nauka, 2004. 388 p.
- Медицинские радиологические последствия Чернобыля: прогноз и фактические данные спустя 30 лет /под общ. ред. чл.-корр. РАН В.К. Иванова, чл.-корр. РАН А.Д. Каприна. М.: ГЕОС, 2015. 450 с.
- Радиационная эпидемиология болезней системы кровообращения человека после радиационных аварий /под общ. ред. чл.-корр. РАН В.К. Иванова. Обнинск: МРНЦ им. А.Ф. Цыба, 2016. 168 с.
- Степаненко В.Ф., Каприн А.Д., Иванов С.А., Мулдагалиев Т.Ж., Колыженков Т.В., Богачёва В.В., Петухов А.Д., Ахмедова У.А., Липихина А.В., Джамбаев М.Т., Апсаликова З.С., Мансарина А.Е., Яськова Е.К., Иванников А.И., Скворцов В.Г., Жумадилов К.Ш., Хоши М. Инструментальные оценки накопленной дозы внешнего облучения методом ретроспективной люминесцентной дозиметрии по
- единичным микрокристаллам кварца: первые результаты международного исследования образцов -«свидетелей» ядерных испытаний (г. Семей, Республика Казахстан) //Радиация и риск. 2019. Т. 28, № 4. С. 118-128.
- Жумадилов К.Ш., Иванников А.И., Степаненко В.Ф., Скворцов В.Г., Тойода Ш., Эндо С., Танака К., Каприн А.Д., Галкин В.Н., Иванов С.А., Колыженков Т.В., Ахмедова У.А., Богачева В.В., Хоши М. ЭПР-дозиметрия населения, проживающего вблизи радиоактивного следа после ядерного испытания 29 августа 1949 г. на Семипалатинском испытательном полигоне //Радиация и риск. 2016. Т. 26, № 4. С. 74-83.
- Stepanenko V.F., Hoshi M., Ivannikov A.I., Bailiff I.K., Zhumadilov K., Skvortsov V.G., Argembaeva R., Tsyb A.F. The 1st Nuclear Test in the former USSR of 29 August 1949: comparison of individual dose estimates by modeling with EPR retrospective dosimetry and luminescence retrospective dosimetry data for Dolon village, Kazakhstan //Radiat. Meas. 2002. V. 42, N 6-7. P. 1041-1048.
- Степаненко В.Ф., Эндо С., Каприн А.Д., Иванов С.А., Каджимото Т., Танака К., Колыженков Т.В., Петухов А.Д., Ахмедова У.А., Богачёва В.В., Коротков В.А., Хоши М. Опыт инструментальной оценки накопленных доз внешнего облучения с использованием метода ретроспективной люминесцентной дозиметрии по единичным микрокристаллам кварца из кварцсодержащих образцов, отобранных в префектуре Фукусима, Япония //Радиация и риск. 2018. Т. 27, № 3. С. 79-90.
- Endo S., Fujii K., Kajimoto T., Tanaka K., Stepanenko V., Kolyzhenkov T., Petukhov A., Akhmedova U., Bogacheva V. Comparison of calculated beta- and gamma-ray doses after the Fukushima accident with data from single-grain luminescence retrospective dosimetry of quartz inclusions in a brick sample //J. Radiat. Res. 2018. V. 59, N 3. P. 286-290.
- Kerr G.D., Egbert S.D., Al-Nabulsi I., Bailiff I.K., Beck H.L., Belukha I.G., Cockayne J.E., Cullings H.M., Eckerman K.F., Granovskaya E., Grant E.J., Hoshi M., Kaul D.C., Kryuchkov V., Mannis D., Ohtaki M., Otani K., Shinkarev S., Simon S.L., Spriggs G.D., Stepanenko V.F., Stricklin D., Weiss J.F., Weitz R.L., Woda C., Worthington P.R., Yamamoto K., Young R.W. Workshop report on atomic bomb dosimetry: review of dose related factors for the evaluation of exposures to residual radiation at Hiroshima and Nagasaki //Health Phys. 2015. V. 109, N 6. P. 582-600.
- Степаненко В.Ф., Бирюков В.А., Каприн А.Д., Галкин В.Н., Иванов С.А., Карякин О.Б., Мардынский Ю.С., Гулидов И.А., Колыженков Т.В., Иванников А.И., Борышева Н.Б., Скворцов В.Г., Ахмедова У.А., Богачева В.В., Петухов А.Д., Яськова Е.К., Хайлов А.М., Лепилина О.Г., Санин Д.Б., Коротков В.А., Обухов А.А., Анохин Ю.Н. Внутриполостная автономная «ин виво» дозиметрия при высокомощ-ностной брахитерапии рака предстательной железы c применением 192Ir: разработка технологии и первые результаты //Радиация и риск. 2017. Т. 26, № 2. С. 72-82.
- Степаненко В.Ф., Бирюков В.А., Карякин О.Б., Каприн А.Д., Галкин В.Н., Иванов С.А., Мардынский Ю.С., Колыженков Т.В., Петухов А.Д., Богачева В.В., Ахмедова У.А., Яськова Е.К., Лепилина О.Г., Санин Д.Б., Скворцов В.Г., Иванников А.И., Хайлов А.М., Анохин Ю.Н. Локальные поглощённые дозы облучения медицинского персонала при брахитерапии рака предстательной железы микроисточниками 125I российского производства //Радиация и риск. 2017. Т. 26, № 1. С. 44-59.
- Степаненко В.Ф., Бирюков В.А., Каприн А.Д., Галкин В.Н., Иванов С.А., Борышева Н.Б., Карякин О.Б., Мардынский Ю.С., Гулидов И.А., Колыженков Т.В., Обухов А.А., Иванников А.И., Скворцов В.Г., Ахмедова У.А., Богачева В.В., Петухов А.Д., Яськова Е.К., Хайлов А.М., Лепилина О.Г., Санин Д.Б., Коротков В.А., Анохин Ю.Н. «Ин виво» дозиметрия при высокомощностной брахитерапии рака предстательной железы с применением 192Ir: сравнение распределения планируемых и измеренных доз при внутриполостном размещении автономных люминесцентных микродозиметров //Радиация и риск. 2018. Т. 27, № 1. С. 77-85.
- Коротков В.А., Каприн А.Д., Иванов С.А., Степаненко В.Ф., Бирюков В.А., Борышева Н.Б., Колыженков Т.В., Ахмедова У.А., Богачёва В.В., Петухов А.Д., Жарова Е.П. Проявления позднего лучевого уретрита в сравнении с инструментальными оценками пространственного внутриполостного распределения доз при высокомощностной брахитерапии рака предстательной железы с применением 192Ir: предварительные результаты //Радиация и риск. 2019. T. 28, № 1. С. 110-123.
- Жарова Е.П., Степаненко В.Ф., Киселёва М.В., Богачёва В.В., Аминов Г.Г., Колыженков Т.В., Петухов А.Д., Жарикова И.А., Демьянович А.В., Борышева Н.Б., Иванов С.А., Каприн А.Д. Ин виво дозиметрия люминесцентными микродозиметрами при брахитерапии рака молочной железы источником 192Ir: разработка технологии и клиническая апробация //Радиация и риск. 2020. T. 29, № 2. С. 67-77.
- Степаненко В.Ф., Колыженков Т.В., Богачева В.В., Петухов А.Д., Бирюков В.А., Борышева Н.Б., Киселева М.В., Коротков В.А., Крикунова Л.И., Кулиева Г.З., Жарова Е.П., Яськова Е.К., Рухадзе Г.А., Иванов С.А., Шегай П.В., Каприн А.Д. Разработка и применение технологий радиационно-обус-ловленной стимулированной люминесценции в онкорадиологии и радиационной безопасности: результаты и перспективы //Радиация и организм: материалы итоговой научн.-практ. конф. 26 ноября 2020 г. Обнинск: MРНЦ им. А.Ф. Цыба - филиал ФГБУ «НMИЦ радиологии» Mинздрава России, 2020. C. 78-79.
- Степаненко В.Ф., Рахыпбеков Т.К., Каприн А.Д., Иванов С.А., Отани К., Эндо С., Сато К., Кавано Н., Такатсуджи Т., Накашима М., Шичиджо К., Сакагучи А., Като Х., Онда Ю., Фуджимото Н., Тойода Ш., Сато Х., Колыженков Т.В., Петухов А.Д., Дюсупов А.А., Чайжунусова Н.Ж., Сайкенов Н.Б., Узбеков Д.Е., Саимова А.Ж., Шабдарбаева Д.М., Пивина Л.Н., Скаков М.К., Вурим А.Д., Гныря В.С., Азимханов А.С., Колбаенков А.Н., Жумадилов К.С., Кайрханова Ы.О., Яськова Е.К., Белуха И.Г., Скворцов В.Г., Иванников А.И., Хайлов А.М., Ахмедова У.А., Богачева В.В., Анохин Ю.Н., Орленко С.П., Хоши М. Облучение экспериментальных животных активированной нейтронами радиоактивной пылью: разработка и реализация метода - первые результаты международного многоцентрового исследования //Радиация и риск. 2016. T. 25. № 4. C. 111-125.
- Stepanenko V., Kaprin A., Ivanov S., Shegay P., Zhumadilov K., Petukhov A., Kolyzhenkov T., Bogacheva V., Zharova E., Iaskova E., Chaizhunusova N., Shabdarbayeva D., Amantayeva G., Baurzhan A., Ruslanova B., Abishev Zh., Apbassova M., Kairkhanova Y., Uzbekov D., Khismetova Z., Zhunussov Y., Fujimoto N., Hitoshi Sato H., Shichijo K., Nakashima M., Sakaguchi A., Toyoda Sh., Kawano N., Ohtaki M., Otani K., Endo S., Yamamoto M., Hoshi M. Internal doses in experimental mice and rats following exposure to neutron-activated 56MnO2 powder: results of an international, multicenter study //Radiat. Environ. Biophys. 2020. V. 59, N 4. P. 683-692.


