3D моделирование локализации патологических изменений биоткани
Автор: Захаров В.П., Синдяева А.Р.
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Физика
Статья в выпуске: 3 т.9, 2007 года.
Бесплатный доступ
Предложен универсальный алгоритм математического моделирования процесса визуализации структуры биологических объектов произвольной конфигурации. Моделирование распростра- нения оптического излучения в исследуемой среде осуществлялось методом Монте-Карло. Раз- работанная аналитическая схема предназначена для усовершенствования метода регистрации и пространственной локализации оптических макронеоднородностей в поверхностной биологи- ческой ткани, что позволит осуществлять in vivo неинвазивную диагностику аномальных обра- зований различной природы.
Короткий адрес: https://sciup.org/148197984
IDR: 148197984 | УДК: 616-7
Текст научной статьи 3D моделирование локализации патологических изменений биоткани
На сегодня перспективным направлением физической оптики является развитие бесконтактных методов оптической диагностики для исследований в биологии и медицине [1, 2, 3]. Особое внимание в рамках данной проблемы уделяется применению бесконтактных оптических методов для контроля патологий кожного покрова и кровеносной системы. Следует отметить, что в настоящее время наиболее распространенным методом оптической диагностики кожи является метод отражательной спектроскопии [2]. Данный метод основан на сравнительном анализе спектров рассеяния, полученных со здоровых и пораженных участков кожи, в целях идентификации глубины и конфигурации макронеоднородностей. Несмотря на малую глубину залегания подкожных образований, решение прямой задачи определения оптических параметров среды по интенсивности обратного рассеянного излучения отнюдь не является тривиальным. Это связано в первую очередь с сильными процессами поглощения и рассеяния излучения в верхних слоях кожи; кроме того, локализация неоднородности существенно ограничена предельными пороговыми значениями фотодетекторов, применяемых для регистрации рассеянного излучения. Обратная задача расчета интенсивности регистрируемого сигнала по известным оптическим параметрам облучаемой ткани не имеет описанных недостатков и была успешно реализована благодаря использованию упрощенных моделей кожного покрова и ме- тода Монте-Карло [3, 4, 5]. Однако большинство исследований в данной области основано на одномерном представлении биологической структуры, что заведомо накладывает довольно существенные ограничения на применимость полученных результатов. Настоящая работа посвящена созданию алгоритма, рассчитывающего объемное распределение поглощенного и рассеянного излучения в многослойной биоткани произвольного строения посредством моделирования методом Монте-Карло в программной среде TracePro Expert.
Моделирование распространения оптического излучения в многослойной поверхностной биоткани
Кожная ткань в общем случае обладает сложной многослойной (рис. 1) неоднородной структурой [7, 8], однако в силу малого размера неровностей случайно-периодических поверхностей, границ раздела между слоями, и естественных неоднородностей по сравнению с диаметром падающего пучка кожу целесообразно представить в виде плоской многослойной поглощающей и рассеивающей свет среды [6]. Оптические характеристики плоской модели соответствуют кожному покрову белого человека [2, 6]. Кроме того, при моделировании принималось во внимание наличие подкожной ткани (клетчатки), содержащей области опухолевых или некротических тканей, проявляющиеся как оптические неоднородности среды. В качестве модельных ис-
Рис. 1. Модельная схема для локализации патологических изменений облучаемой биоткани:
1 – приемная поверхность матричного фотоприемника, 2 – направление падающего лазерного излучения, 3 – эпидермис, 4 – дерма, 5 – дерма с поверхностным сплетением сосудов, 6 – дерма, 7 – дерма с глубинным сплетением сосудов, 8 – слой подкожного жировой клетчатки, 9 – неоднородность, 10 – обратное рассеянное излучение
пользовались два лазерных источника излучения ближнего ИК диапазона с близкими не-перекрывающимися спектрами и одинаковой мощностью излучения (20 мВт), которое направлялось через световод на поверхность ткани под некоторым углом, изменяющимся в пределах от 0 до 45о. Объем модельной ткани составлял 60х40х4,5мм, что при заданной конфигурации источника заведомо превышает область распространения излучения. Выбор конкретных длин волн лазерных излучателей определяется следующими факторами: во-первых, каждая из волн должна вносить одинаковый вклад в интегральный коэффициент рассеяния для нормальной ткани и, во-вторых, одна из волн (сигнальная) должна иметь существенные различия в коэффициентах рассеяния и/или поглощения в области неоднородности. Тогда первая волна может быть использована как опорная волна. Например, для большинства поверхностных тканей в качестве опорной волны может использоваться полупроводниковый лазер с X = 852 нм. Следует также отметить, что регистрируемая интенсивность рассеяния может существенно зависеть от размеров неоднородности, ее топологии и ориентации. В численных экспериментах каждая неоднородность моделировалась в виде сферы и исследовалась зависимость распределение интенсивности рассеяния (поглощения) в зависимости от ее эффективного диаметра (диаметра поперечного сечения по направлению падающего луча).
В результате численных экспериментов было показано, что распределение поглощенного излучения по глубине здоровой жировой клетчатки имеет вид убывающей экспоненциальной зависимости (рис. 2), что хорошо согласуется с результатами [6]. Это позволило сделать ряд допущений, связанных со спектральной зависимостью оптических коэффициентов образования. Было задано, что для опорной волны оптические параметры неоднородности слабо отличаются от параметров окружающей ткани, т.е. функция изменения удельной поглощенной энергии по глубине (рис. 2) убывает по экспоненте, как и в случае отсутствия макронеоднородности. Кроме того, предполагалось, что для сигнальной волны наблюдается резонанс в поглощении и оптические параметры неоднородности существенно отличаются от оптических параметров окружающей среды. Явление резонанса при наличии неоднородности количественно характеризуется величиной дифференциального поглощения, определяемого как разница в поглощении на двух близких длинах волн.
В численных экспериментах исследовались две принципиально разные модели неоднородностей – неоднородность поглощения
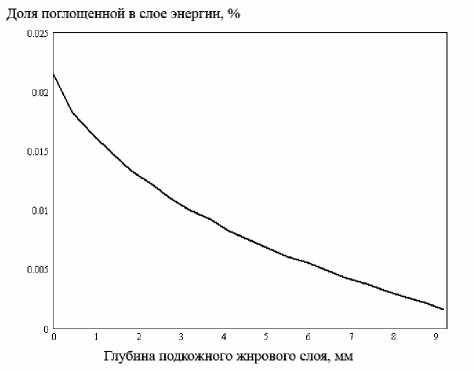
Рис. 2. Распределение поглощенной энергии по глубине подкожного слоя ткани в отсутствии неоднородностей
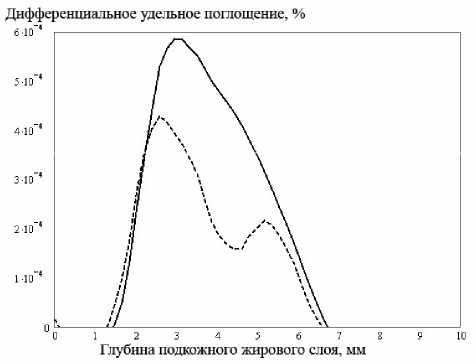
Рис. 3. Распределение дифференциальной поглощенной энергии по глубине подкожного слоя для неоднородности поглощения. Сплошная кривая соответствует неоднородности с размытой границей, а пунктир – с резкой
и неоднородность рассеяния. Первая модель соответствует моделированию некротической ткани или гематомы, что оптически проявляется в существенно большем коэффициенте поглощения при сравнительно малом возрастании рассеяния. На рис. 3 представлено распределение дифференциального поглощения для данной модели. При неоднородности типа опухолевого новообразования коэффициент поглощения практически не изменяется и оптически неоднородность проявляется в виде повышенного коэффициента рассеяния. Полученные численные результаты распределения дифференциального удель-
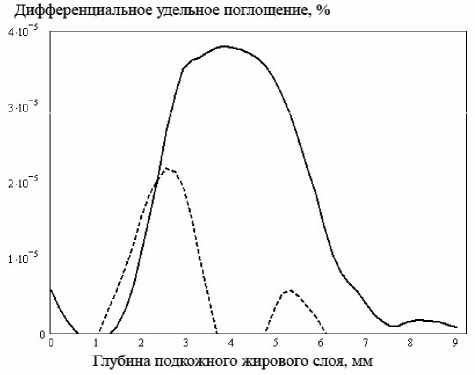
Рис. 4. Распределение поглощенной энергии по глубине подкожного слоя для неоднородности рассеяния. Сплошная кривая соответствует неоднородности с размытой границей, пунктирная – с резкой границей.
ного поглощения для данной модели неоднородности (неоднородность рассеяния) представлены на рис. 4.
Следует отметить, что существенным является локализации неоднородности, а именно распределение плотности на ее границе и, соответственно, градиент оптических характеристик на границе “окружающая ткань-неоднородность”. Для выявления влияния данного фактора на распределение поглощенной энергии были поставлены численные эксперименты для тождественных по диаметру сферических неоднородностей, отличающихся лишь способом задания формы границы, а именно, модель неоднородности с резкой границей и модель с размытой границей (с экспоненциальным изменением показателя преломления, описывающим “размытие” реальной неоднородности в нормальной ткани), дифференциальное поглощение которых представлено соответственно пунктирной и сплошной линиями на рис. 3, 4.
С целью регистрации изменений, вносимых в распределение обратного рассеянного излучения неоднородностью, было проведено моделирование виртуального интегрального фотоприемника с абсолютно поглощающей приемной поверхностью, располагающегося на фиксированном расстоянии от облучаемой биоткани (рис. 1). Полный поток обратного рассеянного излучения опорной волны регистрировался приемной поверхностью детектора и определял граничные ус- ловия для нахождения дифференциальной интенсивности обратного оптического сигнала при освещении биологического образца сигнальной волной.
Обсуждение результатов
Как отмечалось ранее, в ходе численных экспериментов было выяснено, что распределение поглощенного излучения по глубине здорового кожного покрова одинаково и качественно совпадает с данными [6] теоретического распределения интенсивности в коже при ее облучении лазерными пучками обеих длин волн. Дифференциальное поглощение в данном случае постоянно и пренебрежимо мало по всей глубине биологического образца.
При наличии в глубинном слое, например, в подкожной жировой клетчатке, неоднородности характер распространения излучения зависит от спектрального состава излучения и вида неоднородности. Из рис. 3, 4 видно, что различная спектральная зависимость коэффициентов рассеяния и поглощения для двух близких длин волн позволяет выделить и локализовать границу патологически измененной среды. Зона повышенного поглощения, характеризующаяся пиком на графиках (рис. 3 и 4), соответствует действительной глубине залегания неоднородности.
Очевидно, что присутствие неоднородностей поглощения и рассеяния увеличивает поглощение в прилегающих областях, что объясняется отражением на границе образо- вание- нормальная ткань, определяемым разностью соответствующих показателей преломления, и повышенным коэффициентом рассеяния макронеоднородности. В случае неоднородности поглощения с размытой границей значительный вклад в поглощение окружающей среды вносит отражение от первой границы. Из сравнения рис. 3 и 4 видно, что на распределение поглощенной энергии в здоровой прилегающей ткани в равной степени влияет как обратное (френелевское) отражение на границе сред, так и объемное рассеяние неоднородности. Необходимо отметить, что неоднородность с резкой границей сдвигает зону повышенного поглощения к поверхности кожного покрова и вносит таким образом погрешность в определение действительных размеров образования.
Из рис. 3, 4 также следует, что неоднородность с резкой границей характеризуется меньшим поглощением, что, по-видимому, связано с френелевскими потерями на отражение на границе сред и, кроме того, с однородным внутренним строением новообразо- вания, нивелирующим процессы рассеяния. Описанные явления имеют выраженный ха- рактер, в частности, при распространении излучения в биообъекте, содержащем неоднородность рассеяния (рис. 4).
В сериях экспериментов показано, что величина регистрируемого приемной поверхностью фотодетектора полного потока рас-
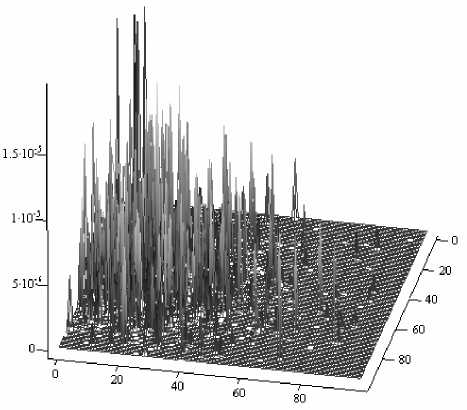
Рис. 5. Распределение дифференциальной интенсивности обратного излучения на приемной поверхности фотоприемника для неоднородности поглощения с эффективным диаметром 1.4 мм
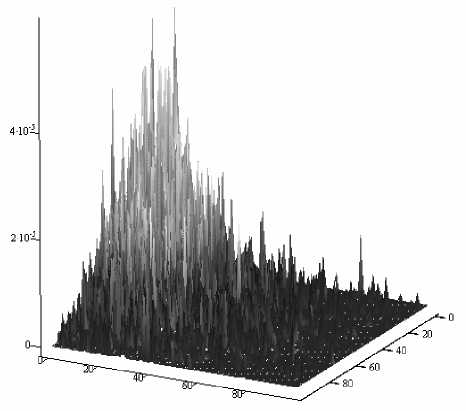
Рис. 6. Распределение дифференциальной интенсивности обратного излучения на приемной поверхности фотоприемника для неоднородности поглощения с эффективным диаметром 2.75 мм
сеянного излучения связана обратной зависимостью с геометрическими размерами неоднородности, ее коэффициентом поглощения и, как следствие, с интегральным поглощением в биоткани. Это ясно видно из сравнения распределений дифференциальной интенсивности рассеянного излучения на поверхности виртуального фотоприемника для неоднородностей с эффективными диаметрами 1.4 мм и 2.75 мм, представленных соответственно на рис. 5 и 6.
Несмотря на то, что для выявления основных тенденций и зависимостей массовые численные эксперименты проводились для плоской среды, развитый алгоритм и математическая модель позволяют с минимальными затратами машинного времени рассчитывать объемное распределение поглощенного и рассеянного лазерного излучения в многослойных биологических средах произвольной структуры и конфигурации в целях определения глубины и размеров патологических включений. Однако следует отметить, что точность идентификации данных параметров обуславливается структурой образования и требует разработки алгоритмов, в полной мере учитывающих флуктуации параметров неоднородности.
Список литературы 3D моделирование локализации патологических изменений биоткани
- Приезжев А.В., Тучин В.В., Шубочкин Л.П. Лазерная диагностика в биологии и медицине. М.: Наука, 1989.
- Tuchin V.V. Tissue optics: light scattering methods and instruments for medical diagnosis. Bellingham, SPIE Press. 2000. V TT 38.
- Меглинский И.В. Моделирование спектров отражения оптического излучения от случайно-неоднородных многослойных сильно рассеивающих поглощающих свет сред методом Монте-Карло//Квантовая электроника. 2001. 31. №12.
- Словецкий С. Д. Моделирование распространения оптического излучения в слоистой случайно-неоднородной среде методом Монте-Карло//Радиотехника. 1994. №7.
- Березин Ю.Д., Еременко С.А. Использование метода Монте-Карлодля расчета трехмерного распределения лазерного излучения с длинами волн 1,06 и 2,09 мкм в биотканях//Оптический журнал. 2000. 67. №2.
- Тучин В.В. Лазеры и волоконная оптика в биомедицинских исследованиях. Саратов, Изд-во Сарат. ун-та, 1998.
- Stenn K.S. In: Cell and tissue biology. Ed. By L. Weiss. Baltimore, Urban&Shwarzenberg, 1988.
- Odland G. F. In: Physiology, biochemistry and molecular biology of the skin. Ed. By L.A. Goldsmith. Oxford, Oxford Univ. Press. 1991. V1.


