Аберрантное метилирование промоторных участков генов APC, CDH13 И MGMT у больных колоректальным раком
Автор: Кит Олег Иванович, Водолажский Дмитрий Игоревич, Двадненко Константин Владимирович, Ефимова Ирина Юрьевна, Олейникова Елена Николаевна, Олейников Денис Диамидович, Тимошкина Наталья Николаевна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 2 (74), 2016 года.
Бесплатный доступ
Аберрантное метилирование промоторных участков генов - основное эпигенетическое изменение, характеризующее колоректальные неопластические образования. В настоящей работе был исследован количественный уровень метилирования 42 CpG-сайтов промоторных участков генов MGMT, APC и CDH13 в опухолях толстой кишки по отношению к уровню метилирования прилежащей условно нормальной ткани 25 пациентов. С помощью метода пиросеквенирования выявлено повышение уровня метилирования промоторных участков генов MGMT, APC и CDH13 в опухолевых образцах от 3 до 5 раз. В этих же образцах опухолей проведен скрининг активирующих SNP-мутаций в онкогенах KRAS (40 %), NRAS (0 %) и BRAF (0 %). Наличие SNP-мутаций в гене KRAS сопровождалось гиперметилированием одного или более промоторов исследованных генов. Доказана ассоциация этого эпигенетического показателя с метастазированием опухоли. Полученные данные об увеличении метилирования промоторных участков генов-онкосупрессоров могут быть использованы в качестве чувствительных прогностических маркеров прогрессирования и метастазирования колоректального рака.
Cpg-метилирование, колоректальный рак, гены mgmt
Короткий адрес: https://sciup.org/14056670
IDR: 14056670 | УДК: 616-006.66:575.23 | DOI: 10.21294/1814-4861-2016-15-2-48-55
Текст научной статьи Аберрантное метилирование промоторных участков генов APC, CDH13 И MGMT у больных колоректальным раком
Колоректальный рак (КРР) – гетерогенное злокачественное новообразование, занимающее третье место в мире в структуре заболеваемости и смертности среди других злокачественных опухолей [2]. В 1988 г. B. Vogelstein et al. предложили первую линейную модель онкогенеза толстой и прямой кишки [22] на базе исторически сложившихся представлений о процессе малигнизации тканей как накоплении в клетке событий хромосомной нестабильности и мутаций в онкогенах и генах-супрессорах. В последующие десятилетия после серьёзных успехов в исследовании микроса-теллитной нестабильности (MSI) и метилирования генома были описаны несколько альтернативных цепочек молекулярных событий при развитии КРР [7]. Основными маркерами предложенной классификации КРР, объединяющей аберрантные структурные и молекулярные изменения, стали взаимоисключающие активирующие мутации в генах KRAS и BRAF, инактивирующие мутации в гене – онко-супрессоре АРС, MSI и статус метилирования генома в целом, и генов MLH1 и MGMT, в частности [10, 17]. Кроме определения клинико-морфологических особенностей, понимание роли генетических и эпигенетических изменений в патогенезе КРР даёт информацию для разработки новых биомаркеров эффективного профилактического скрининга, выбора таргетной терапии, прогнозирования течения заболевания и ответа на лечение.
Метилирование обширных регионов CpG-островков (так называемый фенотип метилированных CpG островков или CIMP) – основное эпигенетическое изменение, описанное в колоректальных неопластических образованиях. Частота обнаружения CIMP в случаях спорадического КРР, по разным оценкам, колеблется от 15 до 50 % [12].
APC , CDH13 и MGMT – гены-онкосупрессоры, транскрипция которых часто подавляется в опухолях человека посредством аберрантного метилирования промоторных участков [4, 12, 13], что функционально эквивалентно инактивирующей мутации [6]. Однако большая часть данных по этим и другим генам была получена с помощью метода аллель-специфичной PCR (MSP), обладающего рядом методических ограничений [14]. Например, в случае использования метода MSP затруднительно идентифицировать фоновый уровень метилирования, так как даже в условно нормальной ткани может отмечаться негативная эпигенетическая регуляция активности генов-онкосупресоров, связанная, например, с возрастом [9, 16].
Цель исследования – количественный анализ CpG-метилирования промоторных участков
генов-онкосупрессоров APC , CDH13 и MGMT в операционных биоптатах условно нормальной и опухолевой ткани толстой кишки в сочетании с идентификацией активирующих SNP-мутаций в генах KRAS , NRAS , BRAF .
Материал и методы
В исследование были включены 25 пациентов с умеренно (G 2 ) и низкодифференцированным (G 3 ) раком толстой кишки (табл. 1), проходивших стационарное лечение в ФГБУ РНИОИ в 2013–14 гг. Медиана возраста составила 59 лет. Каждый пациент подписал добровольное информированное согласие на участие в проведении исследования.
Тотальную ДНК из опухолевых и условно здоровых тканей выделяли методом фенолхлороформной экстракции [1]. Бисульфитное конвертирование ДНК проводили согласно протоколу, предложенному K. Patterson et al. [18] в собственной модификации: для удаления бисульфит-ионов использовали набор очистки ДНК из реакционных смесей (BioSilica, Россия). Количественное метилирование 42 CpG-сайтов трёх генов (APC, CDH13 и MGMT) оценивали методом пиросеквенирования с использованием системы генетического анализа PyroMark Q24 (Qiagen, Germany). По результатам пробных экспериментов для наработки ампликонов и собственно пиросеквенирования были выбраны праймеры (табл. 2). Ампликоны, полученные после постановки ПЦР на матрице бисульфит-конвертированной ДНК, подвергали очистке, денатурации и отмывке с последующим отжигом с секвенирующим праймером при 80°С и постановкой реакции пиросеквенирования. Постановку пиросеквенирования каждого образца проводили, как минимум, в двух повторах. Полученные данные анализировали с помощью программного обеспечения PyroMark Q24 Software (Qiagen, Germany). Значение метилирования отдельного CpG-сайта, рассчитанного как отношение содержания нуклеотидов С/Т (рис. 1), использовали для вычисления усредненного метилирования промоторного участка каждого гена (Met, %).
Методом прямого секвенирования по Сэнгеру (АВ3500, LifeTechnologies, USA) идентифицировали мутации во 2, 3 и 4-м экзонах генов KRAS и NRAS . В настоящее время скрининг наличия мутаций не только в гене KRAS , но и NRAS становится обязательным для характеристики КРР-опухолей в целях определения стратегии лечения с использованием таргетных препаратов [20]. Скрининг мутации V600E в гене BRAF осуществляли с
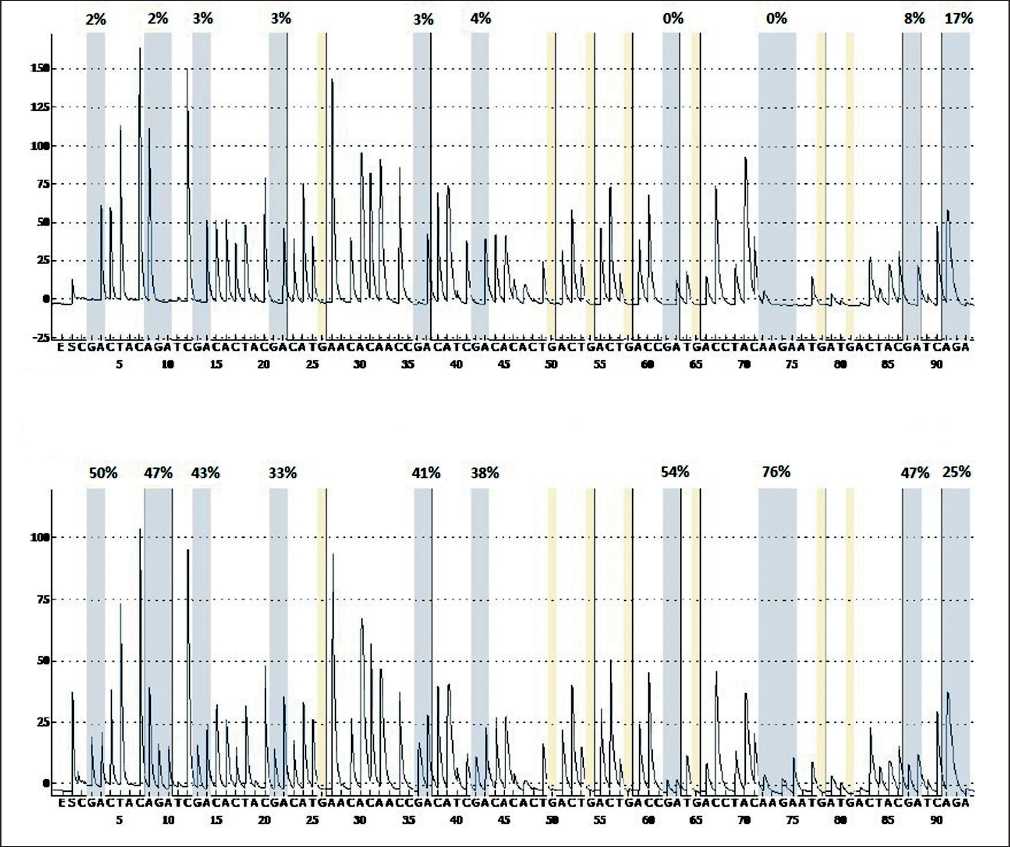
Рис. 1. Пример пирограмм промоторной последовательности гена АРС , полученных с помощью секвенирующего праймера Ру1 для образцов условно нормальной (вверху) и опухолевой (внизу) ткани. Значения соотношения С/Т указаны в процентах над каждым анализируемым CpG-сайтом
таблица 1
клинико-морфологическая характеристика пациентов
Медиана, вариация, U-критерий Манна – Уитни и статистическая достоверность различий были вычислены для каждого CpG-сайта, а также в среднем по множеству CpG-сайтов каждого гена. Достоверность различий по частотным показателям определяли, используя х2-тест. Все расчёты проведены с помощью программы Statistica v. 7.0 (Stat Soft Inc, 2004).
Результаты и обсуждение
Типичные пирограммы секвенс-анализа бисульфит-конвертированной ДНК, выделенной из условно нормальной и опухолевой тканей больных КРР, продемонстрированы на рисунке. Оценка метилирования по отдельным CpG-сайтам выявила неэффективность этого показателя в 10 CpG сайте ампликона APC/Py1 (крайний справа на рисунке) и 12 CpG сайте ампликона MGMT/Re2 ввиду регистрации низкого уровня метилирования во всех пробах (медиана - 19 и 13 % соответственно), что обусловило отсутствие достоверных различий между опухолевой и условно нормальной тканью.
Усредненные данные по уровню метилирования (Меt, %) промоторных участков каждого гена представлены в табл. 3. Во всех образцах условно нормальной ткани был зарегистрирован «фоновый» уровень Меt промоторных участков трёх генов. Сравнительный анализ образцов опухолевой и условно нормальной тканей выявил достоверное повышение тотального показателя уровня Меt в тканях КРР для генов MGMT (p=0,016) и CDH13 (p<0,001). Однако опухолевые образцы продемонстрировали высокую гетерогенность по данному показателю: по каждому из исследованных генов были зафиксированы случаи как гипер-, так и гипо-метилирования. Для отражения этого факта мы классифицировали выборку на подгруппы: условно нормальная ткань (N), колоректальные опухоли в целом (CRC), опухоли с повышенным уровнем метилирования по сравнению с нормой
(CRC-Меt_H), опухоли, не отличающиеся от нормы (CRC-Меt_L). Метилирование промоторных участков генов в подгруппе CRC-Меt_Н было статистически достоверно выше, чем в подгруппах N и CRC-Меt_L по всем генам (p<0,001). Согласно значениям интерквартильного интервала в CRC-Меt_Н наблюдали и более высокое варьирование показателей уровня Меt.
Гиперметилирование промоторного участка гена CDH13 фиксировали в 58 % случаев, тогда как группы CRC-Меt_Н по двум другим генам ( APC и MGMT) насчитывали по 40 % от объёма исследованной выборки (табл. 3). Двадцать (80 %) образцов опухолей КРР из всего проанализированного нами массива данных продемонстрировали CpG-гиперметилирование хотя бы по одному гену, из них 4 (16 %) были гиперметилированы по всем трём генам.
Статус метилирования генов MGMT , APC , CDH13 при КРР был исследован ранее [12]. Однако все подобные исследования были выполнены с использованием метода MSP, что исключает прямое сравнение c нашими данными. Возможно, что в силу определенных ограничений MSP, позволяющего провести только качественную оценку CpG-сайтов по принципу высокого, среднего и низкого уровня метилирования, в работах по исследованию КРР представлены весьма разнородные данные частоты гиперметилирования генов. Например, по гену APC частота гиперметилирования в нашей работе составила 40 % против 21-28 %, определенной методом MSP; по гену CDH13 – 58 % против 32–65 % соответственно [12, 15].
Мы оценили корреляцию возрастных, гендерных и клинических показателей (табл.1) с уровнем CpG-метилирования исследованных промоторных участков. Ранее было показано отсутствие ассоциаций между возрастными, гендерными, гистологическими показателями и статусом CpG-метилирования гена APC в неопластических образованиях толстой кишки [5]. По данным других исследователей, с возрастом происходит увеличение уровня метилирования
Метилирование промоторных участков генов APC, MGMT и CDH13 в условно нормальной и опухолевой тканях
|
Ген |
Группа |
Количество |
Медиана Меt, % |
Интерквартильный интервал Меt, % |
Достоверность различий Меt по сравнению с условно нормальной тканью в U-тесте, p |
|
N |
25 |
6,0 % |
4,3–7,5 % |
||
|
APC |
CRC-Меt_H |
10 (40 %) |
31,8 % |
11,6–34,5 % |
<0,001* |
|
CRC-Меt_L |
15 (60 %) |
4,5 % |
3,0–8,0 % |
0,212 |
|
|
CRC |
25 |
9,0 % |
3,5–14,0 % |
0,195 |
|
|
N |
24 |
10,0 % |
8,0–11,8 % |
||
|
CDH13 |
CRC-Меt_H |
14 (58 %) |
25,8 % |
20,8–31,4 % |
<0,001* |
|
CRC-Меt_L |
10 (42 %) |
9,5 % |
8,0–14,4 % |
0,814 |
|
|
CRC |
24 |
16,5 % |
12,0–26,4 % |
<0,001* |
|
|
N |
25 |
3,0 % |
2,0–4,0 % |
||
|
MGMT |
CRC-Меt_H |
10 (40 %) |
10,5 % |
9,3–16,3 % |
<0,001* |
|
CRC-Меt_L |
15 (60 %) |
2,8 % |
2,0–4,0 % |
0,924 |
|
|
CRC |
25 |
4,0 % |
2,1–10,0 % |
0,016* |
Список литературы Аберрантное метилирование промоторных участков генов APC, CDH13 И MGMT у больных колоректальным раком
- Корниенко И.В., Водолажский Д.И., Вейко В.П., Щербаков В.В., Иванов П.Л. Подготовка биологического материала для молекулярногенетических идентификационных исследований при массовом поступлении неопознанных тел. Ростов н/Д: ООО «Ростиздат», 2001. 256 с.
- Одинцова И.Н., Писарева Л.Ф., Хряпенков А.В. Эпидемиология злокачественных новообразований в мире//Сибирский онкологический журнал. 2015. № 5. С. 95-101.
- Catalogue of somatic mutations in cancer -COSMIC (http://cancer. sanger.ac.uk/cosmic 11.11.2015).
- Chen J., Rocken C., Lofton-Day C., Schulz H.U., Muller O., Kutzner N., Malfertheiner P., Ebert M.P. Molecular analysis of APC promoter methylation and protein expression in colorectal cancer metastasis//Carcinogenesis. 2005. Vol. 26 (1). P. 37-43.
- Ding Z.Y., Jiang T., Piao Y., Han T., Han Y.L., Xie X.D. Meta-analysis of the association between APC promoter methylation and colorectal cancer//Onco Targets Ther. 2015. Vol. 5 (8). P. 211-222. doi: 10.2147/OTT.S75827.
- Esteller M. Molecular origins of cancer: epigenetics in cancer//N. Engl. J. Med. 2008. Vol. 358 (11). P. 1148-1096.
- Grady W.M., Carethers J.M. Genomic and epigenetic instability in colorectal cancer pathogenesis//Gastroenterology. 2008. Vol. 135 (4). P. 1079-1099 DOI: 10.1053/j.gastro.2008.07.076
- Hibi K., Nakao A. Lymph node metastasis is infrequent in patients with highly-methylated colorectal cancer//Anticancer Res. 2006. Vol. 26 (1A). P. 55-58.
- Horvath S. DNA methylation age of human tissues and cell types//Genome Biol. 2013. Vol. 14 (10). R. 115.
- Jass J.R. Colorectal cancer: a multipathway disease//Critical Reviews in Oncogenesis. 2006. Vol. 12 (3-4). P. 273-287.
- Kit O.I., Vodolazhskiy D.I., Gevorkyan Y.A., Soldatkina N.V. KRAS gene mutations and gender differences in colorectal cancer//Int. J. Biomed. 2015. Vol. 5 (1). P. 11-15.
- Kim M.S., Lee J., Sidransky D. DNA methylation markers in colorectal cancer//Cancer Metastasis Rev. 2010. Vol. 29 (1). P.181-206 DOI: 10.1007/s10555-010-9207-6
- Kontic M., Stojsic J., Jovanovic D., Bunjevacki V., Ognjanovic S., Kuriger J., Puumala S., Nelson H.H. Aberrant promoter methylation of CDH13 and MGMT genes is associated with clinicopathological characteristics of primary non small cell lung carcinoma//Clin. Lung Cancer. 2012. Vol. 13 (4). P. 297-303.c DOI: 10.1016/j.cllc.2011.11.003
- Lof-Ohlin Z.M., Nilsson T.K. Pyrosequencing assays to study promoter CpG site methylation of the O6-MGMT, hMLH1, p14ARF, p16INK4a, RASSF1A, and APC1A genes//Oncol. Rep. 2009. Vol. 21 (3). P. 721-729.
- Nagasaka T., Sasamoto H., Notohara K., Cullings H.M., Takeda M., Kimura K., Kambara T., MacPhee D.G., Young J., Leggett B.A., Jass J. R., Tanaka N., Matsubara N. Colorectal сancer with mutation in BRAF, KRAS, and wild-type with respect to both oncogenes showing different patterns of DNA methylation//Clin. Oncol. 2004. Vol. 22 (22). P. 4584-4594.
- Nakagawa H., Nuovo G.J., Zervos E.E., Martin E.W., Salovaara Jr.R., Aaltonen L.A., de la Chapelle A. Age-related hypermethylation of the 5’ region of MLH1 in normal colonic mucosa is associated with microsatellite-unstable colorectal cancer development//Cancer Res. 2001. Vol. 61 (19). P. 6991-6995.
- Ogino S., Goel A. Molecular classification and correlates in colorectal cancer//J. Mol. Diag. 2008. Vol. 10 (1). P. 13-27. doi: 10.2353/jmoldx.2008.070082.
- Patterson K., Molloy L., Qu W., Clark S. DNA Methylation: Bisulphite Modification and Analysis//J. Vis. Exp. 2011. Vol. 56. pii. 3170. doi: 10.3791/3170.
- Phipps A.I., Limburg P.J., Baron J.A., Burnett-Hartman A.N., Weisenberger D.J., Laird P.W., Sinicrope F.A., Rosty C., Buchanan D.D., Potter J.D., Newcomb P.A. Association Between Molecular Subtypes of Colorectal Cancer and Patient Survival//Gastroenterology. 2015. Vol. 148 (1). P. 77-87 DOI: 10.1053/j.gastro.2014.09.038
- Taniguchi H., Yamazaki K., Yoshino T., Muro K., Yatabe Y., Watanabe T., Ebi H., Ochiai A., Baba E., Tsuchihara K. Japanese Society of Medical Oncology Clinical Guidelines: RAS (KRAS/NRAS) mutation testing in colorectal cancer patients//Cancer Sci. 2015. Vol. 106 (3). P. 324-327 DOI: 10.1111/cas.12595
- de Vogel S., Weijenberg M.P., Herman J.G., Wouters K.A., de Goeij A.F., van den Brandt P.A., de Bruine A.P., van Engeland M. MGMT and MLH1 promoter methylation versus APC, KRAS and BRAF gene mutations in colorectal cancer: indications for distinct pathways and sequence of events//Ann Oncol. 2009. Vol. 20 (7). P. 1216-1222 DOI: 10.1093/annonc/mdn782
- Vogelstein B., Fearon E.R., Hamilton S.R., Kern S.E., Preisinger A.C., Leppert M., Nakamura Y., White R., Smits A.M., Bos J.L. Genetic alterations during colorectal tumor development//N. Engl. J. Med. 1988. Vol. 319 (9). P. 525-532.


