Абскопальный эффект: механизм возникновения и перспективы применения в терапии метастатических форм злокачественных опухолей
Автор: Хачатурян А.В., Булычкин П.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Обзоры
Статья в выпуске: 1 т.23, 2024 года.
Бесплатный доступ
Абскопальный эффект (АЭ) в онкологической практике известен на протяжении 70 лет, однако до последнего времени его клиническая значимость была относительно невелика. Развитие препаратов ингибиторов контрольных точек иммунного ответа привело к активному изучению этого феномена. В настоящее время имеются данные об улучшении выживаемости среди пациентов, у которых регистрировался абскопальный эффект, что открывает новые перспективы лечения онкологических заболеваний различных стадий. В этом обзоре представлены сведения о механизмах абскопального эффекта, экспериментальные и клинические данные, текущие ограничения и возможные перспективы. Цель исследования - изучить современную концепцию возникновения абскопального эффекта, оценить перспективы применения в терапии метастатических форм злокачественных опухолей. Материал и методы исследования. Проведен поиск публикаций в системе Pubmed с 2010 по 2023 г., найдено 286 статей, 72 из них использованы для написания обзора.
Абскопальный эффект, злокачественные новообразования, моноклональные антитела, лучевая терапия, иммунотерапия, иммуноопосредованный противоопухолевый ответ
Короткий адрес: https://sciup.org/140303739
IDR: 140303739 | УДК: 616-006.04-033.2-08 | DOI: 10.21294/1814-4861-2024-23-1-120-129
Текст обзорной статьи Абскопальный эффект: механизм возникновения и перспективы применения в терапии метастатических форм злокачественных опухолей
Несмотря на развитие программ скрининга, злокачественные новообразования (ЗНО) продолжают оставаться одной из ведущих причин смерти в мире. В настоящее время лечение онкологических заболеваний является мультимодальным. Для лечения различных видов ЗНО используется широкий арсенал различных методов лечения [1]. Их можно условно разделить на традиционные и «новые». Наиболее широко используемыми традиционными методами лечения являются хирургическое лечение, химио- и лучевая терапия (ЛТ), которые чаще всего используются в комбинации. К новым методам лечения можно отнести моноклональные антитела, гормональную терапию, блокаторы фактора роста эндотелия сосудов (анти-VEGF-препараты), иммунотерапию и некоторые другие группы препаратов [2].
Практически половина всех пациентов со ЗНО подвергается ЛТ в рамках различных схем лечения [3]. Ионизирующее излучение приводит к разрушению молекулярной структуры ДНК или формированию высокоэнергетических молекул, повреждающих опухолевые клетки [4]. Накопленные вследствие радиоактивного излучения повреждения приводят к программной гибели клетки – апоптозу или некроптозу [4–5]. В настоящее время используется несколько видов ЛТ. Наиболее распространенной является дистанционная ЛТ, которая с помощью линейного ускорителя позволяет облучать область опухоли и минимизировать повреждение окружающих здоровых тканей. Традиционно считалось, что эффект ЛТ ограничивается лишь областью воздействия, однако в 1953 г. была опубликована работа R.H. Mole, в которой впервые был описан феномен противоопухолевой регрессии в местах, которые не подверглись облучению [6]. Данное явление названо абскопальным эффектом (АЭ). В дальнейшем АЭ был описан в единичных клинических случаях, которые касались различных видов рака. В литературе представлены клинические случаи АЭ при гепатоцеллюлярной карциноме, аденокарциномах легких, почечно-клеточном раке, меланоме, а также различных вариантах лейкозов и лимфом.
Патогенез абскопального эффекта
Исходно считалось, что ЛТ обладает иммуносупрессивными свойствами вследствие чувствительности лимфоцитов к ЛТ [7]. При облучении всего тела перед трансплантацией стволовых клеток костного мозга нередко отмечается лимфоцитопе-ния. Показано, что различные типы лимфоцитов имеют неодинаковую степень чувствительности к радиации. При этом В-клетки и наивные Т-клетки обладают высокой радиочувствительностью, в то время как Т-клетки памяти, NK-клетки и Treg-клетки более устойчивы к излучению [8–10]. Однако исследования, посвященные АЭ, выявили, что именно стимуляция иммунной системы является одним из основных механизмов активации противоопухолевого ответа после ЛТ.
В экспериментальных работах на модели фибросаркомы показано, что для эффективного контроля опухолевого роста с помощью ЛТ у мышей с нормальной функцией Т-лимфоцитов требовалась меньшая доза излучения по сравнению с мышами с подавленной функцией. Кроме этого, риск развития метастатического поражения был выше у мышей с пониженным количеством Т-лимфоцитов [11]. В дальнейшем эти данные подтверждены S. Demaria et al., по данным которых ответ опухоли на ЛТ в комбинации с Flt3-L (лигандом, стимулирующим продукцию дендритных клеток) зависел от функции Т-лимфоцитов, мыши с Т-клеточным иммунодефицитом продемонстрировали отсут-
Актива ция синтеза N-
/ Activation nt II N-l synthesis
Активация I лимфоцитов
Опухоль под воздействием
ЛТ/ Tumor under the influence of radiation
Опухолевые клетки / итог ce s
Цитозольная диДНК/
Cytosolic dsDNA
Activation of
CD8+T lymphocytes
Reduction of distant metastatic foci
Созревание
ДНК/DNA maturation
Иммунотерапия/
Immunotherapy
Облучение/
Irradiation
Уменьшение отдаленных мстастатисти чески очагов/
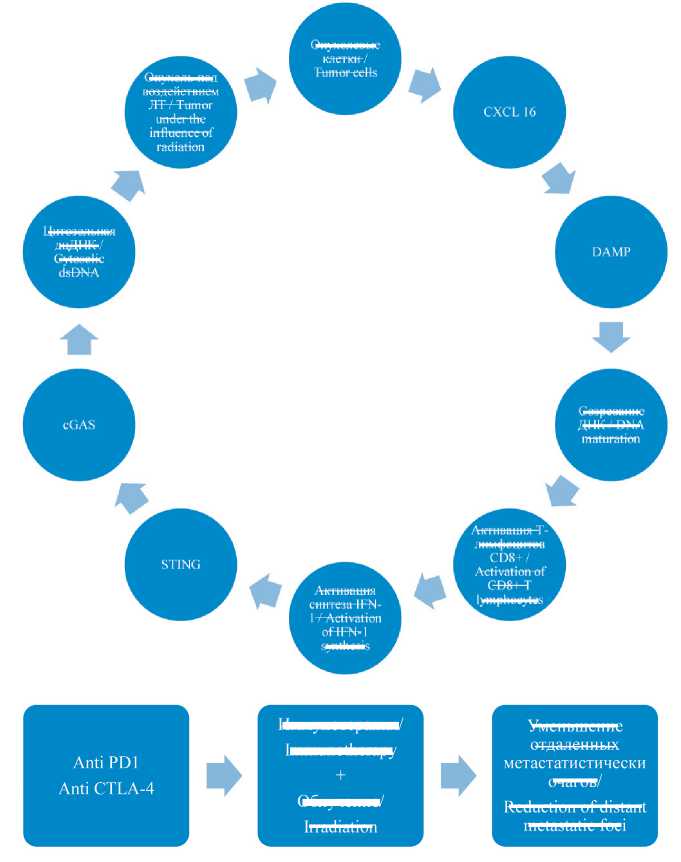
Рис. 1. Схема патогенеза абскопального эффекта при лучевой терапии: cGAS – циклическая;
GMP-AMP – синтаза; STING – стимулятор гена интерферона; IFN-1 – интерферон 1; ДК – дендритные клетки;
DAMP – молекулярные фрагменты, ассоциированные с повреждением. Примечание: рисунок выполнен авторами Fig. 1. Scheme of pathogenesis of the abscopal effect during radiation therapy: cGAS – cyclic; GMP-AMP – synthase; STING – stimulator of interferon genes; IFN-1 – interferon 1; DC – dendritic cells; DAMPs – damage-associated molecular patterns. Note: created by the authors
Рис. 2. Схема абскопального эффекта на фоне комбинированной терапии.
Примечание: рисунок выполнен авторами Fig. 2. Scheme of the abscopal effect during combination therapy.
Note: created by the authors ствие противоопухолевого ответа на фоне комбинированной терапии [12].
Иммуноопосредованный противоопухолевый ответ основан на совместной работе различных звеньев иммунной системы (рис. 1, 2). Первичный противоопухолевый ответ опосредован дендритными клетками (ДК), которые осуществляют презентацию антигена, тем самым активируя Т-клетки [13]. Продемонстрировано, что гибель клеток, вызванная ЛТ, приводит к усилению презентации антигенов ДК и стимуляции Т-лимфоцитов с помощью Toll-Like Receptor 4 (TLR4) и интерферона 1-го типа (IFN-1) [14–15]. Еще одним важным звеном межклеточного взаимодействия является молекула клеточной адгезии ICAM-1 [16]. Исследования, в которых проводилась количественная оценка с помощью ПЭТ, продемонстрировали, что повышенная экспрессия ICAM-1 связана с лучшим ответом на ЛТ и более высокой частотой АЭ [17]. В другой работе выявлена положительная корреляция количества CD8+ и экспрессии ICAM-1. В этой же работе была подтверждена связь АЭ с иммунной системой путем ингибирования ICAM-1 и применения анти-CD8+ аутоантител, что приводило к нивелированию АЭ после ЛТ [18]. Важным элементом эффективного противоопухолевого ответа является изменение микроокружения опухоли и высвобождение радиационно-индуцированных хемокинов. Активация продукции хемокинов, в частности CXCL16, приводит к увеличению миграции и инфильтрации опухолевого микроокружения цитотоксическими Т-лимфоцитами [19]. В свою очередь, повышение продукции CXCL12 приводит к хемотаксису проонкогенных CD11b+ миелоидных клеток и ослаблению частоты возникновения апоптоза [20–21].
Некоторые работы продемонстрировали отрицательный вклад бета-адренэрической стимуляции на формирование АЭ. Норадреналин приводит к уменьшению активации Т-лимфоцитов, а блокада бета-адренорецепторов ведет к увеличению экспрессии рецепторов CXCR3/CXCL9, способствующих миграции Т-лимфоцитов в область опухоли. Применение бета-блокатора пропранолола при- водило к значимому увеличению концентрации молекул (IFNγ+, GzmB+, TNFα+ и T-bet+), способствующих активации CD8+ Т-лимфоцитов [22].
Еще одним звеном, которое играет важную роль в возникновении АЭ, является высвобождение молекулярных фрагментов, ассоциированных с повреждением ( damage-associated molecular pattern – DAMP ). Эти молекулы высвобождаются в ответ на некроптоз или иммунное повреждение опухолевых клеток вследствие облучения [23]. Такими молекулами являются кальретикулин, белок high-mobility group box 1 ( HMGB1 ), белки теплового шока, аденозин-5-фосфат [24]. Макрофаги активно выделяют HMGB1 , в то время как при некроптозе происходит пассивное увеличение концентрации, которая приводит к активации CD8+ T-клеток и увеличению IFN-γ, что, в свою очередь, приводит к дополнительному некротическому повреждению опухолевых клеток [25]. Презентация антигенов происходит посредством TLR рецепторов [26].
Одним из основных механизмов противоопухолевого ответа ЛТ является прямое разрушение связей двухцепочечной ДНК и формирование свободных радикалов, которые вторично приводят к структурным нарушениям ДНК опухолевой клетки [27]. Двухцепочечные разрывы приводят к наиболее серьезным нарушениям функционирования клетки и запуску запрограммированной смерти клетки. Цитозольные ферменты, в частности циклической GMP-AMP-синтазы ( cGAS ), которая связывается с двухцепочечной ДНК, приводят к возникновению каскада реакций, с увеличением продукции IFN I типа через активацию cGAS-STING сигнального пути [28]. По данным экспериментальных исследований, выраженность активации cGAS-STING в значительной степени зависит от дозы излучения.
Регуляция данного эффекта осуществляется в основном за счет продукции экзонуклеазы TREX1, которая влечет ослабление противоопухолевого иммунного ответа. Было продемонстрировано, что экспрессия TREX1 зависела от пороговых значений дозы облучения. В экспериментальной работе схема облучения 8 Гр × 3 не приводила к увеличению экспрессии TREX1 , в отличие от разовой дозы 20 и 30 Гр [29]. Применение препаратов анти-CTLA-4 в комбинации с различными дозами радиации на модели аденокарциномы молочной железы продемонстрировало различные эффекты. АЭ на фоне анти- CTLA-4 отмечался только у мышей, получающих дозу облучения по схеме 8 Гр × 3, в то время как разовое облучение 30 Гр не приводило к АЭ [30].
Влияние режима облученияна частоту абскопального эффекта
Наличию одной-единственной «идеальной» дозы облучения, которая является предиктором АЭ, противоречат некоторые клинические исследова- ния. В работе, посвященной оценке различных доз облучения на фоне пембролизумаба у пациентов с метастатическим немелкоклеточным раком легкого (НМРЛ) или меланомой, фракционированная схема (8 Гр × 3) и разовая доза 17 Гр в равной степени приводили к возникновению АЭ даже в случаях с предшествующей резистентностью к анти-PD-1 препаратам [31].
Имеются данные о частоте возникновения АЭ на фоне комбинированного применения высоких и низких доз облучения. У мышей с 344SQ аденокарциномой легкого использование высокодо-зной стереотаксической ЛТ (H-XRT) первичного очага (12 Гр 3 раза) в комбинации с низкодозовым облучением отдаленных метастазов (1 Гр 2 раза) на фоне анти-PD1 + анти-CTLA-4-терапии продемонстрировало улучшение онкологических исходов по сравнению с монотерапией анти-PD1 + + анти-CTLA-4. Использование комбинированного протокола привело к увеличение инфильтрации опухолевых очагов NK-клетками и макрофагов М1, ассоциированных с опухолью [32]. Данный подход получил название RadScopal. Аналогичные результаты были получены в работе, посвященной комбинированной терапии RadScopal + анти- PD-1 + + анти-TIGIT [33].
Радиационное повреждение не всегда приводит к непосредственному некроптозу и апоптозу вследствие прямого повреждения ДНК. ЛТ способна изменять фенотип клеток, который повышает уязвимость опухоли для клетки иммунной системы. Происходит повышенная выработка иммуногенных антигенов ( MHC1, MUC1 , CEA ) и активация соответствующих специфических CD8+ Т-лимфоцитов [34–35].
На данный момент в исследованиях по оценке АЭ в рамках изолированной ЛТ представлено небольшое количество клинических случаев. Так, в систематическом обзоре Y. Abuodeh et al. [36] описано всего 46 клинических случаев АЭ на фоне лучевой терапии без использования ИИКТ. В настоящее время продолжаются исследования протокола прицельного облучения гипоксического сегмента опухоли SBRT-PATHY. В пилотном исследовании, включающем 33 пациентов, продемонстрированы обнадеживающие результаты. В ходе исследования с помощью ПЭТ и контрастной КТ определялась переходная область между некротическим ядром и периферической гиперваскуляризированной зоной. Облучение переходной зоны осуществлялось по протоколу 10–12 Гр от 1 до 3 фракций, при этом облучение отдаленных лимфатических узлов не выполнялось для оценки АЭ. После 9-месячного наблюдения ответ на ЛТ в переходной области отмечался у 96 %, АЭ – у 52 % пациентов, выживаемость без прогрессирования составляла 87 %, общая выживаемость – 70 %. Возможно, что такой подход является перспективным для применения в клинической практике, однако требуется подтверждение полученных данных в более крупных исследованиях [37].
Исследование по оценке интраоперационного облучения при лампэктомии (TARGIT-IORT) продемонстрировало результаты по выживаемости, сравнимые с дистанционной ЛТ, однако интересным открытием работы являлось то, что в группе TARGIT-IORT локальный рецидив не ухудшал выживаемость, в отличие от группы пациентов с дистанционной ЛТ. Авторы предполагают, что одним из возможных объяснений является интраоперационная травма в комбинации с лучевым повреждением и сопутствующей активацией иммунного ответа, которые в конечном итоге выражаются в АЭ на протяжении довольно длительного времени: средняя выживаемость после выявления местных рецидивов в группе TARGIT-IORT составила 8,7 года, а в группе дистанционной ЛТ – 6,1 года [38]. Эти данные указывают на необходимость индивидуализации дозы ЛТ для каждого вида опухоли, и даже относительно одного типа опухоли продолжаются исследования, которые направлены на поиск оптимальной дозы, позволяющей достигнуть максимальный иммуногенный ответ.
Абскопальный эффект в эру иммунной терапии
Опухолевые клетки способны вырабатывать механизмы, снижающие активность иммунного противоопухолевого ответа, в частности, это активация сигнального пути PD-1 путем взаимодей- ствия с лигандом PD-L1, который располагается на мембране опухолевой клетки [39]. Частота встречаемости данного лиганда в значительной степени зависит от вида опухоли и составляет 20–50 % от всех опухолей [40–41]. Другим наиболее важным рецептором, который приводит к ингибированию активности Т-лимфоцитов, является цитотоксический T-лимфоцит-ассоциированный антиген-4 (CTLA-4) [42]. Исследования в данной области привели к созданию целого ряда препаратов ингибиторов контрольных точек иммунного ответа (ИКТИ), позволяющих преодолевать резистентность опухоли к воздействию иммунной системы [38]. К таким препаратам относятся моноклональные антитела к PD-1, PD-L1 и CTLA-4 [43]. Следствием ингибирования этих рецепторов является потеря опухолевой клеткой инструментов ускользания от иммунного ответа организма и активации противоопухолевого ответа [44]. Исследования по частоте АЭ при иммунной терапии представлены в таблице.
Абскопальный эффектна фоне анти-CTLA-4-терапии
Доклинические и клинические исследования продемонстрировали эффективность анти-CTLA-4-терапии. В частности, при метастатической меланоме терапия ипилимумабом приводила к эффективному контролю заболевания и улучшению выживаемости, в связи с чем FDA одобрило применение данного препарата в клинической практике [44–46]. Использование анти-CTLA-4
Таблица/Table
Частота абскопального эффекта на фоне комбинированной терапии ИИКТ и ЛТ Frequency of the abscopal effect during combined therapy with ISCs and RT
|
Исследование/Study |
Опухоль/Tumor |
ГодYear |
Системная терапия/ЛТ/ Systemic therapy/RT |
Частота АЭ/ AE frequency |
|
NCT02474186 [45] |
Несколько типов/ Several types |
2015 |
Терапия GM-CSF и химиотерапия/ GM-CSF therapy and chemotherapy; 35 Гр/10 фракций/35 Gy/10 fractions |
27 |
|
ChiCTR-1900027768 [46] |
Рак легкого/ Lung cancer |
2021 |
Ниволумаб/Nivolumab; 4–50 Гр/5 фракции и гипофракционная брахитерапия/ 4–50 Gy/5 fractions and hypofractional brachytherapy |
45,2 |
|
NCT02239900 [47] |
Несколько типов/ Several types |
2019 |
Ипилимумаб/Ipilimumab; 50–60 Гр/4–10 фракций/50–60 Gy/4–10 fractions |
26 |
|
NCT03450967 [48] |
Плоскоклеточный рак головы и шеи/ Squamous cell carcinoma of the head and neck |
2021 |
Дурвалумаб и тремелимумаб/ Durvalumab and tremelimumab; Стереотаксическая радиохирургия/ Stereotactic radiosurgery |
27,3 |
|
NCT02492568 [49] |
Рак легкого/ Lung cancer |
2021 |
Пембразумаб/Pembrasumab; 24 Гр/3 фракции или 50 Гр/4 фракции, или 45 Гр/15 фракций/ 24 Gy/3 fractions or 50 Gy/4 fractions or 45 Gy/15 fractions |
41,7 |
Список литературы Абскопальный эффект: механизм возникновения и перспективы применения в терапии метастатических форм злокачественных опухолей
- Debela D.T., Muzazu S.G., Heraro K.D., Ndalama M.T., Mesele B.W., Haile D.C., Kitui S.K., Manyazewal T. New approaches and procedures for cancer treatment: Current perspectives. SAGE Open Med. 2021; 9. https://doi.org/10.1177/20503121211034366.
- Charmsaz S., Collins D.M., Perry A.S., Prencipe M. Novel Strategies for Cancer Treatment: Highlights from the 55th IACR Annual Conference. Cancers (Basel). 2019; 11(8): 1125. https://doi.org/10.3390/cancers11081125.
- Delaney G., Jacob S., Featherstone C., Barton M. The role of radio-therapy in cancer treatment: estimating optimal utilization from a review of evidence-based clinical guidelines. Cancer. 2005; 104(6): 1129-37. https://doi.org/10.1002/cncr.21324. Erratum in: Cancer. 2006; 107(3): 660.
- Azzam E.I., Jay-Gerin J.P., Pain D. Ionizing radiation-induced metabolic oxidative stress and prolonged cell injury. Cancer Lett. 2012; 327(1-2): 48-60. https://doi.org/10.1016/j.canlet.2011.12.012.
- Chen H., Han Z., Luo Q., Wang Y., Li Q., Zhou L., Zuo H. Radio-therapy modulates tumor cell fate decisions: a review. Radiat Oncol. 2022; 17(1): 196. https://doi.org/10.1186/s13014-022-02171-7.
- Mole R.H. Whole body irradiation; radiobiology or medicine? Br J Radiol. 1953; 26(305): 234-41. https://doi.org/10.1259/0007-1285-26-305-234.
- Wirsdörfer F., Jendrossek V. The Role of Lymphocytes in Radio-therapy-Induced Adverse Late Effects in the Lung. Front Immunol. 2016; 7: 591. https://doi.org/10.3389/fimmu.2016.00591.
- Belka C., Ottinger H., Kreuzfelder E., Weinmann M., Lindemann M., Lepple-Wienhues A., Budach W., Grosse-Wilde H., Bamberg M. Impact of localized radiotherapy on blood immune cells counts and function in humans. Radiother Oncol. 1999; 50(2): 199-204. https://doi.org/10.1016/s0167-8140(98)00130-3.
- Yao Z., Jones J., Kohrt H., Strober S. Selective resistance of CD44hi T cells to p53-dependent cell death results in persistence of immunologic memory after total body irradiation. J Immunol. 2011; 187(8): 4100-8. https://doi.org/10.4049/jimmunol.1101141.
- Kachikwu E.L., Iwamoto K.S., Liao Y.P., DeMarco J.J., Agazaryan N., Economou J.S., McBride W.H., Schaue D. Radiation enhances regulatory T cell representation. Int J Radiat Oncol Biol Phys. 2011; 81(4): 1128-35. https://doi.org/10.1016/j.ijrobp.2010.09.034.
- Slone H.B., Peters L.J., Milas L. Effect of Host Immune Capability on Radiocurability and Subsequent Transplantability of a Murine Fibrosarcoma2. JNCI: Journal of the National Cancer Institute. 1979; 63(5): 1229-35. https://doi.org/10.1093/jnci/63.5.1229.
- Demaria S., Ng B., Devitt M.L., Babb J.S., Kawashima N., Liebes L., Formenti S.C. Ionizing radiation inhibition of distant untreated tumors (abscopal effect) is immune mediated. Int J Radiat Oncol Biol Phys. 2004; 58(3): 862-70. https://doi.org/10.1016/j.ijrobp.2003.09.012.
- Marciscano A.E., Anandasabapathy N. The role of dendritic cells in cancer and anti-tumor immunity. Semin Immunol. 2021; 52. https://doi.org/10.1016/j.smim.2021.101481.
- ApetohL.,Ghiringhelli F.,TesniereA.,ObeidM.,OrtizC.,CriolloA., Mignot G., Maiuri M.C., Ullrich E., Saulnier P., Yang H., Amigorena S., Ryffel B., Barrat F.J., Saftig P., Levi F., Lidereau R., Nogues C., Mira J.P., ChompretA.,Joulin V.,Clavel-Chapelon F.,BourhisJ.,André F.,DelalogeS., Tursz T., Kroemer G., Zitvogel L. Toll-like receptor 4-dependent contribution of the immune system to anticancer chemotherapy and radiotherapy. Nat Med. 2007; 13(9): 1050-9. https://doi.org/10.1038/nm1622.
- Burnette B.C., Liang H., Lee Y., Chlewicki L., Khodarev N.N., Weichselbaum R.R., Fu Y.X., Auh S.L. The efficacy of radiotherapy relies upon induction of type i interferon-dependent innate and adaptive immunity. Cancer Res. 2011; 71(7): 2488-96. https://doi.org/10.1158/0008-5472.CAN-10-2820.
- Bui T.M., Wiesolek H.L., Sumagin R. ICAM-1: A master regulator of cellular responses in inflammation, injury resolution, and tumorigenesis. J Leukoc Biol. 2020; 108(3): 787-99. https://doi.org/10.1002/JLB.2MR0220-549R.
- Yang L., Froio R.M., Sciuto T.E., Dvorak A.M., Alon R., Luscinskas F.W. ICAM-1 regulates neutrophil adhesion and transcellular migration of TNF-α-activated vascular endothelium under flow. Blood. 2005; 106(2): 584-92. https://doi.org/10.1182/blood-2004-12-4942.
- Zhao Y., Zhang T., Wang Y., Lu D., Du J., Feng X., Zhou H., Liu N., Zhu H., Qin S., Liu C., Gao X., Yang Z., Liu Z. ICAM-1 orchestrates the abscopal effect of tumor radiotherapy. Proc Natl Acad Sci USA. 2021; 118(14). https://doi.org/10.1073/pnas.2010333118.
- Matsumura S., Wang B., Kawashima N., Braunstein S., Badura M., Cameron T.O., Babb J.S., Schneider R.J., Formenti S.C., Dustin M.L., Demaria S. Radiation-induced CXCL16 release by breast cancer cells attracts effector T cells. J Immunol. 2008; 181(5): 3099-107. https://doi.org/10.4049/jimmunol.181.5.3099.
- Kozin S.V., Kamoun W.S., Huang Y., Dawson M.R., Jain R.K., Duda D.G. Recruitment of myeloid but not endothelial precursor cells facilitates tumor regrowth after local irradiation. Cancer Res. 2010; 70(14): 5679-85. https://doi.org/10.1158/0008-5472.CAN-09-4446.
- Koch C., Fischer N.C., Puchert M., Engele J. Interactions of the chemokines CXCL11 and CXCL12 in human tumor cells. BMC Cancer. 2022; 22(1): 1335. https://doi.org/10.1186/s12885-022-10451-4.
- Chen M., Qiao G., Hylander B.L., Mohammadpour H., Wang X.Y., Subjeck J.R., Singh A.K., Repasky E.A. Adrenergic stress constrains the development of anti-tumor immunity and abscopal responses following local radiation. Nat Commun. 2020; 11(1): 1821. https://doi.org/10.1038/s41467-020-15676-0.
- Bao X., Xie L. Targeting purinergic pathway to enhance radio-therapy-induced immunogenic cancer cell death. J Exp Clin Cancer Res. 2022; 41(1): 222. https://doi.org/10.1186/s13046-022-02430-1.
- Rapoport B.L., Anderson R. Realizing the Clinical Potential of Immunogenic Cell Death in Cancer Chemotherapy and Radiotherapy. Int J Mol Sci. 2019; 20(4): 959. https://doi.org/10.3390/ijms20040959.
- Liao Y., Liu S., Fu S., Wu J. HMGB1 in Radiotherapy: A Two Headed Signal Regulating Tumor Radiosensitivity and Immunity. Onco Targets Ther. 2020; 13: 6859-71. https://doi.org/10.2147/OTT.S253772.
- Kono K., Mimura K., Kiessling R. Immunogenic tumor cell death induced by chemoradiotherapy: molecular mechanisms and a clinical translation. Cell Death Dis. 2013; 4(6). https://doi.org/10.1038/cddis.2013.207.
- Lippert T.P., Greenberg R.A. The abscopal effect: a sense of DNA damage is in the air. Journal of Clinical Investigation. 2021; 131(9). https://doi.org/10.1172/JCI148274.
- Li A., Yi M., Qin S., Song Y., Chu Q., Wu K. Activating cGAS-STING pathway for the optimal effect of cancer immunotherapy. J Hematol Oncol. 2019; 12(1): 35. https://doi.org/10.1186/s13045-019-0721-x.
- Vanpouille-Box C., Alard A., Aryankalayil M.J., Sarfraz Y., Diamond J.M., Schneider R.J., Inghirami G., Coleman C.N., Formenti S.C., Demaria S. DNAexonuclease Trex1 regulates radiotherapy-induced tumour immunogenicity. Nat Commun. 2017; 8. https://doi.org/10.1038/ncomms15618.
- Dewan M.Z., Galloway A.E., Kawashima N., Dewyngaert J.K., Babb J.S., Formenti S.C., Demaria S. Fractionated but not single-dose radiotherapy induces an immune-mediated abscopal effect when combined with anti-CTLA-4 antibody. Clin Cancer Res. 2009; 15(17): 5379-88. https://doi.org/10.1158/1078-0432.CCR-09-0265.
- Maity A., Mick R., Huang A.C., George S.M., Farwell M.D., Lukens J.N., Berman A.T., Mitchell T.C., Bauml J., Schuchter L.M., O’Hara M., Lin L.L., Demichele A., Christodouleas J.P., Haas N.B., Patsch D.M., Hahn S.M., Minn A.J., Wherry E.J., Vonderheide R.H. Aphase I trial of pembrolizumab with hypofractionated radiotherapy in patients with metastatic solid tumours. Br J Cancer. 2018; 119(10): 1200-7. https://doi.org/10.1038/s41416-018-0281-9.
- Barsoumian H.B., Ramapriyan R., Younes A.I., Caetano M.S., Menon H., Comeaux N.I., Cushman T.R., Schoenhals J.E., Cadena A.P., Reilly T.P., Chen D., Masrorpour F., Li A., Hong D.S., Diab A., Nguyen Q.N., Glitza I., Ferrarotto R., Chun S.G., Cortez M.A., Welsh J. Low-dose radiation treatment enhances systemic antitumor immune responses by overcoming the inhibitory stroma. J Immunother Cancer. 2020; 8(2). https://doi.org/10.1136/jitc-2020-000537.
- Barsoumian H.B., Sezen D., Menon H., Younes A.I., Hu Y., He K., Puebla-Osorio N., Wasley M., Hsu E., Patel R.R., Yang L., Cortez M.A., Welsh J.W. High Plus Low Dose Radiation Strategy in Combination with TIGIT and PD1 Blockade to Promote Systemic Antitumor Responses. Cancers (Basel). 2022; 14(1): 221. https://doi.org/10.3390/cancers14010221.
- Malamas A.S., Gameiro S.R., Knudson K.M., Hodge J.W. Sublethal exposure to alpha radiation (223Ra dichloride) enhances various carcinomas’ sensitivity to lysis by antigen-specific cytotoxic T lymphocytes through calreticulin-mediated immunogenic modulation. Oncotarget. 2016; 7(52): 86937-47. https://doi.org/10.18632/oncotarget.13520.
- Punnanitinont A., Kannisto E.D., Matsuzaki J., Odunsi K., Yendamuri S., Singh A.K., Patnaik S.K. Sublethal Radiation Affects Antigen Processing and Presentation Genes to Enhance Immunogenicity of Cancer Cells. Int J Mol Sci. 2020; 21(7): 2573. https://doi.org/10.3390/ijms21072573.
- Abuodeh Y., Venkat P., Kim S. Systematic review of case reports on the abscopal effect. Curr Probl Cancer. 2016; 40(1): 25-37. https://doi.org/10.1016/j.currproblcancer.2015.10.001.
- Tubin S., Popper H.H., Brcic L. Novel stereotactic body radiation therapy (SBRT)-based partial tumor irradiation targeting hypoxic segment of bulky tumors (SBRT-PATHY): improvement of the radiotherapy outcome by exploiting the bystander and abscopal effects. Radiat Oncol. 2019; 14(1): 21. https://doi.org/10.1186/s13014-019-1227-y.
- Vaidya J.S., Bulsara M., Baum M., Wenz F., Massarut S., Pigorsch S., Alvarado M., Douek M., Saunders C., Flyger H., Eiermann W., Brew-Graves C., Williams N.R., Potyka I., Roberts N., Bernstein M., Brown D., Sperk E., Laws S., Sütterlin M., Corica T., Lundgren S., Holmes D., Vinante L., Bozza F., Pazos M., Blanc-Onfroy M.L., Gruber G., Polkowski W., Dedes K.J., Niewald M., Blohmer J., McReady D., Hoefer R., Kelemen P., Petralia G., Falzon M., Joseph D., Tobias J.S. New clinical and biological insights from the international TARGIT-A randomised trial of targeted intraoperative radiotherapy during lumpectomy for breast cancer. Br J Cancer. 2021; 125(3): 380-9. https://doi.org/10.1038/s41416-021-01440-8.
- Han Y., Liu D., Li L. PD-1/PD-L1 pathway: current researches in cancer. Am J Cancer Res. 2020; 10(3): 727-42.
- Chen D.S., Mellman I. Oncology meets immunology: the cancer-immunity cycle. Immunity. 2013; 39(1): 1-10. https://doi.org/10.1016/j.immuni.2013.07.012.
- Yu H., Boyle T.A., Zhou C., Rimm D.L., Hirsch F.R. PD-L1 Expression in Lung Cancer. J Thorac Oncol. 2016; 11(7): 964-75. https://doi.org/10.1016/j.jtho.2016.04.014. Erratum in: J Thorac Oncol. 2017; 12 (1): 157-9.
- Salama A.K., Hodi F.S. Cytotoxic T-lymphocyte-associated antigen-4. Clin Cancer Res. 2011; 17(14): 4622-8. https://doi.org/10.1158/1078-0432.CCR-10-2232.
- Seledtsov V.I., Seledtsova G.V., Dorzhieva A.B., Ivanova I.P. Immunoterapiya v kompleksnom lechenii opukholevykh zabolevanii. Sibirskii onkologicheskii zhurnal. 2022; 21(2): 118-29. https://doi.org/10.21294/1814-4861-2022-21-2-118-129.
- Tsarev I.L., Melerzanov A.V. Obzor podkhodov k immunoterapii v onkologii. Research’n Practical Medicine Journal. 2017; 4(3): 51-65. https://doi.org/10.17709/2409-2231-2017-4-3-5.
- Golden E.B., Chhabra A., Chachoua A., Adams S., Donach M., Fenton-Kerimian M., Friedman K., Ponzo F., Babb J.S., Goldberg J., Demaria S., Formenti S.C. Local radiotherapy and granulocyte-macrophage colony-stimulating factor to generate abscopal responses in patients with metastatic solid tumours: a proof-of-principle trial. Lancet Oncol. 2015; 16(7): 795-803. https://doi.org/10.1016/S1470-2045(15)00054-6.
- Ye H., Pang H., Shi X., Ren P., Huang S., Yu H., Wu J., Lin S. Nivolumab and Hypofractionated Radiotherapy in Patients WithAdvanced Lung Cancer: ABSCOPAL-1 Clinical Trial. Front Oncol. 2021; 11. https://doi.org/10.3389/fonc.2021.657024.
- Bahig H., Aubin F., Stagg J., Gologan O., Ballivy O., Bissada E., Nguyen-Tan F.P., Soulières D., Guertin L., Filion E., Christopoulos A., Lambert L., Tehfe M., Ayad T., Charpentier D., Jamal R., Wong P. Phase I/II trial of Durvalumab plus Tremelimumab and stereotactic body radiotherapy for metastatic head and neck carcinoma. BMC Cancer. 2019; 19(1): 68. https://doi.org/10.1186/s12885-019-5266-4.
- Kim H., Ahn M.J., Oh D., Park S., Jung H.A., Lee S.H., Park K., Ahn Y.C. Phase II trial of combined durvalumab plus tremelimumab with proton therapy to boost the abscopal effect for recurrent or metastatic head and neck squamous cell carcinoma. JCO. 2021; 39(15s). https://doi.org/10.1200/JCO.2021.39.15_suppl.6034.
- Theelen W.S.M.E., Chen D., Verma V., Hobbs B.P., Peulen H.M.U., Aerts J.G.J.V., Bahce I., Niemeijer A.L.N., Chang J.Y., de Groot P.M., Nguyen Q.N., Comeaux N.I., Simon G.R., Skoulidis F., Lin S.H., He K., Patel R., Heymach J., Baas P., Welsh J.W. Pembrolizumab with or without radiotherapy for metastatic non-small-cell lung cancer: a pooled analysis of two randomised trials. Lancet Respir Med. 2021; 9(5): 467-75. https://doi.org/10.1016/S2213-2600(20)30391-X. Erratum in: Lancet Respir Med. 2021; 9(3).
- Hodi F.S., O’Day S.J., McDermott D.F., Weber R.W., Sosman J.A., Haanen J.B., Gonzalez R., Robert C., Schadendorf D., Hassel J.C., Akerley W., van den Eertwegh A.J., Lutzky J., Lorigan P., Vaubel J.M., Linette G.P., Hogg D., Ottensmeier C.H., Lebbé C., Peschel C., Quirt I., Clark J.I., Wolchok J.D., Weber J.S., Tian J., Yellin M.J., Nichol G.M., Hoos A., Urba W.J. Improved survival with ipilimumab in patients with metastatic melanoma. N Engl J Med. 2010; 363(8): 711-23. https://doi.org/10.1056/NEJMoa1003466. Erratum in: N Engl J Med. 2010; 363(13): 1290.
- Vaddepally R.K., Kharel P., Pandey R., Garje R., Chandra A.B. Review of Indications of FDA-Approved Immune Checkpoint Inhibitors per NCCN Guidelines with the Level of Evidence. Cancers (Basel). 2020; 12(3): 738. https://doi.org/10.3390/cancers12030738.
- Small E.J., Tchekmedyian N.S., Rini B.I., Fong L., Lowy I., Allison J.P. A pilot trial of CTLA-4 blockade with human anti-CTLA-4 in patients with hormone-refractory prostate cancer. Clin Cancer Res. 2007; 13(6): 1810-5. https://doi.org/10.1158/1078-0432.CCR-06-2318.
- Bertrand A., Kostine M., Barnetche T., Truchetet M.E., Schaeverbeke T. Immune related adverse events associated with anti-CTLA-4 antibodies: systematic review and meta-analysis. BMC Med. 2015; 13: 211. https://doi.org/10.1186/s12916-015-0455-8.
- Formenti S.C., Rudqvist N.P., Golden E., Cooper B., Wennerberg E., Lhuillier C., Vanpouille-Box C., Friedman K., Ferrari de Andrade L., Wucherpfennig K.W., Heguy A., Imai N., Gnjatic S., Emerson R.O., Zhou X.K., Zhang T., Chachoua A., Demaria S. Radiotherapy induces responses of lung cancer to CTLA-4 blockade. Nat Med. 2018; 24(12): 1845-51. https://doi.org/10.1038/s41591-018-0232-2.
- Theurich S., Rothschild S.I., Hoffmann M., Fabri M., Sommer A., Garcia-Marquez M., Thelen M., Schill C., Merki R., Schmid T., Koeberle D., Zippelius A., Baues C., Mauch C., Tigges C., Kreuter A., Borggrefe J., von Bergwelt-Baildon M., Schlaak M. Local Tumor Treatment in Combination with Systemic Ipilimumab Immunotherapy Prolongs Overall Survival in Patients with Advanced Malignant Melanoma. Cancer Immunol Res. 2016; 4(9): 744-54. https://doi.org/10.1158/2326-6066.CIR-15-0156.
- Chicas-Sett R., Morales-Orue I., Rodriguez-Abreu D., Lara-Jimenez P. Combining radiotherapy and ipilimumab induces clinically relevant radiation-induced abscopal effects in metastatic melanoma patients: A systematic review. Clin Transl Radiat Oncol. 2017; 9: 5-11. https://doi.org/10.1016/j.ctro.2017.12.004.
- Latchman Y., Wood C.R., Chernova T., Chaudhary D., Borde M., Chernova I., Iwai Y., Long A.J., Brown J.A., Nunes R., Greenfield E.A., Bourque K., Boussiotis V.A., Carter L.L., Carreno B.M., Malenkovich N., Nishimura H., Okazaki T., Honjo T., Sharpe A.H., Freeman G.J. PD-L2 is a second ligand for PD-1 and inhibits T cell activation. Nat Immunol. 2001; 2(3): 261-8. https://doi.org/10.1038/85330.
- Theelen W.S.M.E., Peulen H.M.U., Lalezari F., van der Noort V., de Vries J.F., Aerts J.G.J.V., Dumoulin D.W., Bahce I., Niemeijer A.N., de Langen A.J., Monkhorst K., Baas P. Effect of Pembrolizumab After Stereotactic Body Radiotherapy vs Pembrolizumab Alone on Tumor Response in Patients With Advanced Non-Small Cell Lung Cancer: Results of the PEMBRO-RT Phase 2 Randomized Clinical Trial. JAMA Oncol. 2019; 5(9): 1276-82. https://doi.org/10.1001/jamaoncol.2019.1478.
- Tree A.C., Jones K., Hafeez S., Sharabiani M.T.A., Harrington K.J., Lalondrelle S., Ahmed M., Huddart R.A. Dose-limiting Urinary Toxicity With Pembrolizumab Combined With Weekly Hypofractionated Radiation Therapy in Bladder Cancer. Int J Radiat Oncol Biol Phys. 2018; 101(5): 1168-71. https://doi.org/10.1016/j.ijrobp.2018.04.070.
- RogerA.,FinetA.,BoruB.,BeauchetA.,MazeronJ.J.,OtzmeguineY., Blom A., Longvert C., de Maleissye M.F., Fort M., Funck-Brentano E., Saiag P. Efficacy of combined hypo-fractionated radiotherapy and anti-PD-1 monotherapy in difficult-to-treat advanced melanoma patients. Oncoimmunology. 2018; 7(7). https://doi.org/10.1080/2162402X.2018.1442166.
- Chen D., Menon H., Verma V., Guo C., Ramapriyan R., Barsoumian H., Younes A., Hu Y., Wasley M., Cortez M.A., Welsh J. Response and outcomes after anti-CTLA4 versus anti-PD1 combined with stereotactic body radiation therapy for metastatic non-small cell lung cancer: retrospective analysis of two single-institution prospective trials. J Immunother Cancer. 2020; 8(1). https://doi.org/10.1136/jitc-2019-000492. Erratum in: J Immunother Cancer. 2020; 8(1).
- Gerber D.E., Urbanic J.J., Langer C., Hu C., Chang I.F., Lu B., Movsas B., Jeraj R., Curran W.J., Bradley J.D. Treatment Design and Rationale for a Randomized Trial of Cisplatin and Etoposide Plus Thoracic Radiotherapy Followed by Nivolumab or Placebo for Locally Advanced Non-Small-Cell Lung Cancer (RTOG 3505). Clin Lung Cancer. 2017; 18(3): 333-9. https://doi.org/10.1016/j.cllc.2016.10.009.
- Bozorgmehr F., Hommertgen A., Krisam J., Lasitschka F., Kuon J., Maenz M., Huber P.E., König L., Kieser M., Debus J., Thomas M., Rieken S. Fostering efficacy of anti-PD-1-treatment: Nivolumab plus radiotherapy in advanced non-small cell lung cancer - study protocol of the FORCE trial. BMC Cancer. 2019; 19(1): 1074. https://doi.org/10.1186/s12885-019-6205-0.
- Bassetti M.F., Sethakorn N., Lang J.M., Schehr J.L., Schultz Z., Morris Z.S., Matkowskyj K.A., Eickhoff J.C., Morris B., Traynor A.M., Duma N., Campbell T.C., Baschnagel A., Leal T. Outcomes and safety analysis of a phase IB trial of stereotactic body radiotherapy (SBRT) to all sites of oligometastatic non-small cell lung cancer combined with durvalumab and tremelimumab. JCO. 2021; 39(15s). https://doi.org/10.1200/JCO.2021.39.15_suppl.e21212.
- Pakkala S., Higgins K., Chen Z., Sica G., Steuer C., Zhang C., Zhang G., Wang S., Hossain M.S., Nazha B., Beardslee T., Khuri F.R., Curran W., Lonial S., Waller E.K., Ramalingam S., Owonikoko T.K. Durvalumab and tremelimumab with or without stereotactic body radiation therapy in relapsed small cell lung cancer: a randomized phase II study. J Immunother Cancer. 2020; 8(2). https://doi.org/10.1136/jitc-2020-001302.
- Leary R., Gardner R.B., Mockbee C., Roychowdhury D.F. Boosting Abscopal Response to Radiotherapy with Sargramostim:AReview of Data and Ongoing Studies. Cureus. 2019; 11(3). https://doi.org/10.7759/cureus.4276.
- Strigari L., Mancuso M., Ubertini V., Soriani A., Giardullo P., Benassi M., D’Alessio D., Leonardi S., Soddu S., Bossi G. Abscopal effect of radiation therapy: Interplay between radiation dose and p53 status. Int J Radiat Biol. 2014; 90(3): 248-55. https://doi.org/10.3109/09553002.2014.874608. Erratum in: Int J Radiat Biol. 2015; 91(3): 294.
- Dovedi S.J., Adlard A.L., Lipowska-Bhalla G., McKenna C., Jones S., Cheadle E.J., Stratford I.J., Poon E., Morrow M., Stewart R., Jones H., Wilkinson R.W., Honeychurch J., Illidge T.M. Acquired resistance to fractionated radiotherapy can be overcome by concurrent PD-L1 blockade. Cancer Res. 2014; 74(19): 5458-68. https://doi.org/10.1158/0008-5472.CAN-14-1258.
- Slovin S.F., Higano C.S., Hamid O., Tejwani S., Harzstark A., Alumkal J.J., Scher H.I., Chin K., Gagnier P., McHenry M.B., Beer T.M. Ipilimumab alone or in combination with radiotherapy in metastatic castration-resistant prostate cancer: results from an open-label, multicenter phase I/II study. Ann Oncol. 2013; 24(7): 1813-21. https://doi.org/10.1093/annonc/mdt107.
- Kwon E.D., Drake C.G., Scher H.I., Fizazi K., Bossi A., van den Eertwegh A.J., Krainer M., Houede N., Santos R., Mahammedi H., Ng S., Maio M., Franke F.A., Sundar S.,Agarwal N., BergmanA.M., Ciuleanu T.E., Korbenfeld E., Sengeløv L., Hansen S., Logothetis C., Beer T.M., McHenry M.B., Gagnier P., Liu D., Gerritsen W.R.; CA184-043 Investigators. Ipilimumab versus placebo after radiotherapy in patients with metastatic castration-resistant prostate cancer that had progressed after docetaxel chemotherapy (CA184-043): a multicentre, randomised, double-blind, phase 3 trial. Lancet Oncol. 2014; 15(7): 700-12. https://doi.org/10.1016/S1470-2045(14)70189-5.
- D’Andrea M.A., Reddy G.K. Immune SystemActivation in Patients with Metastatic Renal Cell Carcinoma Induced by the Systemic Abscopal Effects of Radiation Therapy. Oncol Res Treat. 2023; 46(1-2): 33-44. https://doi.org/10.1159/000527959.
- Zhang X., Zhang Y., Liu Y., Yang Y., Dong P., He L., Zhou F. Stereotactic body radiotherapy-induced abscopal effect twice after pembrolizumab failure in hereditary leiomyomatosis and renal cell carcinoma: a case report with genetic and immunologic analysis. Transl Androl Urol. 2021; 10(11): 4304-12. https://doi.org/10.21037/tau-21-644.


