Абскопальный противоопухолевый эффект, индуцированный радиационным воздействием
Автор: Гривцова Л.Ю., Исаева В.Г., Жовтун Л.П., Самборский С.М., Иванов С.А., Каприн А.Д.
Рубрика: Научные статьи
Статья в выпуске: 2 т.32, 2023 года.
Бесплатный доступ
Радиационно-индуцированный ответ в клинической практике явление редкое, гибель опухолевых клеток в месте облучения далеко не всегда опосредует эффект в отношении отдалённых очагов. В статье рассматривается способ индукции с помощью ионизирующего излучения абскопального противоопухолевого эффекта в экспериментальной модели карциномы Эрлиха - высоко агрессивной асцитной опухоли молочной железы. Для этого провели подкожную одномоментную билатеральную перевивку асцитной карциномы Эрлиха мышам с последующим формированием опухолевых контралатеральных узлов на нижних конечностях. Через 5 сут после перевивки опухоли один из узлов (правый) подвергли ионизирующему воздействию гамма-лучей 60Со в дозе 30 Гр локально однократно. Динамику роста облучённого (мишенного) и не облучённого (немишенного) узлов изучали на протяжении 20 сут после ионизирующего воздействия. Показано, что облучение правого опухолевого узла в дозе 30 Гр на ранней стадии его роста вызывает торможение роста левого опухолевого узла с 10 до 49% по отношению роста опухоли в контрольной группе опухоленосителей. С целью снижения дозовой нагрузки в данной модели изучено влияние фракционированного облучения: по 10 Гр на фракцию до суммарной дозы в 30 Гр. Также изучена способность иммунной системы мышей (с перевитой опухолью в оба бедра и ионизирующим воздействием в дозе 30 Гр на опухолевый узел) отвечать на антигенный стимул. Установлено, что решающее значение в достижении абскопального эффекта имеют дозы ионизирующего излучения. Вероятно, что и подбор взаимодополняющей комбинации терапевтических воздействий, таких как таргетная терапия или иммунотерапия, будет являться дополнительным звеном в достижении изучаемого эффекта.
Абскопальный эффект, ионизирующая радиация, экспериментальные животные, фракционирование дозы, антителообразующие клетки, инбредные мыши, карцинома эрлиха, контрлатеральные узлы, мишенная опухоль, регрессия опухоли, тимусзависимый антиген
Короткий адрес: https://sciup.org/170199706
IDR: 170199706 | УДК: 616-006.04-092.9:612.014.482:615.277.3 | DOI: 10.21870/0131-3878-2023-32-2-110-119
Текст научной статьи Абскопальный противоопухолевый эффект, индуцированный радиационным воздействием
Известно, что лучевая терапия является основным звеном в комплексном лечении онкологических заболеваний и большая часть пациентов с установленным диагнозом получают её на одном из этапов лечения. Однако известно, что лучевое воздействие может быть рассмотрено и как индуктор системных иммунологических реакций, приводящих к развитию противоопухолевого эффекта [1-5]. В последнее время появились экспериментальные разработки, изучающие возможности системной активации иммунитета и реализацию иммуноопосредованного системного противоопухолевого ответа в отношении отдалённых метастазов при воздействии ионизирующего излучения на опухоль, так называемый «абскопальный эффект». Данные исследования предоставляют широкую возможность для разработки новых, более эффективных схем лучевой терапии.
Впервые термин «абскопальный» был введён в 1953 г. Р.Х. Молем для описания радиационных эффектов на расстоянии от облучаемого объёма, но в пределах одного организма [6].
Гривцова Л.Ю. – зав. отдел., к.м.н., д.б.н.; Исаева В.Г.* – вед. науч. сотр., к.б.н.; Жовтун Л.П. – науч. сотр.; Самборский С.М. – лаборант; Иванов С.А. – директор, чл.-корр. РАН, д.м.н., проф. кафедры РУДН. МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России. Каприн А.Д . – ген. директор, директор МНИОИ им. П.А. Герцена, зав. каф. РУДН, акад. РАН, д.м.н., проф. ФГБУ «НМИЦ радиологии» Минздрава России.
Абскопальный эффект вызывает большой интерес [7-9]. За прошедшие годы этот редкий биологический эффект был зарегистрирован для нескольких видов опухолей, включая меланому [10], почечно-клеточный рак [11], гепатоцеллюлярный рак [12] и другие метастатические солидные опухоли [13]. Конкретные механизмы и биологические маркеры, определяющие возможность развития абскопального эффекта, на настоящий момент чётко не определены. Однако, полученные к настоящему времени данные позволяют предположить, что лучевая терапия может индуцировать иммунный ответ организма и, возможно, изменить репертуар иммунокомпетентных клеток или активировать экспрессию в опухоли факторов, создающих иммуногенный фон.
Радиационно-индуцированный иммунный ответ – явление в клинической практике редкое. Активация иммунитета и запуск каскада гибели опухолевых клеток в месте облучения далеко не всегда опосредует эффект в отношении отдалённых очагов. Решающее значение в развитии аб-скопального эффекта имеют дозы излучения и подбор взаимодополняющей комбинации терапевтических воздействий, таких как таргетная терапия или иммунотерапия. Важным, по всей видимости, является и особое состояние иммунной системы реципиента.
В доступной нам литературе предлагается несколько разработанных моделей индукции аб-скопального эффекта. Но в основном изучают не собственно абскопальный эффект (реализация противоопухолевого эффекта на отдалённые, не облучаемые очаги), а эффект исходной иммунной инициации и анализ изменений в облучаемой опухолевой ткани, применяя, например, модель с одной опухолью. Облучение опухолевого очага проводят в дозах от 15 до 30 Гр при усилении эффекта посредством одновременного применения дендритно-клеточных вакцин [2, 14].
Имеется модель, где уничтожение опухоли осуществляется посредством лучевой терапии, а затем этому же животному повторно трансплантируется опухоль, которая не приживается в случае достижения длительного системного противоопухолевого ответа [15].
Используется вариант модели, где опухоль прививается животному внутривенно и формирует органные опухолевые очаги, а затем облучается половина поражённого органа [16]. Однако есть мнение исследователей, что данная модель является неудачной, поскольку контролировать зону облучения затруднительно. Использование же в экспериментальных моделях цитокинов, клеточных вакцин, ингибиторов контрольных точек иммунитета не позволяет оценить собственный эффект лучевого воздействия в развитии абскопального эффекта.
В связи с этим, актуальной представляется разработка оптимальных экспериментальных моделей для изучения иммуноопосредованного антиметастатического воздействия локального облучения.
В работе изложены результаты разработки экспериментальной модели для реализации индуцированного радиацией абскопального эффекта. Исследованы дозы ионизирующего излучения на первичный опухолевый узел, вызывающие абскопальный эффект в немишенном узле и изучена иммунореактивность опухоленосителей на стадии исследуемого эффекта.
Материалы и методы
Исследования проведены на 150 инбредных мышах-самцах гибридов F1 (CBAxC57BL6) с массой тела 24-26 г, полученных из филиала «Андреевка» ФГБУ НЦБМТ ФМБА России. Животных содержали в карантине в соответствии с СОП Ц-ДКИ-045-1. Длительность карантина (акклиматизационного периода) для всех животных составила 14 дней. В течение карантина проводился осмотр животных, оценивалось их поведение и общее состояние. Во время эксперимента животные содержались в соответствии с требованиями приказа Минздравсоцразвития России
№ 708н от 23.08.2010 г. в условиях естественно-искусственного освещения при температуре 20-22 °C и относительной влажности воздуха 60-70%. Животных содержали в поликарбонатных клетках, оборудованных стальными решетчатыми крышками с кормовым углублением. В качестве подстилки использовали простерилизованные древесные стружки. Животные имели свободный доступ к поилкам (вода из центрального водопровода) и брикетированному корму, изготовленному по заказу ООО «Лабораторкорм» РФ (ТУ 10.92.10-006-00933051-2018, изготовитель ОАО «Мелькомбинат», Тверь). Кормление животных осуществлялось по нормативам в соответствии с видом животных. Количество животных в одной клетке – 8-10 особей. Все работы с лабораторными животными выполнены в соответствии с общепринятыми этическими нормами. Санитарные мероприятия были проведены в соответствии с СОП Ц-СОК-058-1.
Исследования проведены на перевиваемой мышиной карциноме молочной железы «Эрлиха». Штамм поддерживался на беспородных мышах в виде асцитной опухоли, перевиваемой внутрибрюшинно в дозе 1x10 6 в объёме 0,1 мл. Трансплантацию карциномы опытным мышам-самцам гибридов F1 (CBAxC57BL6) проводили подкожным введением 7-дневных опухолевых клеток в дозе 1x10 7 в 0,1 мл суспензии в область латеральной поверхности правого и левого бедра, получая солидную форму роста карциномы [17].
Животных включили в опыт на пятые сутки после трансплантации опухолевых клеток, когда билатеральные опухолевые узлы сформировались и достигли измеряемого размера у всех особей. У опытных животных подвергли локальному однократному облучению правый опухолевый узел в дозе 30 Гр или фракционно по 10 Гр до суммарной дозы в 30 Гр. Животные-опухоленоси-тели контрольной группы после трансплантации им опухоли в дальнейшем никаких воздействий не получали. Каждая исследованная группа мышей состояла из 10 особей. Проведено две независимые повторности данного эксперимента (лето, осень).
Животные опытных групп подвергались воздействию ионизирующего излучения в дозе 30 Гр с мощностью 0,532 Гр/мин, которое проводили на стандартной гамма-терапевтической установке, где в качестве источника излучения используется 60Co. Источник имеет форму цилиндра диаметром и высотой 1-2 см и находится внутри радиационной головки аппарата. В рабочем режиме радиационная головка обеспечивает выпуск, формирование и ориентацию пучка гамма-излучения. Поглощение излучения вне заданного поля обеспечивается диафрагмой специальной конструкции. Пучок гамма-излучения подаётся непрерывно. Форма поля, создаваемая аппаратом, прямоугольная с размером 80x80 мм.
Животные во время облучения находились в индивидуальных пластиковых ячейках, которые имели отверстие для вывода в облучаемое поле правой лапы с опухолевым узлом. Лапа фиксировалась к стержню, находящемуся в центре поля. Размер ячейки не позволял особи совершать каких-либо движений. Согласно дозиметрии, проведённой отделом радиационной биофизики МРНЦ им. А.Ф. Цыба, немишенный опухолевый узел получал в этом случае около 2,2% излучаемой дозы, что соответствует 0,66 Гр.
Влияние ионизирующего воздействия на рост опухолевых узлов оценивали путём статистического сравнения их объёмов в контрольной и опытной группах на протяжении 25 сут наблюдения. Для этого измеряли длину и ширину опухолевых узлов на обеих лапах, вычисляя объём опухоли по формуле:
V = (ахв2) /2, где а – больший, а в – меньший размер узла.
Торможение роста опухоли после облучения, если таковое было, вычисляли у каждой особи по отношению к правой или левой лапе контрольных животных. Торможение роста опухоли:
(Vk - Vo )/Vk 100%, где Vk - объём опухолевого узла у контрольной особи; Vo - объём опухолевого узла у опытной особи.
Иммунореактивность облучённых опухоленосителей изучали по способности отвечать на антигенный стимул. В качестве тимусзависимого антигена использовали эритроциты барана в дозе 1x10 8 кл/мышь. Количество антителообразующих клеток в селезёнке оценивали по методу Каннингема [18] на 5 сут после внутрибрюшинного введения антигена.
Статистическую обработку полученных результатов проводили в программе Statistika10.0 (StatSoft, Inc.) с применением методов вариационной статистики. После проверки нормальности распределения вариационных рядов подсчитывали средний показатель и стандартную ошибку среднего (M±SEM). Групповые сравнения количественных показателей проводили с использованием параметрических критериев Фишера и Стьюдента и непараметрического – Манна-Уитни. Различия считались статистически значимыми при р<0,05. Достоверность основных полученных данных подтверждалась также результатами их воспроизведения в двух независимых сериях экспериментов.
Результаты и обсуждение
Как показали результаты исследования (табл. 1), через 6 сут после ионизирующего воздействия объём опухоли (11 сут роста) на правой облучённой лапе уменьшился в 2,3 раза, регрессия опухоли по отношению к контролю была статистически значима и составила 57,1%. Объём опухоли на левой необлучённой лапе незначительно уменьшился по отношению к объёму опухоли на левой контрольной лапе, а регрессия составила 10,3%.
Таблица 1
Динамика роста (М±т) опухолевого штамма карциномы Эрлиха у мышей-самцов F1 (CBAxC57BL6) после локального облучения (5 сут опухолевого роста) правого опухолевого узла в дозе 30 Гр и процент торможения роста опухоли (ТРО)
|
Рост опухоли, сут |
Объём опухоли, см3 |
|||
|
конт |
роль |
опыт |
||
|
правая лапа |
левая лапа |
правая лапа, 30 Гр |
левая лапа |
|
|
6 сут % ТРО |
0,87 ± 0,05 |
0,84 ± 0,1 |
0,91 ± 0,05 |
0,83 ± 0,04 |
|
8 сут % ТРО |
0,74 ± 0,03 |
0,76 ± 0,04 |
0,7 ± 0,03 5,4% |
0,86 ± 0,07 -13,2% |
|
11 сут % ТРО |
0,91 ± 0,04 |
0,97 ± 0,11 |
0,39 ± 0,02* 57,1% |
0,87 ± 0,06 10,3% |
|
13 сут % ТРО |
1,36 ± 0,08 |
1,48 ± 0,12 |
0,22 ± 0,03* 83,8% |
1,02 ± 0,056* 31,1% |
|
15 сут % ТРО |
1,55 ± 0,16 |
1,89 ± 0,13 |
0,59 ± 0,14* 61,9% |
0,96 ± 0,11* 49,2% |
|
18 сут % ТРО |
2,30 ± 0,19 |
2,65 ± 0,07 |
0,37 ± 0,09* 83,9% |
1,85 ± 0,13* 30,19% |
|
20 сут % ТРО |
2,99 ± 0,16 |
2,55 ± 0,1 |
0,50 ± 0,12* 83,3% |
1,58 ± 0,11* 38,03% |
|
22 сут % ТРО |
3,52 ± 0,1 |
3,31 ± 0,25 |
0,74 ± 0,12* 79,0% |
1,75 ± 0,14* 47,13% |
|
25 сут % ТРО |
4,3 ± 0,15 |
4,05 ± 0,17 |
0,98 ± 0,19* 77,2% |
2,54 ± 0,30* 36,7% |
Примечание: * – р<0,05 по отношению к контролю.
Через 8 сут после облучения регрессия опухоли (13 сут роста) на облучённой лапе составила 83,8%, а на левой необлучённой – 31,1%, что было статистически значимо по отношению к объёму опухоли в эти сроки у контрольной группы мышей.
Через 10 сут после облучения процент торможения роста опухолевого узла (15 сут роста) составил 61,9% на правой облучённой лапе и 49,2% на левой необлучённой лапе.
Торможение роста опухоли, подвергнутой облучению, наблюдали в течение последующих 10 сут. В эти сроки роста опухоли процент её торможения составлял от 77 до 84%. Абскопальный эффект в эти сроки был также статистически значим, а торможение роста немишенного узла составило от 30 до 47%.
Гибель животных в группах (опытной и контрольной) началась через 28 сут после инокуляции опухоли сначала в облучённой группе, а затем в контрольной. Средняя продолжительность жизни мышей в контрольной группе составила 31,2±0,94, в опытной - 30,5±1,4 сут.
Для наглядности полученных результатов представляем рисунок роста опухоли на правой и левой лапе после облучения.
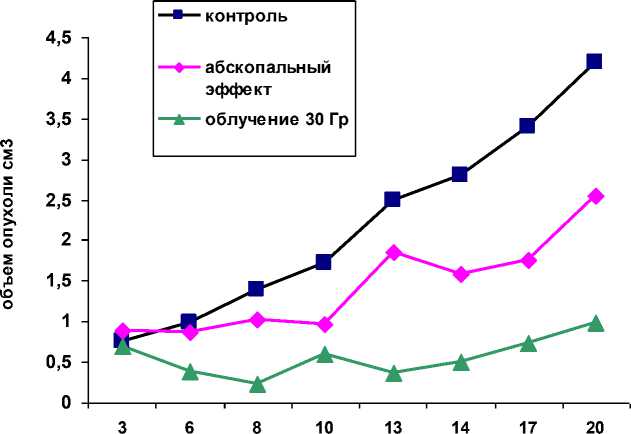
сутки, после облучения
Рис. 1. Динамика роста опухолевого штамма карциномы Эрлиха (трансплантирована в обе лапы мышам-самцам F1 (CBA x C57BL6) после локального облучения правого опухолевого узла в дозе 30 Гр.
Таким образом, облучение правого опухолевого узла в дозе 30 Гр на ранней стадии роста (5 сут после инокуляции) вызывает торможение роста левого необлучённого опухолевого узла с 10 до 49% по отношению к росту опухоли в контроле.
Для снижения лучевой нагрузки на организм были поставлены эксперименты по фракционированию дозы, вызывающей абскопальный эффект. На мишенный узел подавалась доза 10 Гр той же мощности через день до суммарной дозы в 30 Гр. Как показали результаты исследования (табл. 2), через сутки после набранной суммарной дозы облучения 20 Гр наблюдается регрессия мишенной опухоли, составляющая 28% торможения её роста. Через трое суток после набранной дозы в 30 Гр торможение роста мишенной опухоли увеличивается в 1,9 раза, и регрессия составляет 52,7%. Абскопальный эффект в эти сроки исследования не выявлен. И только через 6 сут после набранной суммарной дозы в 30 Гр, когда объём облучённого узла уменьшается почти в 3 раза, и регрессия составляет 64,4%, проявляется абскопальный эффект. Но регрессия немишенного опухолевого узла составляет лишь 17,2%. В последующие сутки наблюдения % торможения роста мишенной опухоли снижался, а % торможения немишенного опухолевого узла не имел статистически значимых различий с контролем.
Таблица 2
Динамика роста карциномы Эрлиха у мышей-самцов гибридов F1 (CBAxC57BL6) после фракционированного локального облучения у - лучами 60Co на установке «Луч» с мощностью дозы 0,532 Гр/мин правого опухолевого узла в суммарной дозе 30 Гр (10 Гр через сутки) и процент торможения (ТРО) роста опухоли
|
Группы животных |
Сутки после облучения |
Объём опухоли (M ± m), см 3 |
|||
|
правый узел |
% ТРО |
левый узел |
% ТРО |
||
|
Контрольные Облучённые |
2 |
0,81 ± 0,03 0,66 ± 0,04 |
18,5 |
0,70 ± 0,04 0,74 ± 0,03 |
|
|
Контрольные Облучённые |
4 |
1,0 ± 0,03 0,72 ± 0,03* |
28,0 |
0,97 ± 0,05 0,93 ± 0,03 |
4,1 |
|
Контрольные Облучённые |
8 |
1,50 ± 0,05 0,71 ± 0,03* |
52,7 |
1,47 ± 0,08 1,47 ± 0,12 |
|
|
Контрольные Облучённые |
9 |
1,65 ± 0,11 0,68 ± 0,03* |
58,8 |
1,61 ± 0,11 1,53 ± 0,10 |
5,0 |
|
Контрольные Облучённые |
10 |
1,85 ± 0,06 0,76 ± 0,05* |
58,9 |
1,63 ± 0,17 1,84 ± 0,15 |
|
|
Контрольные Облучённые |
11 |
2,25 ± 0,11 0,80 ± 0,04* |
64,4 |
2,32 ± 0,12 1,92 ± 0,13* |
17,2 |
|
Контрольные Облучённые |
14 |
2,22 ± 0,13 1,19 ± 0,08* |
46,4 |
2,63 ± 0,10 2,32 ± 0,11 |
11,8 |
|
Контрольные Облучённые |
15 |
2,30 ± 0,11 1,32 ± 0,08 |
42,6 |
3,07 ± 0,30 2,55 ± 0,16 |
16,9 |
Примечание: * – р<0,05 по отношению к контролю.
Продолжительность жизни животных-опухоленосителей при щадящей ионизирующей нагрузке значимо не отличалась от продолжительности жизни мышей после однократного облучения в дозе 30 Гр.
Таким образом, фракционируя дозу облучения в 30 Гр, которая вызывает при однократном воздействии продолжительную и высокую в процентном отношении абскопальную регрессию, не удаётся получить стойкую регрессию немишенной опухоли.
Иммунную реактивность облучённых в дозе 30 Гр опухоленосителей исследовали на стадии развития абскопального эффекта, подсчитывая количество антителообразующих клеток (АОК) в селезёнке (системный ответ) после иммунизации тимусзависимым антигеном – эритроцитами барана. Антиген вводили через 9 сут после облучения (14 сут опухолевого роста) внутрибрюшинно в дозе 1x10 8 клеток на мышь. Количество АОК определяли безгелевым методом локального гемолиза по Каннингему на 5 сут после иммунизации.
Как показали результаты исследования (табл. 3), иммунореактивность животных с перевитой опухолью в оба бедра (14 сут после трансплантации) снижается до 67,5±6,4% от показателя иммунной реактивности контрольных животных. При этом масса и клеточность селезёнки опухолевых животных статистически значимо не отличается от показателей у контрольных особей.
Таблица 3
Иммунологические показатели (М±т) у мышей-самцов F1 (CBAxC57Bl6) после трансплантации им асцитной карциномы Эрлиха в обе лапы и локального облучения (5 сут) правого опухолевого узла в дозе 30 Гр
|
Группы животных |
Селезёнка |
||
|
масса, мг |
клеточность, 1 x 10 6 |
АОК, 1 х 103 |
|
|
Контрольные |
199 ± 21,8 (100 ± 12,5) |
135 ± 13,9 (100 ± 10,3) |
369 ± 10,0 (100 ± 2,7) |
|
Опухолевые |
264 ± 49,3 (133 ± 24,6) |
150 ± 7,3 (111 ± 5,4) |
249 ± 23,7* (67,5 ± 6,4) |
|
Опухолевые + 30 Гр |
135 ± 14,2** (67,8 ± 7,1) |
66,0 ± 5,1** (48,9 ± 3,8) |
55,0 ± 18,3** (14,9 ± 5,0) |
Примечание: в скобках – проценты к контролю; * – статистически значимые различия с группой контрольных животных; ** – статистически значимые различия с группой животных-опухоленосителей.
Иммунореактивность животных-опухоленосителей после локального облучения в дозе 30 Гр снизилась в 4,5 раза по отношению к данному показателю у необлучённых мышей-опухоленоси-телей. Содержание АОК в селезёнке при этом составило 14,9±5,0% от показателя у интактных мышей. То есть, несмотря на агрессивность опухолевого процесса и большую дозу радиационного воздействия, иммунная система остаётся чувствительной к антигенному стимулу.
Заключение
Результаты проведённого исследования позволяют сделать следующие выводы:
-
- разработана экспериментальная модель для реализации абскопального эффекта, индуцированного ионизирующей радиацией, которая заключается в билатеральной трансплантации опухолевых клеток и последующем облучении одного из опухолевых узлов;
-
- поглощённая доза ионизирующего излучения, составляющая 30 Гр на опухолевый узел, вызывает абскопальный эффект в немишенном узле, торможение роста которого составляет от 10 до 49% по отношению к росту опухоли в контроле;
-
- фракционирование дозы облучения в 30 Гр, которая вызывает при однократном воздействии продолжительную и высокую в процентном отношении абскопальную регрессию, не позволяет получить стойкую регрессию немишенной опухоли;
-
- продолжительность жизни опухоленосителей при щадящей лучевой нагрузке значимо не отличается от продолжительности жизни мышей после однократной нагрузки в дозе 30 Гр;
-
- агрессивность опухолевого процесса и большая доза радиационного воздействия снижает реактивность иммунной системы мышей, но оставляет её чувствительной к антигенному стимулу, что позволит в дальнейшем исследовать способы, усиливающие данный биологический феномен.
Выражаем благодарность сотрудникам отдела радиационной биофизики: зав. отд. Корякину С.Н., Лычагину А.А. и Сабурову В.А. за проведение дозиметрических исследований.
Список литературы Абскопальный противоопухолевый эффект, индуцированный радиационным воздействием
- Lugade A.A., Moran J.P., Gerber S.A., Rose R.C., Frelinger J.G., Lord E.M. Local radiation therapy of B16 melanoma tumors increases the generation of tumor antigen-specific effector cells that traffic to the tumor //J. Immunol. 2005. V. 174, N 12. P. 7516-7523.
- Burnette B.C., Liang H., Lee Y., Chlewicki L., Khodarev N.N., Weichselbaum R.R., Fu Y.-X., Auh S.L. The efficacy of radiotherapy relies upon induction of type I interferon-dependent innate and adaptive immunity //Cancer Res. 2011. V. 71, N 7. P. 2488-2496.
- Nishisaka N., Maini A., Kinoshita Y., Yasumoto R., Kishimoto T., Jones R.F., Morse P., Hillman G.G., Wang C.Y., Haas G.P. Immunotherapy for lung metastases of murine renal cell carcinoma: synergy between radiation and cytokine-producing tumor vaccines //J. Immunother. 1999. V. 22, N 4. P. 308-314.
- Filatenkov A., Baker J., Mueller A.M., Kenkel J., Ahn G.-O., Dutt S., Zhang N., Kohrt H., Jensen K., Dejbakhsh-Jones S., Shizuru J.A., Negrin R.N., Engleman E.G., Strober S. Ablative tumor radiation can change the tumor immune cell microenvironment to induce durable complete remissions //Clin. Cancer Res. 2015. V. 21, N 16. P. 3727-3739.
- Schaue D., Ratikan J.A., Iwamoto K.S., McBride W.H. Maximizing tumor immunity with fractionated radia-tion //Int. J. Radiat. Oncol. Biol. Phys. 2012. V. 83, N 4. P. 1306-1310.
- Mole R.H. Whole body irradiation – radiobiology or medicine? //Br. J. Radiol. 1953. V. 26, N 305. P. 234-241.
- Andrews J.R. The radiobiology of human cancer radiotherapy. Baltimore, MD: Univ. Park Press, 1978. 591 p.
- Hu Z.I., McArthur H.L., Ho A.Y. The abscopal effect of radiation therapy: what is it and how can we use it in breast cancer? //Curr. Breast Cancer Rep. 2017. V. 9, N 1. P. 45-51.
- Siva S., MacManus M.P., Martin R.F., Martin O.A. Abscopal effects of radiation therapy: a clinical review for the radiobiologist //Cancer Lett. 2015. V. 356, N 1. P. 82-90.
- Postow M.A., Callahan M.K., Barker C.A., Yamada Y., Yuan J., Kitano S., Mu Z, Rasalan T., Adamow M., Ritter E., Sedrak C., Jungbluth A.A., Chua R., Yang A.S., Roman R.-A., Rosner S., Benson B., Allison J.P., Lesokhin A.M., Gnjatic S., Wolchok J.D. Immunologic correlates of the abscopal effect in a patient with melanoma //N. Engl. J. Med. 2012. V. 366, N 10. P. 925-931.
- Wersall P.J., Blomgren H., Pisa P., Lax I., Kälkner K.-M., Svedman C. Regression of non-irradiated metastases after extracranial stereotactic radiotherapy in metastatic renal cell carcinoma //Acta Oncol. 2006. V. 45, N 4. P. 493-497.
- Ohba K., Omagari K., Nakamura T., Ikuno N., Saeki S., Matsuo I., Kinoshita H., Masuda J., Hazama H., Sakamoto I., Kohno S. Abscopal regression of hepatocellular carcinoma after radiotherapy for bone metas-tasis //Gut. 1998. V. 43, N 4. P. 575-577.
- Golden E.B., Chhabra A., Chachoua A., Adams S., Donach M., Fenton-Kerimian M., Friedman K., Ponzo F., Babb J.S., Goldberg J., Demaria S., Formenti S.C. Local radiotherapy and granulocyte-macrophage colony-stimulating factor to generate abscopal responses in patients with metastatic solid tumours: a proof-of-princi-ple trial //Lancet Oncol. 2015. V. 16, N 7. P. 795-803.
- Wu L., Wu M.O., De la Maza L., Yun Z., Yu J., Zhao Y., Cho J., Perrot M. Targeting the inhibitory receptor CTLA-4 on T cells increased abscopal effects in murine mesothelioma model //Oncotarget. 2015. V. 6, N 14. P. 12468-12480.
- Chakravarty P.K., Guha C., Alfieri A., Beri V., Niazova Z., Deb N.J., Fan Z., Thomas E.K., Vikram B. Flt3L therapy following localized tumor irradiation generates long-term protective immune response in metastatic lung cancer: its implication in designing a vaccination strategy //Oncology. 2006. V. 70, N 4. P. 245-254.
- Younes E., Haas G.P., Dezso B., Ali E., Maughan R.L., Kukuruga M.A., Montecillo E., Pontes J.E., Hillman G.G. Local tumor irradiation augments the response to IL-2 therapy in a murine renal adenocarcinoma //Cell Immunol. 1995. V. 165, N 2. P. 243-251.
- Гривцова Л.Ю., Исаева В.Г., Жовтун Л.П., Иванов С.А., Каприн А.Д. Способ индукции абскопального противоопухолевого эффекта в экспериментальной модели карциномы Эрлиха. Патент на изобретение 2736120 С2, 11.11.2020. Заявка № 2020115487 от 07.05.2020.
- Cunnigham A.J. A method of increased sensitivity for detesting single antibody-forming cells //Nature. 1965. V. 207, N 5001. P. 1106-1107.


