Адаптационно-компенсаторные реакции на ранней стадии острой интоксикации крыс дельтаметрином
Автор: Герунов Т.В., Чигринский Е.А., Федоров Ю.Н., Герунова Л.К., Конвай В.Д.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Оценка токсических эффектов на модельных объектах
Статья в выпуске: 4 т.51, 2016 года.
Бесплатный доступ
Мировой рынок синтетических пиретроидов оценивается более чем в 2,5 млрд долларов и будет расти в ближайшие годы. Токсикологии пиретроидов посвящены многочисленные работы отечественных и зарубежных авторов, однако вопросы патогенеза острого отравления животных препаратами этой группы, принципы лабораторной диагностики на ранней стадии интоксикации и патогенетической терапии при отравлении требуют дальнейшего изучения. Дельтаметрин в течение многих лет с успехом используется в растениеводстве и животноводстве и представляет реальную угрозу отравления при нарушении регламентов применения. Тяжесть течения и исход отравления во многом определяются выраженностью функциональных нарушений эндокринной и иммунной систем. Целью настоящего исследования было определение динамики адаптационно-компенсаторных реакций на ранней стадии острой интоксикации животных дельтаметрином. В эксперименте использовали белых лабораторных крыс как признанную модель млекопитающих в биомедицинских исследованиях. Работа была выполнена на самцах крыс (масса 180-200 г), из которых сформировали 6 групп по 10-12 особей в каждой. Животные II, IV и VI групп были подвергнуты острой пероральной интоксикации дельтаметрином (Butox 50, «Intervet», Нидерланды) в дозе 43,5 мг/кг массы тела. Крысы I, III и V групп служили контролем. Крыс разных групп выводили из эксперимента последовательно: I и II - через 1 сут, III и IV - через 3 сут, V и VI - через 1 нед после начала опытов. В цельной крови крыс оценивали содержание глюкозы, в сыворотке - концентрацию инсулина и кортикостерона. Кусочки тимуса животных фиксировали в 4 % нейтральном растворе формальдегида, обезвоживали в спиртах с возрастающей концентрацией и уплотняли, заливая в парафин. Гистологические срезы толщиной 3-5 мкм получали на ротационном микротоме и окрашивали гематоксилином и эозином, а также по Ван-Гизону. Для выявления тучных клеток срезы окрашивали основным коричневым по Шубичу. Проводили микрофотосъемку гистологических препаратов. В крови у крыс через 1 сут после острого отравления дельтаметрином наблюдалось повышение содержания кортикостерона, инсулина и глюкозы соответственно на 46,3 (p = 0,0001), 31,9 (p = 0,0139) и 25,6 % (p = 0,0052). На 3-и сут после отравления сохранялась высокая концентрация кортикостерона и глюкозы в крови на фоне снижения количества инсулина. На 7-е сут у животных наблюдались гипокортикостеронемия и гипогликемия, а содержание инсулина достигало контрольных значений. Содержание кортикостерона и глюкозы в сравнении с контролем было снижено соответственно на 17,3 (p = 0,0407) и 19,8 % (p = 0,0267). В тимусе у экспериментальных животных регистрировали уменьшение количества тимоцитов, активизацию апоптоза, увеличение числа тучных клеток с интенсификацией процессов дегрануляции, а также развитие гемодинамических нарушений. Через 1 нед после интоксикации отмечали частичное восстановление клеточности тимуса. В течение эксперимента не регистрировали гибели животных, что свидетельствует об эффективности адаптационно-компенса-торных механизмов у экспериментальных крыс, в том числе гипоталамо-гипофизарно-тимусной системы. Результаты наших исследований вносят вклад в понимание компенсаторно-приспо-собительных механизмов при экспериментальной интоксикации, что позволяет оценить функциональные резервы организма и разрабатывать способы фармакокоррекции при отравлениях.
Пестициды, дельтаметрин, кортикостерон, инсулин, глюкоза, тимус, крысы, интоксикация
Короткий адрес: https://sciup.org/142214148
IDR: 142214148 | УДК: 619:616-099:612.017:577.124.8:57.084.1 | DOI: 10.15389/agrobiology.2016.4.516rus
Текст научной статьи Адаптационно-компенсаторные реакции на ранней стадии острой интоксикации крыс дельтаметрином
Мировой рынок синтетических пиретроидов оценивается более чем в 2,5 млрд долларов. В ближайшие годы он будет расти и к 2019 году превысит 3 млрд долларов (1). Препараты этой группы обладают высокой биологической активностью, позволяющей вести эффективную борьбу с насекомыми на разных стадиях их развития. Для теплокровных животных более токсичны вещества, содержащие циангруппу (2, 3).
Дельтаметрин — (S)- α -циано-3-феноксибензил(1R,3R)-3-(2,2-дибром-винил)-2,2-диметилциклопропанкарбоксилат — в течение многих лет с успехом используется в растениеводстве и животноводстве. Этот моноизомер синтетических пиретроидов с выраженной токсичностью представляет 516
реальную угрозу отравления при нарушении регламентов применения. Несмотря на многочисленные исследования по токсикологии пиретроидов (4-6), вопросы патогенеза острого отравления препаратами этой группы, принципы лабораторной диагностики на ранней стадии интоксикации и патогенетической терапии при отравлении требуют глубокого экспериментального обоснования.
Развитие патологического процесса при экзогенных интоксикациях сопровождается изменением взаимосвязей адаптационно-компенсаторных механизмов. Тяжесть течения и исход отравления во многом определяются выраженностью функциональных нарушений эндокринной и иммунной систем (7, 8). Их своевременное выявление способствует совершенствованию качества диагностики, а также профилактике осложнений.
В настоящей работе мы выполнили биохимическую и гистологическую оценку влияния острой экспериментальной интоксикации дельта-метрином на эндокринную и иммунную систему крыс. Эти данные вносят вклад в понимание приспособительных механизмов и функциональных резервов организма у млекопитающих при пестицидном токсикозе, что необходимо для разработки способов его диагностики и фармакокоррекции.
Нашей целью было изучение динамики адаптационно-компенсаторных реакций на ранней стадии острой интоксикации дельтаметрином.
Методика . Эксперименты проводили на белых лабораторных крысах линии Wistar, которые считаются эталонными объектами в многочисленных биомедицинских исследованиях на млекопитающих (9). Из самцов крыс (масса 180-200 г) сформировали 6 групп. Животным II ( n = 12), IV ( n = 12) и VI ( n = 12) групп через зонд в желудок вводили дельтаметрин в дозе 43,5 мг/кг массы тела (1/2 ЛД50). Крысы I ( n = 10), III ( n = 10) и V ( n = 10) групп (контроль) получали эквивалентный объем физиологического раствора. Крыс разных групп выводили из эксперимента последовательно: I и II — через 1 сут, III и IV — через 3 сут, V и VI — через 1 нед после начала опытов. В эти же сроки у животных брали кровь для исследования.
Применяли препаративную форму дельтаметрина Butox 50 («Intervet», Нидерланды). При проведении опытов соблюдались требования Европейской Конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях (Страсбург, 18 марта 1986 года) (European Convention for the Protection of Vertebrate Animals Used for Experimentation and other Scientific Purposes, ¹ 123 of 18 March 1986, Strasbourg).
В цельной крови крыс оценивали содержание глюкозы при помощи унифицированного глюкозооксидазного метода, в сыворотке — концентрацию инсулина и кортикостерона. Количество инсулина определяли посредством твердофазного иммуноферментного анализа (ТФ-ИФА) «сэндвич»-методом, содержание кортикостерона — прямым конкурентным методом ИФА с иммобилизованными на твердую фазу антителами. Для иммуноферментного анализа использовали готовые наборы реагентов фирмы «Cusabio Biotech Co., Ltd» (Китай).
Кусочки тимуса животных, полученные после убоя, фиксировали в 4 % нейтральном растворе формальдегида, обезвоживали в спиртах с возрастающей концентрацией и уплотняли, заливая в парафин. Гистологические срезы толщиной 3-5 мкм получали на ротационном микротоме (CUT 4055, «SLEE Medical GmbH», Германия) и окрашивали гематоксилином и эозином, а также по Ван-Гизону. Для выявления тучных клеток срезы окрашивали основным коричневым по Шубичу (10). Микрофотосъемку гистологических препаратов проводили на цифровом микроскопе Альтами БИО 1 («Альтами», Россия).
Данные обрабатывали в программе Statistica 6.0 («StatSoft, Inc.», США). Результаты представлены в виде медианы (Me) и интерквартильной широты (Q1-Q3). Межгрупповое сравнение выполняли при помощи непараметрического U-критерия Манна-Уитни. Различия считали статистически значимыми при p < 0,05.
Результаты . После однократного введения дельтаметрина в дозе 43,5 мг/кг массы тела у животных в опытных группах отмечали возбуждение и гиперсаливацию. В 1-е сут эксперимента аппетит у них отсутствовал, резко сократилось количество потребляемой воды. В дальнейшем выраженность клинического проявления интоксикации снижалась.
Результаты биохимических исследований свидетельствовали о развитии гиперкортикостеронемии на ранней стадии интоксикации. Концентрация кортикостерона в сыворотке крови через 1 сут после введения крысам дельтаметрина была на 46,3 % выше, чем в контрольной группе (табл.). Постепенно содержание гормона снижалось, и через 3 сут различия с контролем составляли 30,9 %. Усиленная секреция кортикостерона в течение 3 сут после интоксикации могла быть связана с нейротоксическим действием препарата. Гипоталамус реагирует на химический стресс выбросом кортиколиберина, что способствует усиленному синтезу и секреции адренокортикотропного гормона передней долей гипофиза (11). При этом повышается содержание кортикостерона в надпочечниках за счет активации 3- β -гидроксистероиддегидрогеназы (12), что ведет к развитию гипер-кортикостеронемии и нарушению углеводного обмена.
Биохимические показатели крови у белых лабораторных крыс линии Wistar при острой интоксикации дельтаметрином
|
Срок |
Группа |
Кортикостерон, нмоль/л Y |
Инсулин, нМЕ/мл |
Глюкоза, ммоль/л |
|
1-е сут |
I (контроль) |
417 (378-500) |
457 (394-565) |
6,73 (6,02-7,62) |
|
II |
610 (577-711) |
603 (486-700) |
8,45 (7,57-10,8) |
|
|
p [k1] = 0,0001 |
p [k1] = 0,0139 |
p [k1] = 0,0052 |
||
|
3-и сут |
III (контроль) |
395 (366-470) |
484 (390-563) |
6,35 (5,94-7,81) |
|
p [k1] = 0,6683 |
p [k1] = 0,8429 |
p [k1] = 0,8695 |
||
|
IV |
517 (455-621) |
329 (257-412) |
8,56 (7,22-10,3) |
|
|
p [k3] = 0,0130 |
p [k3] = 0,0048 |
p [k3] =0,0412 |
||
|
p [d1] = 0,0612 |
p [d1] = 0,0001 |
p [d1] =0,6031 |
||
|
7-е сут |
V (контроль) |
428 (368-502) |
471 (375-571) |
6,40 (5,96-7,81) |
|
p [k1] = 0,9741 |
p [k1] = 0,9604 |
p [k1] =0,9548 |
||
|
p [k3] = 0,7053 |
p [k3] = 0,6792 |
p [k3] =0,8201 |
||
|
VI |
354 (288-410) |
389 (294-468) |
5,13 (4,29-6,30) |
|
|
p [k7] = 0,0407 |
p [k7] = 0,1209 |
p [k7] = 0,0267 |
||
|
p [d1] = 0,0002 |
p [d1] = 0,0001 |
p [d1] = 0,0001 |
||
|
p [d3] = 0,0001 |
p [d3] = 0,1574 |
p [d3] = 0,0001 |
П р и м еч а ни е. Описание групп см. в разделе «Методика». Приведены значения Me(Q 1 -Q 3 ), где Me — медиана, Q 1 -Q 3 — интерквартильная широта; p [k1] — уровень значимости различий в сравнении с контролем через 24 ч, p [k3] — в сравнении с контролем через 3 сут, p [k7] — в сравнении с контролем через 7 сут, p [d1] — в сравнении с крысами из II опытной группы, p [d3] — в сравнении с крысами IV опытной группы.
Концентрация глюкозы в крови у крыс через 1 сут после введения дельтаметрина оказалась на 25,6 % выше аналогичного показателя в контроле. Содержание инсулина возросло на 31,9 %, что свидетельствовало о временной инсулинорезистентности, причиной которой могла быть высокая доступность липидов для окисления.
Глюкоза занимает далеко не главное место среди используемых для окисления митохондриями субстратов, в отличие от кетоновых тел, коротко- и длинноцепочечных жирных кислот (13). Гипергликемия сохранялась и спустя 3 сут после интоксикации (см табл.) за счет стимуляции глюкокортикоидами глюконеогенеза, а также расщепления запасов гликогена в печени и снижения интенсивности гликолиза (14). Однако содержание инсулина снижалось на 32,0 % по сравнению с аналогичным показателем в контроле. Причиной снижения концентрации инсулина в крови 518
на фоне стойкой гипергликемии могло быть нарушение функции β -клеток островков Лангерганса в поджелудочной железе. Дисфункция β -клеток, вероятно, стала результатом действия нескольких факторов. Первый из них — гиперлипидемия, вызванная повышением количества кортикостерона в крови у крыс после введения дельтаметрина. Высокое содержание жирных кислот в крови способствует их аккумулированию β -клетками, что ведет к усилению свободно-радикальных процессов, главным образом через активацию NO-синтазы, приводящих к гибели клеток по типу апоптоза (15). Второй фактор — гипергликемия. Механизмы ее неблагоприятных последствий хорошо изучены. Это избыточная продукция свободных радикалов, процессы гликирования и изменения в работе регуляторных белков (16). Кроме того, гипергликемия может снижать секреторную функцию β -клеток (17).
Через 1 нед после 1-кратного введения дельтаметрина у крыс развивалась гипокортикостеронемия (см. табл.). Это указывало на снижение секреции кортиколиберина и адренокортикотропного гормона центральными эндокринными железами, а также могло быть связано с дефицитом восстановленного никотинамидадениндинуклеотидфосфата и аскорбата, регистрируемым при активации свободно-радикальных процессов и перекисного окисления липидов в надпочечниках.
Важное значение имеет снижение активности 3- β -гидроксистеро-иддегидрогеназы в коре надпочечников (18). Этот фермент чувствителен к активации свободно-радикальных процессов и увеличению концентрации продуктов перекисного окисления липидов (19). Ранее нами и другими исследователями отмечалось развитие окислительного стресса у крыс при острой интоксикации дельтаметрином (20-24).
С развитием гипокортикостеронемии у крыс наблюдалось снижение содержания глюкозы в крови на 19,8 % относительно контроля, что было связано с замедлением реакций глюконеогенеза на фоне активации гликолиза с возможным истощением запасов гликогена в печени (25). Тран-зиторный характер гипергликемии способствовал нормализации секреции инсулина (см. табл.).
Взаимосвязь иммунной и эндокринной систем обусловливает не только непосредственное участие иммунной системы в стресс-реакциях, но и определяет влияние стресса на иммунную реактивность организма. В связи с этим мы провели гистологическое исследование центрального органа иммунной системы — тимуса у контрольных и опытных крыс.
Гистоструктура тимуса у контрольных крыс оказалась представлена отдельными дольками, разделенными септами из соединительной ткани, капсула образована неоформленной волокнистой соединительной тканью. В структуре каждой дольки были четко дифференцированы зоны коркового и мозгового веществ, граница между ними хорошо различима. В корковом веществе были отчетливо видны отдельные тимоциты, лимфобласты, эпителиальные клетки; в мозговом веществе плотность расположения клеточных элементов оказалась меньше, сосудистая сеть тимуса была умеренно наполнена кровью.
Увеличение секреции гормонов гипоталамо-гипофизарно-кортикоад-реналовой системы при остром отравлении животных снижало содержание лимфоидных клеток в тимусе. На гистологических препаратах тимуса крыс через 3 сут после введения дельтаметрина наблюдалось заметное обеднение долек органа тимоцитами (рис., А) с инверсией коркового и мозгового веществ, что затрудняло визуальное определение границы между ними. Это было характерно для всех долек тимуса и регистрировалось у всех жи- вотных из опытных групп в течение 3 сут после интоксикации, различия заключались лишь в степени выраженности указанных изменений. Уменьшение числа тимоцитов сопровождалось интенсификацией апоптоза в органе с фрагментацией ядер клеток и образованием апоптотических телец. На развитие гемодинамических расстройств указывало скопление форменных элементов крови в просвете сосудов. Интоксикация животных дель-таметрином сопровождалась увеличением количества тучных клеток, расположенных преимущественно в междольковой соединительной ткани, вблизи кровеносных сосудов и значительно реже в паренхиме органа. У животных из опытных групп наблюдали интенсификацию процессов дегрануляции тучных клеток.
Отмеченные патоморфологические изменения в тимусе животных, подвергнутых действию дельтаметрина, свидетельствуют о снижении их иммунной реактивности в условиях гиперкортикостеронемии. Известно, что глюкокортикоиды обладают выраженным иммунодепрессивным действием, нарушают кооперацию клеток иммунной системы и индуцируют апоптоз тимоцитов (26, 27).
А
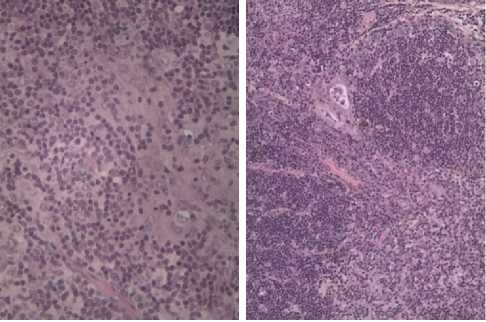
Гистологическая структура тимуса у белых лабораторных крыс линии Wistar после введения дель-таметрина в дозе 43,5 мг/кг: А — на 3-и сут, наблюдается уменьшение плотности тимоцитов в мозговом веществе (увеличение ½600), Б — на 7-е сут, клеточ-ность тимуса частично восстановлена (увеличение ½300) (микроскоп Альтами БИО 1, «Альтами», Россия; окрашивание гематоксилином и эозином).
Снижение содержания кортикостерона через 1 нед после интоксикации сопровождалось частичным восстановлением клеточности тимуса у крыс (см. рис., Б). В течение эксперимента не отмечали гибели животных, что свидетельствовало об эффективности адаптационно-компенсаторных механизмов, в том числе ги-поталамо-гипофизарно-тимусной системы (28), участвующей в торможении гипоталамо-гипофизарно-надпочечниковой оси, которая доминирует при всех видах стресса.
Характер эндокринных и иммунных нарушений на ранней стадии острой интоксикации дельтаметрином указывал на высокую степень риска иммунодефицитных состояний в отдаленный постинтоксикационный период, что подтверждают многочисленные примеры органной патологии при воздействии пестицидов (29).
Таким образом, острая интоксикация крыс дельтаметрином сопровождается развитием гиперкортикостеронемии и гипергликемии на фоне инсулинорезистентности. В течение 3 сут содержание инсулина в сыво- ротке крови резко снижается и по мере уменьшения концентрации глюко- зы и кортикостерона постепенно нормализуется, достигая контрольных значений через 1 нед после интоксикации. Об угнетении иммунной реактивности животных свидетельствует уменьшение числа лимфоидных клеток в тимусе и активизация процессов апоптоза. Возрастающая частота появления тучных клеток и процессы дегрануляции указывают на аллергизи-520
рующее действие препарата. Результаты наших исследований вносят вклад в понимание компенсаторно-приспособительных механизмов при экспериментальной интоксикации и позволяют оценить функциональные резервы организма для разработки способов фармакокоррекции при отравлениях.
Авторы благодарят сотрудников Омской областной ветеринарной лаборатории за содействие в проведении экспериментов.
Список литературы Адаптационно-компенсаторные реакции на ранней стадии острой интоксикации крыс дельтаметрином
- Pyrethroids market by type (Bifenthrin, Deltamethrin, Permethrin, Cypermethrin, Cyfluthrin, and Lambda-cyhalothrin), by crop type (cereals & grains, oilseeds & pulses, and fruits & vegetables) & by region -global trends & forecasts to 2019. MarketsandMarkets, 2015. Режим доступа: http://www.marketsandmarkets.com/Market-Reports/pyrethroids-pesticide-market-170901303.html. Дата обращения: 06.05.2016.
- Shafer T.J., Meyer D.A., Crofton K.M. Developmental neurotoxicity of pyrethroids insecticides: critical review and future research needs. Environ. Health Perspect., 2005, 113: 123-136 ( ) DOI: 10.1289/ehp.7254
- Moser V.C., Stewart N., Freeborn D.L., Crooks J., MacMillan D.K., Hedge J.M., Wood C.E., McMahen R.L., Strynar M.J., Herr D.W. Assessment of serum biomarkers in rats after exposure to pesticides of different chemical classes. Toxicol. Appl. Pharmacol., 2015, 282(2): 161-174 ( ) DOI: 10.1016/j.taap.2014.11.016
- Eraslan G., Bilgili A., Essiz D., Akdogan M., Sahindokuyucu F. The effects of deltamethrin on some serum biochemical parameters in mice. Pestic. Biochem. Phys., 2007, 87(2): 123-130.
- Sharma P., Singh R., Jan M. Dose-dependent effect of deltamethrin in testis, liver, and kidney of Wistar rats. Toxicol. Int., 2014, 21(2): 131-139 ( ) DOI: 10.4103/0971-6580.139789
- Nwozo S., Akpodono E., Oyinloye B. Plasma, erythrocyte membrane bound enzymes and tissue histopathology in male Wistar rats exposed to common insecticides. J. Pestic. Sci., 2015, 40(1): 13-18 ( ) DOI: 10.1584/jpestics.D14-065
- Медицинская токсикология: национальное руководство/Под ред. Е.А. Лужникова. М., 2012.
- Земсков А.М., Земсков В.М., Золоедов В.И., Бжозовский Е.Е. Ассоциативное участие различных систем организма в развитии патологии. Успехи современной биологии, 2003, 123(2): 138-146.
- Sengupta P. The laboratory rat: relating its age with human's. Int. J. Prev. Med., 2013, 4(6): 624-630.
- Лилли Р. Патогистологическая техника и практическая гистохимия/Пер. с англ., под ред. В.В. Португалова. М., 1969.
- Биохимия/Под ред. Е.С. Северина. М., 2015.
- Chandra A.K., Ghosh R., Chatterjee A., Sarkar M. Amelioration of vanadium-induced testicular toxicity and adrenocortical hyperactivity by vitamin E acetate in rats. Mol. Cell. Biochem., 2007, 306(1): 189-200 ( ) DOI: 10.1007/s11010-007-9569-4
- Титов В.Н. Гипогликемическая активность гиполипидемических препаратов. Клиническая медицина, 2014, 5: 18-28.
- Гончаров Н.П., Колесникова Д.С. Кортикостероиды: метаболизм, механизм действия и клиническое проявление. М., 2002.
- Dupre J. Regulation of the secretions of the pancreas. Ann. Rev. Med., 1970, 21: 299-316.
- Brownlee M. The pathobiology of diabetic complications: a unifying mechanism. Diabetes, 2005, 54(6): 1615-1625 ( ) DOI: 10.2337/diabetes.54.6.1615
- Boden G., Cheung P., Stein T.P., Kresge K., Mozzoli M. FFA cause hepatic insulin resistance by inhibiting insulin suppression of glycogenolysis. Am. J. Physiol. Endocrinol. Metab., 2002, 283(1): E12-E19 ( ) DOI: 10.1152/ajpendo.00429.2001
- Martel C., Melner M.H., Gagne D., Simard J., Labrie F. Widespread tissue distribution of steroid sulfatase, 3b-hydroxysteroid dehydrogenase/Δ5-Δ4isomerase(3β-HSD), 17β-HSD5α-reductase and aromatase activities in the rhesus monkey. Mol. Cell. Endocrinol., 1994, 104(1): 103-111 ( ) DOI: 10.1016/0303-7207(94)90056-6
- Aitken R.J., Roman S.D. Molecular mechanisms in spermatogenesis. Newcastle, Landes Bioscience and Springer Sciense + Business media, 2008.
- Chigrinski E.A., Conway V.D., Metrinskiy Y.Y. Ascorbate level in reproductive organs of male rats in acute deltamethrin intoxication. European Journal of Natural History, 2014, 4: 30.
- Chigrinski E.A., Conway V.D., Gerunova L.K., Gerunov T.V. Glutathione-related enzyme activity in rats' testes and epididymis at an acute intoxication with a synthetic pyrethroid deltamethrin. International Journal of Pharma and Bio Sciences, 2015, 6(4): B340-B344.
- Герунов Т.В., Чигринский Е.А., Герунов В.И., Конвай В.Д. Морфобиохимическая оценка повреждения почек у крыс при острой интоксикации дельтаметрином. Вестник АПК Ставрополья, 2015, S1: 44-48.
- Abdel-Daim M.M., El-Ghoneimy A. Synergistic protective effects of ceftriaxone and ascorbic acid against subacute deltamethrin-induced nephrotoxicity in rats. Renal Failure, 2015, 37(2): 297-304 ( ) DOI: 10.3109/0886022X.2014.983017
- Xu M.Y., Wang P., Sun Y.J., Wang H.P., Liang Y.J., Zhu L., Wu Y.J. Redox status in liver of rats following subchronic exposure to the combination of low dose dichlorvos and deltamethrin. Pestic. Biochem. Physiol., 2015, 124: 60-65 ( ) DOI: 10.1016/j.pestbp.2015.04.005
- Герунова Л.К., Герунов В.И., Довгань Н.Б., Козина А.Ю. Инсектициды адонис и суми-альфа: микст-и монотоксичность (экспериментальные исследования). Омск, 2008.
- Калинина М.Н., Кетлинский С.А., Оковитый С.В., Шуленин С.Н. Заболевания иммунной системы. М., 2008.
- Литвинова Л.С., Селедцов В.И., Шуплецова В.В., Гуцол А.А., Анищенко Е.С. Стероидная регуляция иммунной памяти. Вестник Российского государственного университета им. И. Канта, 2011, 1: 77-86.
- Киселева Н.М., Иноземцев А.Н. Возможная роль тимуса в работе стресс-лимитирующей системы. Иммунопатология, аллергология, инфектология, 2010, 2: 13-20.
- Герунов Т.В., Редькин Ю.В., Герунова Л.К. Иммунотоксичность пестицидов: роль в патологии животных и человека. Успехи современной биологии, 2011, 131(5): 474-482.


