Адаптационные возможности интродуцентов различного происхождения в условиях Ботанического сада г. Сургута
Автор: Турбина И.Н., Кукуричкин Г.М.
Журнал: Вестник Нижневартовского государственного университета @vestnik-nvsu
Рубрика: Экология растений
Статья в выпуске: 2, 2020 года.
Бесплатный доступ
Ботанический сад в г. Сургуте является самым северным в Западной Сибири и одним из самых северных ботанических садов в России, он является основным форпостом для продвижения новых агро- и биотехнологий на Крайний Север. В настоящее время коллекция декоративных растений Сургутского ботанического сада насчитывает около 200 видов и сортов травянистых растений, относящихся к 60 родам и 32 семействам, и около 210 видов, форм и культиваров древесных растений. Целью работы являлось изучение механизмов адаптации некоторых декоративных растений из коллекции ботанического сада с использованием современного портативного флавонид- и хлорофиллометра DUALEX. Объекты исследований - пять представителей травянистых растений из рода Iris L. - Iris hungarica Waldst. &Kit., Irisvariegata L., Iris sibirica L., Iris glaucescens Bunge, Iris sulfurea C. Koch. и восемь видов древесных растений из рода Acer L. - Acer pseudoplatanus L., Acer rubrum L., Acer trautvetteri Medw., Acer tataricum L., Acer ukurunduense Trautv...
Адаптация, биохимические показатели, ботанический сад, древесные растения, травянистые растения
Короткий адрес: https://sciup.org/14117224
IDR: 14117224 | УДК: 581.5:635.9 | DOI: 10.36906/2311-4444/20-2/08
Текст научной статьи Адаптационные возможности интродуцентов различного происхождения в условиях Ботанического сада г. Сургута
В последние годы приобрели актуальность исследования содержания растительных пигментов с использованием спектров отражения для получения количественных данных в пространственных и временных масштабах. За рубежом развиты исследования в области моделирования пигментов растений и их диагностических функций с использованием оптических методов дистанционного зондирования [16; 17; 18]. Пигменты растений (хлорофилл, флаваноиды, антоцианы) выполняют защитные функции, предохраняют растения от различных неблагоприятных воздействий [15]. Состояние пигментного комплекса влияет на устойчивость растительных организмов к стрессу. Стресс – это интегральный неспецифический ответ растения на повреждающее действие, направленный на выживание организма за счет мобилизации и формирования защитных систем. Устойчивость является конечным результатом адаптации [5].
Интродукционные исследования проводили в условиях Сургута, который расположен в среднетаежной зоне Западно-Сибирской равнины, характеризующейся резко континентальным климатом, с холодной продолжительной зимой и теплым коротким летом. По обеспечению влагой район находится в области достаточного увлажнения. Находясь на севере Азии, территория испытывает влияние влажных воздушных масс с Северного Ледовитого океана. Поэтому зима относительно сухая и морозная. В летний период доминируют северные ветра, однако в ясную погоду воздушные массы успевают прогреваться.
Ботанический сад в г. Сургуте является самым северным в Западной Сибири и одним из самых северных ботанических садов в России, он является основным форпостом для продвижения новых агро- и биотехнологий на Крайний Север, в т. ч. в арктические регионы, на принципах ступенчатой акклиматизации ценных видов и сортов растений.
В настоящее время коллекция декоративных растений Сургутского ботанического сада насчитывает около 200 видов и сортов травянистых растений, относящихся к 60 родам и 32 семействам, и около 210 видов, форм и культиваров древесных растений, она сформирована по систематическому принципу (родовыми комплексами), что позволяет сравнивать между собой морфологические особенности видов в пределах рода и семейства. Все растения зимуют в открытом грунте, без укрытия.
В культуре ботанического сада насчитывается 15 видов рода Iris L. и 10 культиваров Iris sibirica L., полученные из ботанических садов Новосибирска, Пензы, Махачкалы, Пятигорской эколого-ботанической станции БИН РАН.
Этот травянистый многолетник исключительно многообразен по количеству видов, сортов, диапазону цветовой гаммы. В природе насчитывается более 200 видов ирисов, распространенных в умеренных и отчасти в субтропических широтах всех континентов северного полушария – на открытых, солнечных местах, лишь небольшая часть видов – растения теневых и даже заболоченных местообитаний [9]. Во флоре России встречается около 60 видов [1].
Род Acer L. в коллекции представлен 49 экземплярами 15 видов различного географического происхождения. Всего в природе насчитывается около 150 видов, которые распространены в Европе, в Передней и Средней Азии, в Гималаях, Восточной Азии, в Северной и Центральной Америке. Многие виды этого рода довольно быстро растут, неприхотливы в уходе и обладают более высокой аккумулирующей способностью тяжелых металлов (свинец, кадмий) в листьях взрослых растений по сравнению с другими породами [10].
Целью исследования являлось изучение механизмов адаптации некоторых декоративных растений из коллекции ботанического сада СурГУ с использованием современного портативного флавонид- и хлорофиллометра DUALEX.
Материалы и методы исследования
Объектами исследований являлись пять представителей травянистых растений из рода Iris L. семейства Iridaceae Juss.
Iris hungarica Waldst. &Kit. (syn. Iris versicolor L.) (И1) – ирис разноцветный, является представителем североамериканской флоры. Произрастает на сырых лугах и болотах, по берегам озер и рек, в кустарниках теплоумеренной и субтропической зон северо-востока Канады и США [13]. Корневище ползучее, 8–10 см толщиной, образует рыхлую дерновину. Листья прикорневые, утолщенные посередине, но без резко выступающей средней жилки, к основанию с красноватым оттенком, 1,5–2,5 см шириной, 35–45 см длиной. Этот вид был привезен в 2018 г. из Горного ботанического сада (г. Махачкала).
Iris variegata L. (И2) – ирис пестрый, произрастает на сухих каменистых склонах, среди кустарников, в редколесьях, на лесных полянках, по опушкам дубрав юга теплоумеренной зоны Средней Европы, Балкан. Корневище 1–2 см толщиной. Прикорневые листья широко- или линейно-мечевидные, 15–25 см шириной, прямые или слегка серповидно изогнутые, с заметной продольной ребристостью в средней части пластинки, равны или ниже цветоноса. Один из первых видов, использованных при создании культурных форм ириса [7].
Iris sibirica L. (И3) – ирис сибирский, произрастает в Европе, Предкавказье, Малой Азии и Западной Сибири. Обитает на пойменных и лесных лугах, в березовых колках. Плотнодерновин-ный поликарпик [14]. Стебли 60–135 см высоты. Листья линейные, заостренные, короче стебля. Отрастает в начале июня, цветение во второй половине июля, в течение двух недель, вегетирует до снежного покрова. В культуре неприхотлив, устойчив. В коллекции три экземпляра, с различной окраской венчика, полученных в 2018 г. из Центрального сибирского ботанического сада (г. Новосибирск).
Iris glaucescens Bunge (И4) – ирис сизоватый, произрастает в полынно-дерновиннозлаковых степях на солонцеватых песках, сухих каменистых и щебнистых склонах немногочисленными популяциями на юге Западной Сибири, в Казахстане, Монголии и Китае. Рыхлокустовой поликар-пик. Листья серповидно изогнуты, интенсивно сизые. В коллекции два экземпляра, поступивших в 2018 г. из Горного ботанического сада (г. Махачкала).
Iris sulfurea C. Koch. (syn Iris inbricata Lindl.) (И5) – ирис черепитчатый, встречается на горных лугах, на достаточно увлажненных (проточное увлажнение) каменистых склонах, нередко по обрывистым берегам горных рек в юго-восточных районах Закавказья, в Северном Иране, на высоте 800–2000 м н.у.м. Плотнодерновинный поликарпик. Он имеет широкие, мечеобразные, желто-зеленые или светло-зеленые листья до 30–40 см в длину и от 2 до 3 см в ширину; тонкий стебель овальной формы, с ветвями. Три экземпляра этого вида в 2019 г. получены из Пятигорской эколого-ботанической станции БИН РАН [8].
Вторую группу объектов исследования составили восемь видов древесных растений из рода Acer L. семейства Sapindaceae Juss. различного географического происхождения [3; 4; 6; 11].
Acer pseudoplatanus L. (К1) – клен ложноплатановый, или белый, или явор. Распространен в широколиственных лесах Южной и Центральной Европы, юго-западной Украины и Кавказа. В естественных условиях – высокоствольное дерево. При интродукции в северных регионах часто принимает форму кустарника. Листья до 15–17 см в диаметре, с 5 крупными округлыми лопастями, с верхней стороны темно-зеленые, с нижней – сизовато-белые, обычно волосистые. Требователен к почвенно-климатическим условиям. 2 экземпляра получены из Санкт-Петербурга в 2012 г. и 5 – из Светлогорска (Калининградская область) в 2016 г. Регулярно обмерзают до уровня снега, но интенсивно возобновляются. 4 группа зимостойкости.
Acer rubrum L. (К2) – клен красный Североамериканское не крупное дерево. Растет в лесах по берегам рек и болот, в ущельях и на сухих пониженных участках. Среднетеневынослив. Листья простые 3–5-лопастные, крупные (5–15 на 3,5–10 см), осенью желтые, оранжевые до яркопурпурных. 1 экземпляр получен из Санкт-Петербурга в 2013 г. 2–3 группа зимостойкости.
Acer trautvetteri Medw. (К3) – клен Траутфеттера, или высокогорный. Естественно произрастает в высокогорьях Кавказа. Небольшое дерево с толстым, саблевидно изогнутым в нижней части стволом. Крона широкояйцевидная или шаровидная. Теневынослив. Листья простые, в очертании широкояйцевидные, 9–14 см длиной и 11–16 см шириной, глубоко пятилопастные. Осенью листья приобретают ярко-красно-карминовую окраску. 2 экземпляра получены в 2019 г. из Горного ботанического сада (Дагестан). Группа зимостойкости пока не известна.
Acer tataricum L. (К4) – клен татарский, или черноклен, растет в европейской части России, на Кавказе, в Малой Азии, Иране; на опушках и в окнах широколиственных лесов, чаще на выруб- ках, на высоких гривах в поймах рек. Небольшое дерево, обычно кустовидное. Листья цельные или слегка лопастные, 6–10 см длиной, яйцевидные, заостренные, по краю двоякопильчатые, сверху темно-зеленые, снизу светлее и по жилкам волосистые. Осенью от желтых, оранжево-желтых и пурпурных до коричневых. Теневынослив. Изредка встречается в озеленении и регулярно плодоносит. В коллекции Сургутского ботанического сада имеется несколько экземпляров, поступивших из Уфы в 2012 г., из Санкт-Петербурга в 2014 г., а также полученные из семян сургутской репродукции. 1 группа зимостойкости.
Acer ukurunduense Trautv. &C.A. Mey. (К5) – клен желтый, или укурундский. Ареал: Российский Дальний Восток, Япония, северо-восток Китая. Раскидистый кустарник или кустовидное дерево. Листья пальчато-пятилопастные, довольно жесткие, длиной 8–12 см и почти такой же ширины, опушенные, средняя лопасть значительно крупнее боковых. Осенью листва приобретает красивую яркую окраску, оттенки которой варьируются от светло-красных до коричневатооранжевых и фиолетовых. Хорошо переносит затенение и в природе обычно встречается в верхнем кустарниковом ярусе хвойных лесов. Самый морозостойкий из дальневосточных кленов. 5 экземпляров получено из Санкт-Петербурга в 2016 г. 2–3 группа зимостойкости.
Acer spicatum Lam. (К6) – клен колосистый, является самым северным из видов клена, произрастающих в Северной Америке. Растет на опушках и в подлеске смешанных лесов, довольно хорошо переносит сильное затенение. В естественных условиях – кустарник или небольшое дерево. Листья простые, широко яйцевидные, 7–10 см длиной и 6–9 см шириной, со слабо сердцевидным основанием, неглубоко трех- или пятилопастные, толстые, мягкие, снизу опушены. Осенью листья окрашиваются в желто-оранжевые тона. 3 экземпляра получены из Уфы в 2012 г. 2 группа зимостойкости.
Acer mandshuricum Maxim. (К7) – клен маньчжурский, в природе растет в смешанных лесах на юге Российского Дальнего Востока, в Корее, Японии, Китае. Растет в долинных широколиственных и смешанных лесах, где местами господствует во 2 ярусе. Светолюбив. Дерево, часто кустовидное, с тройчатыми листьями, листочки длиной до 8 см и до 2,5 см шириной на длинных красноватых черешках. Осенью листья становятся пурпурно-красными. В коллекции Сургутского ботанического сада имеется два экземпляра, поступивших из Санкт-Петербурга в 2014 г. и Новосибирска в 2018 г. 2-3 группы зимостойкости.
Acer ginnala Maxim. (К8) – клен гиннала, или приречный, произрастает в широколиственных лесах Российского Дальнего Востока, в Японии и Китае. Деревья 5–7 м высотой, с трехлопастными листьями, центральная лопасть более длинная, боковые – короче, горизонтально распростертые или несколько вверх направленные, нередко почти цельные, яйцевидной формы. Осенью листья становятся малиново-красными. 3 экземпляра получены из Уфы в 2012 г. 1 группа зимостойкости. Цветет и плодоносит.
Для оценки повреждаемости древесных растений низкой температурой использовалась 5-балльная шкала С.Я. Соколова [12]: 1 – растение вполне зимостойко; 2 – у растения отмерзают концы побегов; 3 – отмерзают крупные ветви; 4 – отмерзает вся надземная часть до уровня снегового покрова (или почвы); 5 – растение не зимует, вымерзает с корнем.
Определение биохимических показателей (содержание флавонолов – Flv, мг/см², хлорофилла – Chl, мг/см² и индекса азотного баланса – Nbi) проводили с помощью инновационного аппарата DUALEX (Франция). Индекс азотного баланса растений Nbi (Nitrogen Balance Index) представляет собой соотношение количества хлорофилла и флавонолов. Выборку листьев делали с нескольких близко растущих растений, для древесных на уровне поднятой руки, с максимального количества доступных веток, направленных условно на север, запад, восток и юг.
Статистическая обработка данных осуществлялась при помощи программных пакетов Excel MS Office-2016 и Statistica 10. Соответствие структуры данных закону нормального распределения оценивалось на основе критерия Шапиро–Уилка (для выборок n < 30). Производилась идентификация показателей Nbi, Chl, Flv на соответствие закону нормального распределения. Закон Гаусса подтвердился, поэтому дальнейшие исследования зависимостей производились методами параметрической статистики. Для сравнения двух независимых ненормально распределенных выборок использовали U-тест Манна-Уитни (Mann-Whitney U-test), который сравнивает не средние значения выборок, а суммы рангов по каждой из них. Сравнение двух независимых групп осуществлялось с использованием параметрического критерия t-тест Стьюдента для оценки наличия различий между ними. Для сравнения нескольких независимых выборок видов клена по одному признаку использовали непараметрический дисперсионный анализ Крускала–Уоллиса и медианный тест (ANOVA Kruskal-Wallisand Median test).
Результаты и их обсуждение
Диапазон азотного баланса у травянистых растений составил от 32,2 до 39,7, а содержание хлорофилла – от 48,1 до 58,6мг/см2, с максимальным значением этих двух показателей у Iris hun-garica (рис. 1). Это связано с действием стресса, вызванного нарушением водного режима растительного организма ириса разноцветного, который предпочитает довольно увлажненные местообитания, а в культуре недостаточное водоснабжение привело к нарушению экологических требований растений, что согласуется с литературными источниками [2]. Показатели содержания (Nbi,
Chl) в листьях травянистых растений варьировали больше, чем содержание флавонолов, которое
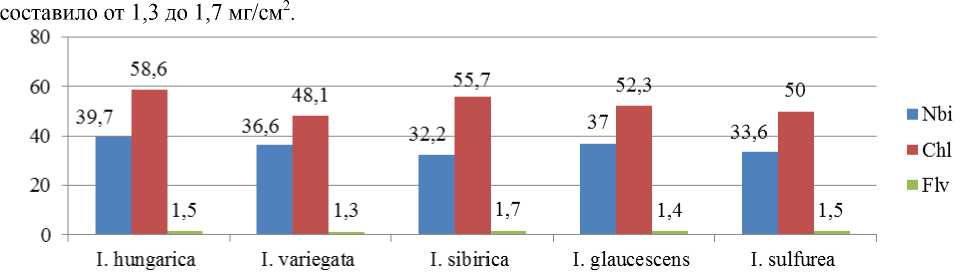
Рис. 1. Сравнительный анализ средних значений показателей (Nbi, Chl, Flv) в листьях травянистых растений рода Iris (август)
Аналогично у древесных растений максимальные значения (Nbi, Chl) отмечены у Acer pseudoplatanus, что является реакцией адаптации к условиям произрастания и указывает на повышение защитных функций растения (рис. 2). Стресс вызван климатическими факторами, так как явор регулярно обмерзает до уровня снега, а затем интенсивно возобновляется за вегетационный период.
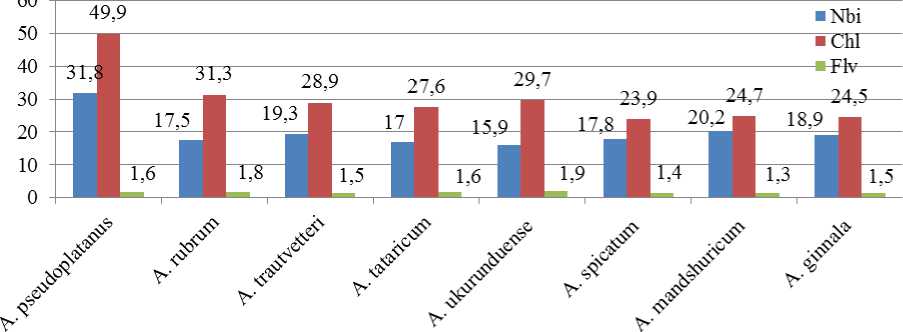
Рис. 2. Сравнительный анализ средних значений показателей (Nbi, Chl, Flv) в листьях древесных растений рода Acer (август)
Значение индекса азотного баланса (NBI) у остальных изученных видов изменялось незначительно – от 15,9 ( Acer ukurunduense ) до 19,3 ( Acer trautvetteri ). Данный показатель зависит от многих экологических факторов, а в нашем случае минимальное значение (NBI) клена укурунд-ского является адаптационной реакцией к условиям достаточного освещения, так как он произрастает на открытом месте, без затенения.
Содержание хлорофилла варьировало от 23,9 мг/см2 ( Acer spicatum ) до 31,3 мг/см2 ( Acer rubrum ), т. е. всего в 1,3 раза в пределах видов группы, произрастающих на одной экспозиции (в одинаковых экологических условиях).
Содержание флавонолов в листьях древесных растений было невелико и варьировало от 1,3 мг/см2 у Acer mandshuricum до 1,9 мг/см2 у Acer ukurunduense .
Таким образом, исследованные группы неодинаково реагируют на условия среды произрастания. Пигментный состав листьев декоративных растений свидетельствует об их относительно высоком физиологическом статусе.
В полученных результатах достоверными были различия по содержанию хлорофилла и флавонолов при сравнении средних значений двух независимых групп декоративных растений, о чем свидетельствуют данные, приведенные в таблице.
Таблица
Результаты выполнения t -теста для независимых выборок
|
Показатель, вид |
Mean |
t-value |
df |
p |
Valid N |
Std. dev. |
F-ratioVariances |
p Variances |
|
Травянистые растения |
||||||||
|
Chl И1–И2 |
59,44 |
2,34 |
8 |
0,04 |
10 |
2,92 |
12,82 |
0,03 |
|
48,1 |
10,45 |
|||||||
|
Flv И1– И2 |
1,49 |
3,32 |
8 |
0,01 |
10 |
0,10 |
3,66 |
0,24 |
|
1,32 |
0,05 |
|||||||
|
Flv И1– И3 |
1,49 |
-3,48 |
8 |
0,008 |
10 |
0,10 |
1,48 |
0,70 |
|
1,73 |
0,12 |
|||||||
|
Flv И2– И3 |
1,32 |
-6,97 |
8 |
0,0001 |
10 |
0,05 |
5,41 |
0,13 |
|
1,73 |
0,12 |
|||||||
|
Flv И2– И5 |
1,32 |
-6,09 |
8 |
0,0003 |
10 |
0,05 |
2,39 |
0,40 |
|
1,49 |
0,03 |
|||||||
|
Flv И3– И4 |
1,73 |
5,26 |
8 |
0,0008 |
10 |
0,12 |
4,09 |
0,20 |
|
1,41 |
0,06 |
|||||||
|
Flv И3– И5 |
1,73 |
4,31 |
8 |
0,003 |
10 |
0,12 |
12,94 |
0,03 |
|
1,49 |
0,03 |
|||||||
|
Древесные растения |
||||||||
|
Flv К1– К6 |
1,58 |
2,66 |
22 |
0,01 |
24 |
0,13 |
2,82 |
0,09 |
|
1,38 |
0,22 |
|||||||
|
Flv К7– К8 |
1,27 |
-3,88 |
38 |
0,0004 |
40 |
0,24 |
1,68 |
0,27 |
|
1,53 |
0,18 |
|||||||
|
Chl К2– К8 |
31,30 |
4,75 |
30 |
0,00005 |
32 |
5,20 |
3,04 |
0,03 |
|
24,46 |
2,99 |
|||||||
|
Chl К3– К8 |
28,88 |
4,86 |
30 |
0,00003 |
32 |
1,23 |
5,87 |
0,005 |
|
24,46 |
2,99 |
|||||||
|
Chl К5– К8 |
29,71 |
3,40 |
30 |
0,002 |
32 |
5,76 |
3,72 |
0,01 |
|
24,46 |
2,99 |
|||||||
|
Chl К2– К4 |
31,30 |
2,84 |
30 |
0,008 |
32 |
5,20 |
6,04 |
0,0007 |
|
27,60 |
2,12 |
|||||||
|
Chl К2– К6 |
31,30 |
2,96 |
22 |
0,007 |
24 |
5,20 |
1,73 |
0,38 |
|
23,94 |
6,84 |
|||||||
Примечание : Mean – средние значения для каждой группы; t - value – значение рассчитанного программой t -критерия Стьюдента; df – число степеней свободы; p – вероятность ошибки (критический уровень значимости принят равным р < 0,05); Valid N – объем выборки; Std. dev. – стандартное отклонение выборки; F-ratio, Variances – значение F -критерия Фишера, с помощью которого проверяется гипотеза о равенстве дисперсий в сравниваемых выборках; P, Variances – вероятность ошибки для F- теста Фишера.
При сравнении суммы рангов показателя Chl у двух независимых ненормально распределенных групп Acer pseudoplatanus и Acer mandshuricum выявлено наличие статистически значимой разницы между сравниваемыми выборками при P = 0,001 (рис. 3a). При анализе данных показателя Flv четырех видов: Acer rubrum, A. trautvetteri, A. tataricum, A. ukurunduense – и совокупностей показателя NBI пяти видов: Acer rubrum, A. trautvetteri, A. tataricum, A. mandshuricum, A. ginnala – наблюдаются различия между сравниваемыми группами, при P < 0,05 (рис. 3b, c).
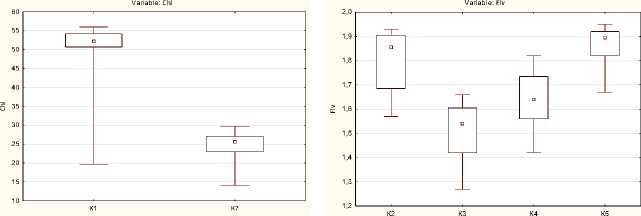
Вид
а
Вид b
* Примечание : Median – медиана; Perсentile – процентили 25–75%; min – минимальные значения показателя; max – максимальные значения показателя
Variable: Nbi
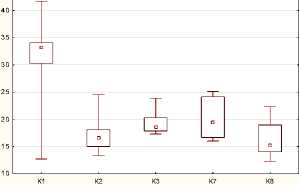
Вид
Рис. 3. Диаграмма сравнения нескольких независимых групп по одному показателю: a – Chl, b – Flv, c – Nbi
Выводы
Все изученные интродуценты находятся в удовлетворительном физиологическом состоянии, о чем говорит незначительное варьирование биохимических показателей в пределах изученных групп декоративных растений.
Максимальные значения показателей Nbi – 39,7; Chl – 58,6 мг/см2 (Iris hungarica ) и Nbi – 31,8; Chl – 49,9 мг/см2 ( Acer pseudoplatanus ) являются реакцией адаптации к условиям произрастания и указывают на формирование защитных функций растений.
Минимальное значение показателя Nbi – 15,9 у Acer ukurunduense является адаптационной реакцией к условиям достаточного освещения.
Исследование выполнено при финансовой поддержке Департамента образования и молодежной политики Ханты-Мансийского автономного округа – Югры (приказ № 1281 от 25.08.17 г.).
Список литературы Адаптационные возможности интродуцентов различного происхождения в условиях Ботанического сада г. Сургута
- Алексеева Н. Б. Род Iris L.(Iridaceae) в России // Turczaninowia. 2008. Т. 11. № 2. С. 5-70.
- Архангельская Г. П., Мухаев Б. А. Особенности адаптации ильмовых к почвенной засухе//Повышение устойчивости и долговечности защитных лесных насаждений. Волгоград, 1980. С. 72-81.
- Булыгин Н. Е. Дендрология. Л.: Агропромиздат, 1991. 352 с.
- Интродукция древесных растений в Сибири / науч. ред. И. Ю. Коропачинский. Новосибирск: Гео, 2017. 716 с.
- Кузнецов В. В., Дмитриева Г. А. Физиология растений. М.: Абрис, 2011. 783 с.
- Мамаев С. А., Дорофеева Л. М. Интродукция клена на Урале. Екатеринбург: УрО РАН, 2005. 104 с.
- Мамонтова Е. Н. Коллекция ирисов природной флоры, интродуцируемых в ботаническом саду Самарского госуниверситета // Самарская Лука, 2007. Т. 16. № 3(21). С. 518-531.
- Михеев А. Д. Iris L. // Конспект флоры Кавказа. СПб., 2006. Т. 2. С. 104-112.
- Павлова Н. С. Касатик - Iris L. // Флора Российского Дальнего Востока. Владивосток, 2006. С. 277-279.
- Панин С. И., Колесниченко Е. Ю, Морозова Т. С., Соловьева В. И. Оценка аккумуляции тяжёлых металлов древесными растениями полезащитной лесополосы и полевыми культурами // Вестник Московского государственного областного университета. Серия: Естественные науки. 2014. № 1. С. 75-80.
- Рязанова Н. А., Путенихин В. П. Клены в Башкирском Предуралье: биологические особенности при интродукции. Уфа: Гилем, 2012. 224 с.
- Соколов С. Я., Связева О. А. География древесных растений. М.-Л.: Наука, 1965. 266 с.
- Ткаченко К. Г. Виды рода Iris L. в коллекциях-экспозициях живых растений альпинария ботанического сада Петра Великого Ботанического института РАН // Вестник Удмуртского университета. Биология. Науки о Земле, 2013. Вып.3. С. 35-43.
- Фомина Т. И. Биологические особенности декоративных растений природной флоры в Западной Сибири. Новосибирск: Гео, 2012.179 с.
- Bueno J. M., Sáez-Plaza P., Ramos-Escudero F., Jiménez A. M., Fett R., Asuero A. G. Analysis and antioxidant capacity of anthocyanin pigments. Part II: chemical structure, color, and intake of anthocyanins // Critical Reviews in Analytical Chemistry. 2012. V. 42. № 2. P. 126-151.
- DOI: 10.1080/10408347.2011.632314
- Chen M., Blankenship R. E. Expanding the solar spectrum used by photosynthesis // Trends in plant science. 2011. V. 16. № 8. P. 427-431.
- DOI: 10.1016/j.tplants.2011.03.011
- Quemada M., Gabriel J. L., Zarco-Tejada P. Airborne hyperspectral images and ground-level optical sensors as assessment tools for maize nitrogen fertilization // Remote sensing. 2014. V. 6. № 4. P. 2940-2962.
- DOI: 10.3390/rs6042940
- Ritz T., Damjanović A., Schulten K., Zhang J. P., Koyama Y. Efficient light harvesting through carotenoids // Photosynthesis Research. 2000. V. 66. № 1-2. P. 125-144. :1010750332320
- DOI: 10.1023/A


