Адаптивный потенциал подвоя Rosa canina L., полученного in vitro, в условиях юга Западной Сибири
Автор: Васильева О.Ю., Амброс Е.В., Козлова М.В.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Клональное микроразмножение
Статья в выпуске: 3 т.57, 2022 года.
Бесплатный доступ
Размножение садовых роз проводится посредством прививки сортов на устойчивые подвои, преимущественно внутривидовые формы Rosa canina L. Подземная часть этих подвоев зимостойка даже в условиях лесостепи и южной тайги Западной Сибири, однако их системы побегов формирования (СПФ), на которых образуются генеративные побеги, повреждаются в период зимовок. В Центральном сибирском ботаническом саду СО РАН (ЦСБС, г. Новосибирск) проводятся многолетние исследования сезонного развития, онтогенеза, биоморфологии, репродуктивной биологии и зимостойкости видов шиповников из секции Caninae Crėp. В настоящей работе впервые приведены результаты многолетнего изучения зимостойкости и семенной продуктивности микроклонально размноженной высокозимостойкой отборной формы R. canina , дана оценка состояния СПФ после экстремальных зимовок. Выявлено, что после экстремальных зимовок растения отборной формы не переходят в категорию «временно не цветущих». Целью работы было введение в культуру in vitro и размножение посредством прямого органогенеза перспективной зимостойкой формы Rosa canina , используемой в качестве подвоя для садовых роз, а также оценка адаптивного потенциала у растений, полученных посредством клонального микроразмножения, в условиях континентального климата. Эксперименты in vitro проводили на отборной зимостойкой форме, выделенной в ЦСБС из растений F3 местной репродукции. Первичными эксплантами служили меристемы с двумя листовыми примордиями, изолированные из пазушных почек однолетних вегетативных побегов. На этапе введения в культуру in vitro экспланты культивировали в течение 3 сут на жидкой питательной среде по прописи Мурасиге-Скуга (МС), дополненной глутатионом (100,0 мг/л) и глюкозой (30,0 г/л). Для индукции прямого органогенеза использовали среду МС с 2,0 мг/л 6-бензиламинопурина (6-БАП) и 1,0 мг/л 3-индолилуксусной кислотой (ИУК). Собственно микроразмножение регенерантов проводили на среде МС с 1,0 мг/л 6-БАП. Микрорастения укореняли на среде МС с половинным содержанием микро- и макроэлементов, дополненной 1,0 мг/л ИУК. Переводу регенерантов в почвенную культуру предшествовало выращивание в контейнерах со стерильным песком, затем в горшках с субстратом, состоящим из смеси торфа с перлитом, перегноя, песка и кокосового субстрата (1:1:0,5:0,5). Дальнейшие исследования проводили в 2015-2021 годах на экспериментальном участке ЦСБС, расположенном в лесостепной зоне юга Западной Сибири (г. Новосибирск, Академгородок), которая характеризуется континентальным климатом. При изучении морфогенеза использовали классические и современные биоморфологические подходы, которые рассматривают кустарниковую форму роста как совокупность систем побегов формирования (СПФ) в пространстве и смену этих систем во времени. Сезонную динамику крахмала в побегах исследовали с помощью реакции с йодом в йодистом калии. Учитывали семенную продуктивность. На этапе собственно микроразмножения на средах с 1,0 мг/л 6-БАП получили 8±1 микропобегов на эксплант. При укоренении регенерантов на среде МС с половинным содержанием микро- и макроэлементов и 1,0 мг/л ИУК частота ризогенеза равнялась 60 %, число корней, развившихся у каждого микропобега, составило в среднем 2±1. Выявлено, что прегенеративный период у R. canina микроклонального происхождения сокращается на год, в онтогенетическое состояние g1 особи вступают на третий год, а образование парциальных кустов, которые могут быть использованы для пополнения семенных плантаций, начинается на четвертый год вегетации. В условиях континентального климата лесостепи Западной Сибири у всех особей отборной формы, размноженных in vitro, было отмечено ежегодное плодоношение на побегах выше снегового покрова. Исключением была зимовка 2020-2021 годов, однако даже после суровой зимовки гипантии сформировались в нижней части СПФ. Продолжительное снижение температуры до -30 °С в декабре приводило к частичному повреждению средней части СПФ, кратковременное снижение температуры воздуха до -28 °С в январе не наносило серьезных повреждений даже средней части СПФ. Отборная форма оказалась также устойчива к сильным весенним заморозкам во II декаде мая. При благоприятных зимовках и сохранении терминальных почек СПФ зрелых генеративных растений (g2) продолжала нарастать в высоту. Сочетание двух благоприятных зимовок подряд привело к образованию и сохранению мощных СПФ до 2 м высотой, а также к формирова-нию на укороченных плодовых побегах преимущественно 2-3 гипантиев с высоким числом выполненных семян. Гидролиз крахмала у тех побегов R. canina , у которых в октябре отмечалось полное опадение листьев (фенофаза Л5), практически завершался в ноябре, однако единичные крахмальные зерна еще находились в однорядных и многорядных сердцевинных лучах, а также перимедуллярной зоне.
Rosa canina, клональное микроразмножение, онтогенез, парциальный куст, семенная продуктивность, гистохимические исследования, лесостепь западной сибири
Короткий адрес: https://sciup.org/142236343
IDR: 142236343 | УДК: 635.9:581.143.6:58.084(571.1) | DOI: 10.15389/agrobiology.2022.3.579rus
Текст научной статьи Адаптивный потенциал подвоя Rosa canina L., полученного in vitro, в условиях юга Западной Сибири
Садовые розы традиционно выращиваются в привитой культуре (14). В Сибири нет естественных местообитаний наиболее широко используемого подвоя Rosa canina L., который произрастает в Европе, Западной и Средней Азии, Северной Африке, в Крыму и на Кавказе. Восточная граница ареала этого вида не достигает Камы (5).
Основная проблема состоит в том, что подземная часть подвоя R. canina обладает высокой зимостойкостью, тогда как надземная побеговая система даже в лесостепи Западной Сибири часто получает серьезные повреждения в результате зимовок. Можно успешно выращивать сеянцы подвоя R. canina из семян, собранных в естественных местообитаниях с более мягким климатом, однако получение семян местной репродукции в промышленных масштабах в регионе не гарантировано.
Неоднократные попытки использовать на Урале и в Западной Сибири в качестве подвоев шиповники местной флоры ( R. acicularis Lindl., R. majalis Herrm. ) , а также наиболее зимостойкие шиповники-интродуценты ( R. rugosa Thunb.) показали неперспективность этих видов. Для всех них характерно наличие большого числа шипов и мелких шипиков на побегах, чрезвычайно затрудняющих прививку и окулировку, а также высокое по-рослеобразование, угнетающее в дальнейшем сортовую привойную часть. К числу особенностей R. acicularis и R. majalis также относятся непродолжительный период хорошего отделения коры, связанный с сокодвижением, и тонкая, лопающаяся кора в зоне прививки (6).
Согласно зарубежным таксономическим и молекулярно-генетическим исследованиям (7-9), R. canina — чрезвычайно полиморфный вид с широким ареалом, что позволяет проводить поиск и отбор форм ex situ, перспективных в конкретных эколого-географических условиях как в качестве подвоя, так и в качестве лекарственного растения (10-12). За пределами естественного ареала, в условиях более комфортного, чем континентальный, муссонного климата Российского Дальнего Востока отмечены случаи натурализации интродуцента R. canina (13).
В Центральном сибирском ботаническом саду СО РАН (ЦСБС, г. Новосибирск) проведены многолетние исследования сезонного развития, онтогенеза, биоморфологии, репродуктивной биологии и зимостойкости видов шиповников из секций Caninae Crep., Indicae Thory, Synstylae DC. и Cinnamomeae DC. Благодаря особому типу Caninae -мейоза (14), а также склонности R. canina и R. corymbifera к автогамии и факультативному апомиксису (15), семенное потомство отборных форм этих видов характеризуется матроклинностью. Наиболее эффективно решить проблему ускоренного размножения зимостойких высокопродуктивных форм можно при использовании клонального микроразмножения. Зарубежными биотехнологами описан положительный опыт размножения in vitro некоторых видов (16-18) и культиваров (19-21) роз.
В настоящей работе впервые приведены результаты многолетнего изучения зимостойкости и семенной продуктивности отборной высокозимостойкой формы Rosa canina, размноженной in vitro, дана оценка состояния системы побегов формирования после экстремальных зимовок. Выявлено, что после экстремальных зимовок растения отборной формы не переходят в категорию «временно не цветущих».
Целью работы была оценка адаптивного потенциала перспективной зимостойкой формы Rosa canina , введенной в культуру in vitro.
Методика. Размножение зимостойкой формы R. canina , используемой в качестве подвоя для садовых роз, осуществляли с помощью микроклонирования.
Растения исходных интродукционных популяций R. canina были выращены из семян, собранных в естественных местообитаниях в Кабардино-Балкарии. Сначала отбор лучших двухлетних особей семенного происхождения проводили по энергии роста в прегенеративный период, зимостойкости, умеренному образованию побегов возобновления, устойчивости к грибным болезням. Далее отмечали образцы с наибольшей урожайностью плодов-гипантиев и регулярным плодоношением. Выделенные зимостойкие формы (в частности, R. canina ¹ 23 и R. canina ¹ 39) использовали для сравнения при дальнейших отборах. Для анализа ритмов роста и развития, степени подготовленности растений R. canina к зимовке в сравнительные исследования привлекался также вид местной флоры R. majalis Herrm.
Эксперименты in vitro проводили на отборной зимостойкой форме, выделенной в ЦСБС из растений F 3 местной репродукции. Первичными эксплантами служили меристемы с двумя листовыми примордиями, изолированные из пазушных почек однолетних вегетативных побегов. На этапе введения в культуру in vitro экспланты культивировали в течение 3 сут на жидкой питательной среде по прописи Мурасиге-Скуга (МС), дополненной 100,0 мг/л глутатиона и 30,0 г/л глюкозы (22, 23). Для индукции прямого органогенеза использовали среду МС с 2,0 мг/л 6-бензиламинопурина (6-БАП) и 1,0 мг/л 3-индолилуксусной кислоты (ИУК). Собственно микроразмножение регенерантов проводили на среде МС с 1,0 мг/л БАП. Микрорастения укореняли на среде МС с половинным содержанием микро- и макроэлементов, дополненной 1,0 мг/л ИУК. Переводу регенерантов в почвенную культуру предшествовало выращивание в контейнерах со стерильным песком, затем в горшках с субстратом, состоящим из смеси торфа с перлитом, перегноя, песка и кокосового субстрата (1:1:0,5:0,5) (24).
Дальнейшие исследования проводили в 2015-2021 годах на экспериментальном участке ЦСБС, расположенном в лесостепной зоне юга Западной Сибири (г. Новосибирск, Академгородок), которая характеризуется континентальным климатом. Метеорологические условия вегетации и зимовки анализировали на основании данных ближайшей к Центральному сибирскому ботаническому саду ГМС (пос. Огурцово, г. Новосибирск).
Растения из горшков с субстратом пересаживали в открытый грунт. Фенологические наблюдения осуществляли согласно описанной методике (25).
При изучении морфогенеза использовали классические и современные биоморфологические подходы (26, 27), которые рассматривают кустарниковую форму роста как совокупность систем побегов формирования (СПФ) в пространстве и смену этих систем во времени. В надземной части куста выделяли побеги кущения, стеблевые и корневищные, в подземной — ксилоподии и ксилоризомы (28). Динамику побегообразования оценивали на 15 растениях. Качественные признаки онтогенетических состояний описывали на основании шкалы периодизации онтогенеза (29).
Сезонную динамику содержания крахмала в побегах исследовали с помощью реакции с йодом в йодистом калии. Состав реактива был следующим: 2 г йодистого калия, 0,2 г кристаллического йода и 100 мл дистиллированной воды (30). Для приготовления микропрепаратов использовали санный микротом MC-2 («Спектро Лаб», Украина) c термоохлаждающим столиком TOC-II («Точмедприбор», Украина), световой микроскоп Carl Zeiss Axioscop-40 («Carl Zeiss», Германия), видеокамеру AxioCam MRc-5 («Carl Zeiss», Германия) с программой для получения и обработки изображений AxioVision 4.8 («Carl Zeiss», Германия, . При учете семенной продуктивности использовались методические указания по семеноведению интродуцентов (31), а также собственные разработки (32). Семенную продуктивность у изучаемых форм R. canina оценивали по 20 плодам-гипантиям.
Статистическую обработку данных осуществляли по Б.А. Доспехову (33) в программе Microsoft Excel 2003. Использовались формулы для вычисления статистических характеристик выборки при количественной изменчивости признаков: рассчитывали средние арифметические значения ( M ), ошибки средних (±SEM), коэффициенты вариации ( Cv ).
Результаты. Особенности морфогенеза отборной зимостойкой формы R. canina , характеризующейся технологически ценным малым числом шипов на побегах (рис. 1, а), изучали в условиях in vitro у почек, взятых в сентябре-октябре, поскольку у них наблюдалась максимальная частота побегообразования (62,0 %).
Соотношение 2,0 мг/л 6-БАП и 1,0 мг/л ИУК в сочетании с глутатионом в нулевом пассаже позволило получить к концу первого пассажа (через 6 нед культивирования) жизнеспособные микропобеги. Регенерация микропобегов из меристем пазушных почек происходила по периферии их основания (см. рис. 1, б). В среднем образовывалось около трех побегов на эксплант. На этапе собственно микроразмножения на средах с 1,0 мг/л 6-БАП число микропобегов на эксплант составило 8±1 (см. рис. 1, в). При укоренении регенерантов на среде МС с половинным содержанием микро-и макроэлементов и 1,0 мг/л ИУК с частотой ризогенеза 60 % у каждого микропобега развивалось в среднем 2 ± 1 корней (см. рис. 1, г, д).
Приживаемость растений-регенерантов в условиях ex vitro составила 95-100 %, при этом растения характеризовались хорошим развитием надземной части и корневой системы (число корней — 2-4 шт., длина — 2,57,5 см) (см. рис. 1, е, ж). У растений с такими морфологическими характеристиками (см. рис. 1, з) изучали их онтоморфогенез и репродуктивную биологии in vivo.
Первый этап исследования позволил в короткий срок размножить высокозимостойкую форму в количестве, необходимом для проведения экспериментов и создания семенной плантации с минимальным использованием побегового материала. Прегенеративный период у R. canina микро-клонального происхождения сокращался на год, в онтогенетическое состояние g1 особи вступали на третий год, а образование парциальных кустов, которые могут быть использованы для пополнения семенных плантаций, начиналось на четвертый год вегетации. При семенном размножении по- требовалось бы еще 1-2 года на стратификацию семян.

Рис. 1. Клональное микроразмножение отборной зимостойкой формы Rosa canina L.: а — однолетние вегетативные побеги, исходный материал для введения в культуру in vitro, б — формирование микропобегов из меристем пазушных почек побегов через 4 нед культивирования на индукционной среде Мурасиге-Скуга (МС) с 2,0 мг/л 6-бензиламинопурина (6-БАП) и 1,0 мг/л 3-индолилуксусной кислоты, в — микропобеги через 6 нед микроразмножения на среде МС с 1,0 мг/л 6-БАП, г — укоренение регенерантов на среде 1/ 2 МС с 1,0 мг/л ИУК, д — микро-
растения через 6 нед культивирования на среде для укоренения, е — адаптация регенерантов в условиях ex vitro в стерильном песке, ж — растения-регенеранты через 4 нед адаптации в стерильном песке, з — растения-регенеранты в субстрате из смеси торфа с перлитом, перегноя, песка и кокосового субстрата (1:1:0,5:0,5) через 4 нед адаптации.
Второй этап работы был необходим в связи с тем, что метеорологические условия и повреждающие факторы во время почти полугодовых зимовок в условиях лесостепи Западной Сибири весьма различаются по годам. Для этой зоны характерно резкое понижение температуры в ноябре до - 20... - 25 ° С, продолжительные декабрьские и январские морозы ниже - 35 ° С, недостаточное накопление твердых осадков в первой половине зимовки. Многолетние исследования, проведенные нами, позволили охватить все проблемные периоды зимовок и составить наиболее полное представление об адаптивном потенциале отборной зимостойкой формы R. canina . Особое внимание уделялось развитию и сохранению систем побегов формирования после зимовок в зависимости от метеорологических условий. Также для достижения фенофазы Пб2 (окончание линейного роста побегов и заложение терминальной почки) важное значение имели гидротермические условия со II декады сентября по III декаду октября.
-
1. Метеорологическая характеристика зимних периодов 2015-2021 годов в условиях континентального климата лесостепи Западной Сибири (г. Новосибирск)
Месяц
Температура воздуха, ° С
Осадки, мм
декада
среднемесячная
отклонение от нормы
декада
I
II
III
I
II
III
средняя min
средняя min
средняя min
2015 год
Ноябрь
- 2,0
- 10,8
- 14,3
- 21,1
- 8,4
- 24,9
- 8,2
- 0,6
6,0
0,0
30,0
Декабрь
- 4,2
- 15,1
- 6,4
- 17,7
- 7,3 - 27,1
2016 год
- 6,0
7,9
9,0
7,0
32,0
Январь
- 20,2
- 29,3
- 20,2
- 34,8
- 18,2
- 29,7
- 19,5
- 2,7
1,0
5,0
0,0
Февраль
- 6,8
- 19,6
- 14,8
- 26,3
- 6,3
- 20,3
- 9,3
6,3
10,0
4,0
0,5
Ноябрь
- 6,1
- 20,8
- 22,3
- 33,2
- 10,2
- 31,7
- 12,9
- 5,3
21,0
6,0
19,0
Декабрь
- 10,4
- 26,5
- 9,4
- 22,0
- 16,6 - 36,1
2017 год
- 12,1
1,8
23,0
19,0
11,0
Январь
- 8,9
- 29,2
- 19,2
- 29,5
- 15,1
- 31,9
- 14,4
2,4
13,0
6,0
5,0
Февраль
- 12,7
- 21,0
- 20,1
- 32,8
- 5,0
- 16,4
- 12,6
3,0
5,0
8,0
4,0
Ноябрь
0,7
- 6,9
- 7,6
- 22,9
- 8,8
- 24,8
- 5,2
2,4
16,0
11,0
7,0
Декабрь
- 9,3
- 18,1
- 17,9
- 27,8
- 9,7 - 24,3
2018 год
- 12,3
1,6
5,0
1,0
33,0
Январь
- 20,2
- 31,5
- 15,7
- 31,2
- 26,8
- 37,4
- 20,9
- 4,1
3,0
21,0
3,0
Февраль
- 14,9
- 26,5
- 15,4
- 27,1
- 15,5
- 28,3
- 15,3
0,3
0,8
3,0
1,0
Ноябрь
- 5,7
- 22,5
- 11,7
- 23,0
- 7,1
- 17,1
- 8,2
- 0,6
27,0
16,0
27,0
Декабрь
- 21,9
- 36,5
- 12,8
- 28,1
- 23,5 - 35,4
2019 год
- 19,4
- 5,5
6,0
11,0
5,0
Январь
- 15,5
- 27,9
- 13,8
- 26,6
- 14,7
- 28,2
- 14,7
2,1
3,0
2,0
7,0
Февраль
- 30,0
- 40,1
- 10,4
- 25,8
- 7,0
- 14,7
- 15,8
- 0,2
0,0
4,0
4,0
Ноябрь
- 1,3
- 14,8
- 13,8
- 29,5
- 15,2
- 28,5
- 10,1
- 2,5
14,0
14,0
8,0
Декабрь
- 6,1
- 22,5
- 8,2
- 13,9
- 13,6 - 31,6
2020 год
- 9,3
4,6
14,0
14,0
28,0
Январь
- 7,9
- 22,4
- 11,9
- 25,8
- 11,7
- 28,8
- 10,5
6,3
11,0
16,0
17,0
Февраль
- 7,9
- 27,4
- 10,8
- 29,8
- 4,9
- 17,2
- 7,9
7,7
19,0
7,0
9,0
Ноябрь
2,2
- 2,8
- 7,0
- 20,8
- 9,3
- 19,4
- 4,7
2,9
11,0
18,0
0,2
Декабрь
- 16,2
- 25,3
- 10,5
- 21,5
- 21,4 - 40,0
2021 год
- 16,0
- 2,1
10,0
10,0
20,0
Январь
- 27,2
- 39,3
- 19,0
- 32,1
- 19,1
- 41,0
- 21,8
- 5,0
3,0
6,0
19,0
Февраль
- 11,2
- 26,3
- 16,4
- 36,1
- 21,5
- 32,6
- 16,4
- 0,8
13,0
12,0
6,0
Как показали наши исследования, для более четкого прогнозирования степени повреждения СПФ необходимо учитывать не только среднедекадную температуру воздуха и суммарное количество твердых осадков за декаду, но и минимальную декадную температуру (табл. 1). Так, средняя температура воздуха в III декаде ноября 2016 года была - 10,2 ° С, а мини-
мальная опускалась до - 31,7 ° С. Такое начало зимовки относится к экстремальным, поскольку в течение всей II декады ноября минимальные температуры воздуха были ниже - 20 ° С, а на протяжении 6 сут опускались даже до - 25 ° С. Отклонение среднемесячной температуры воздуха от нормы составило - 5,3 ° С. Окончание вегетационного периода 2016 года с резким понижением температуры в октябре также не способствовало завершению роста годичных побегов и заложению терминальных почек.
-
2. Структура куста молодых (g1) и зрелых (g2) генеративных растений отборной зимостойкой формы Rosa canina L., полученных посредством клонального микроразмножения, в условиях континентального климата лесостепи Западной Сибири ( n = 15, M ±SEM; г. Новосибирск, Академгородок)
-
3. Семенная продуктивность отборных зимостойких форм Rosa canina L., полученных посредством клонального микроразмножения, в условиях континентального климата лесостепи Западной Сибири ( n = 15; г. Новосибирск, Академгородок )
Возраст растений
Число семян в плоде, шт.
Масса выполненных семян в плоде, г
выполненных
недоразвитых
M ±SEM
Cv , %
M ±SEM
Cv , %
M ±SEM
Cv , %
R. can in a ¹ 23
4 года
36,32±0,90
24,3
6,35±0,45
34,2
0,82±0,02
14,3
5 лет
29,72±1,05
35,6
11,40±0,62
42,0
0,86±0,02
11,7
6 лет
32,95±1,16
22,1
7,82±0,56
39,4
0,95±0,02
9,8
R. can in a ¹ 39
4 года
38,05±1,23
29,7
5,42±0,40
44,5
0,88±0,03
12,0
5 лет
35,21±1,37
19,2
8,10±0,63
32,1
0,94±0,02
8,4
6 лет
32,71±0,90
18,6
7,30±0,47
37,3
0,97±0,03
9,3
R. ca n in
a , отборная
форма
4 года
31,75±1,43
20,5
4,90±0,43
39,6
0,69±0,03
20,3
5 лет
35,30±1,48
18,7
5,20±0,49
42,5
0,84±0,04
21,4
6 лет
34,85±0,95
12,2
5,75±0,44
34,3
0,91±0,04
19,8
После экстремальной зимовки молодые генеративные (g1) растения отборной формы не перешли в состояние «временно не цветущих», хотя СПФ получили повреждения в верхней и частично средней части побегов. Плоды сформировались в нижнем и среднем ярусе СПФ.
Интенсивное образование стеблевых побегов в течение вегетационного периода 2017 года (табл. 2) было следствием гибели верхней и повреждения средней частей осевого побега из-за экстремальной зимовки. Наиболее благоприятное начало зимнего периода отмечалось в ноябре 2017 года и ноябре 2018 года.
|
Год, со- |
СПФ |
Побеги кущения |
Побеги стеблевые |
Парциальный куст |
|
стояние |
число высота, см |
число высота, см |
число длина, см |
число высота, см |
2016, g1 2,13±0,19 128,73±1,52 2,07±0,21 122,60±3,75 0 0
2017, g2 3,47±0,13 143,13±1,83 2,60±0,67 155,80±2,88 7,33±0,43 45,93±1,42 0,67±0,13 92,80±2,23
2018, g2 5.33±0,32 175,93±3,32 4,13±0,26 159,27±1,12 5,87±0,24 23,33±2,18 2,13±0,09 96,20±1,05
2019, g2 2,13±0,09 119,00±1,50 2,13±0,09 119,00±1,50 2,13±0,09 119,00±1,50 2,13±0,09 119,00±1,50
Примечание. СПФ — система побегов формирования.
Сочетание двух благоприятных зимовок подряд привело к образованию и сохранению мощных СПФ до 2 м высотой, а также к формированию на укороченных плодовых побегах преимущественно 2-3 гипантиев с высоким числом выполненных семян (табл. 3). В питомниководстве плоды-орешки шиповников, образующиеся внутри гипантия, традиционно называют семенами, а собственно гипантий (разросшееся цветоложе) — плодом. Чтобы спрогнозировать выход качественных семян подвоя из собранных плодов, мы проводили подсчет выполненных семян и далее эти показатели соотносили с урожаем собранных плодов у различных отборных форм, включая наиболее зимостойкую.
У зимостойкой формы при благоприятных зимовках и сохранении терминальных почек СПФ зрелых генеративных растений (g2) продолжала нарастать в высоту. Как показали многолетние исследования, СПФ отборной формы R. canina были наиболее неустойчивы к низким отрицательным температурам в ноябре, когда процесс перехода в состояние зимнего покоя еще не завершен.
Гистохимическая экспресс-диагностика подготовленности шипов-ников к зимовке проводилась с учетом того, что к началу листопада в тканях побегов содержится осенний максимум крахмала. В октябре-ноябре у зимостойких видов и форм наиболее полно происходит гидролиз крахмала, причем в тканях это имеет центростремительный характер: он наблюдается в однорядных и многорядных сердцевинных лучах, перимедуллярной зоне и сердцевине, но уже отсутствует в коровой паренхиме, флоэме, камбии и ксилеме (6).
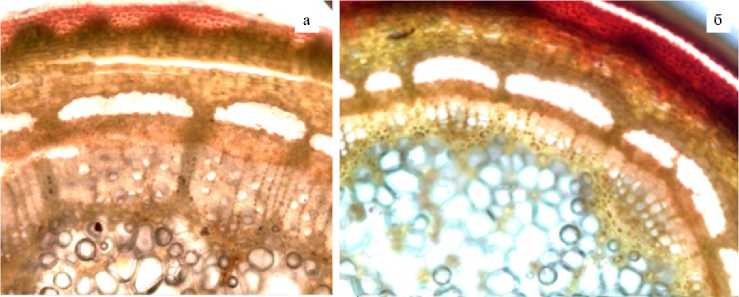
Рис. 2. Содержание крахмала в тканях годичных побегов Rosa canina L. (а) и R. majalis Herrm. (б) в предзимнем состоянии (г. Новосибирск, Академгородок, ноябрь 2021 года; реакция с йодом в йодистом калии, увеличение ½40, световой микроскоп Carl Zeiss Axioscop-40, «Carl Zeiss», Германия; видеокамера AxioCam MRc-5, «Carl Zeiss», Германия, с программой для получения и обработки изображений AxioVision 4.8, «Carl Zeiss», Германия, .
У тех побегов R. canina , у которых в октябре отмечалось полное опадение листьев (фенофаза Л5), гидролиз крахмала практически завершался в ноябре, единичные крахмальные зерна еще находились в однорядных и многорядных сердцевинных лучах, а также перимедуллярной зоне (рис. 2, а). У высокозимостойкого местного вида R. majalis , который используется в исследованиях как контрольный, единичные крахмальные зерна были обнаружены только в перимедуллярной зоне (см. рис. 2, б). Следовательно, у обоих видов содержание крахмала в тканях было минимальным и оценивалось в 1 балл. В ранее проведенных в ЦСБС гистохимических исследованиях побегов R. canina в предзимье (6, 34) были выявлены различия по динамике крахмала даже среди достаточно зимостойких форм: крахмальные зерна в однорядных и многорядных сердцевинных лучах могли находиться менее чем в 50 % клеток, что соответствует 2 баллам.
Продолжительное (более 2 сут) снижение температуры до - 30 ° С в декабре приводило к частичному повреждению средней части СПФ. Кратковременное (на несколько часов в течение дня) снижение температуры в диапазоне от - 25 до - 28 ° С в январе не наносило серьезных повреждений даже средней части СПФ (например, зимой 2018-2019 годов).
К числу экстремальных относилась и зимовка 2020-2021 годов, во время которой в III декаде декабря, а также в I и III декадах января мини- мальная температура опускалась до -41 °С. В результате погибли верхняя и частично средняя части СПФ. Отрицательное влияние на развитие генеративной сферы многих плодовых культур, а также гибель цветков сортов винограда и актинидии в начале вегетационного периода 2021 года в условиях Новосибирска также оказали сильные заморозки 20 (-3,2 °С) и 21 мая (-6,0 °С). В эти дни показатели среднесуточной температуры были на 6,8 и 8,5 °С ниже нормы. Тем не менее в базальной и средней части СПФ на укороченных плодовых побегах отборной формы R. canina образовались преимущественно единичные гипантии, что подтверждает высокую зимостойкость и морозостойкость (рис. 3, а).

Рис. 3. Зрелые генеративные растения (g2) отборной формы Rosa canina L.: a — плодоношение в нижней части системы побегов формирования после экстремальной зимовки, б — парциальный куст (г. Новосибирск, Академгородок, 2021 год).
Семенной материал, как правило, предназначен для получения саженцев подвоев-шиповников в промышленных масштабах, а для скорейшего расширения маточных плантаций перспективно использовать парциальные кусты. Изученная отборная форма характеризовалась ускоренным образованием парциальных кустов (см. рис. 3, б), что служило одним из маркерных признаков перехода в зрелое генеративное состояние (g2).
Создание исходных интродукционных популяций R. canina посредством двухэтапного отбора позволило вести дальнейший отбор зимостойких высокопродуктивных форм среди растений, выращенных из семян местных репродукций. Уже при анализе отборных форм, выращенных из семян первой местной репродукции, была доказана перспективность работ в этом направлении. Сравнение данных по урожайности лучших форм R. canina в ЦСБС и в одном из питомников Голландии (35) в пересчете на урожай с одного куста показало, что отдельные формы R. canina в период максимального плодоношения в местных условиях имеют столь же высокую продуктивность, как в голландском высокоспециализированном хозяйстве.
Анализ исследований, проводимых с подвоями-шиповниками за рубежом (1, 7, 10), показал, что проблемы повышения зимостойкости подвоев в условиях умеренно континентального и более мягкого климата неактуальны. Основные отборы проводятся на устойчивость к грибным заболеваниям, а также решаются вопросы преодоления глубокого покоя семян. Исследования, проводимые в ЦСБС и связанные с выделением зимостойких форм подвоев садовых роз с высокой семенной продуктивностью, имеют большое значение для регионов с суровыми климатическими условиями и позволяют не проводить массовые закупки саженцев подвоя в южных регионах России и СНГ. Выявленные в процессе исследований особенности репродуктивной биологии шиповников (15) представляют более широкий тео- ретический интерес. В экологическом плане также будет иметь значение оценка адаптивного потенциала, проведенная по многим показателям, в частности с использованием гистохимических исследований с применением современного приборного парка с цифровой обработкой изображений.
Таким образом, максимальную частоту побегообразования (62,0 %) у отборной зимостойкой формы Rosa canina отмечали у почек, взятых в сентябре-октябре. Выявлено, что прегенеративный период у R. canina мик-роклонального происхождения сокращается на год по сравнению с растениями семенного происхождения, поэтому в онтогенетическое состояние g1 (молодое генеративное) особи вступают на третий год вегетации. Парциальные кусты, которые могут быть использованы для пополнения семенных плантаций, формируются на четвертый год вегетации. В условиях континентального климата лесостепи Западной Сибири у всех особей отборной формы, размноженных in vitro, отмечали ежегодное плодоношение на побегах выше снегового покрова. Исключением была зимовка 2020-2021 годов, однако даже после суровой зимовки гипантии образовались в нижней части систем побегов формирования. Важная особенность феноритмики отборной формы R. canina — способность заканчивать рост и закладывать терминальную почку на большинстве побегов текущего года, то есть полноценно подготавливаться к зимовке, что подтверждают гистохимические исследования динамики содержания крахмала.
Список литературы Адаптивный потенциал подвоя Rosa canina L., полученного in vitro, в условиях юга Западной Сибири
- Balaj N.X., Zogaj R. Production seedlings of roses by grafting with bud for hybrid teas and climbing roses cultivars. Research Journal of Agricultural Science, 2011, 43(2): 155-160.
- Шагапов Р.Ш., Шагапов Р.Р. Подвои шиповника для культурных роз в Приуралье. Известия Оренбургского государственного аграрного университета, 2016, 2(58): 144-145.
- Plugatar Yu.V., Klimenko Z.K., Zykova V.K., Plugatar S.A. Methods and results of roses' breeding from different garden groups in the south of Russia. Acta Horticulturae, 2019, 1255: 31-34 (doi: 10.17660/ActaHortic.2019.1255.6).
- Plugatar S., Klimenko Z., Zykova V., Kuzmenko D. Reproductive traits of some hybrid tea rose cultivars from the collection of the Nikita botanical gardens. Acta Horticulturae, 2021, 1324: 159164 (doi: 10.17660/ActaHortic.2021.1324.24).
- Хржановский В.Г. Розы. М., 1958.
- Васильева О.Ю. Биологические особенности видов рода Rosa L, интродуцируемых в качестве подвоев в Западной Сибири. Докт. дис. Новосибирск, 2002.
- Werlemark G., Nybom H. Dogroses: botany, horticulture, genetics, and breeding. In: Horticultural Review. Vol. 36/J. Janick (ed.). John Wiley, New Jersey, 2010 (doi: 10.1002/9780470527238.ch4).
- Verma M.K., Lal S., Nazeer A., Sagoo P.A. Character association and path analysis in hip rose (Rosa sp.) accessions collected from North Western Himalyan region of Kashmir. African Journal Agricultural Research, 2013, 8(39): 4949-4955 (doi: 10.5897/AJAR2013.6950).
- Üzün I., Bayir A. Horticultural biodiversity in Turkey. Bulletin UASVM Horticulture, 2009, 66: 536-543 (doi: 10.15835/buasvmcn-hort:4418).
- Iakovoglou V., Radoglou K. Breaking seed dormancy of three orthodox Mediterranean Rosaceae species. Journal Environmental Biology, 2015, 36(2): 345-349.
- Izadi Z., Zarei H., Alizadeh M. Studies on vegetative propagation of Rosa canina. Indian Journal of Horticulture, 2012, 69(4): 598-601.
- Jürgens A., Seitz B., Kowarik I. Genetic differentiation of Rosa canina (L.) at regional and continental scales. Plant Syst. Evol, 2007, 269: 39-53 (doi: 10.1007/s00606-007-0569-3).
- Кожевникова З.В., Кожевников А.Е. Новые и редкие виды заносных растений для флоры Российского Дальнего Востока. Комаровские чтения, 2017, 65: 89-102.
- Grant V. Plant speciation. 2nd ed. Columbia University Press, New York, NY, 1981.
- Vasil'eva O.Yu. Reproduction systems of representatives of the genus Rosa L. under condition of continental climate. Contemporary Problems of Ecology, 2009, 2(4): 361-368 (doi: 10.1134/S1995425509040109).
- Elliott R.F. Axenic culture of meristem tips of Rosa mutiflora. Planta, 1970, 95: 183-186 (doi: 10.1007/BF00387250).
- Walter R.J., Kamp M., Smith R.H. In vitro propagation of Rosa chinensis Jacq. Red Cascade. Journal of the Rio Grande Valley Horticultural Society, 1979, 33: 125-127.
- Voyiatzi C., Voyiatzis D.G., Tsiakmaki V. In vitro shoot proliferation rates of the rose cv. (hybrid tea) 'Dr. Verhage', as affected by apical dominance regulating substances. Scientia Horticulturae, 1995, 61(3-4): 241-249.
- Markovic M., Dunisijevic-Bojovic D., Skocajic D., Milutinovic M., Buvac K. Optimizing the micropropagation protocol for Rosa canina L. elite genotype propagation in the Belgrade area. Glas-nik Sumarskog fakulteta, 2021, 123: 87-96 (doi: 10.2298/GSF2123087M).
- Badzian T., Hennen G.R., Fotyma-Kern J. In vitro rooting of clonal propagated miniature rose cultivars. Acta Hortic, 1991, 289: 329-330 (doi: 10.17660/ActaHortic.1991.289.81).
- Canli F.A., Kazaz S. Biotechnology of roses progress and future prospects. Suleyman Demirel Universitesi Orman Fakultesi Dergisi (Seri: A), 2009, 1: 167-183.
- Shirdel M., Motallebi-Azar A., Matloobi M., Zaare-Nahandi F. Effects of nodal position and growth regulators on in vitro growth of dog rose (Rosa canina). Journal of Ornamental and Horticultural Plants, 2013, 3(1): 9-17.
- Murashige T., Skoog F. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiologia Plantarum, 1962, 15(3): 473-497 (doi: 10.1111/j.1399-3054.1962.tb08052.x).
- Ambros E.V., Vasilyeva O.Yr., Novikova T.Iv. Effects of in vitro propagation on ontogeny of Rosa canina L. micropropagated plants as a promising rootstock for ornamental roses. Plant Cell Biotechnology and Molecular Biology, 2016, 17(1-2): 72-78.
- Методика фенологических наблюдений в ботанических садах СССР. М., 1975.
- Мазуренко М.Т., Хохряков А.П. Структура и морфогенез кустарников. М., 1977.
- Savinykh N.P., Cheryomushkina V.A. Biomorphology: current status and prospects. Contemporary Problems of Ecology, 8: 541-549 (doi: 10.1134/S1995425515050121).
- Васильева О.Ю. Структура и морфогенез шиповников при адаптации к экстремальным условиям резко континентального климата. Бюллетень Московского общества испытателей природы. Отдел биологический, 2007, 112(3): 53-57.
- Онтогенетический атлас растений /Л.А. Жукова (отв. ред.). Йошкар-Ола, 2013.
- Васильева О.Ю. Оценка зимостойкости видов и сортов роз с использованием гистохимических методов. Садоводство и виноградарство, 2016, 3: 29-34 (doi: 10.18454/VSTISP.2016.3.1919).
- Методические указания по семеноведению интродуцентов. М., 1980.
- Козлова М.В., Васильева О.Ю., Юданова С.С. Семенная продуктивность видов семейства Rosaceae, используемых в качестве подвоев в условиях лесостепи Западной Сибири. Вестник КрасГАУ, 2020, 5: 24-30 (doi: 10.36718/1819-4036-2020-5-24-30).
- Доспехов Б.А. Методика полевого опыта (с основами статистической обработки результатов исследований). 5-е изд., доп. и перераб. М., 1985.
- Козлова М.В. Эколого-биологические особенности Rosa glauca Pourr., Rosa canina L., Rosa majalis Herrm. при использовании в качестве подвоев садовых роз в лесостепи Западной Сибири. Самарский научный вестник, 2021, 10(4): 61-67.
- Rosenunterlagen: Mutter Pflanzen sollten nicht stiefmbtterlich behandelt werden. Dt. Baumschule, 1979, 31(7): 254-255 (цит. по Коробов В.И. Розы в открытом грунте Западной Сибири). Новосибирск, 1981.


