Адъювантная химиолучевая терапия на фоне локальной гипертермии в комбинированном лечения первичных глиобластом: предварительные результаты
Автор: Рябова Анастасия Игоревна, Новиков Валерий Александрович, Грибова Ольга Вячеславовна, Чойнзонов Евгений Лхамацыренович, Старцева Жанна Александровна, Боберь Екатерина Евгеньевна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 1 т.16, 2017 года.
Бесплатный доступ
В НИИ онкологии Томского НИМЦ разработана методика проведения химиолучевой терапии на фоне локальной электромагнитной гипертермии в составе комбинированного лечения пациентов с впервые выявленными глиобластомами головного мозга. В соответствии с разработанной методикой комби-нированное лечение получили 20 пациентов, которым одновременно с проведением химиолучевой терапии с темозоломидом два раза в неделю выполнялась локальная гипертермия (10 сеансов на курс лечения) на системе для глубокой гипертермии Celsius TCS. Все пациенты перенесли лечение удовлетворительно. При оценке профиля токсичности термохимиолучевой терапии с темозоломидом была выявлена высокая частота гематологической и неврологической токсичности. Необходимо от-метить, что в рандомизированных исследованиях безопасности проведения химиолучевой терапии с темодалом неврологической токсичности обнаружено не было. Если более высокая частота гема-тологической токсичности может быть связана с небольшой выборкой пациентов в исследовании, появление неврологической токсичности, вероятно, отражает большее токсическое воздействие химиопрепарата на головной мозг при проведении локальной гипертермии, однако причин возник-новения неврологической токсичности во время курсов адъювантной терапии в настоящий момент мы объяснить не можем. Непосредственные результаты термохимиолучевой терапии показали объ-ективный ответ в 70 % случаев, однако частота прогрессирования увеличилась в процессе курсов адъювантной химиотерапии. Одногодичная безрецидивная выживаемость составила 53,3 ± 13,3 %, медиана до прогрессирования - 10,5 мес. Одногодичная общая выживаемость составила 91,7 ± 8 % при медиане наблюдения 9 мес, медиана общей выживаемости не достигнута. Небольшие сроки наблюдения за пациентами в исследовании не позволяют сделать достоверных выводов о влиянии локальной гипертермии на выживаемость пациентов, однако отмечается тенденция к увеличению безрецидивной и общей выживаемости.
Глиобластома, локальная гипертермия, термохимиолучевая терапия
Короткий адрес: https://sciup.org/140254090
IDR: 140254090 | УДК: 616.831-006.484-08-059-036.8:615.28+615.849.1+615.832 | DOI: 10.21294/1814-4861-2017-16-1-32-38
Текст научной статьи Адъювантная химиолучевая терапия на фоне локальной гипертермии в комбинированном лечения первичных глиобластом: предварительные результаты
Глиобластома (ГБ) является самой частой и агрессивной первичной опухолью головного мозга. Средняя продолжительность жизни пациентов с этой патологией при интенсивном комбинированном лечении, проведенном согласно современным стандартам, не превышает двух лет [1–3].
Темозоломид (ТМЗ) является первым химиопрепаратом, при применении которого получено значимое увеличение выживаемости больных ГБ.
В 2004 г. в исследовании III фазы, проведенном Европейской организацией по изучению и лечению рака (EORTC) и Национальным институтом рака Канады (NCIC), получены результаты, указывающие на увеличение выживаемости больных ГБ, которые получали лучевую терапию (ЛТ) с одновременным приемом темозоломида и последующими курсами адъювантной химиотерапии ТМЗ. Медиана выживаемости при применении ЛТ со-
ставила 12,1 мес, при комбинированном лечении с ТМЗ – 14,6 мес. Медиана без прогрессирования 5,0 и 6,9 мес соответственно. Химиолучевая терапия (ХЛТ) с ТМЗ в 2 раза снизила риск прогрессирования по сравнению с монотерапией этим препаратом [4]. На основании этого исследования ХЛТ с темозоломидом стала стандартом первой линии лечения ГБ. Однако, как видно из результатов исследования, улучшение показателей выживаемости было небольшим.
Следующим препаратом, показавшим эффективность при лечении глиобластом, стал бевацизумаб. В рамках клинических исследований эффективность бевацизумаба вначале была оценена при рецидивах ГБ. Проспективные исследования II фазы показали высокую частоту объективного ответа на лечение этой категории больных, а также значительное увеличение времени до прогрессирования. На основании этого FDA в мае 2009 г. одобрила применение бевацизумаба в США для лечения рецидивных ГБ [5]. Последующие исследования показали значительное увеличение общей выживаемости у пациентов с ГБ, получавших антиангиогенную терапию при рецидиве опухоли, медиана общей выживаемости составила от 19,6 до 21,5 мес [3, 6, 7].
Исследование эффективности бевацизумаба при впервые выявленных ГБ в комбинации с ТМЗ и лучевой терапией выполнялось в двух крупных рандомизированных исследованиях III фазы – RTOG 0825 [8] и AVAglio [2]. Хотя безрецидивная выживаемость у пациентов, получавших беваци-зумаб и ХЛТ с ТМЗ, была значимо выше, чем у больных при стандартной ХЛТ с ТМЗ (в исследовании AVAglio – 10,6 и 6,2 мес, в исследовании RTOG 0825 – 10,3 и 7,3 мес), разницы в общей выживаемости (ОВ) не получено (медиана ОВ в исследовании AVAglio составила 16,7 и 16,8 мес, в RTOG0825 – 16,1 и 15,7 мес соответственно).
Таким образом, несмотря на улучшение результатов лечения больных ГБ, показатели выживаемости остаются скромными. Одним из перспективных путей улучшения выживаемости пациентов является преодоление радиорезистентности глиом высокой степени злокачественности. Согласно современной точке зрения, универсальным и наиболее эффективным модификатором радио- и химиотерапии, способным повысить их эффективность в 1,5–2,5 раза, является гипертермия [9, 10]. Согласно существующим стандартам лечения глиобластом головного мозга, гипертермия применяется только в случаях рецидива ГБ, что позволяет увеличить безрецидивную и общую выживаемость [11–13]. Неудовлетворительные результаты комбинированного лечения впервые выявленных глиобластом заставляют искать новые подходы к адъювантной терапии, которые смогут увеличить продолжительность жизни и улучшить прогноз у этих пациентов.
Целью исследования является оценка результатов комбинированного лечения с применением локальной электромагнитной гипертермии у больных с впервые выявленными глиобластомами головного мозга.
Материал и методы
В НИИ онкологии Томского НИМЦ разработана методика проведения химиолучевой терапии на фоне локальной гипертермии (ЛГ) на этапах комбинированного лечения пациентов с впервые выявленными злокачественными глиомами головного мозга. В исследование включены 20 больных с впервые выявленными ГБ, получивших комбинированное лечение с использованием ЛГ. На первом этапе лечения всем пациентам выполнялось удаление опухоли, которое осуществлялось под нейронавигационным контролем с использованием микронейрохирургической техники в пределах визуально не измененного мозгового вещества с учетом физиологической дозволенности. Во всех случаях выполнялось гистологическое исследование операционного материала. Для оценки объема проведенного оперативного вмешательства в послеоперационном периоде выполнялась МРТ головного мозга на аппарате «Siemens Essenza» (Siemens) с напряженностью магнитного поля 1,5 Тесла с внутривенным контрастированием гадобу-тролом (Gadovist, Bayer Schering Pharma AG).
До начала химиолучевого лечения и после его завершения пациентам проводилась оценка неврологического статуса, а также функционального статуса по шкале Карновского. Характер и степень выраженности острых лучевых реакций оценивались по шкале RTOG/EORTC (1995 г.), степень токсичности термохимиолучевой терапии – согласно критериям ВОЗ по шкале CTC-NCIC.
Локальная гипертермия проводилась 2 раза в неделю (10 сеансов на курс лечения) на системе для глубокой гипертермии Celsius TCS, в которой используются электромагнитные волны с частотой 13,56 МГц для передачи энергии по принципу емкостного сопряжения. Площадь нагревания превышала наибольший диаметр опухоли не менее чем на 3 см при поверхностном расположении и увеличивалась пропорционально глубине ее залегания. Нагревание производилось постепенно, путем повышения мощности и продолжительности сеанса ЛГ, ориентируясь на переносимость процедуры пациентом. Длительность сеанса составила от 20 до 60 мин (с шестого сеанса), поглощенная мощность в течение одного сеанса – от 18 кДж до 347 кДж. В дни проведения ЛГ интервал между сеансом гипертермии и лучевой терапией составлял 20–40 мин.
Лучевая терапия проводилась на аппарате Theratron Equinox 1,25 МэВ в стандартном режиме фракционирования дозы (РОД 2,0 Гр, кратность 5 раз в неделю), с курсовой дозой – 60 Гр. В качестве сопутствующей химиотерапии у пациентов с глиобластомами применялся темозоломид (Тезалом, ЗАО Вектор-Медика, Россия и Темомид, Novalek Pharmaceitical, Pvt. Ltd., Индия) в дозе 200 мг/м2 ежедневно в течение 5 дней каждого 28-дневного цикла. После завершения курса термохимиолуче-вой терапии (ТХЛТ) пациенты получали 4 курса адъювантной химиотерапии по той же схеме в условиях онкологического диспансера по месту жительства.
Для оценки непосредственной эффективности термохимиолучевой терапии использовались критерии оценки ответа в нейроонкологии (RANO) [14], применяющиеся при оценке ответа глиом высокой степени злокачественности на терапию первой линии. В порядке динамического наблюдения в течение года пациентам выполнялась МРТ головного мозга с контрастированием каждые 3 мес, затем каждые 6 мес, а также в случаях возникновении (или нарастания) неврологической симптоматики. Для статистического анализа полученных данных применялись стандартные методы медико-биологической статистики с использованием пакета программ «Statistica for Windows» (версия 10.0).
Все пациенты дали письменное информированное согласие на участие в исследовании, которое было одобрено этическим комитетом НИИ онкологии Томского НИМЦ.
Результаты и обсуждение
При оценке объема оперативного вмешательства по данным МРТ головного мозга парциальная резекция была выполнена у 16 (80,0 %) пациентов, тотальная резекция – у 4 (20,0 %) больных. Случаев, когда объем оперативного вмешательства ограничивался биопсией опухоли, в нашем исследовании не было.
Временной период между операцией и началом ТХЛТ составил от 2,7 до 25,6 нед, в среднем – 7,2 ± 3,4 нед. При этом у 3 (15,0 %) пациентов на момент начала термохимиолучевой терапии был зарегистрирован продолженный рост опухоли – в сроки от 5,3 до 25,6 нед. При оценке активности пациентов по шкале Карновского на момент поступления этот показатель составил от 40 до 90 %, при этом низкий уровень активности был обусловлен неврологическим дефицитом (пирамидные расстройства).
Термохимиолучевую терапию все пациенты перенесли удовлетворительно. При оценке уровня активности по шкале Карновского до и после курса ТХЛТ выявлено, что в большинстве случаев – у 14 (70,0 %) пациентов – уровень активности не изменился. У 4 (20,0 %) больных с низким уровнем активности после хирургического лечения, равным 40 %, в процессе ТХЛТ этот показатель увеличился до 60 %, что было обусловлено регрессией очаговой неврологической симптоматики. Стойкое нарастание очаговой симптоматики, не купирующееся противоотечной терапией, отмечалось у 2 (10,0 %) больных. В одном случае диагностировано прогрессирование процесса, в другом – это произошло за счет токсической реакции со стороны центральной нервной системы без признаков прогрессирования опухоли.
Во время курса ТХЛТ в 5 (25,0 %) случаях наблюдалась неврологическая токсичность в виде головокружения I степени (n=1), бессонницы I–II степени (n=3), нарастания афатических расстройств II степени (n=1), всем пациентам проводилась симптоматическая терапия с эффектом. Гематологическая токсичность наблюдалась в 7 (35,0 %) случаях, в том числе I степени – у 3, II степени – у 2, IV степени – у 2 пациентов. При гематологической токсичности IV степени проводилась коррекция показателей крови и редукция дозы последующего курса химиотерапии. Гастроинтестинальная токсичность в виде снижения аппетита и тошноты II степени наблюдалась в 2 случаях. Ни в одном случае не потребовалось прекращения ТХЛТ в связи с явлениями токсичности.
В течение 1-го мес после завершения ТХЛТ у 2 (10,0 %) больных возникли тяжелые инфекции (пневмония), в обоих случаях пациенты во время термохимиолучевого лечения постоянно получали дексаметазон в дозе 16 мг/сут с противоотечной целью. В ходе последующих курсов химиотерапии ТМЗ у 2 (10,0 %) пациентов отмечалась неврологическая токсичность III и IV степени соответственно, в виде нарастания пирамидной недостаточности и изменения личности. Побочные неврологические реакции III степени, возникшие во время 6-го курса ХТ, были купированы симптоматической терапией, что не потребовало изменения тактики лечения. Неврологическая токсичность IV степени (гемиплегия) была зарегистрирована у пациента во время 3-го курса химиотерапии ТМЗ, в связи с чем ХТ была отменена (эффект ТХЛТ расценивался как полная регрессия).
При сравнении профиля токсичности ТХЛТ в представленном исследовании с частотой побочных эффектов ХЛТ, описанных в работе R. Stupp et al. [15], установлено, что у наших пациентов не отмечалось тяжелых эметогенных реакций, однако чаще регистрировалась гематологическая токсичность. Кроме того, нами была зафиксирована высокая частота неврологической токсичности, которой не отмечено при исследовании безопасности проведения одновременной ХЛТ с темодалом. Низкий профиль гастроинтестинальной токсичности в нашем исследовании, по-видимому, был обусловлен профилактическим назначением антиэметиков (ондансетрон) за 30 мин до приема темозоломида. В свою очередь, более высокая частота тяжелых гематологической реакций может быть связана как с небольшой выборкой пациентов, так и с использованием дженериков Темодала, профиль
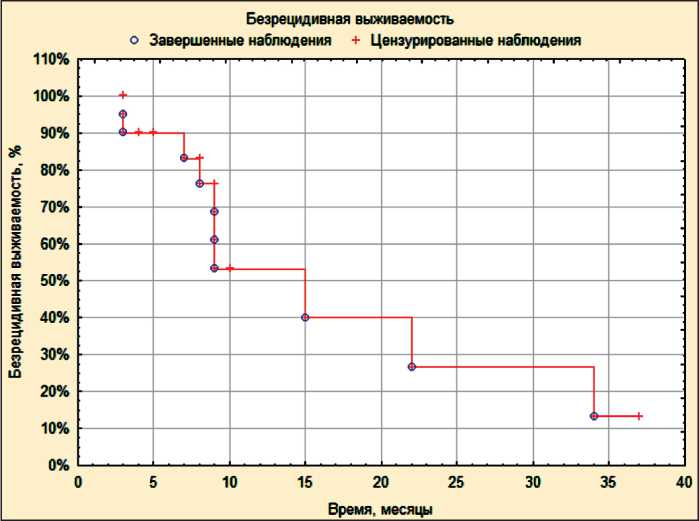
Рис. 1. Безрецидивная выживаемость больных с глиобластомами, которые получили комбинированное лечение с применением термохимиолучевой терапии
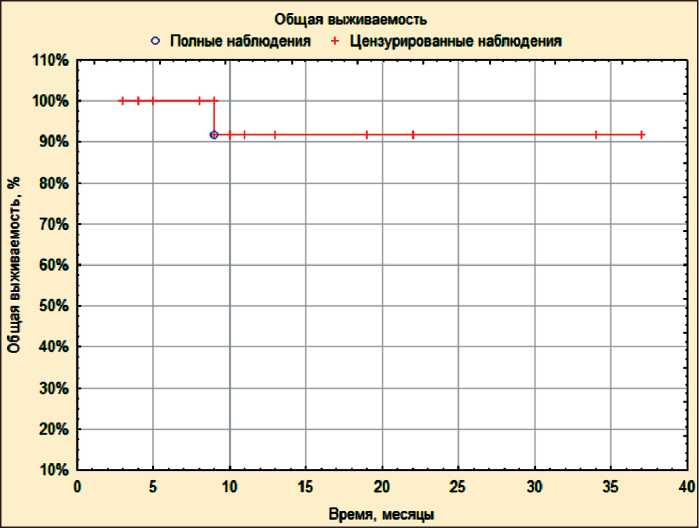
Рис. 2. Общая выживаемость больных с глиобластомами, которые получили комбинированное лечение с применением термохимиолучевой терапии
токсичности которых не изучался в рандомизированных исследованиях. Явления неврологической токсичности у пациентов, получающих ТХЛТ, могут отражать побочное воздействие химиопрепарата на головной мозг при проведении локальной гипертермии, однако причин возникновения побочных неврологических эффектов во время адъювантной терапии мы пока объяснить не можем. Более высокая частота тяжелых инфекций в нашем исследовании может быть связана с небольшой выборкой пациентов, а также длительным приемом глюкокортикоидов.
Острые лучевые реакции кожи в виде аллопе-ции в зоне полей облучения наблюдались у всех больных, в одном случае наблюдалась лучевая реакция II степени. У одного пациента отмечено осложнение в виде ограниченного термического ожога кожи II степени (в зоне воздействия активного электрода), лечение проводилось консервативно, прерывания или прекращения курса лечения не потребовалось. Частота термических осложнений в исследовании не превышает показателей, указанных производителем (Celsius42+, GmbH (Германия)).
При оценке непосредственной эффективности ТХЛТ полная регрессия зарегистрирована в 4 (20,0 %), частичная регрессия – в 10 (50,0 %), стабилизация – в 4 (20,0 %), прогрессирование процесса – в 2 (10,0 %) случаях. При этом в одном случае прогрессирование процесса диагностировано во время проведения курса химиолучевого лечения на фоне локальной гипертермии (на дозе ЛТ – 42 Гр, 7 сеансов локальной гипертермии), в другом случае выявлено без признаков нарастания неврологического дефицита через 1 мес после завершения ТХЛТ при контрольной МРТ головного мозга.
Полностью завершили курс комбинированного лечения 15 пациентов, у 4 больных продолжаются курсы ХТ ТМЗ, один пациент выбыл из-под на- блюдения после завершения ТХЛТ. При оценке эффекта комбинированного лечения полная регрессия диагностирована у 5 (33,3 %), частичная регрессия – у 3 (20,0 %), стабилизация процесса – у 1 (6,7 %) больного, чаще, чем после завершения ТХЛТ, отмечалось прогрессирование процесса – в 6 (40,0 %) случаях.
Сроки наблюдения за больными составили от 3 до 37 мес, медиана наблюдения – 9 мес. Время до прогрессирования процесса варьировало от 3 до 34 мес. Одногодичная безрецидивная выживаемость составила 53,3 ± 13,3 % (рис. 1), медиана до прогрессирования – 10,5 мес. За период наблюдения умер 1 пациент через 9 мес, у которого наблюдалось прогрессирование процесса во время ТХЛТ, 2 больных выбыли из-под наблюдения в сроки 3 и 8 мес после начала лечения. Одногодичная общая выживаемость составила 91,7 ± 8 % (рис. 2), медиана общей выживаемости не достигнута. Несмотря на высокий показатель одногодичной общей выживаемости, достоверно оценить ее невозможно, вследствие небольшой медианы наблюдения за пациентами.
Заключение
На основании полученных предварительных результатов можно сделать вывод, что применение локальной гипертермии с химиолучевой терапией не ухудшает переносимость комбинированного лечения у больных с впервые выявленными ГБ. Наличие неврологической токсичности может быть связано с токсическим воздействием ТМЗ на головной мозг при проведении локальной гипертермии, но причин возникновения неврологической токсичности во время курсов адъювантной терапии пока объяснить не удается. Непосредственные результаты ТХЛТ и полного курса комбинированного лечения показали высокую частоту объективного ответа, однако частота прогрессирования увеличилась в процессе проведения адъювантной химиотерапии. Небольшие сроки наблюдения за пациентами не позволяют сделать окончательных выводов о влиянии локальной гипертермии на отдаленные результаты лечения, тем не менее отмечается тенденция к увеличению показателей безрецидивной и общей выживаемости.
Список литературы Адъювантная химиолучевая терапия на фоне локальной гипертермии в комбинированном лечения первичных глиобластом: предварительные результаты
- Preusser M., de Ribaupierre S., Wöhrer A., Erridge S.C., Hegi M., Weller M., Stupp R. Current concepts and management of glioblastoma. Ann Neurol. 2011 Jul; 70 (1): 9-21. DOI: 10.1002/ana.22425
- Chinot O.L., Wick W., Mason W., Henriksson R., Saran F., Nishikawa R., Carpentier A.F., Hoang-Xuan K., Kavan P., Cernea D., Brandes A.A., Hilton M., Abrey L., Cloughesy T. Bevacizumab plus radiotherapytemozolomide for newly diagnosed glioblastoma. N Engl J Med. 2014 Feb 20; 370 (8): 709-22. DOI: 10.1056/NEJMoa1308345
- Кобяков Г.Л., Смолин А.В., Бекяшев А.Х., Абсалямова О.В., Кобякова Е.А., Поддубский А.А., Иноземцева М.В. Лечение рецидива глиобластомы: есть ли успехи? Опухоли головы и шеи. 2014; 3: 12-20.
- Stupp R., Hegi M.E., Mason W.P., van den Bent M.J., Taphoorn M.J., Janzer R.C., Ludwin S.K., Allgeier A., Fisher B., Belanger K., Hau P., Brandes A.A., Gijtenbeek J., Marosi C., Vecht C.J., Mokhtari K., Wesseling P. Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomised phase III study: 5-year analysis of the EORTC-NCIC trial. Lancet Oncol. 2009 May; 10 (5): 459-66. DOI: 10.1016/S1470-2045(09)70025-7
- Yu Z., Zhao G., Zhang Z., Li Y., Chen Y., Wang N., Zhao Z., Xie G. Eficacy and safety of bevacizumab for the treatment of glioblastoma. Exp Ther Med. 2016 Feb; 11 (2): 371-380. DOI: 10.3892/etm.2015.2947


