Адренореактивность миокарда в условиях дефицита магния
Автор: Иежица И.Н., Харитонова М.В., Желтова А.А., Паньшин Н.Г., Снигур Г.Л., Смирнов А.В., Гурова Н.А., Спасов А.А.
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Рубрика: Фармакология токсикология
Статья в выпуске: 3 (23), 2009 года.
Бесплатный доступ
Целью данного исследования являлась функциональная и морфологическая оценка состояния миокарда в условиях дефицита магния при проведении нагрузки адреналином. В ходе экспериментов было показано, что изменение показателей кардиогемодинамики в ответ на нагрузку адреналином у магнийдефицитных животных менее выражено, чем у животных контрольной группы. При морфологическом исследовании были выявлены признаки ишемического повреждения кардиомиоцитов. Данные изменения также могут служить органической основой для снижения функциональных резервов сердца в условиях дефицита магния в ответ на введение адреналина.
Дефицит магния, адреналин, кардиогемодинамика, миокард
Короткий адрес: https://sciup.org/142148776
IDR: 142148776 | УДК: 615:546.46:616.12-092.4
Текст научной статьи Адренореактивность миокарда в условиях дефицита магния
Дефицит магния часто осложняет течение сердечно-сосудистых заболеваний, начиная врожденными пороками сердца и кончая ишемической болезни сердца (ИБС) [8,12]. Так, Kousa A. с соавт. в исследовании, включавшем 18 946 мужчин 35— 74 лет, перенесших инфаркт миокарда, показали, что дефицит магния в питьевой воде четко коррелирует с частотой данной патологии [10]. Ранее было проведено изучение влияния дефицита магния на аритмогенный порог и липидный статус, показано, что в данных условиях животные становятся более чувствительными к аритмогенному действию кальция хлорида, у них отмечается повышение индекса атерогенности [5, 7]. Дефицит магния снижает стрессоустойчивость животных. В то же время в литературе отсутствуют данные о том, как изменяется кардиогемодинамика магнийдефицитных животных в условиях нагрузки адреналином.
ЦЕЛЬ РАБОТЫ
Оценка адренореактивности миокарда животных с дефицитом магния с дальнейшим морфологическим исследованием миокарда.
МЕТОДИКА ИССЛЕДОВАНИЯ
Эксперименты были выполнены на 13 крысах-самцах массой 200—240 г. Интактная группа животных составляла контроль (n = 7). У осталь- ных 6 крыс вызывали магнийдефицитное состояние, для моделирования которого использовали специальную магнийдефицитную диету. В состав диеты входили: казеин (20 %), крахмал (70 %), DL-метионин (0,3 %), холина битартрат (0,2 %), кукурузное масло (5 %), поливитаминная смесь (1 %) и полиминеральная смесь, не содержащая магния (табл. 1). Весь рацион готовился на деионизированной воде, эту же воду в ходе эксперимента использовали в качестве питьевой воды для животных, находящихся на диете. Интактные животные получали полноценную диету, содержащую 0,84 г MgO на 1 кг диеты, что соответствовало 0,5 г элементарного магния на кг диеты.
ТАБЛИЦА 1
Состав сбалансированной магнийдефицитной полиминеральной смеси AIN-76, входящей в специализированную диету фирмы MP Biomedicals (Ohio, США)
|
Содержание макро- и микроэлементов (процентная доля элемента) |
г/кг |
|
Кальция фосфат двухосновной |
500,0 |
|
Натрия хлорид |
74,0 |
|
Калия цитрат, моногидрат |
220,0 |
|
Калия сульфат |
52,0 |
|
Железа цитрат (16–17% элементарного железа) |
6,0 |
|
Марганца карбонат (43–48 % элементарного марганца) |
3,5 |
|
Цинка карбонат (70 % элементарного цинка) |
1,6 |
|
Калия йодид |
0,01 |
|
Натрия селенит |
0,01 |
|
Хром калия сульфат |
0,55 |
|
Меди карбонат (53–55 % элементарной меди) |
0,3 |
|
Сахароза порошкообразная |
124,0 |
Скорость и глубину развития гипомагнезиемии контролировали, определяя содержание магния в эритроцитах животных, спектрофотометрическим методом по цветной реакции с титановым желтым [4]. При снижении концентрации магния ниже 1,4 ммоль/л в эритроцитах считалось, что у животных развилась гипомагнезиемия средней тяжести. На 71-й день диеты проводилась регистрация основных показателей кардио- и гемодинамики. Животных предварительно наркотизировали (этаминал-натрия 40 мг/кг, внутрибрюшинно), в условиях искусственной вентиляции легких проводилась торакотомия и перикардотомия. Для измерения внутрижелудочкового давления и его первой производной (dp/dt+ и dp/dt-) через верхушку сердца в полость левого желудочка вводился катетер, соединенный с датчиком (Элема, Швеция). Для измерения артериального давления катетеризировалась общая сонная артерия, катетер также соединялся с датчиком. Через датчики с помощью компьютерного гемодинамического анализатора на базе программы ВЕАТ (ВКНЦ РАМН, Москва, 2000) записывались следующие показатели кардио- и гемодинамики: левожелудочковое давление (ЛЖД), скорость сокращения и скорость расслабления миокарда (dp/dt+ и dp/dt- соответственно), частота сер- дечных сокращений (ЧСС), систолическое и диастолическое артериальное давление (АД). Интенсивность функционирования структур (ИФС) получали расчетным способом по формуле [1]:
Л Ж Д X Ч С С И Ф С =---------- m где m = масса левого желудочка + 2/3 массы межжелудочковой перегородки в мг.
После периода стабилизации регистрируемых показателей (10 мин) проводилась дозированная стимуляция адренорецепторов сердца, которая осуществлялась путем введения адреналина внутривенно в дозе 1Ч10-6 мг на кг массы тела [1] и регистрировались вышеперечисленные показатели гемодинамики. Статистическая обработка гемодинамических данных проводилась с помощью программы Statistica 6.0 с использованием критерия Манна-Уитни.
После этого животное забивалось для морфологического изучения срезов левого желудочка. Продольные и поперечные фрагменты, включающие все оболочки сердца, вырезались на среднем уровне и фиксировались в 4%-м растворе нейтрального забуференного формалина (pH 7,4) в течение 24 часов, затем заливались в парафиновые блоки по общепринятым методикам. Парафиновые срезы толщиной 3—5 мкм окрашивались гематоксилином и эозином по Масону, гематоксилином-основным фуксином-пикриновой кислотой (ГОФП) по Ли [5], а также изучались в поляризованном свете. С помощью компьютерной системы «ВидеоТестМорфо-4» (Россия) определялась объемная плотность (ОП) кардиомиоцитов (Vv кмц, мм3), объемная плотность ядер кардиомиоцитов (Vv якмц, мм3) объемная плотность стромы (Vv с, мм3) и объемная плотность фуксинофильных кардиомиоцитов (Vv ГОФП+кмц, мм3), отношение объемной плотности стромы к объемной плотности паренхимы (Vvс/ Vvкмц) [1]. Обработка морфологических данных проводилась с использованием парного t-критерия Стьюдента.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
У крыс, находящихся на безмагниевой диете, к концу 10-й недели наблюдалось достоверное снижение уровня магния в эритроцитах в среднем на 54 % (с 2,01 до 0,92 мМ/л) по отношению к группе интактных животных. Снижение уровня магния в организме сопровождалось изменением внешнего вида (потускнением шерстного покрова, гиперемией открытых участков тела — ушных раковин, хвоста и лап) и снижением массы тела, в среднем на 22 % ( р < 0,05).
В условиях алиментарного дефицита магния у животных наблюдались следующие изменения показателей гемодинамических показателей. В ответ на введение адреналина (табл. 2) прирост левожелудочкового давления, максимальной скорости сокращения и расслабления миокарда у животных с дефицитом магния был в 2,3, 2,25 и 2,6 раза меньше, чем в группе контроля.
ТАБЛИЦА 2
Показатели кардио- и гемодинамики крыс (в дельта % по отношению к исходным показателям) с дефицитом магния после введения адреналина ( M ± m )
|
№ |
Показатель |
Время после внутривенного введения адреналина, сек. |
|||||
|
10 |
20 1 |
30 |
40 1 |
50 1 |
60 |
||
|
Животные, получавшие обычную диету (контроль) |
, n = 7 |
||||||
|
1 |
ЛЖД |
51,72 ± 5,09 |
49,01 ± 6,43 |
43,06 ± 1,94 |
38,47 ± 2,16 |
36,24 ± 1,97 |
34,43 ± 2,11 |
|
2 |
ИФС |
43,02 ± 5,04 |
34,61 ± 6,32 |
47,32 ± 3,21 |
45,16 ± 3,41 |
52,57 ± 7,94 |
56,12 ± 5,39 |
|
3 |
dp/dt+ |
54,26 ± 7,24 |
58,39 ± 6,23 |
72,40 ± 8,23 |
69,08 ± 7,85 |
64,23 ± 8,28 |
59,00 ± 8,62 |
|
4 |
dp/dt- |
29,56 ± 5,23 |
25,70 ± 2,36 |
21,71 ± 2,53 |
19,22 ± 3,18 |
16,35 ± 2,82 |
13,94 ± 3,21 |
|
5 |
АД сист |
71,34 ± 6,57 |
68,10 ± 4,93 |
63,15 ± 5,31 |
56,86 ± 4,06 |
49,85 ± 4,64 |
35,87 ± 4,97 |
|
6 |
АД диаст |
67,16 ± 7,15 |
57,85 ± 6,19 |
46,62 ± 4,73 |
49,33 ± 6,09 |
42,40 ± 7,02 |
42,09 ± 6,94 |
|
7 |
ЧСС |
-5,73 ± 1,20 |
-9,65 ± 1,87 |
2,94 ± 1,18 |
4,78 ± 1,11 |
11,83 ± 4,97 |
16,10 ± 3,26 |
|
Животные, получавшие диету с деф |
ицитом магния |
, n = 6 |
|||||
|
1 |
ЛЖД |
21,13 ± 1,84* |
22,42 ± 3,29* |
18,30 ± 2,75* |
15,77 ± 2,71* |
13,52 ± 3,18* |
11,26 ± 3,62* |
|
2 |
ИФС |
19,02 ± 2,79* |
17,09 ± 4,33* |
18,83 ± 3,45* |
19,45 ± 2,41* |
16,99 ± 3,01* |
20,04 ± 2,15* |
|
3 |
dp/dt+ |
31,97 ± 4,58* |
28,97 ± 4,39* |
32,17 ± 4,83* |
26,90 ± 5,90* |
22,41 ± 6,00* |
20,95 ± 6,16* |
|
4 |
dp/dt- |
10,68 ± 0,96* |
7,54 ± 1,05* |
7,21 ± 2,65* |
5,70 ± 2,93* |
3,34 ± 2,58* |
2,74 ± 1,29* |
|
5 |
АД сист |
58,59 ± 5,32 |
54,64 ± 5,52 |
35,91 ± 7,18* |
28,56 ± 6,60* |
24,50 ± 4,83* |
20,53 ± 4,91 |
|
6 |
АД диаст |
50,43 ± 4,55 |
44,10 ± 7,68 |
38,09 ± 3,57 |
44,56 ± 3,27 |
25,81 ± 3,89* |
25,39 ± 3,17 |
|
7 |
ЧСС |
-1,77 ± 2,00 |
-4,46 ± 1,13 |
0,40 ± 0,92 |
3,24 ± 1,26 |
5,28 ± 1,25 |
8,11 ± 1,62 |
Примечание. Статистическую обработку полученных данных проводили с помощью программы Statistica 6.0 с использованием Манна-Уитни; * достоверны относительно контроля при p < 0,05.
Систолическое и диастолическое артериальное давление возрастало в группе магнийдефицит-ных животных максимально на 10-й секунде наблюдения по сравнению с исходными данными, что существенно не отличалось от показателей, полученных в группе интактных животных. Максимальные различия в приросте ИФС были достигнуты в конце реакции, когда данный показатель в группе магнийдефицитных животных был в 2,8 раза ниже, чем в группе контроля.
Морфологическое исследование показало, что в группе с дефицитом магния объемная плотность кардиомиоцитов достоверно снижалась по сравнению с контрольной группой (табл. 1). Отмечалось достоверное увеличение (по сравнению с контролем) объемной плотности кардиомиоцитов с фуксинофильной цитоплазмой при окраске по Ли (табл. 3). ГОФП-позитивные кардиомиоциты располагались отдельными группами преимущественно периваскулярно в субэпикардиальных отделах миокарда левого желудочка. В эозинофильных мышечных сегментах при поляризационно-микроскопическом исследовании обнаружено сближение анизотропных дисков за счет укорочения изотропных (сегментарные контрактуры I-II степени) (рис. 1).
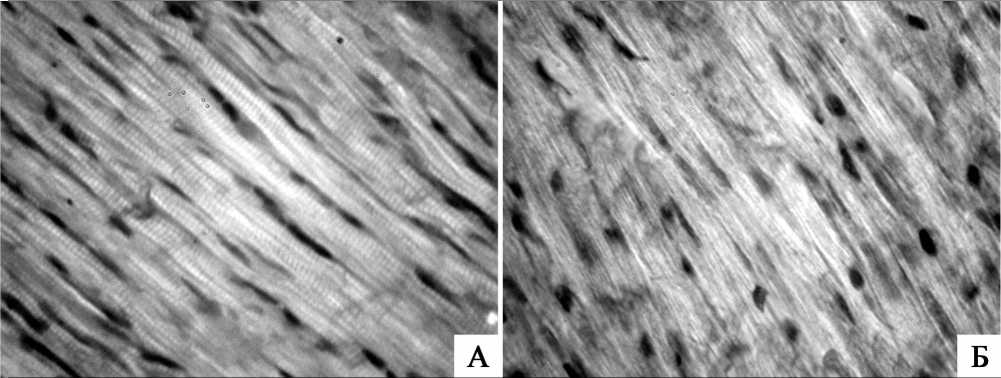
Рис. 1 Стенка левого желудочка, субэпикардиальный миокард:
А — контрольная группа. Б — Дефицит магния, сегментарные контрактуры I-II степени. Поляризационная микроскопия. Объектив х100 (масляная иммерсия), окуляр х10
ТАБЛИЦА 3
Объемная плотность и объемное отношение основных компонентов миокарда крыс с алиментарным дефицитом магния ( M ± m ).
|
Группа |
Показатели: |
||||
|
Vv кмц, мм3 |
Vv якмц, мм3 |
Vv с, мм3 |
VvГОФП+ кмц, мм3 |
Vv с/Vv кмц, у.е. |
|
|
Животные, получавшие обычную диету |
827 ± 13,3 |
7,2 ± 1,2 |
73,6 ± 6,2 |
33,4 ± 3,5 |
0,09 ± 0,02 |
|
Животные, получавшие диету с дефицитом магния |
718 ± 15,2* |
11,4 ± 0,9 |
125 ± 7,4* |
134 ± 8,2* |
0,18 ± 0,03* |
Примечание. Статистическую обработку полученных данных проводили с помощью t-критерия Стьюдента; * достоверны относительно контроля при p < 0,05; Vv кмц— объемная плотность кардиомиоцитов, Vv якмц —объемная плотность ядер кардиомиоцитов, Vv с — объемная плотность стромы; Vv ГОФП+кмц — объемная плотность фуксинофильных кардиомиоцитов, Vvс/ Vvкмц — отношение объемной плотности стромы к объемной плотности паренхимы.
Отмечалось неравномерное полнокровие кровеносных сосудов. Во внутренней, средней и наружной оболочках артерий отмечались признаки умеренно выраженной лимфоплазмоцитарной инфильтрации с отеком, которая распространялась периваскулярно и сочеталась с развитием склеротических изменений вокруг сосудов и в их стенке. Объемная плотность стромы достоверно увеличивалась по сравнению с контрольной группой. Увеличение ОП стромы в сочетании с уменьшением ОП кардиомиоцитов характеризовалось увеличением соотношения Vv с/Vv ( р < 0,05) (табл. 3).
Вышеописанные изменения гемодинамики свидетельствует о снижении функциональных резервов сердца у магнийдефицитных животных при реакции на адреналин. Ранее Williams L. T. с со-авт. было показано, что магний в 20 раз повышает аффинитет β-агонистов к рецепторам, ассоциированных с аденилатциклазой. По мнению Williams L. T. с соавт., Skorodin M. S. с соавт., Mroczek W. J. с соавт. магний необходим для активации аденилатциклазы и синтеза цАМФ. цАМФ обеспечивает фосфорилирование протеинкиназы, что в кардиомиоцитах приводит к открытию кальциевых каналов и повышению сократительной активности. Иначе говоря, магний необходим для реализации инотропного эффекта адреналина [11].
Кроме того, у крыс с алиментарным дефицитом магния обнаруженные морфологические изменения свидетельствовали о развитии хронического воспаления в стенке кровеносных сосудов с последующим склерозированием и формированием мелкоочагового кардиосклероза. Данный процесс сопровождался увеличением объемной плотности соединительнотканной стромы преимущественно вокруг кровеносных сосудов, что существенно ухудшало кровоснабжение миокарда и способствовало развитию его гипоксии. Ишемическое повреждение кардиомиоцитов сопровождалось не только выраженной фуксинофилией, но и выраженными изменениями миофибрилл в виде контрактур. Данные морфологические изменения также могут служить органической основой для снижения функциональных резервов сердца в условиях дефицита магния.
ЗАКЛЮЧЕНИЕ
Таким образом, дефицит магния приводит к формированию мелкоочагового кардиосклероза, что функционально проявляется меньшим приростом левожелудочкового давления, скорости сокращения и расслабления миокарда, систолического и диастолического артериального давления в пробе с нагрузкой адреналином.


