Адсорбция фенолсульфидов на стали, действующих как ингибиторы коррозии в водно-солевых средах, имитирующих морскую воду
Автор: Сикачина А.А.
Журнал: Juvenis scientia @jscientia
Рубрика: Химия
Статья в выпуске: 2, 2016 года.
Бесплатный доступ
В публикуемой научной работе представлен смоделированный в среде квантовохимического пакета HyperChem версии 8.0.9 при помощи полуэмпирического метода ZINDO/1 процесс адсорбции органических соединений класса фенолсульфидов, на железе (имеющегося в испытуемой марке стали в количестве 97%). Научная новизна проводимого исследования заключается в отходе от технологии кластерного моделирования и привлечения более информативного приближения донорно-акцепторного взаимодействия органических соединений с атомами железа. Такой подход, как будет показано далее, с высокой точностью отражает процесс защиты от электрохимической коррозии в водно-солевых коррозионных средах, имитирующих морскую воду, путем электро- и хемосорбции испытуемого как ингибитор коррозии органического соединения на поверхности металла с образованием комплексного соединения. В процессе исследования были получены и проанализированы: составы полученных комплексов (железофенолсульфидов), график, отображающий зависимость локальной электрофильности атома серы, от величины защитного эффекта (обратно пропорционального величине скорости коррозии).
Фенолсульфиды, скорость коррозии, водно-солевые среды, имитирующие морскую воду, электрохимическая коррозия, адсорбция, сталь ст3, парциальные эффективные заряды
Короткий адрес: https://sciup.org/14110206
IDR: 14110206 | DOI: 10.15643/jscientia.2016.2.32
Текст научной статьи Адсорбция фенолсульфидов на стали, действующих как ингибиторы коррозии в водно-солевых средах, имитирующих морскую воду
Введение: Производные фенолов, содержащие в структурах различные функциональные группы и гетероатомы (S, N, P), находят разнообразное применение в качестве присадок к маслам и топливам, термо- и светостабилизаторов высокополимеров, лигандов для нанесенных катализаторов и др. [2, с. 2148; 3, с. 583].
Как показывает анализ литературы в этой области, дальнейший прогресс в развитии химии фенольных соединений в немалой степени будет обусловлен успехами, связанными с использованием в различных процессах алкенилзамещенных фенолов [5, с. 18; 6, с. 100; 8, с. 27].
Наличие в них одновременно нескольких реакционноспособных фрагментов, таких как кратная С=С- связь, ОH-группа и ароматическое ядро позволяет целенаправленно подойти к синтезу многочисленных новых соединений с полезными свойствами [7, с.53].
В настоящей статье приводятся результаты исследований по изучению ОС класса фенолсульфиды в качестве ингибиторов коррозии стали марки Ст. 3. Прежде всего такое свойство зависит от наличия в структуре ОС гетероатомов, поскольку несение свободных электронных пар позволяет таким ОС дозировать электронную плотность на незаполненные d-подуровни металла, давая поверхностные комплексы, в той или иной мере тормозящие катодную и анодную реакцию электрохимической. Как следствие, должно наблюдаться снижение скорости коррозии. Из вышеуказанных гетероатомов последний обладает наименьшей электроотрицательностью, что в работе [1, с.10-12] расценивается как положительный признак.
Материалы и методы: Исследованные соединения (класса фенолсульфидов) были следующие (рисунок 1 и таблица 1) [7, с. 52]:
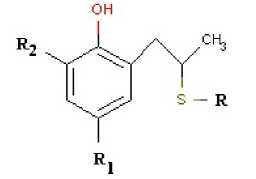
Рис. 1. Общая структура исследуемых молекул
Расшифровка кодовых обозначений дана в таблице 1
Таблица 1Расшифровка состава радикалов каждой молекулы
|
Код радикала |
ОС1 |
ОС2 |
ОС3 |
ОС4 |
ОС5 |
|
R |
н-амил |
н-нонил |
н-доде-цил |
н-амил |
н-амил |
|
R 1 |
-Н |
-Н |
-Н |
метил |
-Н |
|
R 2 |
-Н |
-Н |
-Н |
-Н |
метил |
Данные по Z конкретной выборки фенолсульфидов были взяты также из [7, с. 53].
Квантовохимические электронные свойства исходных фе-нолсульфидов были получены в среде квантовохимического пакета HyperChem версии 8.0.9, используя уровень теории ММ+/АМ1. Квантовохимические электронные свойства конечных железофенолсульфидов были получены путем моделирования протекания электрофильной реакции x Fe + OCY = Fe x (OCY), используя уровень теории OPLS/АМ1/ZINDO1 [12, с. 21].
Научная новизна проводимого исследования заключается в отходе от технологии кластерного моделирования и привлечения более информативного приближения донорно-акцепторного взаимодействия ОС с атомами железа (что является хорошим приближением, поскольку в стали Ст3 имеется 97% железа).
Технология проведения численного эксперимента состояла в задании предельного числа атомов железа, каковым считалось такое их число a, когда из (a+b) заданных атомов железа несли нулевой заряд их число b. Тогда принималось, что донорные возможности ОС исчерпывались. Получаемые соединения по общепринятой классификации следует отнести к комплексным, поскольку налицо существование донорно-акцепторных взаимодействий, где атомы железа – акцепторы электронной плотности, в связи с этим заряжающиеся отрицательно [13, с. 104].
Методика расчета величин электрофильности атомов и их групп была применена согласно [4, с. 80].
Результаты (Results): Сгенерированные квантовохимические дескрипторы фенолсульфидов и железофенолсульфи-дов представлены в таблицах 2 и 3:
Таблица 2
Значения вычисленных парциальных эффективных зарядов молекул фенолсульфидов и комплексных соединений на их основе
|
Код молекулы по порядку |
Дескриптор |
Величина у железофенол-сульфида |
Величина уфенол-сульфида |
исхωогдлонбой молекулы |
ω лок гетероатомов фенол-сульфида |
|
ОС1 |
QS QO QCH3 QRCH3 ∑БQС |
0,097 -0,191 -0,112 -0,032 1,250 |
0,060 -0,253 -0,211 -0,211 -0,561 |
0,893 |
0,037 0,062 0,088 0,179 1,811 |
|
ОС2 |
QS Q O QCH3 RCH3 ∑ Б Q С |
0,070 -0,206 -0,057 -0,042 1,258 |
0,035 -0,257 -0,210 -0,210 -0,561 |
0,887 |
0,031 0,045 0,136 0,149 1,819 |
|
ОС3 |
QS QO QCH3 Q RCH3 ∑БQС |
-0,022 -0,198 -0,062 -0,006 1,216 |
0,035 -0,251 -0,200 -0,211 -0,581 |
0,952 |
-0,054 0,050 0,131 0,195 1,711 |
|
ОС4 |
QS QO QCH3 Q RCH3 Q пара-CH3 ∑ Б Q С |
0,159 -0,170 -0,069 -0,006 -0,127 1,377 |
0,051 -0,255 -0,205 -0,211 -0,173 -0,489 |
0,864 |
0,126 0,099 0,158 0,239 0,054 1,867 |
|
ОС5 |
QS QO QCH3 Q RCH3 Q пара-CH3 ∑ Б Q С |
0,064 -0,108 -0,100 0,011 -0,050 1,312 |
0,046 -0,270 -0,212 -0,209 -0,177 -0,270 |
0,929 |
0,017 0,150 0,104 0,204 0,118 1,470 |
Таблица 3
Значения вычисленных энергий граничных орбиталей молекул фенолсульфидов и комплексных соединений на их основе
|
Код фе-нолсуль-фида |
ОС1 |
ОС2 |
ОС3 |
ОС4 |
ОС5 |
|
Значение Е(ВЗМО) |
-8,301 |
-8,307 |
-8,339 |
8,267 |
-8,329 |
|
Значение Е(НСМО) |
0,408 |
0,431 |
0,251 |
0,488 |
0,312 |
|
Состав железофенол-сульфида |
Fe11ОС1 |
Fe13ОС2 |
Fe15ОС3 |
Fe13ОС4 |
Fe13ОС5 |
|
Значение Е(ВЗМО) |
-7,498 |
-7,376 |
-7,318 |
-7,762 |
-7,486 |
|
Значение Е(НСМО) |
-0,089 |
-0,351 |
-0,367 |
-0,300 |
-0,071 |
Зависимость ωлок атомов серы фенолсульфидов от защитного антикоррозионного эффекта, проявляемого ОС в концентрации 200 мг/л представлена на рисунке 2:
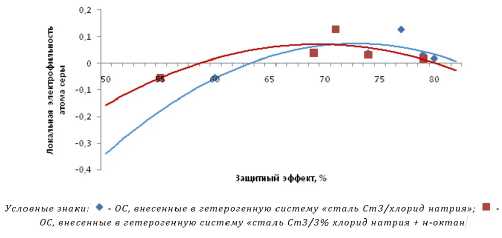
Рис. 2. Зависимость скорости коррозии от плотности заряда на железе
Обсуждение и заключение: Сложность состава кластера железокомплекса в данном случае прямо пропорционален сложности исследуемого ОС и, как, например, в [12, с. 23] несет в себе наименьшую информационную нагрузку.
Очевидно, что данные ОС абсолютно электродонорны, за исключением ОС3, где атом серы проявляет акцепторные свойства (его функция Фукуи отрицательна). Несмотря на то, что акцепторные свойства проявляет лишь один гетероатом, это существенно обуславливает Z – наиболее низкий по величине из всей представленной выборки. Вероятно, это происходит вследствие наличие самого длинного R, поскольку в ОС2 где R включает в себя 9 атомов углерода, и где бензольное кольцо не содержит иной радикал, ωлок атомов серы наименьшая. ωлок кислорода изменяется аналогичным образом. ωлок метильных групп в составе соответствующих R наиболее высока у ОС4 и ОС5, поскольку в них имеются метильные группы в орто- и пара- положениях бензольного кольца (по отношению к фенольному гидроксилу), также подающие электронную плотность на бензольное кольцо. Из имеющихся радикалов метил наиболее электродонорен радикальный, из заместителей бензольного кольца – орто -метил, который резко понижает электрофильность бензольного кольца.
По данным таблицы видно, что бензольное кольцо является основным центром хемосорбции — даже наблюдается смена знака величины его заряда в процессе донирования электронной плотности на металл. Вероятнее всего, что сера выступает как центр электросорбции, на что указывает ее положительный заряд как в свободной молекуле, так и в ад-мо-лекуле. Конечно, имеется тенденция к преобразованию данного центра электросорбции в центр хемосорбции, учитывая меньшую электроотрицательность серы по сравнению с кислородом.
Выборка ОС презентована так, что ОС4 и ОС5 являются изомерами, а ОС1…3 – гомологами. На примере первых можно проследить, что метил в орто-положении дает: повышение ωглоб молекулы, слабее донирует бензольное кольцо, атом серы, радикалы метил всей упоминаемой природы. Сам орто-метил проявляет более сильные донорные свойства. На примере вторых можно проследить, что ωлок атомов серы падает (в случае ОС1 и ОС2 наличествуют очень близкие величины здесь и далее). Если задать ряд «ОС3-ОС1-ОС2», падает величина ωглоб молекулы вследствие укорочения R, а также растет ωлок бензольного кольца, при уменьшении ωлок радикального метила, что говорит о явлении донирования R на бензольное кольцо.
При рассмотрении энергий граничных орбиталей очевид- но, что метод АМ1 очень хорошо подходит для определения электронных свойств фенолсульфидов, поскольку величина Е(НСМО) положительна [1, с. 12], в отличие от отрицательной (в случае ОС2…ОС4, являющихся гомологами по R) или близкой к нулю (в случае ОС1 и ОС5, являющихся гомологами по радикалу орто-метил) величины Е(НСМО). В общем и целом для ад-молекул в сравнении со свободными молекулами Е(ВЗМО) возрастает, Е(НСМО) падает. Радикал метил в орто-положении бензольного кольца не влияет на падение Е(НСМО) и Е(ВЗМО). В ОС2 и ОС3 идет самое сильное понижение Е(НСМО) и самое сильное повышение Е(ВЗМО), что можно объяснить наличием самого длинного радикала. В ОС1 и ОС5 Е(НСМО) является практически нулевым.
Z в прямой зависимости от ωлок атома серы возрастает, пока сера имеет низкую электрофильность. Z при этом принимает диапазон величин 0…67% (происходит электро- и хемосорбция путем донирования электронной плотности на металл). С диапазона 67%...74% ω лок атомов серы держится на уровне 0,08 (именно с этой величины ωлок атомов серы начинается отток электронной плотности с металла вследствие большого уровня разницы величин электроотрицательности — 1,83 у железа против 2,58 у серы – а также наличия у серы вакантных 3р- и 3d-орбиталей - металл постепенно начинает переходить в ионное состояние). Сдвиг кривых идет относительно точки, где Z = 71%, что свидетельствует о схожести механизмов ингибиторной защиты в водно-солевых средах, имитирующих морскую воду (о чем говорит и близость и наложение точек друг к другу). С диапазона 74%...100% указанная электрофильность резко падает вплоть до нулевого значения при Z = 80%…82% (ликвидация ионизации металла в связи с понижением ωлок атомов серы, рост величины Z, падение скорости коррозии). Присадка н-октана практически повышает ωлок атомов серы при конкретной величине Z, вероятно, за счет погружения неполярных фрагментов молекулы в неполярную присадку, что дает с их стороны меньшее влияние Z.
Список литературы Адсорбция фенолсульфидов на стали, действующих как ингибиторы коррозии в водно-солевых средах, имитирующих морскую воду
- Beloglazov, Georgy S.; Sikachina, Andrei A.; Beloglazov, Sergei M. Modelling macroscopic properties of organic species on the basis of quantum chemical analysis (on an example of inhibiting efficiency of ureides and acetylides against corrosion).//Solid State Phenomena;2014, Vol. 225, p7 -12
- Haino Takcharu, Araki Hiromi. Сенсоры фуллерена на основе каликс арена, Chem.Coomun,//РЖХ 2003, 03.08-19 Ж.236, 2002, №18, с. 2148-2149
- Галимзянова А.У., Биглова П.З., Талипов Р.Ф. Синтезы и антиокислительные свойства серосодержащих олигоизобутенилфенолов./Материалы Междунар. конф. по орг. химии «Органическая химия от Бутлерова и Бельштейна до современности», Санкт-Петербург: 2006, с. 583-584
- Захарова В. С. Квантово-химическое исследование форм тяжелых металлов, извлекаемых из водных растворов методом ионной флотации /В. С. Захарова, Л. А. Амангусова//Молодой ученый. -2014. -№15. -С. 80-82
- Заявка 1033950 Германия. Новые лиганды для катализаторов, МПК7СО7F 9/53, 2005
- Заявка 1211271 ЕПВ, Способ получения сополимеров алкенилфенолов с метакрилатами с контролируемой структурой, МПК7СО8 29/02, 2002
- Магеррамов А.М., Байрамов М.Р., Джавадова О.Н., Агаева М.А., Алиева С.Г., Джавадов М.А. Получение фенолсульфидов на основе пропенилфенолов и исследование их в качестве ингибиторов коррозии стали//Вестник Бакинского Университета, -Баку: Изд-во "Бакинский Университет", 2009. С. 52-55
- Пат. 6300035 США, Химически усиливаемые позитивные фоторезисты, МПК7G03F/004, 2001
- Пат. 6346362 СШФ, Полимеры и их применение, МПК7GO3F 7/039, 2002
- Пат. 6864381 США. Способ получения ацилоксибензолсульфонатов, МПК7СО7 В45/40, 2005
- Пат. 7226979 США, Сополимеры, содержащие олефины и защищенные или незащищенные оксистирольные звенья, МПК7 СО8F 297/00, 2007
- Сикачина А.А. Квантовохимическое моделирование адсорбции органических соединений на стали углеродистой конструкционной//Интернет-журнал «НАУКОВЕДЕНИЕ» Том 7, №4 (2015) http://naukovedenie.ru/PDF/47TVN415.pdf (доступ свободный). Загл. с экрана. Яз. рус., англ DOI: 10.15862/47TVN415
- Сикачина А.А. Квантово-химическое моделирование реакции различных форм 2-аминопропановой кислоты с атомами железа/А.А. Сикачина//Вестник КузГТУ. -2015. -№3. -C. 102-106
- Сикачина А.А. О перспективе использования единого квантовохимического подхода для характеристики совокупности форм молекул//Перспективы науки-2015 -№ 8 -C. 100-104


