Адсорбция на стали серосодержащих органических соединений как основа ингибирования коррозии, микологически инициируемой
Автор: Сикачина А.А.
Журнал: Juvenis scientia @jscientia
Рубрика: Химия
Статья в выпуске: 1, 2016 года.
Бесплатный доступ
В публикуемой научной статье представлен смоделированный при помощи квантовохимического пакета HyperChem версии 8.0.7 при помощи полуэмпирического метода ZINDO/1 процесс адсорбции органических серосодержащих соединений на железе (имеющегося в стали Ст3 в количестве 97%). Такой подход, как будет показано далее, с высокой точностью отражает процесс защиты от коррозии с микологическим контентом (клетки Aspergillus niger) путем хемосорбции органического соединения на поверхности металла с образованием комплексного соединения. В процессе исследования были получены и проанализированы: заряды на гетероатомах, плотность заряда (на 1 атом железа), состав получившихся соединений Fex [ИМ Y], а также энергетические диаграммы при образовании адсорбционного комплекса из исследуемой молекулы.
Скорость коррозии, адсорбция, сталь ст3, парциальные эффективные заряды
Короткий адрес: https://sciup.org/14110050
IDR: 14110050
Текст научной статьи Адсорбция на стали серосодержащих органических соединений как основа ингибирования коррозии, микологически инициируемой
Список принятых авторских сокращений:
ИМ – исследуемая молекула сqS – заряд на атоме тиасеры qN – заряд на атоме азота
1q – заряд на одном конкретном атоме
2q – заряд на другом конкретном атоме
Σq –величина суммарного заряда, равняется: Σq = 1q + 2q
ВЗМО – высшая заполненная молекулярная орбиталь
НСМО – низшая свободная молекулярная орбиталь
1НСМО – орбиталь, следующая после низшей свободной молекулярной орбитали
ω – величина глобальной электрофильности
ωS – величина локальной электрофильности конкретного атома
Fe ρ q – заряд, приходящийся на один атом железа (плотность заряда)
Введение: Биоповреждение материала есть любое нежелательное изменение его свойств, вызванное жизнедеятельностью организмов. Биокоррозия металлов – составная часть проблемы биоповреждений. Наиболее активными возбудителями повреждений являются микроорганизмы – мицелиальные грибы и бактерии, на долю которых приходится до 20% от общего числа повреждений. Многие бактерии и мицелиальные грибы образуют в процессе метаболизма аммиак, сероводород, а также различные органические кислоты, большинство из которых характеризуется высокой коррозионной активностью. В процессе своего развития микроорганизмы, являясь акцепторами на поверхности металлов, разрушают ингибиторы, защищающие металл, и стимулируют его коррозию. Биокоррозия металлических изделий, конструкций обычно происходит в условиях повышенной влажности при наличии загрязнений. Наиболее активными агентами биокоррозии металлов и покрытий являются плесневые грибы [1].
Методика проведения эксперимента: В рамках статьи исследовались гетерогенные системы закрытого термодинамического типа «Ст3/среда Чапека + Aspergillus niger».
Подвергались исследованию следующие серосодержащие соединения: 4-оксо-2-тиоксо-1,3-тиазолидин или роданин (ИМ 1); 10 H -дибензо-[ b,e ]-1,4-тиазин или фенотиазин (ИМ 2); 1,3,4-тиадиазолидин-2,5-дитион или висмутол I (ИМ 3) [2].
Реализуемая технология проведения численного эксперимента описана в [3].
Данные по скорости коррозии, полученной по стандартной методике гравиметрического анализа, были взяты из [5]. Согласно [5], вышеуказанные структуры составляли структурный ряд молекул.
При задании исходной структуры, в файле-задании был учтен мезомерный эффект по структуре иона. В работе контролировались следующие дескрипторы электронной структуры: заряды на гетероатомах (by Mulliken), плотность заряда (на 1 атом железа), состав получившихся соединений Fex [ИМ Y], а также изменение положения уровней энергии орбиталей ВЗМО [4], НСМО, 1НСМО при образовании адсорбционного комплекса из ИМ.
Результаты и обсуждение: Сгенерированные результаты сведены в таблицу 1
Таблица 1.
Согласно таблице 1, энергия НСМО органических железо- содержащих комплексов коррелирует с количеством атомов
Значения вычисленных квантовохимических дескрипторов молекул сульфаниламидов и комплексных соединений на их основе
|
Коды соединений |
ИМ 1 |
ИМ 2 |
ИМ 3 |
|
ω |
0,163 |
0,031 |
0,171 |
|
ωS |
0,079 |
0,016 |
0,077 |
|
ωN |
0,031 |
0,005 |
0,045 |
|
Эффективные заряды на гетероатомах |
сqS = - 0,167 |
сqS = - 0,270 |
сqS = - 0,123 |
|
qN= - 0,229 |
qN= - 0,236 |
ΣqN= - 0,214 (1,2qN=-0,107) |
|
|
Состав комплексов |
Fe9[ИМ 1] |
Fe14[ИМ 2] |
Fe8[ИМ 2] |
|
Эффективные заряды на гетероатомах |
сqS = 0,318 |
сqS = 0,259 |
сqS = 0,329 |
|
qN= - 0,038 |
qN= - 0,079 |
ΣqN= - 0,081 (1qN= - 0,050) (2qN= - 0,031) |
|
|
Feρq |
- 0,264 |
- 0,367 |
- 0,299 |
Энергетические диаграммы для реакции x Fe + ИМ Y = Fe x [ИМ Y] представлены на рисунках 1-3:
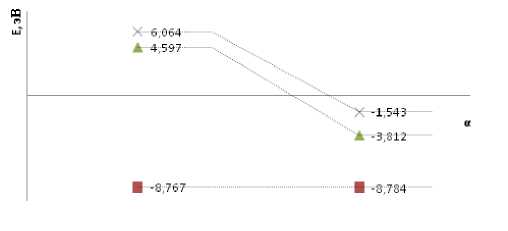
Рис. 1. Изменение положения уровней энергии орбиталей ВЗМО
( ■ ), НСМО ( A ), 1НСМО ( X) при образовании адсорбционного комплекса (cправа) из ИМ 1 (слева)

Рис. 2. Изменение положения уровней энергии орбиталей ВЗМО
( ■ ), НСМО ( ▲ ), 1НСМО ( X) при образовании адсорбционного комплекса (cправа) из ИМ 2 (слева)
4.301 Д 4.599

-2,037'-*-tW
■ -8318
Рис. 3. Изменение положения уровней энергии орбиталей ВЗМО
( ■ ), НСМО ( A ), 1НСМО ( X) при образовании адсорбционного комплекса (cправа) из ИМ 3 (слева)
серы: энергия тем выше, чем меньше количество атомов серы, при этом хуже оттягивается электронная плотность.
В рамках научной работы прослежена донорная активность атомов азота и тиасеры. Этот подход наиболее объек- тивен, поскольку такие группы характерны для всех 3 соединений.
Согласно данным таблицы 1, очевидно, что тиасера является более сильным донором электронной плотности. Исследуемые соединения могут составить ряд «фенотиазин-ро-данин-висмутол I», т.е. прослеживается зависимость как от величины молекулы (самые высокие донорные свойства), так и от количества атомов серы (чем больше в молекуле тиогрупп, тем донорные свойства хуже).
В отличие от атомов тиасеры, донорные свойства атомов азота не зависят от величины молекулы. Так, донорные свойства наиболее сильны у висмутола I, где атомы азота наличествуют в количестве двух, но, несмотря на это, суммарный за- ряд на них такого же порядка, как и на остальных молекулах (из чего следует, что по свойствам они похожи на атомы азота 2 других ИМ). Далее убывают они в ряду «роданин-феноти-азин». По-видимому, решающую роль играет сопряжение атома азота с другими структурами ИМ. В случае роданина сопряжение протекает как с тиасеры, так и с кетогруппы, в то время как в случае фенотиазина – только с бензольными кольцами.
Рассматривая величины глобальной электрофильности, очевидно, что уменьшение такового идет в ряду «висмутол I – роданин-фенотиазин», что по всей вероятности коррелирует с количеством атомов серы в виде тиогруппы. В ряду «висмутол I – роданин» падение не столь резкое, поскольку роль второго атома тиосеры берет на себя кетогруппа, исчезновение же обоих фрагментов влечет за собой почти нулевую величину глобальной электрофильности.
Очевидно, что результаты по глобальной электрофильности наиболее информативны. Получается высокая величина локальной электрофильности. Полученные величины говорят о сильной склонности донирования электронной плотности на железо. Крайне низкие величины локальной электрофильности ИМ 2 показывают, что электронная пара атома азота и атома серы вовлечена в сопряжение с бензольными кольцами. Равные величины локальной электрофильности серы ИМ 1 и ИМ 3 показывают, что электронная пара атома азота и атома серы эквивалентно участвуют в донировании электронной плотности.
Согласно рисункам 1-3, очевидно, что рисунок орбиталей комплексов и исходного ИМ в целом друг друга повторяют, полное же наложение НСМО и 1НСМО реализуется в ИМ2 и ИМ3, что говорит об ароматичности данных соединений (ИМ 2 является ароматичным благодаря наличию бензольных колец, ИМ 3 находится в таутомерном равновесии с IIS'^'S'^'SH [2], подпадающем под правило Хюккеля; из-за таутомерии уровни энергии на рис. 3 в целом ниже). По-видимому, наличие кетогруппы в составе ИМ 1 порождает сильное разделение энергий НСМО и 1НСМО. Тот же фактор, очевидно, влияет на неуменьшение донорных свойств как комплекса, так и исходного ИМ (поскольку энергия ВЗМО не меняется).
Зависимость скорости коррозии в концентрации ингибитора 1, 2, 5 мМоль/л от плотности заряда на железе выражается графически на рисунке 4 следующим образом на рисунке 4:
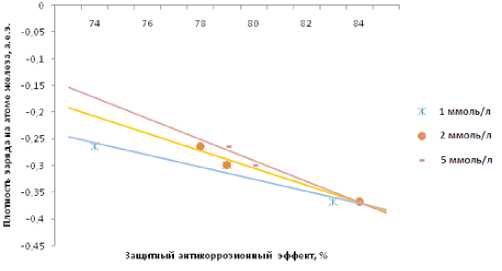
Рис. 4. Зависимость скорости коррозии от зарядовой плотности на железе
Очевидно, что ингибирующее действие начинает проявляться при величине плотности заряда на железе свыше -0,15. Также очевидно, что в концентрации 5 мМоль/л такая зависимость наиболее сильна, т.е. на более резкое увеличение плотности приходится более резкое уменьшение скорости коррозии. При концентрациях менее высоких такая зависи- мость сохраняется, но выражается менее резко. При величине защитного эффекта 84% зависимость такового от зарядовой плотности на железе теряется, последняя принимает стабильное значение -0,37.
Список литературы Адсорбция на стали серосодержащих органических соединений как основа ингибирования коррозии, микологически инициируемой
- Актуальные вопросы биоповреждений/Под ред. Бочарова В.В. -М.: Наука, 1983
- Бусев А.И., Симонова Л.Н., Заюкова Н.Д., «Тр. Комис. по аналит. хим. АН СССР», 1969, т. 17, с. 21-29.
- Сикачина А.А. Квантово-химическое моделирование реакции различных форм 2-аминопропановой кислоты с атомами железа/А.А. Сикачина//Вестник КузГТУ. -2015. -№3. -C. 102-106. URL: http://vestnik.kuzstu.ru/index.php?page=articles&id=2907
- Сикачина А.А. Правило аддитивности как прогнозирование численного значения энергии высшей заполненной молекулярной орбитали//Современная наука: Актуальные проблемы теории и практики. -М.: «Научные технологии». №3 (2015) URL: http://www.vipstd.ru/nauteh/index.php/ru/-etn15-03/1558-a
- Ягунова Л.К. Влияние некоторых классов органических соединений на процесс коррозии стали в нейтральной и кислой средах/Л.К. Ягунова//Коррозия металлов и защита от коррозии с помощью органических соединений. Охрана окружающей среды: сборник научных трудов/КГУ.-Калининград, 2002. -С. 9-12.


