Адсорбционный механизм экстракции коллоидного оксигидрата железа ди-(2-этилгексил)фосфорной кислотой
Автор: Голованов Владимир Иванович, Иняев Игорь Викторович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Неорганическая химия
Статья в выпуске: 33 (250), 2011 года.
Бесплатный доступ
На основе данных о стехиометрии и химическом строении органозоля оксигидрата железа (III), а также данных об его извлечении в органическую фазу предложена математическая модель экстракции, основанная на представлениях об ионообменной адсорбции Д2ЭГФК частицами коллоида.
Жидкостная экстракция, д2эгфк, ионообменная сорбция, коллоидно-химический механизм, гидролиз, гидроксид железа (iii), органозоль, нанодисперсные оксиды, физико-химическое моделирование
Короткий адрес: https://sciup.org/147160204
IDR: 147160204 | УДК: 546.04+544.7
Текст научной статьи Адсорбционный механизм экстракции коллоидного оксигидрата железа ди-(2-этилгексил)фосфорной кислотой
В работе [1] впервые был обнаружен эффект коллоидно-химической экстракции железа ди-2(-этилгексил)фосфорной кислотой (НХ, Д2ЭГФК) из золя его гидроксида. Золь получали методом пептизации свежеосажденного Fe(OH) 3 соляной кислотой по известной методике [2, с 20]. Из гептанового экстракта при замене растворителя (гептана на ацетон) выделены два продукта. Химический анализ позволил приписать первому продукту формулу 17Fe(OH) 3 ⋅ FeX 3 . Это коллоидное вещество можно считать ксерогелем (сухим гелем) органозоля Fe(OH)3. Состав второго неколлоидного продукта в точности отвечал формуле средней соли ди-2(-этилгексил)фосфата железа FeX 3 . По нашим оценкам [1] в экстракте преобладает коллоидная форма 17Fe(OH) 3 ⋅ FeX 3 Содержание FeX 3 не превышает 3 мол. %. Механизм экстракцию железа из сильнокислых растворов в виде средней соли подробно изучен в [3].
Ранее [1] было высказано предположение о том, что основной причиной экстракции коллоидных форм Fe(OH) 3 является ионообменная адсорбция поверхностно-активных анионов Д2ЭГФК частицами водного золя. Это предположение аргументировали построением стереохимической модели частиц органозоля. Согласно этой модели частица органозоля содержит неорганическое ядро и оболочку из дифильных ионов Х–. Моделирование позволяет объяснить стехиометрию мицелл 17Fe(OH)3 ⋅ FeX3, (молярное отношение Fe : X = 6 : 1, в частности) из соотношения площади поверхности сферической мицеллы и площади поперечного сечения дифильного аниона Д2ЭГФК. Другими словами, стехиометрия органозоля определяется стерическими препятствиями при упаковке дифильных противоионов на поверхности. При этом, поверхностный заряд неорганического ядра лишь частично скомпенсирован ионами Х–. Позднее [4, 5], при изучении гидролиза хлорного железа, обменная емкость коллоидного Fe(OH) 3 была уточнена. Что позволило для частиц органозоля записать формулу Fe(OH) 2,75 Х 1/6 Cl 1/12 . Ниже покажем, что реальный состав мицелл только в первом приближении отвечает составу Fe(OH)2,75Х1/6Cl1/12.
Данная работа посвящена подробному изучению механизма экстракции железа из золей его гидроксида, которые получают не только методом пептизации, но также при гидролизе растворов хлорного железа. В качестве метода исследования применили метод физико-химического моделирования процесса экстракции. Знание состава и строения органозоля существенно упрощает количественное описание, а также верификацию и валидацию механизма экстракции. Построение содержательной физико-химической модели неразрывно связано с моделированием стехиометрии и стереохимии экстрагируемых форм.
Поставленная задача может представлять существенный интерес не только для химии экстракции [6], но также для химии и технологии нанодисперсных оксидов и, прежде всего, для золь-гель метода [7], который является основным методом их получения.
В работе использовали вещества реактивной чистоты. Растворители, гептан и октан, применяли без дополнительной очистки. Д2ЭГФК c содержанием 98 % основного вещества получали очисткой технической кислоты по прописям [8]. Растворы экстрагента приготовляли по навеске. Концентрацию Д2ЭГФК устанавливали алкалиметрическим титрованием ее спиртовых растворов [9]. Водные золи приготовляли нейтрализационным аммиачным методом [7] (методом гидролиза) или методом пептизации [2]. Для получения золей использовали хлорное и, иногда, азотнокислое железо. Экстракцию осуществляли при перемешивании фаз в пробирках с притертыми пробками (или виалах) вместимостью 20 мл. Фазы перемешивали на встряхивательной машине WU-3 (Польша) при частоте 100 кол/мин и температуре (30±0,5) °С. Оптимальное время экстракции, 60 мин, найдено специальными опытами. Этого времени достаточно для установления равновесия. После разделения фаз определяли железо в водной фазе. Степень извлечения R и/или коэффициент распределения D рассчитывали из условия материального баланса. При потенциометрических определениях со стеклянным рН-чувствительным и серебряным индикаторными электродами использовали рН-метр-милливольтметр рН-121. Фотометрические измерения проводили на спектрофотометре Specol 10 (Германия) и фотоколориметре КФК-2МП. В экспериментах по ультрафильтрации использовали ячейку ЭФМ-3-3, оснащенную фильтром марки Хали-пор Г с диаметром пор 0,17 мкм.
Концентрацию железа в гидрозолях устанавливали по известной методике комплексонометрического титрования с сульфасалициловой кислотой в качестве металлоиндикатора. Золи предварительно разрушали кипячением с 1 М HNO3. Малые концентрации железа определяли при фотометрировании его сульфосалицилатных комплексов обычным способом. Содержание железа, фосфора и хлорида в экстрактах и ксерогелях определяли после мокрого озоления проб смесями H 2 SO 4 и HNO 3 с добавлением H 2 O 2 . Фосфор определяли фотометрически в виде фосфорно-ванадиевомолибденовой гетерополи кислоты. Концентрацию хлорида определяли аргентометрическим титрованием c индикаторным Ag 2 S – электродом.
Стабилизированные Д2ЭГФК ксерогели оксиграта железа выделяли из экстрактов при осаждении ацетоном по способу замены растворителя [1].
Линейные размеры частиц органозоля состава Fe(OH) 2,75 Х 1/6 Cl 1/12 оценивали методом Гинье, по данным о рентгеновском малоугловом рассеянии, полученным А.И. Головановым на установке КРМ-1.
На рис. 1 показаны зависимости степени извлечения железа из водного золя его гидроксида от концентрации Д2ЭГФК в гептане. Золи предварительно синтезировали по способу сдвига рН растворов хлорного железа с концентрацией 0,002 моль/л водным аммиаком в присутствии 0,1 М NH 4 Cl. Гидролиз проводили при температуре 30 °С; при той же температуре осуществляли экстракцию, перемешивая равные объемы (5:5 мл) водной и органической фаз в течение 60 мин. После завершения экстракции определяли железо в водной фазе. По результатам анализа вычисляли коэффициент распределения железа ( D ) и/или степень его извлечения ( R ).
Эти и другие изученные нами зависимости R от с НХ по форме напоминают изотермы адсорбции Ленгмюра. Покажем, что такая аналогия имеет неформальный характер. Для этого применим к нашим данным методологию количественного описания сложных равновесий, таких как реакции комплексообразования [10]. Согласно этому подходу, вначале определяют число, а также химический состав металлсодержащих частиц. Затем на основе законов сохранения и закона действующих масс записывают математическую модель равновесия. На заключительном этапе исследуют модель для выяснения ее надежности.
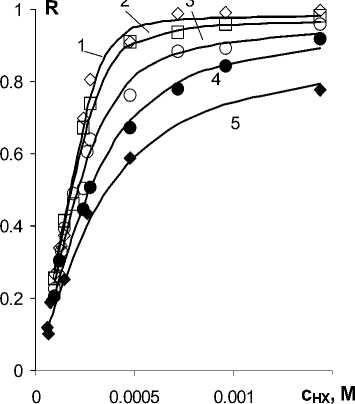
Рис.
1. Кривые экстракции 0,002 М железа гептановыми растворами Д2ЭГФК из золей, полученных гидролизом хлорного железа при рН 3,8(1), 3,6(2), 3,4(3), 3,2(4) и 2,8(5), Vw:Vo = 1:1 (сплошные линии – расчетные)
Состав экстрагируемых форм железа определяли методом насыщения, в сочетании с методом химического анализа [11]. Состав, в ходе работы, определяли неоднократно, задавая различные мольные соотношения Fe : HX в исходной системе. Найдено, что при большом избытке же- леза, Fe : HX ≥ 3 : 1 и рН водного золя ≥ 2,8, как в случае [1], из экстрактов (при замене растворителя) в основном осаждается ксерогель и в небольшом количестве FeХ3 и/или основные соли Д2ЭГФК. Причем, при действии на гептановый экстракт трехкратным избытком ацетона, первым сразу выделяется вишнево-коричневый продукт, близкий по составу к Fe(OH)2,75Х1/6Cl1/12. По
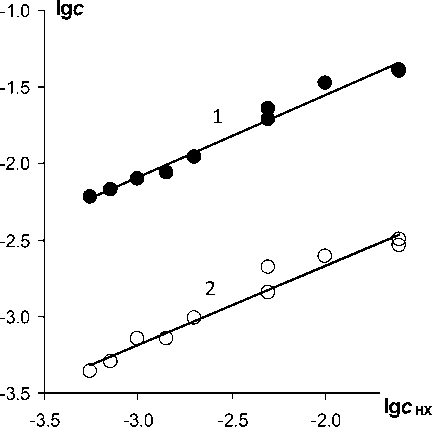
Рис. 2. Изменения концентрации железа (1) и хлорида (2) при экстракции коллоидного железа растворами Д2ЭГФК в гептане при рН 2,8 ( V w : V o = 2,5 : 1, t = 20 °C)
прошествии ≈ 1 часа из маточного раствора выпадает белое вещество, которое можно идентифицировать как FeХ 3 [1].
О соэкстракции хлорида с железом можно судить по данным на рис. 2. Аппроксимирующие прямые имеют практически одинаковый наклон. При этом разность логарифмов концентраций можно считать постоянной величиной. Отсюда получаем Fe : Cl = 12,5 : 1. Разумеется, это кажущаяся «стехиометричность» органозоля. Тому есть много причин, которые можно обобщенно назвать энтропийными эффектами «дефекта структуры».
О составе экстрагируемых форм можно судить из рассмотрения результатов элементного анализа ксерогелей, табл. 1. Ксерогели синтезировали в разное время с разными партиями реактивов. Водные золи для получения ксерогелей приготовляли по способу гидролиза соли железа аммиаком (образцы III, V) или методом пептизации геля Fe(OH)3 (остальные образцы в табл. 1). Для синтеза чаще использовали FeCl3, а также Fe(NO3)3 (образцы IV, V). Образцы получали при разных мольных избытках железа по отношению к экстрагенту. От Fe : HX = 1 : 4 (образец VI) до Fe : HX = 4 : 1 (образцы II–V). Показатель кислотности водного золя обычно задавали в интервале от рН 2,3 до рН 3. При большом избытке Д2ЭГФК для получения ксерогеля с постоянным составом требуется большее число его переосаждений. Однако и при этом, в конечном счете, образуется вещество, не отличающееся по составу и свойствам от вещества, полученного при Fe : HX = 4 : 1.
Таблица 1 Результаты элементного анализа ксерогелей, мас. %
|
Элемент |
Образцы |
Гипотетические формы |
||||||||
|
I |
II |
III |
IV |
V |
VI |
VII |
1 |
2 |
3 |
|
|
Fe |
37,6 |
39,3 |
40,5 |
38,8 |
42,0 |
35,9 |
35,4 |
35,1 |
35,4 |
39,6 |
|
P |
3,5 |
3,5 |
3,4 |
3,6 |
3,4 |
3,1 |
3,2 |
3,2 |
3,3 |
3,7 |
|
Cl |
1,9 |
– |
– |
– |
– |
– |
– |
1,9 |
– |
2,1– |
Примечания: 1 = Fe(OH) 2,75 Х 1/6 Cl 1/12 ; 2 = Fe(OH) 2,83 Х 1/6 ; 3= FeO(OH) 0,75 Х 1/6 Cl 1/12 .
Опыты по синтезу и анализу ксерогелей позволяют сделать вывод о том, что состав экстрагируемых форм коллоидного гидроксида железа изменяется в достаточно узких пределах. Частицам органозоля можно приписать состав, промежуточный между составом Fe(OH) 2,75 Х 1/6 Cl 1/12 и FeO(OH) 0,75 Х 1/6 Cl 1/12 , см. табл. 1. Одной из причин переменчивости состава является обнаруженная нами ранее [5] закономерность, согласно которой с повышением рН содержание хлорида в мицеллярной фазе уменьшается из-за обменной адсорбции гидроксила. Другой, более существенной причиной переменчивости состава является оляция и оксоляция гидролизованных форм при старении коллоида. Важно, что несмотря на переменчивости мольных масс коллоидных мольные отношения Fe : X = 6 : 1 и Fe : Cl = 12 : 1 остаются приблизительно постоянными.
Данные табл. 1 хорошо согласуются с данными о соэкстракции хлорида, см. рис. 2. Кроме того отсюда можно оценить общую обменную емкость и заряд коллоидного оксигидрата в расче- те на один атом железа. Заряд равен 1/6 + 1/12 = +0,25 единиц заряда. Такое же значение мы получили при изучении функции образования коллоидного оксигидрата в водном растворе [5].
Вместе с тем нельзя исключить возможность существования в экстрактах коллоидных частиц, стабилизированных не только благодаря обменной сорбции, но также за счет образования сольватных слоев Д2ЭГФК (и/или растворителя). На это обстоятельство указывают результаты опытов, которые мы приводим ниже.
При двукратном насыщении 0,1 М НХ в гептане водным раствором 0,2 М гидролизованного хлорного железа при рН 2,8, имеем в органической фазе соотношение HX : Fe = 2 : 3. Экстрагируемому продукту мы приписали формулу Fe(OH) 2,75 Х 1/6 Cl 1/12 ∙4/3HX. Такой состав, с одной стороны, можно обосновать стереохимической моделью мицелл органозоля (если предположить двухслойное строение органической оболочки). С другой стороны, при пятикратном переосажде-нии получают твердый продукт, отвечающий составу Fe(OH) 2,75 Х 1/6 Cl 1/12 , см. данные для образца I в табл. 1. Другими словами, первичный органозоль Fe(OH) 2,75 Х 1/6 Cl 1/12 дополнительно сольватирован молекулами Д2ЭГФК.
При переосаждении сольватная оболочка разрушается ацетоном. Из этого эксперимента также следует, что замена гептана на полярный ацетон повышает кислотную активность Д2ЭГФК. В результате чего органозоль частично растворяется с образованием молекул FeХ 3 и, по-видимому, основных солей. На то, что образование солей является вторичным процессом, указывает их замедленное осаждение при добавлении к экстракту ацетона. Побочному белому продукту можно приписать формулу Fe 3 (OH) 4 X 5 , поскольку осадок содержит (8,6±0,2) мас. % Fe и (8,0±0,9) мас. % Р.
Справедливость предположения о двухслойном заполнении поверхности положительно за- ряженного ядра мицеллы покажем расчетом ее мицеллярного числа:
- 1
4 п R2 ( пх 1 ]
p =-- °- — — I = 743
to ( n Fe 6 )
где Ro = 3,6 нм, найденный методом рассеяния рентгеновских луче под малыми углами радиус несольватированной частицы органозоля, ω = 0,45 нм2 – поперечное сечение кислотного остатка Д2ЭГФК [12]. Мольное отношение nX/nFe в формуле (1) приняли равным 2/3. По независимым данным n ≈ 700 [13]. Следовательно, предположение о возможности образования частиц Fe(OH)2,75Х1/6Cl1/12∙4/3HX непротиворечиво.
Покажем, что кривые экстракции на рис. 1 можно, по аналогии, описать уравнением изотермы ионного обмена [14]. Вначале запишем уравнение реакции взаимодействия НХ с анионообменными центрами на поверхности водной мицеллы. Для простоты, будем полагать, что поверх- ностный заряд ядра мицеллы полностью скомпенсирован хлорид-ионами:
RCl ( m ) + HX ( o ) → RX ( m ) + H+ ( w ) + Cl– ( w ) . (2)
При постоянной концентрации хлорида и постоянном рН уравнение изотермы адсорбции примет простой вид. Степень заполнения поверхности мицелл Д2ЭГФК как функция ее свободной кон- центрации в органической фазе запишем уравнением:
Γ K[HX] o
.
θ= =
Γ m 1 + K[HX] o
В свою очередь предельная адсорбционность Γ выразим как отношение количества связанной Д2ЭГФК к количеству железа мицеллярной фазы:
[HX] m V о Rmc Fe Vw
где R m имеет смысл доли мицеллярного железа в исходном водном золе. c Fe – общая концентрация железа в водной фазе. Из записи (4) понятно, что экстракционную систему мы рассматриваем как систему, состоящую из двух дисперсионных сред и одной дисперсной фазы. Предельную ад-сорбционность, для простоты, выразим как Γ m = 1/6 или Γ m = 1/ m , в общем случае.
Будем полагать, что концентрация связанного экстрагента [HX] m прямо пропорциональна концентрации железа в органической фазе, с коэффициентом пропорциональности близким к 1/6. Это следует из рассмотренной выше стехиометрии экстрагируемых форм. Тогда выражение для степени заполнения адсорбента адсорбатом примет вид:
9 = R / R m . (5)
Говоря иначе, мы предполагаем, что частицы золя, остающиеся при экстракции в водной фазе свободны от Д2ЭГФК. При связывании Д2ЭГФК мицеллы неминуемо переходят в органическую фазу. Это возможно при кооперативном механизме заполнения обменной емкости дифильными ионами Х–. Заполнение происходит так, что заполняется «все – или ничего». Это предположение проверяли при определении нагруженности экстрагента по железу P = Fe : HX двумя способами. По первому способу P находили косвенно как отношение количество железа, перешедшего в органическую фазу, к заданному количеству экстрагента. По второму способу P рассчитывают по результатам химического анализа экстракта на содержание железа и фосфора. Оказалось, что, в пределах погрешности анализа, результаты обоих способов не различаются. Так при экстракции 0,1 М железа октановым 0,025 М раствором Д2ЭГФК при r = V w : V o = 5 : 1, pH 3 и комнатной температуре первым способом нашли P 1 = 4,5±0,8, и вторым P 2 = 4,8±0,8. Из сравнения этих чисел следует, что гипотеза о кооперативном механизме стабилизации коллоида в органической фазе подтверждается.
Концентрацию свободной кислоты в уравнении (3) будем вычислять из условия материального баланса:
[HX] o = c HX - -1 rRc Fe . (6) m
Здесь мы фактически приняли допущение том, что, во-первых, при определенных условиях связыванием Д2ЭГФК во внешней сольватной оболочке можно пренебречь и, во-вторых, низкомолекулярные формы железа из водной фазы не извлекаются. Эти допущения мы в дальнейшем уточним.
Параметр K в уравнении изотермы имеет смысл условной константы экстракции коллоида. Можно предположить, что основными влияющими на условную константу факторами являются рН водного золя, концентрация хлорида и концентрация железа:
lg K = lg K ex + x pH + y lg C Fe + z lg C a. (7).
Коэффициенты x , y и z в дальнейшем будем уточнять по экспериментальным данным в ходе построения модели. Для количественного описания кривых на рис. 1 знание этих коэффициентов не требуется.
Можно ожидать, что для параметра R m должно выполняться уравнение, аналогичное (7):
lg(1 - R m ) = P K h - x PH - У' lg c Fe + z’ lg C Cl . (8)
Иначе, доля неэкстрагируемых интермицеллярных форм подчиняется закономерности, которой обычно описывают растворимость осадка гидроксида [15]. При изучении кривых экстракции параметр R m , также как условная константа, остается постоянным.
Уравнение (3), с уче том выражений (4)–(6), перепишем в виде:
R =- p — a (p ^ - q , (9)
2 Vk 2 )
где m + mKcHX + KRmrcFe _ mRmChx
p =--=---------- и q =-------
K rc Fe rc Fe
Мы получили математическую модель, для описания кривых экстракции на рис. 1. Дополнив уравнения (8) и (9) выражением коэффициента распределения через степень извлечения:
D =
R
1 - R
получаем уравнение для расчета зависимостей коэффициента распределения от состава экстракционной системы.
Неизвестные параметры модели K , R m и m отыскивали при обработке экспериментальных данных методом нелинейного регрессионного анализа (НЛРА). В настоящее время НЛРА доступен широкому кругу пользователей пакетов MS Excel и/или Open Office.org Calc. Качество аппроксимации экспериментальных кривых, по отдельности, характеризуется остаточным стандартным отклонением, не превышающим 5 %, что в пределах погрешности эксперимента, см.
рис. 1. При варьировании стехиометрического коэффициента m оказалось, что во всех случаях его можно принято равным 6. Таким образом, для описания зависимостей степени извлечения органозоля от концентрации Д2ЭГФК достаточно двух параметров.
Результаты отыскания параметров 17 кривых экстракции, которую осуществляли в широком интервале составом экстракционных систем, в разное время, с разными водными золями приведены в табл. 2. При задании рН и концентрации железа в системе руководствовались пределами седиментационной устойчивости водных золей, которую исследовали ранее в [5].
Таблица 2 Результаты моделирование кривых экстракции
|
Серия |
Число точек |
Факторы |
Параметры |
|||
|
рН |
lg c Fe |
lg C Cl |
~ lgK |
R m |
||
|
1 |
6 |
2,3 |
–2,22 |
–2,22 |
3,30 |
0,80 |
|
2 |
6 |
2,5 |
–2,75 |
–2,22 |
3,73 |
0,79 |
|
3 |
6 |
2,5 |
–3,10 |
–1,00 |
3,56 |
0,79 |
|
4 |
6 |
2,5 |
–2,74 |
–2,22 |
3,63 |
0,73 |
|
5 |
6 |
2,5 |
–2,73 |
–1,00 |
3,21 |
0,82 |
|
6 |
10 |
2,8 |
–2,70 |
–1,00 |
3,80 |
0,90 |
|
7 |
6 |
3,0 |
–2,80 |
–2,22 |
4,03 |
0,86 |
|
8 |
6 |
3,0 |
–2,90 |
–1,00 |
5,04 |
0,98 |
|
9 |
6 |
3,0 |
–2,71 |
–2,22 |
4,09 |
0,95 |
|
10 |
6 |
3,0 |
–2,73 |
–1,00 |
4,91 |
0,97 |
|
11 |
19 |
3,0 |
–1,70 |
–2,00 |
3,06 |
0,98 |
|
12 |
12 |
3,0 |
–1,70 |
–1,22 |
3,50 |
0,97 |
|
13 |
10 |
3,2 |
–2,70 |
–1,00 |
4,00 |
0,97 |
|
14 |
10 |
3,4 |
–2,70 |
–1,00 |
4,36 |
0,97 |
|
15 |
10 |
3,6 |
–2,70 |
–1,00 |
4,80 |
0,98 |
|
16 |
10 |
3,8 |
–2,70 |
–1,00 |
5,10 |
0,99 |
|
17 |
10 |
4,0 |
–2,70 |
–1,80 |
5,16 |
0,99 |
Для отыскания общих закономерностей в параметрах кривых экстракции мы применили к данным табл. 2 методологию линейного метода наименьших квадратов (МНК), который позволяет оценить вклады факторов в каждый параметр. Другими словами мы исследовали применимость уравнения (7) и уравнения (8). При регрессионном анализе осуществляют дискриминацию и ранжирование коэффициентов уравнений. В табл. 3 приведены МНК-оценки коэффициентов уравнений (7) и (8) с ранжированием факторов по их значимости.
Таблица 3
Регрессионные коэффициенты уравнений (7) и (8)
|
lgK x |
x |
у |
z |
pK h |
x' |
y' |
z' |
|
–0,7 ± 1 |
1 ± 0,2 |
–0,6 ± 0,3 |
Незначим |
1,5 ± 0,3 |
–0,9 ± 0,1 |
Незначим |
Незначим |
Наиболее значимым фактором является рН водного золя. рН влияет на величину K точно так, как это следовало ожидать, если справедливо уравнение реакции ионного обмена (2). Доля неэкстрагируемых интермицеллярных форм возрастает при повышении активности ОН– в степени, близкой к единице.
Обнаруженная нами зависимость K от концентрации исходного водного золя никак не следует из теории твердых ионитов. Очевидно, что обнаруженная нами закономерность отражает специфику адсорбции нанодисперсными ионитами. В качестве возможной причины можно назвать уменьшение активности наночастиц из-за коагуляционных контактов. С повышением концентрации золя его агрегативная устойчивость уменьшается [7]. Любопытно, что стехиометрический коэффициент у ≈ –1/2.
По нашему мнению «размытость» МНК-оценки IgKx также связана со спецификой экстракционных коллоидных систем. Известно [7], что по агрегативной устойчивости золи гидроксидов и оксидов металлов занимают промежуточное положение между типично лиофобными и лио- фильными системами. Поэтому агрегативная устойчивость, а также химическая активность золей гидроксидов при экстракции должна зависеть от большого числа факторов, как детерминированных, так и случайных. Вариации агрегативной устойчивости золей, полученных в разное время, по разным схемам смешения реактивов, с использованием разных ионов-стабилизаторов, старение золей и др. могут приводить к различной их способности к экстрагированию. Экстракционная способность должна в первую очередь определяться распределением мицелл по их размерам, состоянием и распределением адсорбционных центров на поверхности мицеллы. Очевидно, что наиболее объективную информацию общего характера о механизме экстракции можно получить при постановке эксперимента в условиях, которые в аналитической химии называют условиями воспроизводимости (или экспериментом при статистическом контроле) [16]. При постановке опытов, результаты которых приведены в табл. 2 мы придерживались стратегии статистического контроля.
Обращает на себя внимание незначимость концентрации хлорида, как фактора нашей модели. В этом можно усмотреть некоторый парадокс. Действительно соэкстракция хлорида нами надежно установлен, см. рис. 2 и данные о составе ксерогелей в табл. 1. Однако хлорид не оказывает заметного влияния на коэффициент распределения железа. Здесь видится аналогия с механизмом экстракции сильных электролитов, которые полностью диссоциируют и в водной, и в органической фазе [6]. Как следует из рассмотрения стереохимии и стехиометрии частицы органозоля, поверхностный заряд ее ядра лишь частично скомпенсирован ионами Х–. Полная компенсация заряда достигается за счет соизвлечения неорганических анионов, которые располагаются во внешнем диффузном слое органической мицеллы. Если диалкилфосфат-ион образует с железом поверхностные комплексы, то хлорид ион связан с мицеллой только электростатически. В водном золе противоионы тоже не образуют химических связей с ядром. Поэтому коэффициент y' также незначим.
Надежность выводов о том, что при экстракции из водных золей преимущественно извлекаются коллоидные формы, проверяли в опытах по ультрафильтрации золей. Водные золи с концентрацией 0,002 М готовили при гидролизе хлорного железа аммиаком до заданного рН в присутствии 0,1 М NH 4 Cl. Каждый золь промывали на фильтре трехкратным объемом соответствующего аммиачного буферного раствора, поддерживая объем жидкости в ячейке на постоянном уровне. По завершении фильтрации определяли железо в редентате и рассчитывали степень удерживания R uf . В табл. 4 эти коэффициенты сравниваются с их оценками из данных по экстракции. Вычислим значения R m для таких же составов золей, как при ультрафильтрации. Расчетные значения находят из уравнения:
R m = 1 - 10pK h + x ' pH = 1 - 101 ,5 - 0 ,9 pH, (12) являющегося одной из записей уравнения (8). Видим высокий уровень взаимной согласованности данных разных методов, несмотря на неопределенность оценок параметров pK h и y' , см. табл. 3. Судя по значениям R m и коэффициентам в уравнении (12), неэкстрагируемыми интермицеллярными формами могут являться как одноцентровые, так и полиядерные гидроксокомплексы (ПЯГК) [7, 15]. Причиной низкой экстрагируемости интермицеллярных форм может быть замедленная кинетика экстракции железа (III) Д2ЭГФК [3], и/или подавление экстракции ПЯГК коллоидом из-за конкуренции за обладание экстрагентом.
Таблица 4
Степени удерживания железа при ультрафильтрации водных золей в сравнении с их теоретическими оценками по R m
|
рН |
R uf , % |
R m , % |
|
2,3 |
74 |
73 |
|
2,5 |
79 |
82 |
|
3,0 |
98 |
94 |
|
4,0 |
100 |
99 |
В качестве обобщения результатов количественное описание большой совокупности кривых экстракции и исследования их моделей запишем уравнение (3) в развернутом виде:
R m = 1 — [H] x К h
1 + К -X [HX]-* [H] c-ey 1 + K "1 ( -1 rRc, e )-1 [H] cFey ex 6 e e
Это квадратичное уравнение имеет решением выражение, аналогичное (9). Запись (13) удобна в том отношении, что позволяет определиться с числом подгоняемых параметров. Всего в модели четыре независимых параметра: lgK ex , pK h , y и х ′ . Однако их число можно сократить вдвое, если считать R m = 1. Такое допущение не приводит к существенным ошибкам при рН > 2,8 водного золя. В записи (13) все основные влияющие факторы, pH, c HX и c Fe , непосредственно входят в уравнение. Это обстоятельство позволяет использовать уравнение при планировании многофакторных экспериментов и прогнозировать их результаты.
Надежность полученной нами модели экстракции коллоидных оксигидратов покажем на примере количественного описания зависимости степени извлечения железа от его концентрации в водном золе (рис. 3). Это более сложная задача, по сравнению с описанием зависимостей R от c HX , поскольку требуется модель с четырьмя параметрами, т. е. уравнение (13). Параметры модели были нами ранее оценены по данным других экспериментов, см. табл. 3. Поэтому можно построить прогноз зависимости R от c Fe при выбранных уровнях факторов pH, c HX и c Fe , не прибегая к эксперименту.
Результаты прогнозирования показаны на рис. 3 пунктиром. Параметры, для вычислений по уравнению (13) брали из табл. 3. Сплошной линией на этом рисунке показан результат оптимизации параметров, при котором расчетная кривая подгоняется под экспериментальные точки по принципу наименьших квадратов. Точки на рисунке показаны значками. Оптимальный набор параметров: (lgK ex , pK h , y , х ′ ) = (–0,83; 1,58; –0,6; –0,84) статистически не отличается от вектора этих параметров в табл. 3 (–0,7; 1,5; –0,6; –0,9).
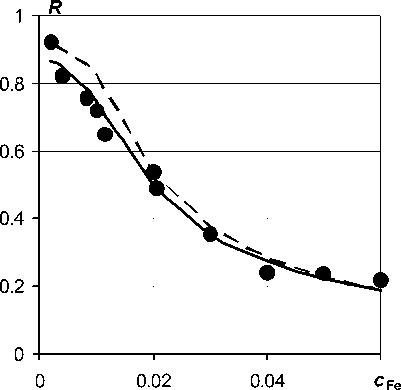
Рис. 3. Влияние концентрации железа водного золя с рН 3 на степень извлечения железа 0,002 М гептановым раствором Д2ЭГФК при V w : V o = 1 : 1 и t = 30 °C (линии – расчет, см. текст)
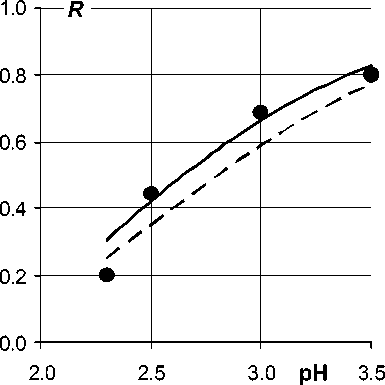
Рис. 4. Экстракция 2·10–3 М железа 4·10–4 М Д2ЭГФК в гептане на фоне 0,1 М аммиачного буфера при V w : V o = 1 : 1 и t = 30 °C (линии – расчет, пояснения в тексте)
На рис. 4 сравниваются результат прогнозирования (пунктир) экстракции железа из водных золей с различными значениями рН и результат оптимизации параметров модели (линия). Моделирование осуществляют с использованием уравнения (13). Полученный при оптимизации вектор параметров (lgK ex , pK h , y , х ′ ) = (–0,46; 1,6; –0,6; –0,9) незначимо отличается от его оценок в табл. 3. Вместе с тем количественное описание в этом примере менее удовлетворительно из-за большого отклонения вычисленного значения R при рН 2,3, которое составляет –0,1.
Возможной причиной расхождения является смена механизма экстракции при низких значениях рН золя. Выше, при рассмотрении состава экстрагируемых форм, мы отмечали возможность образования сольватированных молекулами Д2ЭГФК частиц органозоля при большом относительном избытке экстрагента и низком рН. В настоящее время данных еще не достаточно для обоснованного суждения об этом новом механизме. Однако, полученные на рис. 4 результаты определенно полезны, поскольку служат постановке новой исследовательской задачи.
В заключении перечислим принятые при моделировании (и отмеченные выше) допущения, которые в дальнейшем следует проанализировать подробнее:
-
1) допущение о квазиравновесности и идеальности системы;
-
2) предположение о кооперативном механизме адсорбции экстрагента при образовании органозоля;
-
3) предположение о том, что экстрагируемой формой железа является коллоид, а интермицеллярные формы не экстрагируются;
-
4) предположение о том, что при коллоидно-химической экстракции аква- и органозоль являются одной дисперсной фазой;
-
5) предположение о том, что рН водной фазы экстракционной системы не отличается от рН исходного водного золя.
Последнее допущение особенно примечательно. Оно выполняется, несмотря на то, что в действительности водная фаза несколько закисляется по сравнению с исходным золем. Отсюда можно предположить, что при экстракции состояние частиц золя в водной фазе остается тем же самым, что и исходном золе.
Подводя итог, можно сказать, что предложенный в этой работе подход к количественному описанию коллоидно-химического механизма экстракции себя оправдывает, поскольку при этом удается построить содержательную физико-химическую модель процесса.
-
1. Голованов, В.И. Экстракция железа(III) из золя его гидроксида / В.И. Голованов, И.В. Иня-ев, Ю.А. Золотов // Докл. АН СССР. – 1989. – Т. 308, № 4. – С. 886–889.
-
2. Практикум по коллоидной химии и электронной микроскопии / под ред. С.С. Воюцкого. – М.: Химия, – 1971. – 224 с.
-
3. Baes, C.F. The extraction of iron (III) from asid perchorat solutions by di-(2-ethylhexyl)-phosphoric acide n-octen / C.F. Baes, H.T. Baker // J. Phys. Chem. – 1960. – Vol. 64, № 1. – Р. 89–94.
-
4. Экстракция коллоидного гидроксида железа / В.И. Голованов, Д.В. Волович, А.И. Голованов, И.В. Иняев // III Всерос. конф. по методам концентрирования в аналитической химии: тез. докл. – Черноголовка, 1990. – С. 42.
-
5. Голованов, В.И. Состав и обменная емкость коллоидного оксигидрата железа (III) при гидролизе и экстракции / В.И. Голованов, И.В. Иняев // Вестник ЮУрГУ. Серия «Химия». – В настоящем выпуске.
-
6. Основы жидкостной экстракции / под ред. Г.А. Ягодина. – М.: Химия, – 1981. – 400 с.
-
7. Шабанова, Н.А. Химия и технология нанодисперсных оксидов / Н.А. Шабанова, В.В. Попов, П.Д. Саркисов. – М.: ИКЦ «Академкнига», 2007. – 309 с.
-
8. Partridge, J.A. Purification of di(2-ethylhhexyl)phosphoric acid by precipitation of copper(II) di(2-ethylhhexyl)phosphate / J.A. Partridge, R.C. Jensen // J. Inorg. and Nucl. Chem. – 1969. – Vol. 31, № 8. – Р. 2587–2589.
-
9. Рублев, В.В. Потенциометрическое определение алкилфосфорных кислот методом титрования в неводных растворах / В.В. Рублев, Ю.А. Булатов //Журн. аналит. химии. – 1969. – Т. 24, № 7. – С. 1106–1108.
-
10. Хартли, Ф. Равновесия в растворах / Ф. Хартли, К. Бёргес, Р. Олкок. – М.: Мир, 1983. – 360 с.
-
11. Фомин, В.В. Химия экстракционных процессов / В.В. Фомин. – М.: Атомиздат, 1960. – 167 с.
-
12. Голованов, В.И. Экстракция ди-(2-этилгексил)фосфата меди как коллоидного ПАВ / В.И. Голованов, И.Н. Ишимова // Журн. неорган. химии. – 1987. – Т. 32, № 1. – С. 141–145.
-
13. Буянов, Р.А. Разработка теории кристаллизации малорастворимых гидроокисей металлов и научных основ приготовления катализаторов из веществ этого класса / Р.А. Буянов, О.П. Криворучко // Кинетика и катализ. – 1976. – Т. 17, № 3. – С. 765–775.
-
14. Кокотов, Ю.А. Равновесия и кинетика ионного обмена / Ю.А. Кокотов, В.А. Пасечник. – Л.: Химия, 1970. – 336 с.
-
15. Baes, C.F. The Hydrolysis of Cations / С.F. Baes, R.E. Mesmer. – N-Y.: J Wiley&Sons, 1960. – 489 р.
-
16. Дворкин, В.И. Метрология и обеспечение качества количественного химического анализа / В.И. Дворкин. – М.: Химия, 2001. – 263 с.
Список литературы Адсорбционный механизм экстракции коллоидного оксигидрата железа ди-(2-этилгексил)фосфорной кислотой
- Голованов, В.И. Экстракция железа(III) из золя его гидроксида/В.И. Голованов, И.В. Иняев, Ю.А. Золотов//Докл. АН СССР. -1989. -Т. 308, № 4. -С. 886-889.
- Практикум по коллоидной химии и электронной микроскопии/под ред. С.С. Воюцкого. -М.: Химия, -1971. -224 с.
- Baes, C.F. The extraction of iron (III) from asid perchorat solutions by di-(2-ethylhexyl)-phosphoric acide n-octen/C.F. Baes, H.T. Baker//J. Phys. Chem. -1960. -Vol. 64, № 1. -Р. 89-94.
- Экстракция коллоидного гидроксида железа/В.И. Голованов, Д.В. Волович, А.И. Голованов, И.В. Иняев//III Всерос. конф. по методам концентрирования в аналитической химии: тез. докл. -Черноголовка, 1990. -С. 42.
- Голованов, В.И. Состав и обменная емкость коллоидного оксигидрата железа (III) при гидролизе и экстракции/В.И. Голованов, И.В. Иняев//Вестник ЮУрГУ. Серия «Химия». -В настоящем выпуске.
- Основы жидкостной экстракции/под ред. Г.А. Ягодина. -М.: Химия, -1981. -400 с.
- Шабанова, Н.А. Химия и технология нанодисперсных оксидов/Н.А. Шабанова, В.В. Попов, П.Д. Саркисов. -М.: ИКЦ «Академкнига», 2007. -309 с.
- Partridge, J.A. Purification of di(2-ethylhhexyl)phosphoric acid by precipitation of copper(II) di(2-ethylhhexyl)phosphate/J.A. Partridge, R.C. Jensen//J. Inorg. and Nucl. Chem. -1969. -Vol. 31, № 8. -Р. 2587-2589.
- Рублев, В.В. Потенциометрическое определение алкилфосфорных кислот методом титрования в неводных растворах/В.В. Рублев, Ю.А. Булатов//Журн. аналит. химии. -1969. -Т. 24, № 7. -С. 1106-1108.
- Хартли, Ф. Равновесия в растворах/Ф. Хартли, К. Бёргес, Р. Олкок. -М.: Мир, 1983. -360 с.
- Фомин, В.В. Химия экстракционных процессов/В.В. Фомин. -М.: Атомиздат, 1960. -167 с.
- Голованов, В.И. Экстракция ди-(2-этилгексил)фосфата меди как коллоидного ПАВ/В.И. Голованов, И.Н. Ишимова//Журн. неорган. химии. -1987. -Т. 32, № 1. -С. 141-145.
- Буянов, Р.А. Разработка теории кристаллизации малорастворимых гидроокисей металлов и научных основ приготовления катализаторов из веществ этого класса/Р.А. Буянов, О.П. Криворучко//Кинетика и катализ. -1976. -Т. 17, № 3. -С. 765-775.
- Кокотов, Ю.А. Равновесия и кинетика ионного обмена/Ю.А. Кокотов, В.А. Пасечник. -Л.: Химия, 1970. -336 с.
- Baes, C.F. The Hydrolysis of Cations/С.F. Baes, R.E. Mesmer. -N-Y.: J Wiley&Sons, 1960. -489 р.
- Дворкин, В.И. Метрология и обеспечение качества количественного химического анализа/В.И. Дворкин. -М.: Химия, 2001. -263 с.


