Агглютинация латексных микросфер как метод функциональной оценки иммунореактивности и дифференциации терапией-индуцированных гуморальных ответов
Автор: Шанин Е., Брёкер Ф., Сизова М.В., Горбурнов Н.А., Супильников А.А., Лысова А.Н., Лысов Н.А.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 5 т.15, 2025 года.
Бесплатный доступ
Системная активация гуморального иммунитета наблюдается при злокачественных новообразованиях, аутоиммунных заболеваниях, инфекциях и во время беременности, однако её количественная оценка с помощью простых лабораторных методов остаётся затруднительной. Мы разработали быстрый и недорогой латекс-агглютинационный тест (ЛАТ) как антиген-независимый сенсор системной гуморальной активации. Метод основан на визуальной регистрации агглютинации непокрытых латексных микросфер диаметром 2 мкм сывороточными антителами и предоставляет полуколичественный титр (наибольшее разведение с видимой агглютинацией). Были исследованы сыворотки онкологических пациентов, беременных женщин и здоровых добровольцев. Непокрытые микросферы выявляли повышенную системную активность в отдельных группах: при раке молочной железы (n=11) у 73% пациентов сохранялись низкие титры (≤1:8), тогда как у 27% отмечался терапией-ассоциированный подъём до 1:64; у пациентов с HER2-позитивными опухолями фиксировались транзиторные или стойкие повышения на фоне таргетной терапии, а при лечении комбинацией ингибитора CDK4/6 и эндокринной терапии наблюдалось отсроченное нарастание. У беременных женщин регистрировались высокие титры (1:32–1:64), у здоровых добровольцев реакция отсутствовала. Эти данные указывают, что ЛАТ обеспечивая функциональную оценку степени «интенсивность иммунной активности» и позволяет отличать терапией-обусловленное усиление гуморального ответа, поддерживая использование теста как универсального серологического маркера, дополняющего антиген-специфические методы в клинической и исследовательской практике.
Латекс-агглютинационный тест [D007841], гуморальный иммунитет [D056724], аутоантитела [D001323], системная активация иммунитета [D007107], HER2-положительный рак молочной железы [D018719], Breast Neoplasms [D001943], ингибиторы контрольных точек [D000077594], аутоиммунитет [D001327], беременность [D011247], серологическая диагностика [D012698], иммунореактивность [D007159]
Короткий адрес: https://sciup.org/143185323
IDR: 143185323 | УДК: 616-097:616-078.33:577.27 | DOI: 10.20340/vmi-rvz.2025.5.CLIN.1
Текст научной статьи Агглютинация латексных микросфер как метод функциональной оценки иммунореактивности и дифференциации терапией-индуцированных гуморальных ответов
Актуальной задачей современной иммунологии является изучение аутоантител и их диагностической значимости как маркеров системной гуморальной активации и ранних признаков патологических процессов. Одним из наиболее простых и надёжных методов выявления антител и антигенов в клинических образцах является латекс-агглютинационный тест (ЛАТ), также известный как реакция латексной фиксации. Метод был предложен Сингером и Плотцем в 1950-х годах для обнаружения ревматоидного фактора у пациентов с ревматоидным артритом [1, 2]. Его принцип основан на способности микроскопических полистирольных частиц, покрытых определённым антигеном или антителом, образовывать видимые агрегаты при взаимодействии с комплементарными антителами или антигенами. С момента внедрения метод получил широкое распространение — от выявления микробных антигенов ( Haemophilus influenzae тип b, Salmonella enteritidis ) [3, 4] до диагностики аутоантител при аутоиммунных заболеваниях [5], — и до настоящего времени остаётся востребованным способом быстрой и экономичной серологической диагностики [6].
Аутоантитела — антитела, направленные против собственных антигенных структур организма — традиционно ассоциируются с аутоиммунными заболеваниями, однако нередко обнаруживаются и у он- кологических больных [7–9]. Они отражают реакцию иммунной системы на аутоантигены, специфичные для различных тканей и органов, и могут служить индикатором локальных патологических изменений. Известно, что у здоровых людей спектр и уровень аутоантител относительно стабильны, тогда как при опухолевом росте гуморальный аутоиммунный ответ активируется на ранних стадиях опухолевого процесса. Циркулирующие аутоантитела нередко выявляются за месяцы или даже годы до постановки клинического диагноза [10]. Ассоциированные с опухолью аутоантитела отражают иммунное распознавание опухолевых антигенов и рассматриваются как возможные биомаркеры для ранней диагностики злокачественных новообразований и прогнозирования течения болезни. Для этого активно исследуются антитела к белкам p53 или тепловым шоковым белкам (HSP, heat shock proteins) [9].
Высокие уровни аутоантител характерны также для классических аутоиммунных заболеваний — ревматоидного артрита (ревматоидный фактор), системной красной волчанки (антинуклеарные антитела) и др., – и служат важными диагностическими и прогностическими маркерами [11]. Повышенная продукция аутоантител отмечается и при некоторых физиологических и терапевтических состояниях, сопровождающихся перестройкой иммунной регуляции. Например, при терапии ингибиторами кон- трольных точек иммунного ответа активация T-лимфоцитов усиливает противоопухолевую защиту, но может вызывать иммуноопосредованные нежелательные явления (тиреоидит, колит и др.), а также образование de novo аутоантител [12, 13]. Аналогичные изменения описаны при применении HER2-таргетных антител (трастузумаб, пертузумаб) и ингибиторов CDK4/6 (палбоциклиб), способных вызывать ремоделирование лимфоцитарного пула и временный дисбаланс аутоиммунных реакций [14–20]. В отдельных случаях развитие паранеопла-стических синдромов (например, анти-Yo-ассоциированной дегенерации мозжечка при раке молочной железы <2 %) демонстрирует как чрезмерный противоопухолевый иммунный ответ может повреждать собственные ткани организма [21].
Физиологическим примером регулируемой иммунной активации служит беременность, при которой поддерживается баланс между толерантностью к по-луаллогенному плоду и сохранением иммунной защиты матери. Несмотря на преимущественно защитный характер таких изменений, в этот период возможна транзиторная выработка аутоантител и изменения активности B-лимфоцитов [22–25]. Умеренная гуморальная активация при беременности носит адаптационный характер, однако чрезмерное или персистирующее увеличение аутоантител связано с риском неблагоприятных исходов — потери беременности, преэклампсии и поражения плода [26, 27].
Несмотря на значительный прогресс в изучении аутоиммунных состояний и иммунотерапии, простые и доступные методы количественной оценки общей гуморальной активности остаются ограниченными. Существующие тесты выявляют отдельные аутоантитела к конкретным антигенам [28, 29] или требуют сложных аналитических платформ [30, 31].
Целью настоящего исследования являлась разработка и апробация латекс-агглютинационного теста, способного служить универсальным индикатором системной гуморальной активации, основанного на регистрации опосредованной антителами агглютинации непокрытых латексных микросфер, а также оценка возможности его применения для анализа иммунного статуса пациентов с различными заболеваниями и физиологическими состояниями.
Материалы и методы
Получение тканевых антигенов
Белковые экстракты тканей получали двумя различными методами механической гомогенизации — метод 1 и метод 2. Метод 1: механическая гомогенизация (референтный протокол), основан на процедуре, описанной в международном патенте WO2012053928A1. Небольшие фрагменты свежих или размороженных тканей (5–10 г) гомогенизирова- ли в физиологическом растворе 0,9 % NaCl (B. Braun, Германия; pH 7,4) с помощью механической обработки ткани при помощи замораживания (3 цикла) и перетиранием песком до полного разрушения тканевых структур и освобождения внутриклеточного материала. Полученный гомогенат центрифугировали при 10 000 g в течение 60 минут при температуре 4–10°С. В дальнейшем отбирали только супернатант, представляющий собой растворимую фракцию белков. Полученный экстракт антигена хранили при -20°С до использования для покрытия латексных микросфер или дальнейшего анализа. Метод 2: комбинированная механическая и ультразвуковая обработка (модифицированный протокол). В данном варианте гомогенизацию дополняли ультразвуковым воздействием для более полного разрушения клеток. Образцы ткани (8–10 г) гомогенизировали в физиологическом растворе 0,9 % NaCl до конечного объёма 10–15 мл при помощи гомогенизатора в течение 4–5 минут. Полученный гомогенат разбавляли 1:1 физиологическим раствором и подвергали обработки ультразвуком в пробирках 50 мл с использованием зондового ультразвукового дезинтегратора (диаметр зонда 8 мм; режим 10 сек работы и 20 сек паузы; общая продолжительность 15 мин; мощность 20 %). Во время обработки образцы размещали на льду для предотвращения перегрева. После гомогенат центрифугировали при 12 000 g в течение 30 минут при 10–12 °С. Полученный супернатант аккуратно отделяли от осадка и распределяли по аликвотам по 1–2 мл, которые хранили при –20°С. В обоих методах для дальнейшего покрытия латексных микросфер и биохимических исследований использовали исключительно супернатантные фракции.
Подготовка реагентов «латексные микросферы–антиген»
В качестве частиц для агглютинации использовали полистирольные латексные микросферы (диаметр 2 мкм; 50 мг/мл, Alpha Nanotech Inc, Канада). Для получения реагентов из микросфер с тканевыми антигенами была протестирована пассивная адсорбция полученных экстрактов тканей человека на поверхность латекса. Образцы тканей (кожа, лёгкое, матка и молочная железа) получали из операционного материала и от посмертных доноров с разрешения локального этического комитета. Полученные супернатанты использовали как антигенные экстракты. Латексные микросферы инкубировали с каждым экстрактом в физиологическом растворе при комнатной температуре в течение 1 часа при мягком перемешивании, затем центрифугировали и отмывали (3 раза) для удаления несвязанных белков. Покрытые частицы ресуспендировали в физиологическом растворе, содержащем 0,05 % формальдегида в качестве консерванта, и хранили при
4 °С до использования. Консистентную адсорбцию показали только антигены кожного происхождения, формируя стабильную суспензию, пригодную для агглютинационного тестирования; экстракты из лёгкого, матки и молочной железы демонстрировали минимальное связывание.
Латекс-агглютинационный тест и определение титра
ЛАТ проводили в 96-луночных микропланшетах с U-образным дном. Образец сыворотки каждого пациента последовательно разводили в два раза физиологическим раствором (0,9% NaCl) с 1:1 000 000 Твин-20 по ряду лунок (например, 1:2, 1:4, 1:8, 1:16 и т.д.). Объём реакции в каждой лунке составлял 25 мкл: 12,5 мкл разведённой сыворотки и 12,5 мкл суспензии латексных микросфер в разведении от 1:7 до 1:40 (покрытых кожным антигеном или «без антигена» — непокрытых). Планшет инкубировали при комнатной температуре не менее 2 часов, позволяя микросферам осесть и произойти процессу агглютинации в случае наличия антител. По завершении инкубации лунки оценивали визуально. Тест был рассмотрен положительным на агглютинацию если идентифицировалось образование диффузного мата/ неправильной сетчатой структуры из микросфер, покрывающей дно лунки. Отрицательная реакция давала компактный осадок («точку») из осевших частиц. Конечный титр определяли как наибольшее разведение сыворотки крови, при котором агглютинация ещё визуально фиксируется. Более высокий конечный титр соответствовал более выраженной гуморальной реактивности образца. В качестве отрицательных контролей использовали лунки с одним физиологическим раствором или сыворотки здоровых доноров, не дававшие (или дававшие минимальную, а именно до 1:8) агглютинацию. Для интерпретации данных конечные титры конвертировали в полуколичественный индекс активации иммунитета (ИАИ) по «логарифмической лестнице»: отсутствие агглютинации = 0; 1:2 = 2; 1:4 = 4; 1:8 = 8; 1:16 = 16; 1:32 = 32; 1:64 = 64 и т.д. Практически титры < 1:8 определяли как низкие (фоновый или минимально повышенный уровень), а титры >1:16 — как завышенные, указывающие на выраженную системную гуморальную активацию.
Образцы пациентов и группы
Сыворотки крови собирали и тестировали из нескольких групп: (i) онкологические пациенты — включая лиц с иммунологически активными («горячими») опухолями, такими как рак молочной железы с лимфоцитарной инфильтрацией (С50.4) и (ii) «холодными» — злокачественным новообразованием верхних дыхательных путей (C34.1); (iii) беременные женщины как физиологическое состояние иммунной модуляции организма. Дополнительно в качестве исход- ных контролей привлекали здоровых добровольцев. Все образцы получали с одобрения этического комитета, анонимизировали и обрабатывали по стандартным рекомендациям для серологических исследований, включая получение письменного информированного согласия (по применимости). Для лонгитюдной когорты по раку молочной железы, ретроспективно проанализировали сыворотки M1 и М5 пациенток с инвазивной карциномой молочной железы (C50.4) и злокачественным новообразованием верхних дыхательных путей (C34.1). Сыворотки хранили при –80°С до анализа. Для корреляции с титрами аутоантител и терапевтическими иммунными изменениями регистрировали соответствующие клинико-патологические данные (возраст, подтип опухоли, стадия, режим лечения и исход).
Результаты
Оценка эффективности адсорбции тканевых антигенов на поверхности латексных микросфер Первоначальные эксперименты были проведены с целью получения органоспецифических латексных реагентов путём пассивной адсорбции белковых экстрактов тканей человека на полистирольные микросферы диаметром 2 мкм. Эффективность адсорбции существенно различалась в зависимости от типа ткани. Наиболее выраженную и стабильную адсорбцию продемонстрировали антигены кожного происхождения. Латексные микросферы, инкубированные с кожными экстрактами, полученными из свежих операционных материалов, характеризовались отчётливо определяемым связыванием белка и сохраняли стабильность суспензии в течение двух лет хранения при стандартных лабораторных условиях.
В противоположность результату с кожным экстрактом, микросферы, инкубированные с экстрактами лёгочной, маточной или ткани молочной железы, а также с кровью, сывороткой или раствором бычьего сывороточного альбумина (БСА), демонстрировали минимальную адсорбцию белка: после отмывок большая его часть оставалась в супернатанте. Полученные данные подтверждают, что эффективность пассивной адсорбции в значительной степени определяется физико-химическими свойствами белка, как указано ранее [32]. Кожные экстракты, богатые структурными и гидрофобными белками (коллагенами, кератинами), более эффективно взаимодействуют с гидрофобной поверхностью полистирола, тогда как белки иных типов тканей обладают низким сродством к поверхности микросфер [33].
Как показано на рисунке 1, функциональные профили титров агглютинации отражали выявленные различия в адсорбционной способности различных белковых экстрактов.
Ряд разведений сыворотки крови
^ х^х^хА^ ^ х^х^х^х^ х^ ^^^^^ х^х^х^х^ х^ х^х^Л^ х^ х^х^х^х^ х^ х^х^х^х^
К^Щ
М4 |Ь'О'ОО1]
М5| - р -. -]
Непокрытые микросферы
+ БСА
+ Кровь
, , f ГЕШ
^^ffl i
+ Сыворотка + Молчная
+ Лёгкие + Кожа
крови
железа
Рисунок 1. Латекс-агглютинационный тест: сравнение сывороток пациентки с раком молочной железы (МКБ-10 C50.4) и здорового донора (К) с использованием латексных микросфер, предварительно инкубированных с различными тканевыми антигенами, БСА, кровью, сывороткой либо оставленных непокрытыми. Тканевые антигены были подготовлены двумя методами экстракции (1 и 2; см. раздел «Материалы и методы» ). Лунки с конечными титрами (наибольшее разведение, при котором наблюдалась видимая агглютинация) выделены красным. Только кожный антиген эффективно связывался с латексом, что приводило к более низкому титру агглютинации для сыворотки пациентки с раком (1:8 против 1:32). Сокращения: АГ — антиген; БСА — бычий сывороточный альбумин
Figure 1. Latex agglutination test: comparison of sera from a breast cancer patient (ICD-10 C50.4) and a healthy donor (C) using latex microspheres pre-incubated with various tissue antigens, BSA, blood, serum, or left uncoated. Tissue antigens were prepared by two extraction methods (1 and 2; see Materials and Methods section). Wells with endpoint titers (highest dilution at which visible agglutination was observed) are highlighted in red. Only skin antigen efficiently bound to latex, resulting in a lower agglutination titer for the breast cancer patient serum (1:8 versus 1:32). Abbreviations: Ag — antigen; BSA — bovine serum albumin
Сыворотка пациентки с раком молочной железы (МКБ-10 C50.4) демонстрировала одинаковые конечные титры агглютинации (1:32) при использовании микросфер без антигенного покрытия, а также микросфер, предварительно инкубированных с большинством тканевых экстрактов, сывороткой крови или раствором БСА. В то же время, микросферы, покрытые кожным антигеном, обеспечивали более низкий титр агглютинации (1:8), что позволяет предположить частичное экранирование реакционно-способных участков поверхности латекса за счёт нанесённого слоя кожного антигена и, как следствие, формирование специфического, зависящего от кожного антигена, взаимодействия.
Сыворотка здорового донора характеризовалась низким фоновым уровнем реактивности (1:4) для всех типов микросфер, включая частицы, покрытые кожным антигеном. Сравнение двух методов экстракции белков (см. раздел «Материалы и методы» ) не выявило достоверных различий в уровнях наблюдаемых титров. Таким образом, стабильный латексный реагент с кожным покрытием был успешно получен, тогда как покрытия микросфер экстрактами других тканей оказались неэффективными при пассивной адсорбции в исследованных условиях.
ЛАТ с кожным антигеном как модель выявления аутоиммунной активности при дерматологических заболеваниях
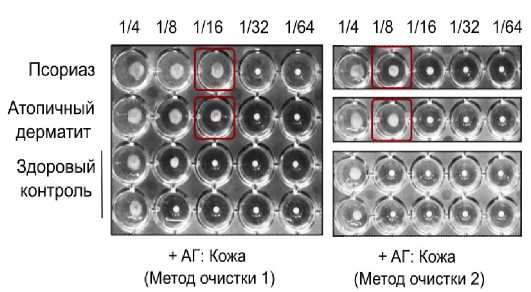
Для оценки способности разработанного теста выявлять ассоциированные с патологией аутоантитела были исследованы сыворотки пациентов с псориазом и атопическим дерматитом с использо- ванием латексных микросфер, покрытых антигенами человеческой кожи, полученными двумя различными методами экстракции. Предполагалось, что повышенная аутоиммунная активность при указанных заболеваниях приведёт к более высоким титрам агглютинации по сравнению с сыворотками здоровых доноров [34–36].
Как показано на рисунке 2, у обоих пациентов титры агглютинации значительно превышали показатели сыворотки здорового контроля, что подтверждает наличие реактивных аутоантител к коже человека. Метод 1 обеспечивал стабильно более высокие титры по сравнению с методом 2, что свидетельствует о лучшем сохранении антигенных эпитопов при его применении. Сыворотки здоровых контролей демонстрировали минимальную агглютинацию (≤ 1:4), тогда как у пациентов с аутоиммунными дерматозами титры достигали 1:16. Эти результаты подтверждают способность теста надёжно отражать различия в уровне аутоиммунной активности и подчёркивают его зависимость от качества подготовки антигенного материала.
Оптимизация латекс-агглютинационного теста
Опираясь на полученные результаты, на следующем этапе было проведено исследование возможности возникновения агглютинации, зависящей от аутоиммунного статуса, без покрытия антигеном, с использованием латексных микросфер. С целью повышения чувствительности и воспроизводимости латекс-агглютинационного теста изучено влияние концентрации микросфер на одну лунку при применении непокрытых полистирольных микросфер диаметром 2 мкм.

РисунокЗ. Ряд разведений латексных микросфер в сыворотке крови здорового донора (слева) и пациентки с раком молочной железы (МКБ-10 C50.4), сопровождающимся аутоиммунной реакцией (справа), для оценки влияния соотношения «антитела сыворотки/количество микросфер»
Figure 3. Dilution series of latex microspheres in serum from a healthy donor (left) and a breast cancer patient (ICD-10 C50.4) with accompanying autoimmune reaction (right), to assess the effect of the "serum antibodies/microsphere number" ratio
Рисунок 2. Латекс-агглютинационный тест с микросферами, покрытыми антигеном ткани человеческой кожи, выделенным методами 1 и 2. Представлено сравнение сывороток крови пациентов с хроническими аутоиммунными кожными заболеваниями — псориазом и атопическим дерматитом — с образцами здоровых доноров. Метод 1 обеспечивал более полное сохранение антигенной структуры, что подтверждается более высоким титром антител к кожному антигену, выделенному данным методом, по сравнению с методом 2
Figure 2. Latex agglutination test with microspheres coated with human skin tissue antigen extracted by methods 1 and 2. A comparison is presented of blood sera from patients with chronic autoimmune skin diseases — psoriasis and atopic dermatitis — with samples from healthy donors. Method 1 provided more complete preservation of antigenic structure, which is confirmed by a higher titer of antibodies to skin antigen extracted by this method compared to method 2
В качестве референсной сыворотки для подбора условий, обеспечивающих максимальную выраженность видимой агглютинации при минимальном уровне неспецифического фона, использовалась сыворотка пациентки с раком молочной железы (МКБ-10 C50.4) с высоким титром антител. Были протестированы различные разведения исходной суспензии микросфер (от 7-кратного до 40-кратного). Оптимальные показатели читаемости и различимости между положительными и отрицательными реакциями достигались при 15-кратном разведении (1:15). При этих условиях наблюдалась чётко выраженная агглютинация на ожидаемых титрах при минимальном неспецифическом слипании (рис. 3). Указанные параметры использовались во всех последующих экспериментах.
Тест показал, что даже без покрытия антигеном сыворотки с повышенным содержанием антител — например, у онкологических пациентов при активном вовлечении иммунной системы — формируются отчётливые, зависящие от концентрации аутоантител картины агглютинации.
ЛАТ-анализ сывороток крови пациенток с раком молочной железы
Используя оптимизированные условия теста, была проведена оценка возможности возникновения агглютинации без покрытия антигеном в более широком клиническом контексте. Для этого были про- анализированы сыворотки 11 пациенток с раком молочной железы (C50.4), представляющих различные молекулярные подтипы и схемы терапии (см. приложение, дополнительную таблицу S1 и дополнительные данные). Проведённый анализ позволил определить, может ли терапией-индуцированная или заболеванием-обусловленная иммунная активация выявляться посредством неспецифической агглютинации при отсутствии антигенов на поверхности микросфер.
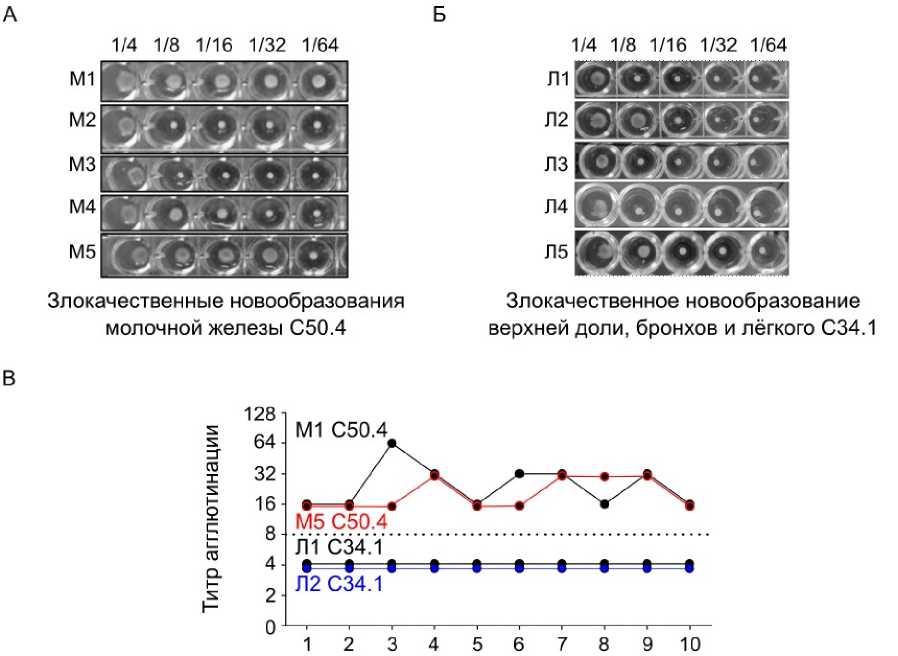
ЛАТ-тест выявил различные типы системной гуморальной активности. У пациенток 1, М3, М4, 5–7, 9 и 10 на протяжении лечения и наблюдения сохранялись низкие титры (≤ 1:8), что свидетельствует об ограниченной системной активации иммунитета. В этих случаях эффективные локальные или цитотоксические вмешательства, такие как HER2-направленная терапия (трастузумаб/ пертузумаб) или дозоинтенсивная (dose-dense) химиотерапия, вероятно, концентрировали иммунные реакции в микроокружении опухоли или подавляли системное образование антител [15, 37, 38].
Напротив, у двух пациенток отмечались повышенные титры (≥1:16) в определённых клинических ситуациях: у пациентки М1 наблюдался транзитор-ный подъём во время адъювантного лечения трастузумабом; у пациентки М5 — стойко высокие титры (1:16–1:64) в период неоадъювантной и адъювантной HER2-направленной терапии (рис. 4A). Сыво- ротка пациентки М5 (рис. 4В), у которой диагностирована HER2-положительная, гормон-рецептор-негативная (HR–) карцинома, имела признаки иммунологически «горячей» опухоли: высокий пролиферативный индекс (Ki-67 = 70 %), гиперэкспрессия HER2 и выраженная системная активация иммунитета. HER2-положительные/HR– опухоли относятся к наиболее иммуногенным подтипам: для них характерно наличие большого количества опухоль-инфильтрирующих лимфоцитов, экспрессия молекул контрольных точек иммунного ответа и выраженные ответы на антитело-опосредованные виды терапии [39]. Таким образом, стойкие и высокие титры у данной пациентки, вероятно, отражают присущую HER2-положительным опухолям иммуногенность и иммуномодулирующее действие трастузу- маба и пертузумаба, реализующих антителозависимую клеточную цитотоксичность (ADCC) [14, 15]. В то же время ингибиторы CDK4/6 могут индуцировать отсроченную перестройку иммунной системы и частичную утрату толерантности [18–20]. Напротив, индуцированная химиотерапией иммуносупрессия, вероятно, объясняет отсутствие системной гуморальной активации у большинства пациенток [38]. В совокупности эти данные указывают, что высокие титры ЛАТ отражают преимущественно терапией-ассоциированное усиление иммунного ответа, а не генерализованный аутоиммунитет. Для сравнения, сыворотки пациента с иммунологически «холодными» опухолями лёгкого (C34.1) не демонстрировали повышения титров ЛАТ в курсе лечения (рис. 4Б).
Время (в месяцах)
Рисунок 4. ЛАТ-анализ сывороток пациентов с раком молочной железы. (А) Ряд разведений сыворотки крови пациенток М1-5 с диагнозом рак молочной железы (C50.4) от 1:4 до 1:64 в присутствии латексных микросфер; повышение титров выше 1:8 соответствует аутоиммунной реакции. (Б) Для сравнения показана сыворотка крови пациента с иммунологически «холодной» опухолью (C34.1) без повышения титров ЛАТ. (В) Динамика иммунного профиля пациентов с HER2-положительной, гормон-рецептор-негативной (HR–) карциномой (М1, М5) и злокачественным новообразованием верхней доли, бронхов и лёгкого (Л1, Л2) в течение 10 месяцев противоопухолевого лечения
Figure 4. LAT analysis of sera from breast cancer patients. (A) Dilution series of blood sera from patients M1–5 with breast cancer diagnosis (C50.4) from 1:4 to 1:64 in the presence of latex microspheres; titer elevation above 1:8 corresponds to an autoimmune reaction. (B) For comparison, shown is blood serum from a patient with an immunologically "cold" tumor (C34.1) without LAT titer elevation. (C) Dynamics of immune profile in patients with HER2-positive, hormone receptor-negative (HR–) carcinoma (M1, M5) and malignant neoplasm of the upper lobe, bronchus and lung (L1, L2) over 10 months of anticancer treatment
Системная гуморальная активация во время беременности
Для расширения анализа за пределы патологических состояний, ЛАТ анализ был применён к исследованию сывороток беременных женщин. В отличие от когортов пациентов с онкологической патологией и инфекционными заболеваниями, беременность стабильно ассоциировалась с повышенными титрами агглютинации, нередко достигающими 1:32–1:64 (рис. 5А и 5Б, см. приложение, дополнительную таблицу S2), что свидетельствует о выраженной системной гуморальной активации иммунитета.
Полученные результаты согласуются с современными представлениями о беременности как об иммунологически динамическом состоянии, характеризующемся не глобальной иммуносупрессией, а модуляцией иммунного ответа и транзиторным усилением аутореактивности в отдельных иммунных компартментах [40, 41]. Ранее в ряде исследований было показано временное повышение уровней аутоантител, включая антифосфолипидные и анти- тиреоидные антитела, в период физиологической беременности. Такие изменения, как правило, носят обратимый характер и рассматриваются как компонент нормальной иммунной адаптации [42–44].
Вместе с тем избыточная или персистирующая аутоиммунная активация может приводить к неблагоприятным исходам беременности, включая самопроизвольные выкидыши, преэклампсию и задержку внутриутробного роста плода [45–47]. В этой связи выявленные в настоящем исследовании высокие титры ЛАТ могут отражать физиологическое усиление гуморального звена иммунитета, направленное на поддержание толерантности к плоду. Однако при нарушении регуляторного баланса подобная сенсибилизация способна способствовать развитию гестационных осложнений.
Таким образом, ЛАТ фиксирует физиологическое повышение продукции антител и аутореактивности при беременности, позволяя отличить сбалансированную иммунную адаптацию от патологической аутоиммунной активации, связанной с утратой толерантности.
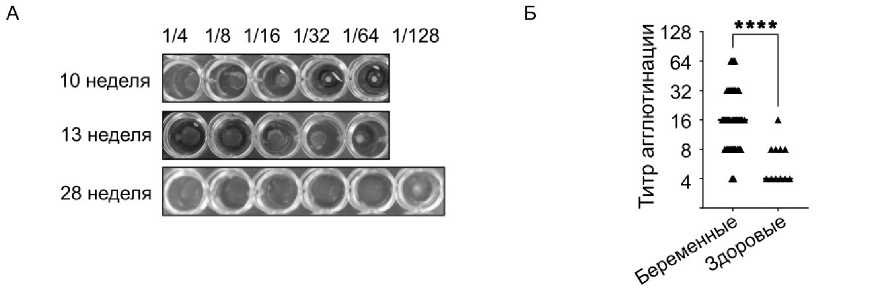
Рисунок 5. Латекс-агглютинационный тест для определения иммунной активности у беременных женщин. (А) Представлен пример реакций агглютинации латексных микросфер с сыворотками крови беременной пациентки P19, демонстрирующие повышенные титры (1:16–1:64) в течение 10, 13, 28 недели беременности по сравнению с (Б) здоровыми и небеременными женщинами, что отражает физиологическую системную активацию гуморального иммунитета в период беременности (лонгнормальный двусторонний непарный t-тест, **** = Р < 0.0001)
Figure 5. Latex agglutination test in pregnant women. (A) An example of serum agglutination reactions of patient P19 is presented, demonstrating elevated titers (1:16–1:64) compared to (B) control samples, reflecting physiological systemic activation of humoral immunity during pregnancy (log-normal two-tailed unpaired t-test, **** = P < 0.0001)
Обсуждение
Общий обзор и основные результаты
В настоящем исследовании представлен упрощённый вариант латекс-агглютинационного теста как инструмента для мониторинга системной активации гуморального иммунитета при физиологических (беременность) и патологических (онкологических) состояниях. Тест основан на определении опосредованной антителами агглютинации непокрытых латексных микросфер, что позволяет получать широкий, не зависящий от нанесённого на микросферы антигенного состава показатель активности циркулирующих аутоантител.
ЛАТ обеспечивал выявление иммунных реакций, специфичных для заболевания или проводимой терапии. Так, в когорте пациенток с раком молочной железы (C50.4) у большинства наблюдались низкие титры, соответствующие ограниченной системной активации гуморального звена иммунитета. В то же время, у подгруппы пациенток с HER2-положительными высокопролиферативными опухолями или на фоне терапии, вызывающей иммунную перестройку, регистрировались транзиторные, либо стойкие высокие титры, отражающие усиление иммунного ответа вследствие противоопухолевого лечения.
Беременность характеризовалась наивысшими значениями (1:32–1:64), что согласуется с литературными данными о беременности как о состоянии регулируемого аутоиммунитета и усиленной продукции антител [50–54]. Совокупность полученных результатов подтверждает, что ЛАТ является быстрым, воспроизводимым и экономичным методом для оценки системной гуморальной активации при физиологических (беременность) и патологических (онкологических) состояниях.
ЛАТ как суррогатный маркер системной гуморальной активации
ЛАТ измеряет совокупную антителоопосредованную реактивность посредством визуальной регистрации агрегирования латексных микросфер и, тем самым, обеспечивает не зависящую от антигена оценку активности гуморального иммунитета. В отличие от традиционных серологических анализов, направленных на выявление антител к определённым эпитопам, ЛАТ отражает общую концентрацию и функциональную авидность циркулирующих иммуноглобулинов, а также наличие иммунных комплексов и полиреактивных антител.
Данный принцип сопоставим с классическими тестами латексной фиксации, показавшими, что гипер-гаммаглобулинемия, ревматоидный фактор и иммунные комплексы способны вызывать неспецифическую агглютинацию за счёт Fc-опосредованного «сшивания» микросфер [1–6, 48]. В настоящем исследовании «непокрытые» микросферы легко агглютинировали в сыворотках лиц с высоким уровнем антител — например, у пациентов, получавших HER2-направленную терапию или ингибиторы контрольных точек, — что подтверждает: тест отражает системную гуморальную активацию, а не антигенную специфичность.
Усиление гуморального иммунитета, связанное с терапией при раке
В когорте больных раком молочной железы ЛАТ позволил разделить пациенток с низкими титрами (≤1:8) и с терапией-ассоциированной иммунной активацией (≥1:16). У большинства получавших химио-или эндокринную терапию титры оставались низкими, что согласуется с иммуносупрессивным или локально ограниченным действием данных методов лечения [38].
У трёх пациенток были зарегистрированы тран-зиторные либо устойчивые высокие титры, связанные с определёнными терапевтическими режимами. HER2-направленная терапия (трастузумаб ± пер-тузумаб) вызывала кратковременное повышение титров, что, вероятно, связано с механизмом антителозависимой клеточной цитотоксичности (ADCC) и временным расширением спектра аутоантител, ранее описанным при блокаде HER2 [14, 15]. Стойко высокий титр у молодой пациентки с высокопролиферативной HER2+/HR– опухолью соответствовал иммунологически «горячему» фенотипу опухоли, обогащённому опухоль-инфильтрирующими лимфоцитами, что согласуется с известными характеристиками HER2-положительных новообразований [39]. У другой пациентки, длительно получавшей терапию ингибиторами CDK4/6 в сочетании с эндокринной терапией, отмечено отсроченное повышение титров, что согласуется с данными о способности ингибиторов CDK4/6 моделировать иммунный ответ и в некоторых случаях провоцировать аутоиммунные реакции [19].
Таким образом, полученные данные свидетельствуют о том, что ЛАТ фиксирует преимущественно терапией-индуцированное усиление гуморального иммунного ответа, а не спонтанный аутоиммунитет при раке молочной железы.
Беременность: физиологическая аутоиммунная активация и повышенные титры ЛАТ
В отличие от патологических заболеваний, сыворотки беременных женщин демонстрировали равномерно высокие титры ЛАТ (1:32–1:64), что указывает на выраженную, но физиологическую форму системной гуморальной активации. В настоящее время беременность рассматривается как состояние иммунной адаптации, характеризующееся селективным усилением активности В-клеток, ремоделированием цитокинового профиля и транзитор-ной аутореактивностью, способствующей поддержанию иммунологической толерантности к плоду [40, 43].
Многочисленные исследования показывают временные повышения аутоантител — антинуклеарных, антифосфолипидных, антитиреоидных — при нормальной беременности, обычно исчезающие после родов [22, 42–44]. При этом чрезмерная или стойкая аутоиммунная активация может способствовать развитию осложнений, включая выкидыш, преэклампсию и неонатальные аутоантительные синдромы [45–47]. Наблюдаемые высокие титры ЛАТ, вероятно, отражают физиологическое усиление гуморального ответа, фиксируя сбалансированную иммунную сенсибилизацию, отличающую нормальную адаптацию от патологического аутоиммунитета при утрате толерантности.
Практическое значение и перспективы
Совокупность полученных данных позволяет рассматривать ЛАТ как простой, информативный и доступный инструмент для оценки системной гуморальной активации при физиологических (беременность) и патологических (онкологических) состояниях. Простота, воспроизводимость и низкие требования к реагентам делают метод удобным для про- дольного мониторинга иммунного статуса в клинических и научных целях.
В дальнейшем целесообразно исследовать количественные взаимосвязи между титрами ЛАТ и уровнями антиген-специфических аутоантител, ци-токиновыми профилями и фенотипами иммунных клеток для уточнения биологических механизмов повышенных титров. Расширенные когорты пациентов позволят определить, коррелируют ли тенденции ЛАТ с эффективностью терапии, или исходами беременности.
Таким образом, ЛАТ может стать дополнением к существующим иммунологическим и мультиплексным платформам как быстрый, низкозатратный серологический индекс «иммунной атаки», объединяющий классические методы серологического анализа с современными подходами к иммуномониторингу.
Выводы
В результате проведённого исследования установлено, что латекс-агглютинационный тест может служить универсальным и экономичным инструментом для оценки системной гуморальной активации как при физиологических, так и при патологических состояниях. Повышенные титры ЛАТ были зафиксированы при блокаде контрольных точек иммунного ответа, в ходе HER2-направленной терапии и во время беременности — состояниях, отражающих различные, но измеряемые формы усиленной гуморальной реактивности. Полученные данные позволяют рассматривать ЛАТ как простой, воспроизводимый и масштабируемый метод, дополняющий антиген-специфические иммунологические анализы и пригодный для мониторинга иммунной динамики в онкологии и репродуктивной медицине.
Обеспечивая функциональную оценку степени «интенсивность иммунной активности», ЛАТ занимает промежуточное положение между классическими серологическими тестами и современными технологиями иммунопрофилирования, открывая перспективы для клинического иммунного мониторинга, персонализированной терапии и раннего выявления нарушений регуляции иммунного ответа.
ПРИЛОЖЕНИЕAPPLICATION
Дополнительная таблица S1. Сводная характеристика когорты пациенток с раком молочной железы , проанализированных продольно во время или после лечения с целью оценки аутоиммунных титров методом латекс-агглютинационного теста с «непокрытым» латексом. BRCA1, ген предрасположенности к раку молочной железы 1 ( Breast Cancer Gene 1 ; BRCA1⁺, наличие патогенных мутаций в этом гене-супрессоре опухолевого роста); CT, компьютерная томография ( Computed Tomography ); HER2, рецептор эпидермального фактора роста человека 2 ( Human Epidermal Growth Factor Receptor 2 ; HER2⁺, гиперэкспрессия или амплификация гена HER2 в ткани опухоли); HR, гормональные рецепторы ( Hormone Receptor ; HR⁺, положительная экспрессия эстрогеновых и/или прогестероновых рецепторов); Ki-67, ядерный маркёр пролиферации, характеризующий пролиферативную активность опухоли (процент указывает долю клеток, экспрессирующих Ki-67); RCB, остаточная опухолевая нагрузка ( Residual Cancer Burden ); SERD, селективный деградатор рецептора эстрогена ( Selective Estrogen Receptor Degrader ); TNBC, тройной негативный рак молочной железы ( Triple-Negative Breast Cancer ; отсутствие экспрессии рецепторов эстрогена, прогестерона и HER2)
Supplementary Table S1. Summary characteristics of the breast cancer patient cohort analyzed longitudinally during or after treatment for assessment of autoimmune titers by latex agglutination test with "uncoated" latex. BRCA1, Breast Cancer Gene 1 (BRCA1 ⁺, presence of pathogenic mutations in this tumor suppressor gene); CT, Computed Tomography; HER2, Human Epidermal Growth Factor Receptor 2 (HER2⁺, overexpression or amplification of the HER2 gene in tumor tissue); HR, Hormone Receptor (HR⁺, positive expression of estrogen and/or progesterone receptors); Ki-67, nuclear proliferation marker characterizing tumor proliferative activity (percentage indicates the proportion of cells expressing Ki-67); RCB, Residual Cancer Burden; SERD, Selective Estrogen Receptor Degrader; TNBC, Triple-Negative Breast Cancer (absence of estrogen receptor, progesterone receptor, and HER2 expression)
|
Пациент № |
Подтип опухоли и ключевые параметры |
Схема лечения |
Исход |
Титры ауто-антител (даты и значения) |
Характер динамики |
|
1 |
HER2⁺, HR⁻, Ki-67 = 70 % |
Неоадъювантная терапия трастузумабом + перту-зумабом в комбинации с доцетакселом и карбо-платином до мастэктомии (окт 2023 – фев 2024); мастэктомия — апр 2024 (RCB 0); адъювантная терапия трастузумабом (10 циклов, май – ноя 2024) |
Полный ответ (RCB 0) |
Дек 2023 – дек 2024: все 1:4 |
Стабильно низкий |
|
2 = М1 |
HER2⁺, HR⁺, Ki-67 = 60 % |
Неоадъювантная терапия (доксорубицин + циклофосфамид → паклитаксел + трастузумаб); мастэктомия — окт 2023 (RCB 0); адъювантная терапия трастузумабом (18 циклов, завершена сент 2024) |
Полный ответ (RCB0) |
Дек 2023: 1:16; фев 2024: 1:16; июн 2024: 1:16 |
Временное повышение |
|
3 = М2 |
HER2⁺, HR⁺, Ki-67 = 40 % |
Неоадъювантная химиотерапия → мастэктомия янв 2024 (RCB II); адъювантная терапия — трастузумаб (11 циклов) + лучевая (март – окт 2024) |
Частичный ответ (RCB II) |
Июн 2024: 1:4; июл 2024: 1:4 |
Стабильно низкий |
|
Пациент № |
Подтип опухоли и ключевые параметры |
Схема лечения |
Исход |
Титры ауто-антител (даты и значения) |
Характер динамики |
|
4 = М3 |
HER2⁺, HR⁻, Ki-67 = 70 % |
Неоадъювантная терапия (трастузумаб + пертузу-маб + доцетаксел + карбоплатин, 6 циклов, июн – окт 2023); мастэктомия ноя 2023 (RCB 0); адъювантная HER2-терапия (10 циклов, янв – июл 2024) |
Полный ответ (RCB0) |
Янв 2024: 0; фев – авг 2024: 1:4 |
Стабильно низкий |
|
5 |
Тройной негативный рак (TNBC), BRCA1⁺, Ki-67 = 65 % |
Мастэктомия май 2024; адъювантная химиотерапия: дозоинтенсивный доксорубицин + циклофосфамид (4 цикла, июн – авг 2024) → еженедельный паклитаксел (12 циклов, авг – ноя 2024) |
Без признаков заболевания |
Июл – окт 2024: 1:8; ноя 2024: 1:4 |
Стабильно низкий |
|
6 |
HR⁺, HER2⁻, метастатический рак |
Системная терапия с 2021 г.: гозерелин + палбо-циклиб + ингибитор ароматазы + бисфосфонаты; стабильное состояние по КТ (окт 2023) |
Стабильные костные метастазы |
Июн 2024 – янв 2025: 1:4; март – апр 2025: 1:8 |
Стабильно низкий |
|
7 |
HR⁺, HER2⁻, метастатический рак |
Летрозол + палбоциклиб (2021 – ноя 2024); прогрессирование (печень) — ноя 2024 |
Прогрессирование 2024 |
Авг 2024: 1:8; дек 2024: 1:8 |
Стабильно низкий |
|
8 = М4 |
HR⁺, HER2⁻, метастатический рак |
Палбоциклиб + эндокринная терапия с 2021 г.; стабильное заболевание до начала 2025 г.; прогрессирование в костях — начало |
Янв 2024: 8; авг–дек 2024: 4; фев–апр 2025: 1:8 |
Стабильно низкий |
|
|
9 |
HER2+ HR+ likely |
Восемь циклов химиотерапии, затем мастэктомия в июне 2023 года; адъювантная терапия трастузумабом начата в июле 2023 года, терапия тамоксифеном — с ноября 2023 года |
Без признаков заболевания |
Dec 2023: 0; Feb 2024: 0 |
Стабильно низкий |
|
10 |
HR+ HER2? Metastatic |
Палбоциклиб + ингибитор ароматазы ± SERD (с 2021 года); золедроновая кислота; прогрессирование заболевания в августе 2024 года (печень) |
Прогрессирование 2024 |
Dec 2023: 8; Feb 2024: 4; May 2024: 4 |
Стабильно низкий |
|
11 = М5 |
HER2+ HR-Ki-67 70% |
Неоадъювантная терапия трастузумабом + доцетакселом + карбоплатином (октябрь 2023 – февраль 2024); мастэктомия в марте 2024 года (RCB 0); адъювантная терапия трастузумабом + перту-зумабом — 10 циклов (май – ноябрь 2024 года) |
Полный ответ (RCB 0) |
Dec 2023: 16; Feb 2024: 16; May 2024: 64; May 28: 32; Jun 2024: 16; Jul 2024: 32; Jul 29: 32; Aug 2024: 16; Sep 2024: 32; Oct 2024: 16 |
Временное повышение |
Дополнительная таблица S2. Сводная характеристика когорты беременных пациенток, проанализированных продольно во время беременности с целью оценки аутоантител титров методом латекс-агглютинационного теста с «непокрытыми» латексными микросферами. w: неделя
Supplementary Table S2. Summary characteristics of the «pregnant» patient cohort analyzed longitudinally during pregnancy for assessment of autoantibody titers by latex agglutination test with "uncoated" latex beads. w: week
|
Пациент No |
Кол-во проанализированных сывороток крови |
Начальная неделя / титр |
Последняя неделя / титр |
Характер динамики титров ЛАТ |
|
P1 |
2 |
12w / 16 |
21 w / 32 |
Повышение |
|
P2 |
2 |
12w / 4 |
24 w / 16 |
Повышение |
|
P3 |
2 |
12 w / 32 |
17 w / 32 |
- |
|
P4 |
2 |
29 w / 64 |
29 w / 64 |
- |
|
P5 |
2 |
9w / 8 |
16w / 16 |
Повышение |
|
P6 |
2 |
7w / 8 |
12w / 16 |
Повышение |
|
P7 |
4 |
10w / 8 |
27 w / 16 |
Повышение |
|
P8 |
2 |
13w / 16 |
20 w / 32 |
Повышение |
|
P9 |
2 |
28 w / 32 |
32 w / 64 |
Повышение |
|
P10 |
3 |
10w / 16 |
24 w / 64 |
Повышение |
|
P11 |
3 |
12 w / 32 |
27 w / 64 |
Повышение |
|
P12 |
2 |
19w / 8 |
30 w / 64 |
Повышение |
|
P13 |
3 |
19 w / 16 |
30 w / 32 |
Повышение |
|
P14 |
3 |
13 w / 16 |
26 w / 64 |
Повышение |
|
P15 |
3 |
8w / 8 |
25 w / 64 |
Повышение |
|
P16 |
2 |
19 w / 16 |
28 w / 16 |
- |
|
P17 |
2 |
12w / 16 |
13w / 16 |
- |
|
P18 |
3 |
8w / 16 |
27 w / 32 |
Повышение |
|
P19 |
3 |
10w / 16 |
28 w / 64 |
Повышение |
|
P20 |
2 |
9w / 16 |
19w / 32 |
Повышение |
|
P21 |
2 |
8w / 32 |
21 w / 64 |
Повышение |
|
P22 |
3 |
15w / 8 |
29 w / 16 |
Повышение |
|
P23 |
2 |
6 w / 8 |
12w / 8 |
- |
ДОПОЛНИТЕЛЬНЫЕ ДАННЫЕ
Характеристика когорты пациенток с раком молочной железы
Пациентка 1. Женщина 44 лет, диагноз — инвазивная карцинома молочной железы, HER2-положительная, гормон-рецептор-негативная (стадия IIIA, cT2N2M0; Ki-67 = 70 %). С октября 2023 по февраль 2024 гг. получала неоадъювантную комбинированную терапию доцетакселом, карбоплатином, трастузумабом и перту-зумабом (HP + TCb), после чего в апреле 2024 г. выполнена радикальная мастэктомия с реконструкцией. Гистологически — полный патоморфологический ответ (Residual Cancer Burden 0, RCB 0). Адъювантная терапия трастузумабом + пертузумабом проводилась 10 циклов (май - ноябрь 2024 г.). Лечение переносилось удовлетворительно. Серийные исследования методом ЛАТ показали стабильно низкие титры (1:4) на всех этапах лечения и наблюдения, что указывает на отсутствие системной гуморальной аутоиммунной активации при интенсивной HER2-таргетной терапии. Пациентка находится в стойкой ремиссии, что демонстрирует возможность достижения полного ответа без повышения аутоантительного фона.
Пациентка 2. Женщина 55 лет, HER2-положительная, гормон-рецептор-положительная инвазивная карцинома молочной железы (стадия IIIA, cT2N2M0; Ki-67 = 60 %). Получала неоадъювантную химиотерапию (доксорубицин + циклофосфамид, затем паклитаксел + трастузумаб), что привело к значительному уменьшению опухоли. В октябре 2023 г. выполнена мастэктомия, гистологически — полный ответ (RCB 0). Адъювантная терапия трастузумабом — 18 циклов до сентября 2024 г. На фоне лечения отмечалась удовлетворительная переносимость и хороший соматический статус. При серийных измерениях ЛАТ выявлялось кратковременное повышение титра (до 1:16) во время адъювантного лечения трастузумабом с последующей нормализацией после его завершения, что соответствует временной иммуноактивации, связанной с HER2-направленной терапией. Пациентка без признаков рецидива; случай демонстрирует обратимый характер гуморальной активации на фоне эффективного лечения.
Пациентка 3. Женщина 51 год, HER2-положительная, гормон-рецептор-положительная инвазивная карцинома (Ki-67 = 40 %). Проведена неоадъювантная химиотерапия, в январе 2024 г. выполнена мастэктомия. Гистологически — частичный ответ (RCB II). С марта по октябрь 2024 г. проводилась адъювантная терапия трастузумабом (11 циклов) в сочетании с лучевой терапией. Переносимость удовлетворительная. Серийные измерения ЛАТ показали устойчиво низкие титры (1:4), что указывает на отсутствие системной гуморальной активации. Данный случай демонстрирует стабильный серологический профиль при частичном ответе на HER2-направленное и цитотоксическое лечение.
Пациентка 4. Женщина 75 лет, HER2-положительная, гормон-рецептор-негативная инвазивная карцинома (Ki-67 = 70 %). С июня по октябрь 2023 г. получала 6 циклов неоадъювантной терапии трастузумабом, пертузумабом, доцетакселом и карбо-платином (HP + TCb). В ноябре 2023 г. выполнена мастэктомия; достигнут полный ответ (RCB 0). С января по июль 2024 г. проведено 10 циклов адъювантной HER2-терапии (HP). Лечение переносилось хорошо. Титры ЛАТ оставались низкими (от отрицательных значений до 1:4), что свидетельствует об отсутствии системной аутоиммунной активации.
Пациентка 5. Женщина 36 лет, тройной негативный (HER2-, ER-, PR-), BRCAI-положительный рак молочной железы (Ki-67 = 65 %). В мае 2024 г. проведена мастэктомия, после чего проведена адъювантная химиотерапия (четыре цикла дозоинтенсивного доксорубицина + циклофосфамида, июнь–август 2024 г.; затем 12 недель паклитаксела, август–ноябрь 2024 г.). Лечение переносилось удовлетворительно. Тестирование ЛАТ выявило низкие, но определяемые титры (1:8 ^ 1:4 после терапии), что согласуется с умеренной иммуносупрессией на фоне цитотоксического лечения. Пациентка под наблюдением, признаков рецидива нет. Случай демонстрирует, что даже при иммуногенном тройном негативном подтипе выраженной аутоантительной активации не происходит при интенсивной химиотерапии.
Пациентка 6. Женщина 45 лет, гормон-рецептор-положительный, HER2-отрицательный метастатический рак молочной железы. С 2021 г. получает непрерывную терапию: гозе-релин (супрессия функции яичников), палбоциклиб (ингибитор CDK4/6), ароматазный ингибитор, а также бисфосфонаты для профилактики костных осложнений. По данным КТ на октябрь 2023 г. заболевание стабильно. Тестирование ЛАТ показало низкие титры (1:4) с небольшим повышением до 1:8 в начале 2025 г., что соответствует минимальной гуморальной активации при длительной эндокринно-таргетной терапии.
Пациентка 7. Женщина 73 лет, гормон-рецептор-положительный, HER2-отрицательный метастатический рак. В 2004 г. выполнена мастэктомия с предоперационной лучевой терапией; адъювантное лечение (CMF + тамоксифен 2005–2010 гг.). В 2020 г. диагностирован метастатический рецидив (кости, лёгкие); с марта 2021 г. получала летрозол + палбоциклиб. Заболевание оставалось стабильным до ноября 2024 г., когда выявлен очаг в печени. Титры ЛАТ оставались низкими (1:8) на всём протяжении наблюдения, что свидетельствует об отсутствии системной аутоиммунной активации даже при прогрессировании. Случай демонстрирует длительное поддержание иммунного равновесия на фоне комбинированной эндокринно-таргетной терапии.
Пациентка 8. Женщина 48 лет, гормон-рецептор-положительный, HER2-отрицательный метастатический рак. После радикальной мастэктомии (2018 г.) получала адъювантную химио- и лучевую терапию, тамоксифен. В декабре 2020 г. диагностированы костные метастазы. С марта 2021 г. проводилась терапия палбоциклибом в сочетании с эндокринными препаратами (летрозол/фулвестрант) и золедроновой кислотой. До 2024 г. заболевание оставалось стабильным; в начале 2025 г. по данным КТ — прогрессирование в костях. Титры ЛАТ оставались низкими (1:4–1:8) до 2024 г. Случай демонстрирует длительное поддержание иммунного равновесия на фоне комбинированной эндокринно-таргетной терапии.
Пациентка 9. Женщина 52 лет, HER2-положительная, гормон-рецептор-положительная инвазивная карцинома. После 8 циклов химиотерапии проведена мастэктомия (июнь 2023 г.), затем адъювантное лечение трастузумабом (с июля 2023 г.) и тамоксифеном (с ноября 2023 г.). Клинически состояние стабильное. Результаты ЛАТ — отсутствие агглютинации (титр 0) в позднем 2023 и начале 2024 г., что свидетельствует об отсутствии системной гуморальной активации. Случай демонстрирует возможность достижения стойкой ремиссии без аутоиммунных проявлений на фоне комбинированного лечения.
Пациентка 10. Женщина 49 лет, гормон-рецептор-положительный, HER2-неопределённый метастатический рак. История: мастэктомия 2009 г., рецидив грудной стенки с операцией и лучевой терапией 2013 г., двусторонняя овариоэктомия. С августа 2021 г. получает палбоциклиб (CDK4/6-ингибитор) + ароматазный ингибитор (AI) ± селективный деградатор рецептора эстрогена (SERD) в рамках клинического исследования, а также золедроновую кислоту. Заболевание контролировалось до августа 2024 г., когда выявлено прогрессирование в печени. Титры ЛАТ — стабильно низкие (1:4-1:8), что указывает на минимальную системную гуморальную активацию при длительной таргет-ной терапии.
Пациентка 11. Женщина 36 лет, HER2-положительная, гор-мон-рецептор-негативная инвазивная карцинома (Ki-67 = 70 %). Неоадъювантная терапия: трастузумаб + пертузумаб + доцетаксел + карбоплатин (HP + TCb, октябрь 2023 - февраль 2024 г.), затем мастэктомия (март 2024 г.), полный патоморфологический ответ (RCB 0). Адъювантная терапия HP — 10 циклов (май - ноябрь 2024 г.). Лечение переносилось хорошо, пациентка без признаков заболевания. Титры ЛАТ оставались стабильно высокими (1:16-1:64) на протяжении неоадъювантного и адъювантного этапов, что отражает стойкую системную гуморальную активацию, вероятно связанную с HER2-направленной терапией. Случай демонстрирует, что выраженное вовлечение иммунной системы при лечении может сопровождаться стойкой гуморальной акти- вацией без клинических признаков аутоиммунитета и отражать эффективный противоопухолевый иммунный ответ.
Характеристика пациента с аденокарциномой лёгкого (C34.1). Мужчина 65 лет с диагнозом — немуцинозная аденокарцинома верхней доли левого лёгкого (C34.1), стадия после хирургического лечения. С июля по ноябрь 2024 года прошёл 6 циклов первой линии химиотерапии (паклитаксел + карбопла- тин + бевацизумаб), после чего переведён на поддерживающую терапию бевацизумабом. По данным КТ (август 2024 – февраль 2025 гг.) — стабилизация заболевания. Серологически титры по ЛАТ оставались стабильными на уровне 1:4 на всём протяжении лечения, что соответствует отсутствию системной гуморальной активации при хорошем клиническом контроле болезни.


