Агрессивный фиброматоз
Автор: Владимирова Л.Ю., Алькина А.К.
Журнал: Злокачественные опухоли @malignanttumors
Статья в выпуске: 3S1 т.14, 2024 года.
Бесплатный доступ
Агрессивный фиброматоз (АФ) или десмоидные опухоли (ДО) — это локально агрессивные и инвазивные опухоли мягких тканей мезенхимального происхождения, которые сложно лечить из‑за их вариабельных клинических проявлений, непредсказуемого клинического течения и отсутствия в настоящее время одобренных методов лечения. Это группа ЗНО редко встречается в клинической практике онколога, в связи с чем диагностика и опции лечения данной патологии существенно ограничены. На сегодняшний день, нет стандартного подхода к ведению больных с АФ, поэтому в зависимости от локализации опухоли, ее симптомов и риска развития осложнений и прогрессирования подбирается один из оптимальных методов лечения: хирургическое вмешательство или другие локальные методы, системная терапия или динамическое наблюдение. Лекарственная терапия активно развивается на протяжении последних десятилетий: от химиотерапии до внедрения тирозинкиназных ингибиторов (ТКИ) и одобрения новых молекул. В настоящее время сорафениб и пазопаниб являются одними из наиболее используемых ТКИ. Кроме того, новые ингибиторы гамма‑секретазы (нирогацестат и AL102) обещают быть эффективными средствами для лечения АФ с управляемым профилем безопасности.
Агрессивный фиброматоз, десмоидные опухоли, ингибиторы гамма‑секретазы, ингибиторы тирозинкиназ, химиотерапия
Короткий адрес: https://sciup.org/140307166
IDR: 140307166 | DOI: 10.18027/2224-5057-2024-14-3s1-35-41
Текст научной статьи Агрессивный фиброматоз
Агрессивный фиброматоз (АФ) — представляет собой опухоли мезенхимального происхождения, которые возникают из фибробластов, клеток, являющиеся основой соединительной ткани. Заболевание также известно, как десмоидный фиброматоз, глубокий фиброматоз, мышечно-апоневротический фиброматоз и десмоидная опухоль. Это агрессивные новообразования, для которых характерен инфильтративный рост с тенденцией к локальному рецидивированию, вместе с тем они практически никогда не метастазируют. Данные опухоли могут возникать в любой части тела, при этом отдельно выделяют внутрибрюшинные и экстраабдоминальные новообразования — возникающие в органах головы и шеи, грудной клетки, в области верхних и нижних конечностей [1,2]. Частота встречаемости АФ составляет от 2 до 6 случаев на миллион населения, пик заболеваемости приходится на возраст от 30 до 40 лет, чаще встречается у женщин [3,4]. Ежегодно в США регистрируется около 1700 новых случаев, но истинная распространенность заболевания намного выше, поскольку пациенты редко умирают от этого заболевания, что сказывается на статистике.
По данным литературы, разные авторы выделяют следующие факторы риска: предшествующая травма, повышение уровня эстрогенов во время беременности, влияющее на рост опухоли и на ее обратный регресс, а также были зарегистрированы случаи возникновения образования в месте послеоперационных шрамов [5,6]. 90–95% дес-моидных опухолей являются спорадическими, а 5–10% возникают при семейном аденоматозном полипозе (САП) [6,7]. У 8% больных со спорадическим АФ были отмечены случаи возникновения колоректального рака в семейном анамнезе, что свидетельствует о генетической предрапо-ложенности к этому заболеванию [8].
МОЛЕКУЛЯРНОГЕНЕТИЧЕСКИЕ НАРУШЕНИЯ
Десмоидные опухоли характеризуются мутациями в гене β-катенина (CTNNB1) или APC [6,9–11]. Это приводит к дисрегуляции пути WNT, который предотвращает деградацию цитозольного β-катенина [12]. Некоторые из этих генов участвуют в пролиферации и фиброзе (ADAM12, Fap-1α, WISP1 и SOX11). Напротив, другие участвуют в ангиогенезе (VEGF — фактор роста эндотелия сосудов) и активации рецепторов фактора роста (COX2 (Цикл-оксигеназа-2), активируя фактор роста тромбоцитов (PDGF) — α и β) [13].
При этом по данным ряда авторов большинство больных (85%) имеют мутации в гене CTNNB1: 41A, 45F и 45P в 59%, 33% и 8% случаев соответственно [14]. Мутация 45F ассоциировалась с более высокой частотой возникновения локального рецидива у пациентов с первичными, полностью резецированными спорадическими ДО, и была наиболее распространена в экстраабдоминальных образованиях [15]. При медиане наблюдения 31 месяц 5-летняя ВБП составили 58% и 74% соответственно для пациентов с мутацией CTNNB1 и с опухолями дикого типа [16].
КЛИНИЧЕСКАЯ КАРТИНА
АФ может протекать длительно бессимптомно. Первые признаки заболевания — это боль, деформация, вызванные компрессией, эрозией и разрушением расположенных рядом структур. ДО обладают инфильтративным ростом, проникая в соседние органы, фасциальные пространства, сжимают кровеносные сосуды и нервы. Поражение мышц, нервов и сосудов приводят к таким симптомам, как боль, ограничение подвижности или их деформацию [5]. Опухоли, поражающие конечности, ограничивают движения суставов и вызывают хромоту или трудности при движении рук или ног.
Клиническое течение непредсказуемо, так как ДО могут расти как очень быстро, так и очень медленно, при этом примерно 10–28% ДО склонны к обратной регрессии (22% для внебрюшных опухолей, 28% для опухолей брюшной полости). 30% имеют циклическое развитие- то растут, то регрессируют, 50% не меняются с момента постановки диагноза, а 10% имеют быструю прогрессию [5,17]. Считается, что опухоли на конечностях локально агрессивны и имеют частоту рецидивов от 24% до 77%. Локальные показатели рецидивов внутрибрюшных опухолей у пациентов с САП выше, чем у внебрюшных образований и составляет 57–86% [5]. Смертность связана с расположением опухоли и влиянием на смежные структуры.
ДИАГНОСТИКА
При подозрении на АФ диагностический поиск включает изучение анамнеза, физикальный осмотр, клинико-рентгенологические методы, и биопсию, поскольку окончательный диагноз можно поставить только с помощью гистологического анализа [17,18.]. Для обнаружения ядерной гиперэкспрессии β-катенина в опухолевых клетках используется иммуногистохимический анализ, однако этот маркер не специфичен для АФ и не является положительным во всех случаях [19]. Генетическое тестирование применяется для поиска мутации в генах CTNNB1 или APC [20]. Использование методов визуализации зависит от расположения опухоли: например, КТ является методом выбора для внутрибрюшной ДО, в то время как МРТ — предпочтительный метод для вне-брюшных опухолей. УЗИ чаще используется при опухолях, расположенных на конечностях или брюшной стенке [21]. Ряд ошибок в диагностике связан с тем, что при проведении гистологического исследования ДО имеют сходство с другими миофибробластными заболеваниями (например, саркомой, стромальной опухолью ЖКТ, узловым фасции-том или лейомиомой) [22].
ЛЕЧЕНИЕ АФ
Из-за редкой встречаемости подходы к лечению данной когорты больных существенно ограничены, одобренные методы лечения отсутствуют. Вместе с тем в 2020 году ESMO опубликовало по результатам проведенного глобального консенсуса алгоритм лечения АФ (рис. 1) В целом, за последние 10 лет в лечении пациентов с АФ произошел сдвиг парадигмы. До этого времени десмоидные опухоли лечили как злокачественные саркомы мягких тканей, часто с помощью очень обширных операций. Теперь подход стал гораздо более консервативным. Исходно у большинства пациентов с АФ предпринимается активное наблюдение. Согласно данным недавних ретроспективных анализов этот подход может быть особенно целесообразным для отдельных пациентов с резектабельными опухолями (при бессимптомном течении, небольшом размере, расположении в местах, где увеличение размеров не изменит результат операции и не приведет к функциональным ограничениям) [8,23]. При продолженном росте опухоли согласно решению консилиума врачей, пациенты могут быть подвергнуты хирургическому вмешательству и/или лучевой терапии и/или лекарственному лечению.
Хирургическое вмешательство является основным методом лечения пациентов с резектабельными ДО [24]. Расположение и размер опухоли, возраст пациента и состояние краев резекции являются факторами риска, связанными с местным рецидивом после резекции. Вне-брюшные опухоли имеют более высокий риск рецидива, чем абдоминальные [25,26].
При неуклонном прогрессировании опухолевого процесса, усилении симптомов или высоком риске рецидива NCCN рекомендуют варианты лечения в зависимости от анатомического расположения образования и его клиники. Хирургическое вмешательство не считается вариантом лечения первой линии, за исключением определенных клинических случаев, если это решение принято междисциплинарной командой. При возможности проведения операции ее цель должна заключаться в том, чтобы попытаться сохранить функцию органа [21].
Также в ряде источников сообщается об использовании других локальных методов лечения. По данным литературы, сообщается о полученных преимуществах у пациентов с прогрессирующими или местно-распространенными ДО при применении изолированной перфузии конечности (ИПК) с фактором некроза опухоли альфа и мелфаланом. При медиане наблюдения 7 лету 90% из 25 пациентов был достигнут контроль над заболеванием; из ниху 40% развилось прогрессирование заболевания спустя 2 года [27]. Использование низкой дозы TNF (1 мг) помогает уменьшить частоту возникновения и степень проявления побочных эффектов. В ряде случаев сообщалось, что криоабляция также является эффективным альтернативным методом лечения при внебрюшных ДО небольшого размера. CRYODESMO-1-это проспективное исследование, в которое включались пациенты с внебрюшными ДО, не подлежащие резекции. Первичная конечная точка — отсутствие
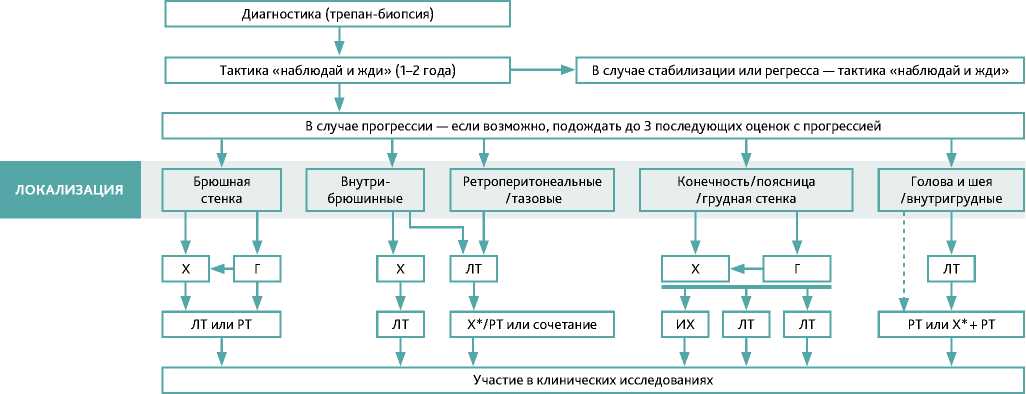
Х — хирургическое лечение;
Х* — хирургическое вмешательство, если опухоль ограничена;
ГТ — гормонотерапия;
ЛТ — лекарственная терапия;
РТ — радиотерапия;
ИХП — изолированная химиоперфузия.
Рисунок 1. Алгоритм лечения пациентов с АФ (Консенсус EORTC и STBSG, 2020, 2023)
прогрессирования заболевания в течение 12 месяцев. Из 42 пациентов, 12-достигли полного ответа, 11-частич-ного ответа, а ОО составил 55%. Отсутствие прогрессирования в течение 12 месяцев было отмечено у 36 из 42 пациентов (86%), что позволило достичь первичной конечной точки исследования. Медиана ВБП не была достигнута при долгосрочном наблюдении. Одним из явных преимуществ криоабляции перед другими методами является визуализация опухоли во время процедуры с помощью КТ, что обычно недоступно при других методах, например, при радиочастотной абляции (РЧА) [28].
ЛЕКАРСТВЕННАЯ ТЕРАПИЯ
При нерезектабельных, быстрорастущих, симптоматических или угрожающих жизни новообразованиях предпочтительно использовать химиотерапию. Могут использоваться метотрексат в сочетании с винбластином или винорелбином [29,30] или монотерапия винорелбином [31], а также схемы на основе антрациклинов (аналогичные схемам для пациентов с саркомой мягких тканей) [32] или пегилированного липосомального доксорубицина [33–35]. Химиотерапевтическая комбинация метотрексата и винбластина часто используется в педиатрической популяции, так как она имеет наибольшее количество данных у детей. Важно отметить, что рандомизированных исследований при АФ для этих схем химиотерапии не проводилось. Имеются лишь довольно небольшие отчеты о сериях случаев или небольшом количестве пациентов [6]. Выбор схемы химиотерапии должен быть индивидуальным для каждого пациента, и следует учитывать отсроченную токсичность этих агентов, такие, как кардиотоксичность, гипертония, бесплодие. Для молодых взрослых пациентов пегилированный липосомальный доксорубицин может быть предпочтительным в качестве антрациклинового режима из-за его более низкого риска сердечной токсичности.
Ранее при данной патологии в качестве первой линии терапии широко использовалась гормонотерапия, например, тамоксифен, [36] или ее комбинация с НПВС [37]. Её преимуществами считались малая токсичность, редкие побочные явления и низкая стоимость. Однако частота ответа на лечение оказалась низкой, кроме того, не удалось продемонстрировать четкой взаимосвязи между изменениями симптомов и размером опухолевых очагов [38]. Поэтому в случае ее использования при прогрессировании на фоне приема гормональной терапии или агрессивном течении заболевания целесообразно проведение низко-дозной химиотерапии с метотрексатом и/или винбласти-ном/винорельбином [39], или 6–8 циклов химиотерапии с использованием антрациклиновых режимов [40].
ТКИ хорошо изучены при АФ и являются еще одним вариантом лечения, основанном на достаточном количестве клинических исследований (табл. 1) Было проведено множество небольших проспективных одногрупповых исследований с использованием ежедневного имати-ниба, но показатели ответа были невысокими (6%–19%) [41]. В одном из исследований II фазы проводили оценку эффекта иматиниба при нерезектабельных опухолях. ВБП составила 66%, а ЧОО — 6%, время достижения ответа варьировало от 19 до 26 месяцев [42].
Сорафениб оценивали в исследовании III фазы, включавшем 87 пациентов с прогрессирующими или рецидивирующими ДО. При медиане наблюдения 27 месяцев 2-летняя ВБП составила 81% в группе сорафениба против 36% в группе плацебо, после кроссовера ЧОО в группе сорафениба составила 33% и 20% в группе плацебо. Медиана времени до ответа составила 9,6 месяца в группе сорафениба и 13,3 месяца
Таблица 1. Эффективность ТКИ при АФ
В исследовании II фазы DESMOPAZ, включившим 72 пациента для терапии пазопанибом в сравнении с метотрексатом и винбластином, было выявлено, что у 84% пациентов в группе пазопаниба ВБП сохраняется в течение 6 месяцев по сравнению с 45% пациентов, получавших метотрексат и винбластин [45]. Чаще всего встречались НЯ 1–2 степени: усталость (75%), диарея (65%), тошнота и рвота (54%), головная боль (40%), ладонно-подошвенный синдром (33%) и анорексия (33%). Проспективные исследования, сравнивающие пазопаниб с сорафенибом, не проводились, и выбор между ТКИ часто определяется профилем побочных эффектов и сопутствующей патологией пациента.
Таким образом, при использовании ТКИ, в первую очередь при лечении пазопанибом и сорафенибом отмечается улучшение показателей эффективности и удобство перорального приема этих препаратов, однако их применение иногда затрудняется из-за плохой переносимости и возможности возникновения долгосрочных побочных эффектов (в частности, гипертонии). Также имеются определенные ограничения, связанные с тем, что все эти препараты используются при АФ off-label.
НОВЫЕ НАПРАВЛЕНИЯ
В последнее время появились новые стратегии лечения, воздействующие на сигнальный путь NOTCH с помощью ингибиторов гамма-секретазы [46]. Существует четкое обоснование использования ингибиторов гамма-секретазы при АФ. Следует отметить, что эти опухоли в высокой степени экспрессируют Notch [41]. Наблюдалось перекрестное взаимодействие между путем Notch и путем Wnt/β -катенина, а также активация пути Notch в результате нару- шения регуляции со стороны пути Wnt/β -катенина [47]. Путь Notch можно заблокировать ингибиторами гамма-секретазы [41]. Ингибирование Notch может замедлить пролиферацию клеток и вызвать апоптоз [48]. В настоящее время разрабатываются 2 ингибитора гамма-секретазы для десмоидных опухолей: нирогацестат и AL102.
Первым ингибитором гамма-секретазы, который был испытан при АФ, является нирогацестат. Нирогаце-стат — селективный пероральный низкомолекулярный ингибитор гамма-секретазы, который продемонстрировал противоопухолевую активность в исследованиях фазы I и II с управляемым профилем побочных эффектов [9,49]. Это стало основой для исследования DeFi, результаты которого были представлены на Конгрессе Европейского общества медицинской онкологии (ESMO) в 2022 году. Иследование DeFi было глобальным рандомизированным двойным слепым плацебо-контролируемым исследованием фазы III, сравнивающим эффективность, безопасность и переносимость нирогацестата по сравнению с плацебо у взрослых пациентов с прогрессирующим АФ. Нирогаце-стат статистически значимо снизил риск прогрессирования заболевания на 71 % по сравнению с плацебо. Медиана ВБП для плацебо составила 15,1 месяца и не была достигнута для нирогацестата из-за малого количества событий (HR: 0,29; 95% ДИ: 0,15–0,55; P < 0,001) [49]. ЧОО для ни-рогацестата составила 41% по сравнению с 8% в группе плацебо (P < .001); 5 пациентов (7%), получавших ниро-гацестат, достигли полного ответа по сравнению с отсутствием полного ответа в группе плацебо. Медиана времени до объективного ответа составила 5,6 месяцев (диапазон: 2,6–19,4 месяца) для нирогацестата по сравнению с 11,1 месяцами (диапазон: 2,8–16,4 месяца) для плацебо [49]. Кроме того, было показано улучшение качества жизни по ряду показателей и уменьшение боли, обусловленной опухолевым процессом. Ингибитор гамма-секретазы продемонстрировал управляемый профиль безопасности, при этом 95% всех НЯ были 1/2 степени [49,50]. Благодаря этим результатам нирогацестат стал первым одобренным препаратом для лечения десмоидных опухолей и стан- дартом лечения пациентов с десмоидными опухолями, которым требуется системное лечение [50].
Кроме того, на том же Конгрессе были представлены результаты исследования RINGSIDE (NCT04871282) с применением AL102, который является еще одним мощным пероральным ингибитором гамма-секретазы. Это комбинированное исследование фазы II/III, оценивающее AL102 при прогрессирующем АФ. AL102 в целом хорошо переносился с управляемым профилем безопасности, без побочных эффектов 4/5 степени, большинство побочных эффектов были 1/2 степени. В части A (фаза II) была продемонстрирована его эффективность, при этом первый случай ЧО наблюдался на 16 неделе, а 3 случая ПО были отмечены в течение периода наблюдения. Результаты исследования фазы II (Часть A) нашли подтверждение в фазе III (Части B) с начальной дозой 1,2 мг один раз в день для сравнения с плацебо [51].
Однако следует отметить, что выше упомянутые препараты не зарегистрированы для лечения АФ и, следовательно, недоступны в большинстве стран. Для расширения опций системной терапии пациентов с АФ необходимо увеличить включение больных в клинические исследования. В настоящее время проходит исследование, оценивающее нирогацестат в популяции пациентов детского возраста (NCT04195399), исследованиеI/IIфазыТегавивинта, ингиби-торβ-катенина, при рецидивирующих/рефрактерныхсолид-ных опухолях, включая десмоидные (NCT04851119) и другие.
ВЫВОДЫ
Подводя итог актуальной на сегодня стратегии лечения АФ следует учитывать непредсказуемое течение заболевания, с возможностью к спонтанной регрессии опухолей, что дает возможность в ряде случаев остановиться на динамическом наблюдении. Если все-таки требуется лечение, то необходимо обсуждение выбора оптимальной тактики и решения вопроса о применении локальных методов или системной терапии мульти-дисциплинарной командой. Для большинства пациентов хирургическое вмешательство больше не является «золотым стандартом». Тщательная разработка тактики лечения может помочь оптимизировать ведение пациента и обеспечить достижения клинической эффективности (например, ВБП) и улучшение качества жизни с помощью лекарственной терапии. Следует отметить, что при АФ больше не рекомендуется использовать гормональную терапию. Лекарственная терапия активно развивается на протяжении последних десятилетий: от химиотерапии до внедрения тирозинкиназных ингибиторов (ТКИ) и одобрения новых молекул. В настоящее время сорафениб и пазопаниб являются одними из наиболее используемых ТКИ. Кроме того, новые ингибиторы гамма-секретазы (нирогацестат и AL102) обещают быть эффективными средствами для лечения АФ с управляемым профилем безопасности.
Список литературы Агрессивный фиброматоз
- Napolitano A., Mazzocca A., Spalato Ceruso M., et al. Recent advances in desmoid tumor therapy. Cancers (Basel) 2020;12(8):2135. https://doi.org/10.3390/cancers12082135
- Husson O., Younger E., Dunlop A., et al. Desmoid fibromatosis through the patients' eyes: time to change the focus and organisation of care? Support Care Cancer 2019;27(3):965-980. https://doi.org/10.1007/s00520-018-4386-8
- Bektas M., Bell T., Khan S., et al. Desmoid tumors: a comprehensive review. Adv Ther 2023;40(9):3697-3722. https://doi.org/10.1007/s12325-023-02592-0
- Bonvalot S., Desai A., Coppola S., et al. The treatment of desmoid tumors: a stepwise clinical approach. Ann Oncol 2012;23:x158-x166. https://doi.org/10.1093/annonc/mds298
- Constantinidou A., Scurr M., Judson I., Litchman C. Clinical presentation of desmoid tumors. In: Litchman C, editor. Desmoid tumors. Dordrecht, the Netherlands: Springer 2012.p.5-16.
- Kasper B., Strobel P., Hohenberger P. Desmoid tumors: clinical features and treatment options for advanced disease. Oncologist 2011;16(5):682-693. https://doi.org/10.1634/theoncologist.2010-0281
- Bertario L., Russo A., Sala P., et al. Multiple approach to the exploration of genotype-phenotype correlations in familial adenomatous polyposis. J Clin Oncol 2003;21(9):1698-1707. https://doi.org/10.1200/JCO.2003.09.118
- Fiore M., Rimareix F., Mariani L., et al. Desmoid-type fibromatosis: a front-line conservative approach to select patients for surgical treatment. Ann Surg Oncol 2009;16(9):2587-2593. https://doi.org/10.1245/s10434-009-0586-2
- Riedel R.F., Agulnik M. Evolving strategies for management of desmoid tumor. Cancer 2022;128(16):3027-3040. https://doi.org/10.1002/cncr.34332
- Hughes D., Kummar S., Lazar A. New, tolerable Y-secretase inhibitor takes desmoid down a notch. Clin Cancer Res 2015;21(1):7-9. https://doi.org/10.1158/1078-0432.CCR-14-1660
- Zhang Z., Shi J., Yang T., et al. Management of aggressive fibromatosis. Oncol Lett 2021;21(1):43. https://doi.org/10.3892/ol.2020.12304
- Zhan T., Rindtorff N., Boutros M. Wnt signaling in cancer. Oncogene 2017;36(11):1461-73. https://doi.org/10.1038/onc.2016.304
- Timbergen M. JM., Smits R., Grunhagen D.J., et al. Activated signaling pathways and targeted therapies in desmoid-type fibromatosis: a literature review. Front Oncol 2019;9:397. https://doi.org/10.3389/fonc.2019.00397
- Lazar A. J, Tuvin D., Hajibashi S., et al. Specific mutations in the beta-catenin gene (CTNNB1) correlate with local recurrence in sporadic desmoid tumors. Am J Pathol 2008;173(5):1518-1527. https://doi.org/10.2353/ajpath.2008.080475
- Colombo C., Miceli R., Lazar A.J., et al. CTNNB1 45F mutation is a molecular prognosticator of increased postoperative primary desmoid tumor recurrence: An independent, multicenter validation study. Cancer 2013;119(20):3696-3702. https://doi.org/10.1002/cncr.28271
- Mullen J.T., DeLaney T.F., Rosenberg A.E., et al. в-Catenin mutation status and outcomes in sporadic desmoid tumors. Oncologist 2013;18(9):1043-1049. https://doi.org/10.1634/theoncologist.2012-0449
- Referenced with permission from the NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines) for Soft Tissue Sarcoma V. 1.2023. National Comprehensive Cancer Network, Inc. 2023. All rights reserved. Accessed March 20, 2023. To view the most recent and complete version of the guideline, go online to NCCN.org.
- Gounder M. The Desmoid Tumor Research Foundation. Diagnosis and treatment. 2021. https://dtrf.org/diagno-sis-and-treatment. Accessed 13 December 2021.
- Kasper B., Baumgarten C., Garcia J., et al. An update on the management of sporadic desmoid-type fibromatosis: a European Consensus Initiative between Sarcoma Patients EuroNet (SPAEN) and European Organization for Research and Treatment of Cancer (EORTC)/Soft Tissue and Bone Sarcoma Group (STBSG). Ann Oncol 2017;28(10):2399-2408. https://doi.org/10.1093/annonc/mdx323
- Penel N., Chibon F., Salas S. Adult desmoid tumors: biology, management and ongoing trials. Curr Opin Oncol 2017;29(4):268-74. https://doi.org/10.1097/CCO.0000000000000374
- Garcia-Ortega D.Y., Martin-Tellez K.S., Cuellar-Hubbe M., et al. Desmoid-type fibromatosis. Cancers (Basel) 2020;12(7):1851. https://doi.org/10.3390/cancers12071851
- Penel N., Coindre J.M., Bonvalot S., et al. Management of desmoid tumours: a nationwide survey of labelled reference centre networks in France. Eur J Cancer 2016;58:90-6. https://doi.org/10.1016/j.ejca.2016.02.008
- Bonvalot S., Eldweny H., Haddad V., et al. Extra-abdominal primary fibromatosis: Aggressive management could be avoided in a subgroup of patients. Eur J Surg Oncol 2008;34(4):462-468. https://doi.org/10.1016/j.ejso.2007.06.006
- Ma D., Li S., Fu R., et al. Long-term outcomes of 47 patients with aggressive fibromatosis of the chest treated with surgery. Eur J Surg Oncol 2016;42(11):1693-1698. https://doi.org/10.1016/j.ejso.2016.06.396
- Seinen J.M., Niebling M.G., Bastiaannet E., et al. Four different treatment strategies in aggressive fibromatosis: a systematic review. Clin Transl Radiat Oncol 2018;12:1-7. https://doi.org/10.1016/j.ctro.2018.03.001
- Yang T., Liu H., Liao Z., et al. Postoperative adjuvant radiotherapy can delay the recurrence of desmoid tumors after R0 resection in certain subgroups. Front Surg 2021;8:697793. https://doi.org/10.3389/fsurg.2021.697793
- Van Broekhoven D.L., Deroose J.P., Bonvalot S., et al. Isolated limb perfusion using tumour necrosis factor a and melphalan in patients with advanced aggressive fibromatosis. Br J Surg 2014;101(13):1674-1680. https://doi.org/10.1002/bjs.9659
- Kurtz J.-E., Buy X., Deschamps F., et al. CRYODESMO-O1: a prospective, open phase II study of cryoablation in desmoid tumour patients progressing after medical treatment. Eur J Cancer 2021;143:78-87. https://doi.org/10.1016/j.ejca.2020.10.035
- Skapek S.X., Ferguson W.S., Granowetter L., et al. Vinblastine and methotrexate for desmoid fibromatosis in children: results of a pediatric oncology group phase II trial. J Clin Oncol 2007;25(5):501-506. https://doi.org/10.1200/JCO.2006.08.2966
- Palassini E., Frezza A., Marianai L., et al. Long-term efficacy of methotrexate plus vinblastine/vinorelbine in a large series of patients affected by desmoid-type fibromatosis. Cancer J 2017;23(2):86-91. https://doi.org/10.1097/PPO.0000000000000254
- Mir O., Rahal C., Rimareix F., et al. Efficacy of oral vinorelbine in advanced/progressive desmoid tumors: an updated retrospective study of 50 patients. Presented at: Annual Meeting of the American Society of Clinical Oncology; June 3-7, 2016. Abstract 11050
- de Camargo V.P., Keohan M.L., D'Adamo D.R., et al. Clinical outcomes of systemic therapy for patients with deep fibromatosis (desmoid tumor). Cancer 2010;116(9):2258-2265. https://doi.org/10.1002/cncr.25089
- Constantinidou A., Jones R.L., Scurr M., et al. Pegylated liposomal doxorubicin, an effective, well-tolerated treatment for refractory aggressive fibromatosis. Eur J Cancer 2009;45(17):2930-2934. https://doi.org/10.1016/j.ejca.2009.08.016
- Constantinidou A., Jones R.L., Scurr M., et al. Advanced aggressive fibromatosis: effective palliation with chemotherapy. Acta Oncol 2011;50(3):455-461. https://doi.org/10.3109/0284186X.2010.509105
- Pang A., Gouveia Macedo D.V., Carbini M., et al. Pegylated liposomal doxorubicin (PLD) as an active treatment option for desmoid tumors (DT) patients. Presented at: Annual Meeting of the American Society of Clinical Oncology; June 3-7, 2016. Abstract 11032
- Fiore M., Colombo C., Radaelli S., et al. Hormonal manipulation with toremifene in sporadic desmoid-type fibromatosis. Eur J Cancer 2015;51(18):2800-2807. https://doi.org/10.1016/j.ejca.2015.08.026
- Quast D.R., Schneider R., Burdzik E., et al. Long-term outcome of sporadic and FAP-associated desmoid tumors treated with high-dose selective estrogen receptor modulators and sulindac: a single-center long-term observational study in 134 patients. Fam Cancer 2016;15(1):31-40. https://doi.org/10.1007/s10689-015-9830-z
- Mitra I., Szucs Z., Libertini M., et al. Aggressive fibromatosis response to tamoxifen: MRI features with symptomatic correlation-the Royal Marsden experience. In CTOS Annual Meeting 2016, Lisbon. Abstract 2549467
- Mir O., Rahal C., Rimareix F., et al. Efficacy of oral vinorelbine in advanced/progressive desmoid tumours: an updated retrospective study in 50 patients. J Clin Oncol 2016;34. Abstract 11050
- Garbay D., Le Cesne A., Penel N., et al. Chemotherapy in patients with desmoid tumors: a study from the French Sarcoma Group (FSG). Ann Oncol 2012;23(1):182-186. https://doi.org/10.1093/annonc/mdr051
- Kasper B., Raut C.P., Gronchi A. Desmoid tumors: to treat or not to treat, that is the question. Cancer 2020;126(24):5213-5221. https://doi.org/10.1002/cncr.33233
- Chugh R., Wathen J.K., Patel S.R., et al. Efficacy of imatinib in aggressive fibromatosis: Results of a phase II multicenter Sarcoma Alliance for Research through Collaboration (SARC) trial. Clin Cancer Res 2010;16(19):4884-4891. https://doi.org/10.1158/1078-0432.CCR-10-1177
- Heinrich M.C., McArthur G.A., Demetri G.D., et al. Clinical and molecular studies of the effect of imatinib on advanced aggressive fibromatosis (desmoid tumor). J Clin Oncol 2006;24(7):1195-203. https://doi.org/10.1200/JCO.2005.04.0717
- Gounder M.M., Mahoney M.R., Van Tine B.A., et al. Sorafenib for advanced and refractory desmoid tumors, N Engl J Med 2018;379(25):2417-2428. https://doi.org/10.1056/NEJMoa1805052
- Toulmonde M., Pulido M., Ray-Coquard I., et al. Pazopanib or methotrexate-vinblastine combination chemotherapy in adult patients with progressive desmoid tumours (DESMOPAZ): a non-comparative, randomised, open-label, multicentre, phase 2 study. Lancet Oncol 2019;20(9):1263-1272. https://doi.org/10.1016/S1470-2045(19)30276-1
- Kummar S., O'Sullivan Coyne G., Do K.T., et al. Clinical activity of the Y-Secretase inhibitor PF-03084014 in adults with desmoid tumors (aggressive fibromatosis). J Clin Oncol 2017;35(14):1561-1569. https://doi.org/10.1200/JCO.2016.71.1994
- Shang H., Braggio D., Lee Y.J., et al. Targeting the Notch pathway: a potential therapeutic approach for desmoid tu-mors. Cancer 2015;121(22):4088-4096. https://doi.org/10.1002/cncr.29564
- Purow B. Notch inhibition as a promising new approach to cancer therapy. Adv Exp Med Biol 2012;727:305-319. https://doi.org/10.1007/978-1-4614-0899-4_23
- Kasper B., Ratan R., Alcindor T., et al. DeFi: a phase III, randomized controlled trial of nirogacestat versus placebo for progressing desmoid tumors (DT). Presented at: Annual Congress for the European Society for Medical Oncology; September 9-13, 2022. Abstract LBA2
- Gounder M., Ratan R., Alcindor T., et al. Nirogacestat, a gamma-secretase inhibitor for desmoid tumors. N Engl J Med 2023;388(10):898-912. https://doi.org/10.1056/NEJMoa2210140
- Gounder M.M., Jones R.L., Chugh R., et al. Initial results of phase II/III trial of AL102 for treatment of desmoid tumors (DT). Presented at: Annual Congress for the European Society for Medical Oncology; September 9-13, 2022. Abstract 1488M0.


