Агробактериальная трансформация культуры клеток василистника малого (Thalictrum minus L.)
Автор: Осипова Елена Александровна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Общая биология
Статья в выпуске: 5-3 т.20, 2018 года.
Бесплатный доступ
Разработан метод агробактериальной трансформации каллусной культуры клеток лекарственного растения - василистник малый. Для трансформации использовали штамм Agrobacterium tumefaciens, содержащей коинтегративный вектор pGV 3850. Плазмида содержит целевой ген ipt, кодирующий ключевой фермент биосинтеза цитокининов - изопентенилтрансферазу, под промотором 35S вируса мозайки цветной капусты и селективный ген nptII, кодирующий фермент неомицинфосфотрансферазу, придающий устойчивость к канамицину, под контролем NOS промотора. Трансформировали два штамма «В» и 233, различающихся по интенсивности роста и уровню биосинтеза протобербериновых алкалоидов. Оценивали эффективность влияния на трансформацию вакуумной инфильтрации и экстракта табака. Отбор трансформированных каллусов проводили на сублетальной концентрации канамицина: для штамма «В» - 50 мг/л и штамма 233 - 20 мг/л. Устойчивые к канамицину клеточные линии оценивали методом ПЦР на наличие в них гена ipt. Отмечена отдаленная реакция на канамицин, то есть снижение жизнеспособности каллусов при отсутствии канамицина происходило к третьему пассажу. Наиболее низкая выживаемость каллусов отмечена в варианте с экстрактом табака. Однако методом ПЦР показано, что наиболее эффективным для трансформации был вариант с экстрактом табака без вакуумной инфильтрации. В результате были выделены ipt-положительные клеточные линии: пять клеточных линий из штамма 233 и одна клеточная линия из штамма «В». Эффективность трансформации (отбор на канамицине + ПЦР) для штамма 233 составила 14,6%, для штамма «В» - 0,1%. Из пяти ipt-положительных линий от штамма 233 две из них имели более высокую интенсивность роста и уровень содержания протобербериновых алкалоидов, единственная ipt-положительная линия от «В» штамма имела, наоборот, более низкую интенсивность роста и низкий уровень протобербериновых алкалоидов. Cреди ipt-положительных линий отмечена вариабельность по интенсивности роста и уровню биосинтеза протобербериновых алкалоидов.
Трансформация, культура клеток, протобербериновые алкалоиды
Короткий адрес: https://sciup.org/148314083
IDR: 148314083 | УДК: 576.5
Текст научной статьи Агробактериальная трансформация культуры клеток василистника малого (Thalictrum minus L.)
Василистник малый ( Thalictrum minus L.) – лекарственное растение семейства Ranunculaceae. Широко распространено на территории России, а также за рубежом. Листья и корни растения применяются в тибетской медицине при отеках, водянке, женских болезнях. Трава василистника малого входит в состав сбора Здренко [1]. В васи-листнике малом найдены алкалоиды (1,2-1,3%), среди которых значительная часть принадлежит берберину (1,1-1,2%) [2]. Берберин является производным изохинолина, имеет протобербериновую структуру и может существовать в трех формах: аммонийной, карбонильной и альдегидной [3]. К настоящему времени известна антимикробная активность берберина при лечении лейшманиоза, амебной дизентерии, трихомоноза, малярии, холеры [4], желчегонная, применяемая при хрони ческом гепатите, гепатохолецистите, холецистите, Осипова Елена Александровна, кандидат биологических наук, старший научный сотрудник лаборатории биологии культивируемых клеток.
желчнокаменной болезни [3]. Берберин проявляет противоопухолевую [5,6] и антиоксидантную активность [6], рассматривается в качестве антидепрессанта [7]. Исследуется перспективность применения берберина для снижения уровня холестерина в крови [8,9], болезни Альцгеймера [10,11]. Берберин синтезируется в ряде других растений семейств Berberidaceae, Menispermaceae, Ranunculaceae, Rutaceae, Papaveraceae . Из растений рода Berberis L., Coptis japonica, Thalictrum minus L. получены культуры клеток растений. В культуре клеток растений рода Berberis берберин был второстепенным алкалоидом, тогда как в Coptis Japonica и Thalictrum minus он был основным [4]. Содержание берберина в культуре клеток растения Thalictrum minus может достигать 0,67% от сухой массы клеток [12,2].
К настоящему времени известен путь биосинтеза берберина, ключевые ферменты, а также ряд факторов активирующих ферменты его синтеза [4]. Было показано, что добавление цитокинина (6-бензиламинопури-на) в среду культивирования культуры клеток Thalictrum minus активировало норкоклаурин-
6-О-метилтрансферазу – ключевого фермента биосинтеза берберина, который катализирует первое метилирование норкоклаурина до ко-клаурина, активировало фермент (S)-тетрагид ропротобербериноксидазу, ответственного за превращение (S) – тетрагидроколумбамина в колумбамин, узлового соединения в образовании разнообразия протобербериновых алкалоидов. Повышение активности ферментов коррелировало с повышением уровня содержания берберина [13,14].
Изменение гормонального метаболизма, в частности цитокининов, в растениях и культуре клеток растений возможно путем агробак-териальной трансформации геном изопенте-нилтрансферазы ( ipt ) – фермента биосинтеза цитокининов. Показано, что в трансгенных ipt -растениях изменялся ряд характеристик, повышалось содержание цитокининов [15,16,17], возрастал регенерационный потенциал побегов [18], происходила задержка старения [17,19], повышалась скорость фотосинтеза и содержание хлорофилла [15,20,19], повышалась устойчивость к экзогенному этилену [19], отмечено, что экзогенный этилен повышал уровень экспрессии ipt [20], повышалась устойчивость к засухе [21], устойчивость к корневому затоплению [16]. Повышалось содержание артемизина в ipt -растениях Artemisia annua [15], изменялся состав эфирного масла листьев asakura-sanshoo: содержание оксигенированных сесквитерпеноидных соединений было выше, а ароматических соединений – ниже [17]. В то же время в ipt – трансгенных каллус-ных линиях Catharantus roseus наблюдали повышение уровня цитокининов, однако содержание алкалоидов в них было ниже, чем в контрольном штамме. Более того, экзогенные цитокинины повышали содержание алкалоидов в контрольном штамме, тогда как трансгенные линии по содержанию алкалоидов оставались на низком уровне [22]. Таким образом, исходя из вышесказанного можно предположить, что изменение уровня эндогенных цитокининов в культуре клеток васи-листника малого, может привести к изменению уровня биосинтеза берберина. Для этого можно применить метод агробактериальной трансформации до настоящего времени не разработанный для культуры клеток василистника малого.
Цель нашей работы состояла в разработке метода агробактериальной трансформации культуры клеток василистника малого, получение трансформированных ipt -клеточных линий и оценка содержания в них протобербериновых алкалоидов.
МЕТОДИКА ИССЛЕДОВАНИЙ
Объектом исследования служили два штамма каллусной культуры василистника малого. Штамм, полученный из черешка листа растения василистника малого киргизской популяции, растущего в ботаническом саду НПО «ВИЛАР» [23], далее обозначен, как «В» и штамм, полученный путем клеточной селекции из исход- ного «В» штамма - 233 [24]. Культивирование каллусов проводили на модифицированной MS-среде (Мурасиге -Скуга) [25] с добавлением витаминов по Стаба, 2,4-Д – 1,0 мг/л, кинетина 0,5 мг/л, сахарозы 5%, агара 0,7%. Каллусы массой 80-100 мг помещали в чашки Петри диаметром 9 см со средой 15-20 мл по 10 каллусов в каждой чашке. Цикл субкультивирования 4-5 недель. Условия культивирования: темнота, температура 26±1 °С. Рост каллуса определяли по сырой биомассе в динамике путем взвешивания на электронных полуаналитических весах Scout Pro (USA) каждые две недели.
Чтобы определять содержание протобербериновых алкалоидов каллусы массой 80 мг сажали в маленькие чашки Петри диаметром 4 см с заполнением средой 3 мл. Содержание протобербериновых алкалоидов проводили экспресс-методом [26]. Из сырой ткани массой 500 мг экстрагировали алкалоиды 96 ° этанолом трижды до полного обесцвечивания. Экстракт фильтровали через стеклянный фильтр, доводили объем до 18 мл. Экстракты с агаризованной среды получали путем экстракции 80% этанолом по 8 мл дважды до полного обесцвечивания. Спектрофотометрическое определение целевого комплекса в экстрактах проводили на спектрофотометре СФ-26 (Россия) при длине волны 427 нм.
Трансформация. Для трансформации использовали штамм Agrobacterium tumefaciens , содержащей коинтегративный вектор pGV 3850, любезно предоставленный профессором СПбГУ Лутовой Л.А. Плазмида содержит целевой ген ipt , кодирующий ключевой фермент биосинтеза цитокининов изопентенилтрансферазу, под промотором 35S вируса мозайки цветной капусты и селективный ген nptII , кодирующий фермент неомицинфосфотрансферазу, придающий устойчивость к канамицину, под контролем NOS промотора.
Штамм агробактерии культивировали на LB-среде (Луриа-Бертрани) [27], содержащей агар 1,5%, pH 7,5 (доводили 1 Н раствором NaOH) с антибиотиками стрептомицином (Ферейн, Россия) 300 мг/л и карбенициллином (Ферейн, Россия) 100 мг/л в чашках Петри. Агробакте-риальную культуру наносили штрихами на поверхность агаризованной среды, помещали в термостат при 28 °С на 48 часов, далее хранили при 4 °С в течение месяца.
Для трансформации каллуса использовали агробактериальную суспензионную культуру, которую получали путем переноса микробиологической петлей с агаризованной среды в жидкую LB-среду 50 мл, после её культивирования 16-20 часов в колбе V 100 мл на качалке 100 об/ мин, в темноте, при температуре 26±1 °С.
Перед проведением трансформации культуру агробактерии:
-
1) адаптировали к MS-среде. Для этого 10 мл ночной культуры агробактерии смешивали с 35 мл MS-среды и ставили на качалку в темноту на 1,5 часа;
-
2) активировали vir-гены агробактерии. Для этого использовали экстракт мелкоизмельченных
листьев табака, как источник фенольных соединений [28]. Экстракт получали после инкубирования в 10 мл MS-среды измельченных 7-10 листьев стерильного растения табака в течении 1,5 часа на качалке в темноте. Температура камеры 26±1 °С.
Вакуумную инфильтрацию проводили в вакуумном шкафу марки К-45 (Россия). Откачивали воздух (давление - 0,8 атм). Через 45 минут давление постепенно повышали до атмосферного . При раз -ности давления происходит заполнение межклеточ -ного пространства суспензией агробактерии.
Схема опыта:
-
1) . Адаптированную к MS-среде культуру агробактерии разливали в две колбы по 10 мл. В каждую добавляли по 10 кусочков 4-недельного каллуса. Одну колбу ставили на качалку в темноту, а другую - в вакуумный шкаф. Оставляли на 45 минут.
-
2) . В оставшуюся культуру агробактерии добавляли экстракт табака и ставили на качалку на 1,5 часа для активации vir генов агробактерии. Затем, как и в предыдущих вариантах, разливали культуру агробактерии на две колбы по 10 мл и добавляли в каждую 10 кусочков каллуса. Одну колбу ставили на качалку, другую в вакуумный шкаф и оставляли на 45 минут.
Далее культуру агробактерии и василистника высевали на чашки для совместного культивирования в виде газона для длительного контакта с агробактерией и оставляли на четыре недели.
Через 4 недели выросшие в виде газона культуры клеток василистника малого и агробактерии переносили кусочками на свежую MS-среду с добавлением цефотаксима 500 мг/л (клафорана Roussel Uclaf, France) для элиминации агробактерии и оставляли на 4 недели. После этого, на следующий пассаж, каллусы переносили на среду с канамицином (Ферейн, Россия) для отбора трансформированных каллусов. Устойчивость каллуса к канамицину оценивали визуально по окраске каллуса. Устойчивыми считали каллусы, увеличивающие массу клеток в течение пассажа и имеющие желтую или светло-желтую окраску, характерную для каллуса василистника малого. Коричневые или черные каллусы считали погибшими. Устойчивые к ка-намицину каллусы оценивали по ПЦР.
ПЦР-анализ каллусной культуры. Геномную ДНК выделяли методом, описанным Moller с соавт. [29] из 60-80 мг каллуса. Для анализа на ipt ген в полученных устойчивых к канами-цину клеточных линиях методом ПЦР применяли следующие пары праймеров: TMR-1 – 5´-GGAAGCGGACGACCAACAGTGGAA-3´ и TMR-2 – 5´-CTCCTGAGCGATCCCATTAATCAA-3´. Праймеры были изготовлены НПФ «Литех». Ампли-фикационная смесь объемом 30 мкл содержала: 67 мМ Трис-HCl (pH 8.6), 16,6 мМ (NH4)2SO4, 2,5 мМ MgCl2, 0.0025% Tween-20, 0,0025% Np40, 0,0125% крезолового красного, 6,25% глицерина, 0,2 мМ dNTP, 0,25 мМ праймера, 2 ед. Tag-полимеразы («Силекс М»), 30 нг выделенной ДНК. На реакционную смесь наслаивали 20 мкл минерального масла. Амплификацию проводи- ли в программируемом термоцикле МС2 («ДНК-Технология») со следующими условиями: денатурация при 94°С 2 мин; 5 циклов: денатурация при 94°С 20 с, отжиг при 65°С 10 с, элонгация при 72°С 10 с; 35 циклов: денатурация – 94°С 5 с, отжиг – 65°с 5 с, элонгация – 72°С 5 с. Продукты реакции (15 мкл из реакционной смеси) разделили электрофорезом в 1,5% агарозном геле с 0,01% бромистого этидия в TBE-буфере (89 мМ Трис, 89 мМ борной кислоты и 2 мМ ЭДТА). Для определения длины фрагмента использовали маркер М26 (100-1000 п.н.) («Сибэнзим»). Для проверки чистоты реактивов в качестве отрицательного контроля (-К) в реакционную смесь добавляли 5 мкл воды.
Статистическая обработка результатов. Опыты проводили в трехкратной повторности. В таблицах и графиках приведены среднеарифметические значения параметров и их стандартная ошибка. Статистическую обработку данных проводили с помощью компьютерной программы Microsoft Excel.
РЕЗУЛЬТАТЫ
Характеристика исходных штаммов. Ростовой цикл для обоих штаммов продолжительностью 8 недель. В исходном штамме «В» после восьмой недели рост переходил в стационарную фазу, тогда как в штамме 233 начиналась стадия деградации. Рост исходного штамма «В» был интенсивнее, чем у штамма 233. К 8 неделе в исходном штамме «В» масса клеток увеличивалась в 8,9 раз, а в штамме 233 – в 6,4 раза. Уровень содержания протобербериновых алкалоидов увеличивался на протяжении всего ростового цикла параллельно росту культуры клеток. В штамме 233 содержание протобербериновых алкалоидов был выше, чем в исходном штамме «В» и достигал к 8 неделям 228±67 мг/л среды (суммарное содержание в клетках и агаризованой среде), в исходном штамме - 49±17 мг/л среды (Рис. 1,2)
Агробактериальную трансформацию каллусов проводили в 4-недельном возрасте, что соответствовало началу экпоненциальной фазе роста. Важным этапом в процедуре агробакте-риальной трансформации является отбор трансформированных клеточных линий на селективной среде с канамицином. Канамицин токсичен для нетрасформированных клеток. Для выбора концентрации канамицина необходимо было определить чувствительность исходных штаммов к этому антибиотику. Чувствительность к канамицину определяли по выживаемости каллуса при разных концентрациях (рис. 3,4).
Оказалось, что у исходных штаммов разная чувствительность к канамицину. Для исходного штамма «В» выживаемость каллусов сохранялась на уровне 53,8% при концентрации канамицина 30 мг/л. При повышении концентрации кана-мицина до 40 и 50 мг/л, выживаемость каллуса снижалась до уровня 30 и 24,3%, соответственно. При повышении концентрации канамицина
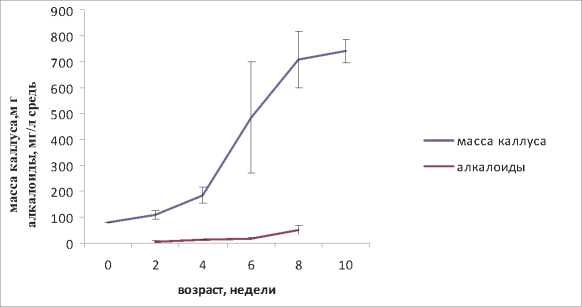
Рис. 1. Характеристика роста каллуса штамма «В» и содержание в нем протобербериновых алкалоидов
s
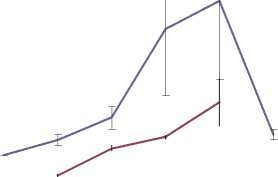
возраст,недели
— масса каллуса
----алкалоиды
Рис. 2. Характеристика роста каллуса штамма 233 и содержание в нем протобербериновых алкалоидов до 80 мг/л выживаемость каллуса сохранялась на уровне 24,3%, как и при концентрации канами-цина 50 мг/л. Штамм 233 был более чувствителен к канамицину. При более низкой концентрации 12 мг/л выживаемость каллусов достигала уровня 47,5%. При повышении концентрации канами-цина до 16 и 20 мг/л, выживаемость каллусов сохранялась на уровне 20,0 и 13.3%, соответственно. При отборе трансформированных каллусов использовали сублетальную концентрацию для штамма «В» - 50 мг/л, для штамма 233 - 20 мг/л.
Определяли влияние на эффективность трансформации вакуумной инфильтрации и экстракта табака, а также их взаимного воздействия.
В первом пассаже на канамицине каллусы после трансформации агробактерией показали высокую устойчивость к канамицину, на уровне 100% обоих штаммов при всех вариантах. Далее, чтобы не повышать концентрацию канамицина, каллусы переносили на среду без антибиотика. В этом случае также сохранялась выживаемость каллуса на уровне 100% у обоих штаммов при разных вариантах трансформации. Только в следующем пассаже на среде без антибиотика наблюдали снижение жизнеспособности каллуса.
В исходном штамме «В» наибольшая выживаемость каллуса была в варианте без вакуумной инфильтрации и без добавления экстракта табака, 24%. После проведения вакуумной инфильтрации без добавления экстракта табака выживаемость каллуса снижалась, до 8%. Наиболее низкая выживаемость каллуса была при добавлении экстракта табака, как в случае с вакуумной инфильтрацией, так и без нее, 1-3%.
В штамме 233 достоверное снижение выживаемости каллуса, до 35%, наблюдали только в варианте с экстрактом табака без вакуумной инфильтрации. Во всех остальных случаях она сохранялась на высоком уровне 90-100% (табл. 1,2)
Таким образом, отмечена более высокая устойчивость к канамицину у каллусов после кокультивирования с агробактерией, чем в исходных штаммах, в первом пассаже. Проявление реакции на канамицин было более отдаленным, в третьем пассаже. Причем во втором и третьем пассажах канамицин в среду не добавляли. Наибольшая устойчивость каллусов к канамицину отмечена в варианте без воздействия вакуумной инфильтрации и без добавления экстракта табака в штамме «В» и все варианты, кроме варианта с экстрактом табака без вакуумной инфильтрации, в штамме 233. Значительное снижение выживаемости каллуса наблюдали в вариантах с экстрактом табака для обоих штаммов. Оценка методом ПЦР устойчивых к канамицину каллусов из исходного штамма «В» и штамма 233 разных вариантов показала, что только в вариантах с экстрактом табака без вакуумной инфильтрации был обнаружен ген ipt. Из 10 случайно выбранных линий, полученных от исходного штамма
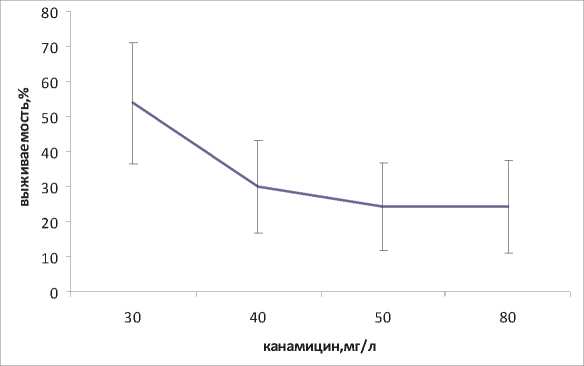
Рис. 3. Устойчивость каллуса штамма «В» к канамицину, % от числа исходно посаженных каллусов
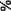
S
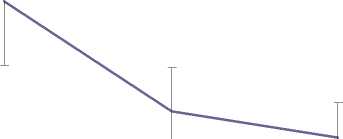
канамицин, мг/л
Рис. 4. Устойчивость каллуса штамма 233 к канамицину, % от числа исходно посаженных каллусов
«В», только одна содержала ген ipt , из 12 случайно выбранных линий, полученных от штамма 233, пять содержали ген ipt (рис. 5,6).
Эффективность агробактериальной трансформации для исходного штамма «В» составила 1% по канамицину и 10% (по ПЦР), конечная 0,1%. Для штамма 233 эффективность трансформации по канамицину составила 35% и 41,7% (по ПЦР), конечная – 14,6%. Не наблюдали корреляции между устойчивостью каллусов к канамицину и ipt -положительных каллусов разных вариантов.
Из пяти ПЦР положительных каллусных клеточных линий от штамма 233 две имели более интенсивную окраску каллуса и окрашивали агаризованую среду. Была проведена оценка вновь полученных клеточных линий на содержание протобербериновых алкалоидов и по интенсивности роста на 7-8-ой неделе культивирования и ipt -положительная клеточная линия, полученная от исходного штамма «В» (табл. 3).
Единственная ipt положительная клеточная линия, полученная от штамма «В», уступала по своим характеристикам исходному штамму. Среди ipt положительных клеточных линий, полученных от штамма 233, только две из пяти превышали уровень исходного штамма, как по росту, так и по содержанию протобербериновых алкалоидов. То есть ipt клеточные линии могут, как превышать уровень исходного штамма, так и уступать ему по своим характеристикам.
ОБСУЖДЕНИЕ
На эффективность агробактериальной трансформации могут влиять множество факторов. Среди них физиология растений (возраст растения, тип ткани), тип и источник эксплантов, размер экспланта. Влияние условий при проведении трансформации: условия кокультивирования, среды для культивирования. Физические факторы, например, температура, рН [28]. Процедура трансформации включает основные этапы: ко-культивирование с агробактерией, элиминация агробактерии, отбор вариантов на селективной среде, анализ устойчивых клеточных линий к селективному антибиотику методом ПЦР. При выборе концентрации антибиотиков важно учитывать чувствительность каллусов к ним. Применяемая нами концентрация цефотаксима 500 мг/л не влияла на жизнеспособность каллусов и приводила к элиминации агробактерии. В случае с канамицином необходимо было применять разные концентрации для разных штаммов из-за их разной чувствительности к антибиотику.
Таблица 1. Устойчивость к канамицину каллусов штамма «В» после кокультивирования с Agrobacterium tumefaciens , % живых каллусов от числа посаженных
|
Пассаж/фактор |
- В - Т |
+ В - Т |
- В + Т |
+ В + Т |
|
1 (+канамицин) |
100 |
100 |
100 |
100 |
|
2 (-канамицин) |
100 |
100 |
100 |
100 |
|
3 (-канамицин) |
24±3 |
8±2 |
1±1 |
3±1 |
В – вакуумная инфильтрация; Т-экстракт табака
Таблица 2. Устойчивость к канамицину каллусов штамма 233 после кокультивирования с Agrobacterium tumefaciens , % живых каллусов от числа посаженных
|
Пассаж/фактор |
- В - Т |
+ В - Т |
- В + Т |
+ В + Т |
|
1 (+канамицин) |
100 |
100 |
100 |
100 |
|
2 (-канамицин) |
100 |
100 |
100 |
100 |
|
3 (-канамицин) |
100 |
90±7 |
35±10 |
100 |
В – вакуумная инфильтрация; Т-экстракт табака
Для штамма «В» » - 50 мг/л, для штамма 233 – 20 мг/л. В обоих случаях были выбраны сублетальные концентрации. По литературным данным также известно, что для разных растений применяли разные концентрации канамицина. Более чувствительным отмечен рапс, использовалась концентрация канамицина 35 мг/л [30]. Оптимальная концентрация канамицина для разных генотипов сафлоры была 50 мг/л [31]. Для отбора трансгенного баклажана использовали 100 мг/л канамицина [32]. Концентрация канамицина для селекции трансформированных европейских каштановых эмбриогенных культур была 150 мг/л [33]. В наших экспериментах отмечена высокая жизнеспособность каллусов на канамици-не, прошедших процедуру кокультивирования с агробактерией, в первом пассаже по сравнению с исходным штаммом. Гибель каллусов наблюдали только через три пассажа, причем последние два пассажа культивировали на среде, в которую не добавляли канамицин. В работе по трансформации каллусной культуры кукурузы также наблюдали высокую устойчивость трансформиро- ванных каллусов в первом пассаже на основании чего сделан вывод, что отбор каллусных культур на канамицине невозможен [34]. Однако наш опыт показывает, что гибель каллусов происходит, но при более продолжительном культивировании, причем даже без канамицина.
В наших экспериментах мы проводили ко-культивирование с агробактерией в жидкой среде в течение 45 минут с последущим кокуль-тивированием в виде газона. Изучали влияние на эффективность трансформации вакуумной инфильтрации и экстракта табака. Вакуумная инфильтрация применяется для облегчения заполнения межклеточного пространства агробактерией, экстракт табака, как источник фенольных соединений, необходимый для активации vir генов агробактерии. При сравнении результатов отбора клеточных линий на кана-мицине и ПЦР анализа на ген ipt были выявлены противоречивые данные. Наиболее низкая устойчивость к канамицину была в варианте с экстрактом табака, тогда как по ПЦР этот вариант был единственно успешным. Последние
1 2 3 4 5 7 8 9 10 11 С- С+ М п.н.
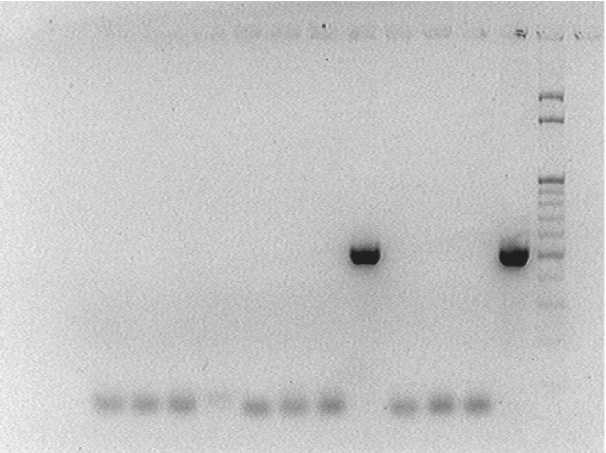
Рис. 5. Электрофореграмма продуктов ПЦР ДНК культуры клеток Thalictrum minus каллусов штамма «В» со специфичными к гену ipt праймерами: С- – отрицательный контроль (вода вместо ДНК-содержащей пробы);
С+ – положительный контроль (вектор pGV3850);
М – маркер молекулярной массы (100 – 1000 п.н.)
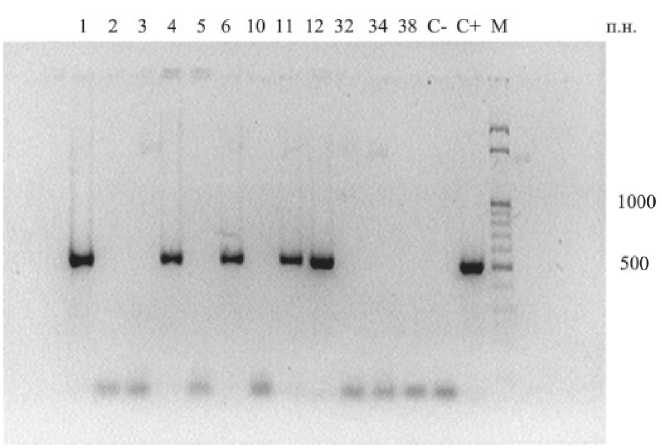
Рис. 6. Электрофореграмма продуктов ПЦР ДНК культуры клеток Thalictrum minus каллусов штамма 233 со специфичными к гену ipt праймерами: С- – отрицательный контроль (вода вместо ДНК-содержащей пробы);
С+ – положительный контроль (вектор pGV3850);
М – маркер молекулярной массы (100 – 1000 п.н.)
исследования по трансформации разных исследователей показывают, что для успешной трансформации фенольные соединения обязательны для активирования агробактерии.
В результате эффективность трансформации для штамма «В» по устойчивости к канами-цину 1%, конечная – 0,1% по результатам ПЦР, очень низкая. Для штамма 233 по устойчивости к канамицину 35%, конечная – 14,6% по результатам ПЦР. Различия по эффективности трансформации связаны, вероятно, с индивидуальными особенностями штаммов. Среди ipt- положительных клеточных линий были такие, у которых интенсивность роста и содержание протобербериновых алкалоидов была выше, чем в исходном штамме. Но были и такие, которые отличались более низким уровнем. Таким образом, ipt-положительные клеточные линии были вариабельны по интенсивности роста и уровню содержания протобербериновых алкалоидов. Это может быть связано, с экспрессией генов, которая зависит от многих факторов, в том числе от растительного генома и от сайта интеграции (эффекта положения) [28].
Таблица 3. Характеристика ipt -положительных каллусных клеточных линий по росту и содержанию в них протобербериновых алкалоидов на 7-8 неделе ростового цикла, % к исходному штамму
|
Штамм, от которого получена клеточная линия |
Наименование клеточной линии |
Масса каллуса |
Алкалоиды |
|
«В» |
9 |
82-93 |
68-82 |
|
233 |
4 |
121-185 |
154-239 |
|
233 |
12 |
137-171 |
108-141 |
ЗАКЛЮЧЕНИЕ
В результате проведенной работы был разработан метод агробактериальной трансформации для каллусной культуры клеток василист-ника малого. Разработанный метод включает следующие этапы: смешивание активированной экстрактом табака агробактерии с каллусом и кокультивирование на качалке при 100 об/мин в темноте в течение 45 мин. Далее проведение посева смешанных культур агробактерии и каллуса на агаризованную MS-среду в виде газона и культивирование в течение 4 недель (кокульти-вирование). Через 4 недели перенос кусочками выросшего каллуса на агаризованную MS-среду с 500 мг/л цефотаксима для элиминации бактерии. Через 4 недели перенести каллус на агари-зованную MS-среду с добавлением канамицина (селективная среда) с 50 мг/л для штамма «В» и 20 мг/л для штамма 233. Далее культивировать каллусы два пассажа на агаризованной MS-среде без антибиотиков. Отобранные на канамицине каллусные линии оценить методом ПЦР. В результате разработанного метода получены ПЦР-положительные клеточные линии василистни-ка малого с эффективностью трансформации для штамма «В» 0,1%, для штамма 233 14,6%. Было показано, что с помощью агробактери-альной трансформации можно получать новые клеточные линии с более высоким уровнем содержания алкалоидов и интенсивностью роста. Однако, ipt -положительные линии оказались вариабельны, имеют разный уровень содержания алкалоидов и разную интенсивность роста, как выше, так и ниже, чем у исходных штаммов.
Список литературы Агробактериальная трансформация культуры клеток василистника малого (Thalictrum minus L.)
- Гаммерман А.Ф., Кадаев Г.Н., Яценко-Хмелевский А.А. Лекарственные растения - М.: Изд-во Высшая школа, 1990. 544 с.
- Сараев И.В., Величко Н.А., Репях С.М. Химический состав василистника малого Thalictrum minus L. // Химия растительного сырья. 2000 № 1, С. 37-39.
- Растительные лекарственные средства / Н.П. Максютина, Н.Ф. Комиссаренко., А.П. Прокопенко [и др.] Киев.: Здоров,я, 1985. 280 с.
- Холина А.Б., Журавлев Ю.Н. Культура клеток растений как источник проторбербериновых алкалоидов // Растительные ресурсы. 1996. Вып.1-2 С. 134-148.
- Потопальский А.И., Петличная Л.И., Ивасивка С.В. Барбарис и его препараты в биологии и медицине. Киев.: Изд-во Наук. Думка, 1989. 287 с.


