Агротехнологические основы создания усовершенствованных форм микробных биопрепаратов для земледелия
Автор: Кожемяков А.П., Лактионов Ю.В., Попова Т.А., Орлова А.Г., Кокорина А.Л., Вайшля О.Б., Агафонов Е.В., Гужвин С.А., Чураков А.А., Яковлева М.Т.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Экологические основы создания микробных препаратов
Статья в выпуске: 3 т.50, 2015 года.
Бесплатный доступ
Выполнены комплексные исследования по созданию жидкой формы биопрепаратов для симбиотических и ассоциативных ризобактерий. Объектами изучения служили клубеньковые бактерии, обитающие в ризосфере козлятника (Rhizobium galegae), сои (Bradyrhizobium japonicum), и ассоциативные ризобактерии (Arthrobacter mysorens, Azospirillum brasilense, Ag-robacterium radiobacter), а также растения сои (Glycine max), кукурузы (Zea L.) и пшеницы (Triticum L.). В качестве носителей бактерий использовали гамма-стерильный торф, стерильный вспученный вермикулит и жидкие среды на основе компонентов растительного или синтетического происхождения с внесением стабилизирующих и питательных добавок (гуматы, глицерин, сорбат калия, карбоксиметилцеллюлоза и др.). Сравнительную эффективность биопрепаратов изучали в различных регионах Российской Федерации. В условиях Ленинградской области оценивали эффективность препаратов на основе производственных и перспективных штаммов клубеньковых бактерий люцерны Sinorhizobium meliloti. Подобраны оптимальные сочетания стабилизирующих, питательных и защитных субстратов, обеспечивающих длительное хранение и высокую эффективность биопрепаратов. Растительные питательные среды (бобовые отвары) не поддерживали требуемого качества препаратов. Использование бобовой среды для культивирования позволяло получить нужный титр бактерий в препарате, однако их численность быстро уменьшалась. Кроме того, препараты, полученные на бобовом отваре, через 2-3 мес после начала хранения теряли свое качество из-за развития в них посторонней микрофлоры. Новая форма препаратов, разработанная на основе синтетической питательной среды, способна храниться при комнатной температуре (при стерильной расфасовке в пластиковые бутыли) не менее 6 мес. В конце культивирования был получен высокий титр бактерий (3,6-4,2 млрд КОЕ/мл жидкого препарата). Установлено, что усовершенствованная жидкая форма имеет высокую эффективность. Ее применение на зернобобовых культурах повышало урожай зерна сои на 20-40 %, гороха - на 15-25 %. Продуктивность зерновых культур (пшеница, ячмень) возрастала на 15-25 %, а продуктивность люцерны - на 20-45 %. При этом установлено повышение качества продукции за счет увеличения содержания белка. Эффективность биопрепаратов существенно корректировалась агроэкологическими условиями и биологическими особенностями сельскохозяйственных культур. Применение различных штаммов клубеньковых бактерий S. meliloti в Ленинградской области способствовало созданию эффективной растительно-микробной системы. При этом на дерново-подзолистой почве наиболее эффективным оказался штамм А-4, обеспечивавший прибавку урожая более 25 %, на дерново-карбонатной - штамм А-5, который повышал продуктивность люцерны на 140 %.
Биопрепарат, клубеньковые бактерии, ассоциативные ризобактерии, формы биопрепаратов
Короткий адрес: https://sciup.org/142133599
IDR: 142133599 | УДК: 631.559.2:631.847.21:579.64 | DOI: 10.15389/agrobiology.2015.3.369rus
Текст научной статьи Агротехнологические основы создания усовершенствованных форм микробных биопрепаратов для земледелия
Микробные биопрепараты — экономически выгодный и экологически чистый способ повышения продуктивности растений (1-5). Особенно значимы преимущества использования микробно-растительных симбиозов в обеспечении растений азотом.
Процесс получения и применения минеральных азотных удобрений чрезвычайно энергоемок: на него расходуется до 50 % всей энергии АПК. Решить проблемы энергосбережения невозможно без использования более дешевого и экологически безопасного биологического азота (6-9).
Практика инокуляции семян известна уже более 100 лет. Препараты на основе клубеньковых бактерий выпускались в различных формах: почва, в которую были внесены клубеньковые бактерии, препараты на ос-
Работа поддержана МЦП ЕврАзЭС «Инновационные биотехнологии», Государственный контракт ¹ 14.М04.12.0011.
нове торфов (стерильных и нестерильных) и на твердых носителях (перлит, вермикулит, древесная или кокосовая стружка), пастообразные, гелеобразные и жидкие препараты (10-15).
Основные проблемы, сдерживающие широкое использование большинства землеудобрительных биопрепаратов, заключаются в отсутствии удобных для применения, технологичных в производстве и недорогих форм на базе не образующих споры ризосферных микроорганизмов. Культивирование и длительное сохранение последних в живом виде связано с определенными технологическими сложностями.
Наиболее перспективна, технологична и экономична жидкая форма инокулянтов, которая представляет собой питательную среду с выращенными в ней клубеньковыми бактериями. Ее производство позволяет упростить технологический процесс за счет исключения стадий подготовки субстратов и их инокуляции (16, 17).
Питательные среды из натуральных продуктов очень сложны и меняются в зависимости от качества и происхождения исходного сырья. Эта технология была разработана несколько десятков лет назад, и самый большой ее недостаток состоит в том, что жидкая форма препаратов имеет короткий срок хранения. В условиях жидкой культуры титр бактерий начинает резко снижаться уже через 10-15 сут (18).
Целью настоящей работы было создание эффективных и технологичных в производстве и применении землеудобрительных биопрепаратов для широкого круга сельскохозяйственных культур (зерновых, зернобобовых, кормовых, овощных) и сравнительная оценка эффективности традиционных и новых форм биопрепаратов в различных агроэкологических условиях.
Методика. Объектами исследования служили клубеньковые бактерии козлятника ( Rhizobium galegae ), сои ( Bradyrhizobium japonicum ) и ассоциативные ризобактерии ( Arthrobacter mysorens , Azospirillum brasilense , Agrobacterium radiobacter ), а также растения сои ( Glycine max ), ячменя ( Hordeum L.). В качестве носителей бактерий использовали гамма-стерильный торф, стерильный вспученный вермикулит и жидкие среды на основе компонентов растительного или синтетического происхождения с внесением стабилизирующих и питательных добавок (гуматы, глицерин, сорбат калия, карбоксиметилцеллюлоза — КМЦ и др.).
Исследования проводили на базе учреждений Географической сети опытов с землеудобрительными биопрепаратами в различных агроэкологических условиях.
Полевые опыты закладывали в Ленинградской (Санкт-Петербургский государственный аграрный университет — ГАУ; люцерна изменчивая Medicago varia L. сорта Агния), Ростовской (Донской ГАУ; соя Glycine max L. сорта Вилана), Брянской (Брянский государственный университет — ГУ; ячмень Hordeum L. сорта Зазерский 85), Орловской (Всероссийский НИИ зернобобовых культур; соя Glycine max L. сорта Ланцетная), Томской областях (Томский ГУ; люцерна посевная Medicago sativa L., люцерна хмелевидная M. lupulina L. и козлятник восточный Galеga ori-entalis L.) и Красноярского края (Красноярский ГАУ; соя Glycine max L. сорта СИБНИИК 315).
В экспериментах использовали производственные и перспективные штаммы клубеньковых бактерий, выделенные из почв и клубеньков растений разных регионов мира, а также ассоциативные азотфиксирующие бактерии, выделенные из различных почв и ризосферы растений (19).
В условиях Ленинградской области оценивали эффективности препаратов на основе производственных перспективных штаммов клубенько-370
вых бактерий люцерны. Эксперименты проводили на опытном поле Санкт-Петербургского ГАУ на дерново-подзолистой (pH 5,9; содержание гумуса 2,4 %) и дерново-карбонатной (pH 6,5; содержание гумуса 2,8 %) окультуренных почвах.
В качестве инокулянтов использовали штаммы клубеньковых бактерий Sinorhizobium meliloti — производственные (415б, 425а) и перспективные (А-3, А-4, А-5, А-6) из коллекции Всероссийского НИИ сельскохозяйственной микробиологии (г. Санкт-Петербург).
Семена перед посевом скарифицировали и инокулировали микробными препаратами согласно схеме опыта. Посев рядовой с шириной междурядий 30 см. При проведении исследований удобрения не применялись. Люцерна изменчивая возделывалась по общепринятой для Ленинградской области технологии.
Полученные данные обрабатывали с использованием дисперсионного и многофакторного анализа (20).
Результаты. В предыдущих исследованиях были подобраны оптимальные соотношения различных питательных и защитных компонентов, благодаря чему срок хранения препаратов при пониженной температуре мог достигать 2 мес.
Растительные питательные среды (бобовые отвары) не обеспечивали требуемого качества препаратов (табл. 1). Использование бобовой среды для культивирования клубеньковых бактерий позволяло получить нужный титр бактерий в препарате, однако их численность довольно быстро уменьшалась. Начальный титр жидких препаратов клубеньковых бактерий сои составлял 3,1-4,5 млрд КОЕ/мл, а спустя 2 мес число бактерий снижалось в 2 раза — до 1,7-2,1 млрд КОЕ/мл. Через 3 мес титры препаратов резко падали до 3,1-6,1 млн КОЕ/мл и продолжали уменьшаться с высокой скоростью. Кроме того, препараты, полученные на бобовом отваре, через 2-3 мес после начала хранения теряли свое качество из-за развития в них посторонней микрофлоры.
1. Титр (½106 КОЕ/мл) жидких препаратов на основе клубеньковых бактерий козлятника ( Rhizobium galegae , штамм 912) при добавлении различных компонентов в бобовую среду и разных температурах хранения (лабораторный опыт)
|
Вариант |
Срок хранения, температура |
|||||
|
2 нед |
4 нед |
8 нед |
||||
|
18-21 °С | |
4-6 ° С |
18-21 |
’С | 4-6 ° С |
18-21 °С | |
4-6 ° С |
|
|
Контроль |
610 |
3400 |
61 |
740 |
34 |
8 |
|
Гуматы, 1 % |
830 |
7100 |
360 |
62 |
41 |
47 |
|
Глицерин, 1 % |
2300 |
1200 |
410 |
820 |
57 |
450 |
|
Глицерин, 2 % |
1200 |
760 |
80 |
300 |
20 |
300 |
|
Глицерин, 1 % + гуматы, 1 % |
430 |
210 |
31 |
140 |
4,3 |
100 |
|
Сорбат калия, 1 % |
4100 |
3200 |
150 |
1800 |
110 |
1200 |
|
Сорбат калия, 2 % |
730 |
2700 |
28 |
650 |
14 |
300 |
|
Карбоксиметилцеллюлоза, 1 % |
810 |
2800 |
210 |
280 |
67 |
780 |
|
Сoрбат калия, 1 % + карбокси-метилцеллюлоза, 1 % |
1200 |
1400 |
340 |
440 |
60 |
840 |
|
НСР 05 |
36,7 |
94,2 |
31,0 |
47,0 |
6,1 |
36,4 |
За последние годы разработан абсолютно новый тип сред для культивирования полезных микроорганизмов — синтетические (21, 22). Их готовят из химически чистых органических и неорганических соединений, взятых в точно указанных концентрациях. Важное преимущество этих сред в том, что их состав постоянен, поэтому они легко воспроизводимы.
Наши данные убедительно доказали, что для получения препаратов на основе клубеньковых бактерий целесообразно использовать именно их (табл. 2). В отличие от натуральной среды (бобового отвара) на синтетиче- ских средах, как правило, не наблюдается загрязнения препаратов при хранении. Кроме того, можно более точно регулировать содержание в среде элементов питания и их соотношение, чего не позволяет сделать отвар, поскольку его состав меняется в зависимости от времени варки, качества, сорта исходного сырья и многих других факторов.
2. Титр (½106 КОЕ/мл) разных штаммов клубеньковых бактерий сои Bra-dyrhizobium japonicum в жидкой форме препарата на синтетической среде (температура хранения 22-25 ° С) (лабораторный опыт)
|
Штамм |
Срок хранения |
|||||
|
1 сут |
14 сут |
1 мес |
2 мес 3 мес |
5 мес |
6 мес |
|
|
634б |
3,8±0,40 |
3,7±0,25 |
3,7±0,26 |
3,5±0,30 3,1±0,20 |
2,8±0,20 |
2,7±0,15 |
|
640б |
3,6±0,40 |
3,6±0,31 |
3,5±0,30 |
3,5±0,26 3,2±0,26 |
2,9±0,26 |
2,8±0,23 |
|
645б |
4,2±0,32 |
4,1±0,42 |
3,9±0,24 |
3,8±0,37 3,0±0,34 |
2,8±0,23 |
2,7±0,35 |
Новая синтетическая среда обеспечивала получение высокого титра бактерий (3,6-4,2 млрд КОЕ/мл жидкого препарата) в конце культивирования. Она позволяла сохранить высокий титр бактерий на протяжении 6 мес без снижения качества препарата. Результаты, полученные в рамках Географической сети опытов, показали, что по своей эффективности препараты, приготовленные на основе синтетических сред, после 6 мес хранения не уступают свежим препаратам на основе традиционной жидкой среды и препаратам на основе торфа (23).
Предпосевная обработка больших объемов семян на сегодняшний день связана с определенными трудностями. Согласно рекомендациям, она должна осуществляться непосредственно в день высева, без доступа солнечного света. Решить эту проблему возможно посредством разработки методов механизированного внесения микробиологических препаратов в почву при посеве. В этом случае не требуется дополнительных технологических операций перед посевом; обработка проводится непосредственно высевающим агрегатом в поле. Такой подход будет способствовать более широкому внедрению в сельское хозяйство инокулянтов, а следовательно, получению высоких урожаев.
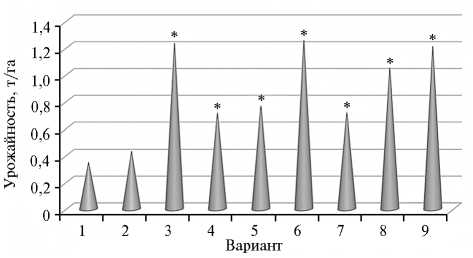
Рис. 1. Урожайность сои сорта СИБНИИК 315 при обработке семян разными формами биопрепаратов на основе Bradyrhizobium japonicum : 1 — контроль, 2 — штамм 634б (на торфе), 3 — штамм 634б (жидкая форма), 4 — штамм 634б (на вермикулите), 5 — штамм 626а (на торфе), 6 — штамм 626а (жидкая форма), 7 — штамм 626а (на вермикулите), 8 — штамм 640б (на торфе), 9 — штамм 645б (на торфе) (Красноярский край, 2014 год).
* Различия с контролем достоверны.
Сравнительную эффективность биопрепаратов на основе стерильного торфа, вермикулита и жидкой формы изучали в различных регионах РФ на зерновых (озимая и яровая пшеница, ячмень, рис), зернобобовых (соя) и кормовых культурах (люцерна, козлятник).
В опытах с соей в Красноярском крае (рис. 1) жидкая форма биопрепарата повышала продуктивность практически в 4 раза, а торфяная форма и препарат на основе вермикулита увеличивали сбор зерна в среднем в 2 раза. В целом, такая высокая результативность объясняется отсутствием «аборигенных» штаммов клубеньковых бактерий, специфичных для сои. В аналогичных случаях применение инокулянтов — необходимый агрономический прием (24).
В условиях Ростовской области показано, что все три формы
(торф, вермикулит, жидкость) биопрепарата на основе клубеньковых бактерий Bradyrhizobium japonicum (штамм 626а) способствовали достоверному увеличению урожайности сои. В контрольном варианте она составляла 20,3 ц/га, при обработке семян биопрепаратом на основе торфа — 23,1 ц/га, вермикулитной формой — 25,0 ц/га, жидкой формой — 24,4 ц/га.
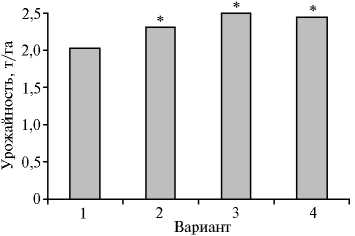
Рис. 2. Урожайность сои сорта Вилана при обработке семян разными формами биопрепарата на основе клубеньковых бактерий Bradyrhizobium japonicum (штамм 626а): 1 — контроль, 2 — на торфе, 3 — на вермикулите, 4 — жидкая форма (Ростовская обл., 2012-2014 годы).
*Различия с контролем достоверны.
На серых лесных почвах Брянской области твердофазные формы (на основе торфа и вермикулита) повышали урожайность ячменя на 5-10 %; при использовании жидкой формы она увеличивалась на 12-16 %.
В условиях Орловской области урожай зерна сои повышался на 6 % в варианте с препаратом на основе торфа и на 12 % при использовании жидкой формы биопрепарата (относительно контроля без инокуляции семян). На черноземных почвах Ростовской области прибавка урожая зерна сои при применении торфяной формы составила 19 %, жидкой формы — 25 %; на горохе эти показатели равнялись соот- ветственно 17 и 23 %. Высокую эффективность от инокуляции люцерны получили на серых лесных почвах Томской области, где прибавка при применении торфяных препаратов составила 20-70 %, жидкой формы — 30-90 %.
Важные условия повышения эффективности биопрепаратов — се- лекция и скрининг перспективных штаммов микроорганизмов с учетом агроэкологических условий.
3. Урожайность (т/га) сухой массы люцерны изменчивой сорта Агния при инокуляции семян разными штаммами клубеньковых бактерий Sinorhizo-bium meliloti в зависимости от типа почвы, на которой выращивали растения (Ленинградская обл.)
|
Вариант |
Среднее |
Прибавка к контролю |
|
Дерново-подзолистая почва |
(2008-2010 годы) |
|
|
Контроль |
6,1 |
|
|
Штамм 415б |
7,8 |
+1,7 |
|
Штамм 425а |
6,7 |
+0,6 |
|
Штамм А-3 |
7,6 |
+1,5 |
|
Штамм А-4 |
8,2 |
+2,1 |
|
НСР 05 |
0,6 |
|
|
Дерново-карбонатная почва |
(2012-2014 годы) |
|
|
Контроль |
8,7 |
|
|
Штамм 415б |
8,2 |
- 0,5 |
|
Штамм А-4 |
15,2 |
+6,5 |
|
Штамм А-5 |
22,0 |
+13,3 |
|
Штамм А-6 |
20,5 |
+11,8 |
|
НСР 05 |
1,1 |
Так, в Ленинградской области применение различных штаммов клубеньковых бактерий Sinorhizobium meliloti для инокуляции семян перед посевом люцерны изменчивой способствовало созданию эффективной растительно-микробной системы. При этом на дерново-подзолистой почве наиболее эффективным оказался штамм А-4, обеспечивавший прибавку урожая более 25 % и урожайности — 2,1 т/га сухой массы. На дерново- карбонатной почве лучшие результаты показал штамм А-5, который повышал продуктивность люцерны на 140 %; прибавка сухой массы к контролю при использовании для инокуляции штаммов А-5 и А-6 составила соответственно 13,3 и 11,8 т/га (табл. 3).
Таким образом, разработана методика полевой оценки эффективности новых форм микробных препаратов, повышающих урожайность и качество сельскохозяйственных культур. Показано, что новый тип питательных синтетических сред хорошо подходит для получения бактериальных препаратов в жидкой форме. Урожайность растений при использовании новых форм препаратов не ниже (или даже выше), чем при использовании традиционных форм. Исследованные биопрепараты удобны для применения, высокотехнологичны при производстве. Следует также учесть благоприятное влияние инокуляции на почвенное плодородие и экологическую обстановку.
Л И Т Е Р А Т У Р А
-
1ФГБНУ Всероссийский НИИ сельскохозяйственной Поступила в редакцию
микробиологии, 30 марта 2015 года
196608 Россия, г. Санкт-Петербург—Пушкин, ш. Подбельского, 3, e-mail: kojemyakov@rambler.ru , laktionov@list.ru , yanevich-2@mail.ru ;
-
2ФГБОУ ВПО Санкт-Петербургский
государственный аграрный университет,
196608 Россия, г. Санкт-Петербург—Пушкин, Санкт-Петербургское ш.,
-
2, корп. 1,
-
4ФГБОУ ВПО Донской государственный аграрный
университет,
346493 Россия, Ростовская обл., Октябрьский р-н, пос. Персиановский,
-
5ФГБОУ ВПО Красноярский государственный
аграрный университет,
660041 Россия, г. Красноярск, пр. Свободный, 66,
Sel’skokhozyaistvennaya biologiya [ Agricultural Biology ], 2015, V. 50, ¹ 3, pp. 369-376
THE SCIENTIFIC BASIS FOR THE CREATION OF NEW FORMS OF MICROBIAL BIOCHEMICALS
A.P. Kozhemyakov1, Yu.V. Laktionov1, T.A. Popova1, A.G. Orlova1, A.L. Kokorina2, O.B. Vaishlya3, E.V. Agafonov4, S.A. Guzhvin4, A.A. Churakov5, M.T. Yakovleva6
-
1All-Russian Research Institute for Agricultural Microbiology, Federal Agency of Scientific Organizations, 3, sh. Podbel’skogo, St. Petersburg, 196608 Russia, e-mail kojemyakov@rambler.ru , laktionov@list.ru , yanevich-2@mail.ru ;
-
2Saint Petersburg State Agrarian University, 2/1, Sankt-Peterburgskoe sh., St. Petersburg, 196608 Russia, e-mail spbgau@mail.ru ;
-
3Tomsk State University, 36, pr. Lenina, Tomsk, 634050 Russia, e-mail plantaplus@list.ru ;
-
4Donskoi State Agrarian University, pos. Persianovskii, Oktyabr’skii Region, Rostov Province, 346493 Russia, e-mail sguujvin@rambler.ru ;
-
5Krasnoyarsk State Agrarian University, 66, pr. Svobodnyi, Krasnoyarsk, 660041 Russia, e-mail a-tjn@ay.ru ;
-
6Yakutsk Research Institute of Agriculture , Federal Agency of Scientific Organizations, 23/1, ul. Bestuzheva-Marlinskogo, Yakutsk, 677001 Russia, e-mail maryatimofeevna@mail.ru
Supported by EurAsEC program «Innovative biotechnologies», State Contract ¹ 14.М04.12.0011.
Научные собрания

AГРОРУСЬ 2015
МЕЖДУНАРОДНАЯ АГРОПРОМЫШЛЕННАЯ
ВЫСТАВКА-ЯРМАРКА
Специализированные экспозиции. Деловая программа (22 августа-30 августа 2015 года, г. Москва)
Тематические разделы:
-
• Оборудование для переработки и хранения сельхозпродукции
-
• Научные разработки и технологии
-
• Сельскохозяйственная техника
-
• Продукты питания и напитки. Пищевые добавки
-
• Животноводство. Звероводство. Птицеводство.
-
• Ветеринария. Зоотехния. Корма.
-
• Удобрения. Семена. Рассада. Садово-огородный инвентарь. Теплицы.
-
• Автономные энергетические и инженерные системы
-
• Поместно-усадебное домостроение, технологии и материалы
-
• АГРО/ЭКО туризм. Развитие сельских территорий
-
• Оборудование для лесной промышленности
-
• Транспорт и логистика
-
• Образование в АПК
Контакты и информация:
Список литературы Агротехнологические основы создания усовершенствованных форм микробных биопрепаратов для земледелия
- Завалин А.А. Биопрепараты, удобрения и урожай. М., 2005.
- Тихонович И.А., Кожемяков А.П., Чеботарь В.Ч. и др. Биопрепараты в сельском хозяйстве. М., 2005.
- Благовещенский Г.В., Войтович И.В., Штырхунов В.Д., Ольховый В.Е. Влияние многолетних трав на плодородие почв. Кормопроизводство, 2003, 4: 20-23.
- Емельянова А.Г., Яковлева М.Т., Кожемяков А.П. Прием улучшения плодородия мерзлотных почв с использованием инокуляции семян люцерны желтой штаммами клубеньковых и ассоциативных бактерий. Методическое пособие. Якутск, 2014.
- Кожемяков А.П., Тимофеева С.В., Попова Т.А. Разработка и перспективы использования биопрепаратов комплексного действия. Защита и карантин растений, 2008, 2: 42-43.
- Мишустин Е.Н. Азотный баланс в зонах СССР. В сб: Минеральный и биологический азот в земледелии СССР. М., 1985: 3-11.
- Кожемяков А.П. Продуктивность азотфиксации в агроценозах. Микробиологический журнал, 1997, 59(4): 22-28.
- Beveridge C.A., Mathesius U., Rose R.J., Gresshoff P. Common regulatory themes in meristem development and whole-plant homeostasis. Curr. Opin. Plant Biol., 2007, 10: 44-51 ( ) DOI: 10.1016/j.pbi.2006.11.011
- Marra L.M., Fonseca Sousa Soares C.R., Oliveira S.M., Avelar Ferreira P.A., Soares B.L. Biological nitrogen fixation and phosphate solubilization by bacteria isolated from tropical soils. Plant Soil, 2012, 357: 289-307 ( ) DOI: 10.1007/s11104-012-1157-z
- Хотянович А.В. Методы культивирования азотфиксирующих бактерий, способы получения и применение препаратов на их основе (методические рекомендации). Л., 1991.
- Tittabutr P., Payakapong W., Teaumroong N., Singleton P.W., Boonkerd N. Growth, survival and field performance of bradyrhizobial liquid inoculant formulations with polymeric additives. Science Asia, 2007, 33: 69-77.
- Albareda M., Rodriguez-Navarro D.N., Camacho M., Temprano F.J. Alternatives to peat as a carrier for rhizobia inoculants: solid and liquid formulations. Soil Biol. Biochem., 2008, 40: 2771-2779 ( ) DOI: 10.1016/j.soilbio.2008.07.021
- Covarrubias S.A., de-Bashan L.E., Moreno M., Bashan Y. Alginate beads provide a beneficial physical barrier against native microorganisms in wastewater treated with immobilized bacteria and microalgae. Appl. Microbiol. Biotechnol., 2012, 93(6): 2669-2680 ( ) DOI: 10.1007/s00253-011-3585-8
- Denton M.D., Pearce D.J., Ballard R.A., Hannah M.C., Mutch L.A., Norng S. A multi-site field evaluation of granular inoculants for legume nodulation. Soil Biol. Biochem., 2009, 41: 2508-2516 ( ) DOI: 10.1016/j.soilbio.2009.09.009
- Diaz-Zorita M., Fernandez-Canigia M.V. Field performance of a liquid formulation of Azospirillum brasilense on dry land wheat productivity. Eur. J. Soil Biol., 2009, 45: 3-11 ( ) DOI: 10.1016/j.ejsobi.2008.07.001
- John R.P., Tyagi R.D., Brar S.K., Prevost D. Development of emulsion from rhizobial fermented starch industry wastewater for application as Medicago sativa seed coat. Eng. Life Sci., 2010, 10: 248-256.
- Лактионов Ю.В. Бактериальные препараты. LAP LAMBERT Academic Publishing, 2011 (ISBN 978-3-8433-1137-3).
- Лактионов Ю.В., Попова Т.А., Андреев О.А., Ибатуллина Р.П., Кожемяков А.П. Создание стабильной формы ростстимулирующих микробиологических препаратов и их эффективность. Сельскохозяйственная биология, 2011, 3: 116-118.
- Tikhonovich I. A., Kozhemyakov A.P., Provorov N.A. Genetic potential of plants for improving the beneficial microbe interactions. NATO ASI series. In: Biological fixation of nitrogen for ecology and sustainable agriculture. Berlin, 1997: 191-194.
- Белимов А.А., Воробьев Н.И., Кожемяков А.П. Применение дисперсионного анализа в изучении механизмов взаимодействия растений и корневых диазотрофов. Бюлл. ВНИИСХМ, 1989, 52: 6-12.
- Лактионов Ю.В., Кожемяков А.П. Использование синтетических и натуральных питательных средств для производства жидких форм биопрепаратов на основе клубеньковых бактерий. Мат. докл. 7-й конф. «Перспективы использования новых форм удобрений, средств защиты и регуляторов роста растений в агротехнологиях сельскохозяйственных культур». Анапа, 2012: 86-87.
- Лактионов Ю.В., Попова Т.А., Андреев О.А., Ибатуллина Р.П., Кожемяков А.П. Создание стабильной формы ростстимулирующих микробиологических препаратов и их эффективность. В сб.: Современные подходы в биотехнологии Республики Татарстан. Казань, 2013: 34-38.
- Лактионов Ю.В., Белоброва С.Н., Кожемяков А.П., Воробьев Н.И., Сергалиев Н.Х., Аменова Р.К. Эффективность бобово-ризобиального симбиоза «нут Cicer arientium L.-бактерии Mezorizobium cicer» при использовании минеральных удобрений. Плодородие, 2013, 5: 24-25.
- Берестецкий О.А., Доросинский Л.М., Кожемяков А.П. Эффективность препаратов клубеньковых бактерий в Географической сети опытов. Известия АН СССР, серия биологическая, 1987, 5: 670-679.


