Аэробное целлюлозолитическое сообщество ассоциантов сфагнового мха Sphagnum fallax как основа в процессах деструкции пожнивных остатков
Автор: Щербаков А.В., Русакова И.В., Орлова О.В., Воробьев Н.И., Свиридова О.В., Щербакова Е.Н., Чеботарь В.К.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Почвенная микробиология
Статья в выпуске: 1 т.49, 2014 года.
Бесплатный доступ
В настоящее время в сельскохозяйственной практике остро стоит проблема утилизации отходов производства, в частности наиболее актуальным остается вопрос о переработке стерни и соломы зерновых культур. Методом накопительных культур из тканей сфагнового мха Sphagnum fallax (H. Klinggr.) H. Klinggr. нами выделена аэробная целлюлозолитическая микробная ассоциация (ЦМА), стабильная при периодическом культивировании в жидкой минеральной среде с добавлением целлюлозы. Установлено таксономическое положение пяти доминантных компонентов сообщества и изучены их физиолого-биохимические свойства. В микрополевом опыте проведено сравнение эффективности утилизации растительных остатков зерновых культур изучаемого ЦМА, а также культуры Bacillus subtilis Ч-13 и микробного препарата баркон. Полученные экспериментальные данные свидетельствуют о влиянии культур микроорганизмов на процессы гумификации и минерализации соломы в почве, что позволяет дать обоснованную агроэкологическую оценку эффективности использования соломы зерновых культур совместно с биопрепаратами в специализированном зерновом севообороте. Эффективность изучаемого ЦМА в отношении ускорения минерализации и гумификации пожнивных остатков ячменя, внесенных в пахотный слой дерново-подзолистой почвы в качестве удобрения, доказана на основании изменения следующих показателей: повышения численности микроорганизмов - деструкторов свежего органического вещества, увеличения коэффициента минерализации и содержания микробной биомассы, усиления эмиссии СО 2, роста актуальной целлюлозолитической активности и содержания легкоразлагаемого органического вещества. Активность ЦМА была максимальной в начальные сроки после инокуляции и заделки соломы в почву.
Сфагновые мхи, целлюлозолитическая микробная ассоциация, утилизация стерни и соломы зерновых культур
Короткий адрес: https://sciup.org/142134831
IDR: 142134831 | УДК: 579.64+631.572:633.1
Текст научной статьи Аэробное целлюлозолитическое сообщество ассоциантов сфагнового мха Sphagnum fallax как основа в процессах деструкции пожнивных остатков
В настоящее время в сельскохозяйственной практике остро стоит проблема утилизации отходов сельскохозяйственного производства, в частности особенно актуальными остаются вопросы переработки стерни и соломы зерновых культур. Общая масса получаемой соломы злаковых в мире оценивается в 2900 млн т (1), причем большая ее часть сжигается, что значительно загрязняет окружающую среду и запрещено законом во многих странах, в том числе в России. Показано, что к наиболее эффективным и безопасным способам переработки стерни злаковых относится ее деструкция с использованием микробиологических препаратов (2-4).
Ранее нами отмечалось, что сфагновые мхи служат уникальными местообитаниями для микроорганизмов (5), которые могут быть перспективны для сельскохозяйственной биотехнологии (6, 7). Кроме того, имеются сведения о присутствии представителей Actinobacteria и Strepto-myces , которые активно осуществляют деструкцию природных полимеров, в том числе целлюлозы, в составе торфяных отложений сфагновых болот (8, 9).
Цель настоящей работы — выделение бактериальных ассоциантов сфагновых мхов, обладающих целлюлозолитической активностью, и изучение влияния этих микроорганизмов на процессы разложения растительных остатков и баланс гумуса в почве.
Методика. Ассоциацию целлюлозолитических бактерий выделяли из образцов сфагновых мхов Sphagnum fallax (H. Klinggr.) H. Klinggr., ранее отобранных в районе оз. Волоярви (Ленинградская обл.) (7). Для изоляции бактерий использовали метод накопительных культур в жидкой среде Гетченсона (10) с pH 5,0. Для этого 3-5 растений мха, отмытых в стерильном физиологическом растворе, тщательно перетирали в асептических условиях с добавлением 10 мл физраствора до кашицеобразного состояния. Затем по 1 мл полученной растительной массы вносили в колбы с 50 мл среды Гетченсона и складчатым фильтром из фильтровальной бумаги. Посевы инкубировали стационарно 14 сут при температуре 20 ° C, периодически встряхивая, и отмечали изменения в структуре складчатого фильтра. По результатам роста в накопительной культуре отобрали один образец, у которого наблюдалась максимальная степень разложения фильтровальной бумаги.
При определении стабильности целлюлозолитической ассоциации провели 10 последовательных пассажей культуры, для чего по 100 мкл первоначальной суспензии вносили в колбы с 200 мл среды Гетченсона с добавлением 5 г измельченной фильтровальной бумаги и инкубировали 7 сут при 20 ° C с аэрацией (220 об/мин), отмечая изменения в цвете и консистенции фильтровальной бумаги.
Полученную культуру, представляющую собой смесь бактериальной массы и остатков полудеградированых волокон целлюлозы, исследовали под микроскопом («Ломо», Россия) в живых и окрашенных препаратах (10). Целлюлазную активность сообщества определяли по методике Кассана (11) в сравнении с обладающей целлюлазной активностью жидкой культурой Bacillus subtilis 4-13 из коллекции лаборатории технологии микробных препаратов Всероссийского НИИ сельскохозяйственной микробиологии (ВНИИСХМ). Для разделения ассоциации и выделения доминантных форм чистых культур суспензию методом последовательных серийных разведений высевали на поверхность агаризованой среды Гетченсона с 1 % микрокристаллической целлюлозы и инкубировали 7 сут при 20 ° C. Колонии бактерий отсевали на свежие чашки Петри и в пробирки со скошенным агаром и описывали культурально-морфологические свойства полученных изолятов. Их физиолого-биохимические признаки исследовали методом мультисубстратного анализа с применением системы GEN III Microplate («BioLog», США).
Для молекулярно-генетической идентификации чистых культур доминантных изолятов бактериальную ДНК выделяли с помощью стандартного метода (лизис лизоцимом и SDS с последующей экстракцией с помощью фенола и хлороформа). Фрагмент гена 16S-рРHК амплифицирова-ли с использованием праймеров BD1/FD1 (12), ампликоны после очистки из геля секвенировали согласно протоколу фирмы «Beckman Coulter» (США) для 8-канального секвенатора SEQ8000 с коммерческим набором SEQ Dye Terminator Cycle Sequencing (DTCS) with Quick Start Kit.
Видовую принадлежность изолятов определяли с помощью программы BLAST GenBank .
Влияние целлюлозолитической ассоциации на процессы разложения растительных остатков и баланс гумуса в почве исследовали в микрополевом опыте, заложенном осенью 2011 года после уборки ярового ячменя (сорт Зазерский 85) на опытном поле Всероссийского научно-исследовательского, конструкторского и проектно-технологического института органических удобрений и торфа (ВНИИОУ) согласно схеме: 1 — без удобрений (контроль); 2 — солома ячменя (5 т/га); 3 — солома ячменя
(5 т/га) + N50; 4 — солома ячменя (5 т/га) + N50 + препарат баркон (ВНИИСХМ) (13-15); 5 — солома ячменя (5 т/га) + N50 + культура B . sub-tilis 4-13; 6 — солома ячменя (5 т/га) + N50 + культура ЦМА. Опыт закладывали на двух полях, площадь опытной делянки 3,36 м2 (2,1*1,6 м), повторность опыта 4-кратная. Почва участка дерново-подзолистая супесчаная. В эксперименте использовали солому ячменя с опытного поля ВНИИОУ. Солому после уборки зерна измельчали (размер фрагментов 1-3 см) и равномерно распределяли по делянке вручную из расчета указанной выше дозы. После этого по поверхности соломы распределяли компенсирующую дозу азота (N50) в виде аммиачной селитры и изучаемые культуры микроорганизмов согласно схеме опыта. В тот же день (28 августа 2011 года) обработанную таким образом солому равномерно заделывали в почву на глубину 0-20 см (модель зяблевой вспашки).
Для оценки влияния применяемых культур микроорганизмов на скорость трансформации соломы и показатели плодородия дерново-подзолистой почвы изучали минерализационные потери (эмиссию CO2 из пахотного слоя почвы) — абсорбционным методом по И.Н. Шаркову каждые 7 сут (16); численность основных физиологических групп микроорганизмов (ФГМ) — посевом почвенной суспензии на агаризованные и жидкие питательные среды (10); содержание микробной биомассы (Смик) — методом регидратации-экстракции (17); динамику содержания азота — по ГОСТ (18); нитрифицирующую способность (НС) — по методу Крав-кова; актуальную (полевую) целлюлозолитическую активность — по доле (%) разложенной целлюлозы; содержание углерода, экстрагируемого горячей водой (Сэгв), — согласно описанию (17). Учет величины и структуры урожая у ярового сорта тритикале Амиго и статистическую обработку полученных данных выполняли по Б.А. Доспехову (19). Углерод микробной биомассы определяли в динамике после заделки соломы ячменя (с 6 сентября по 9 ноября 2011 года) и в течение вегетационного периода 2012 года (с 4 мая по 6 сентября).
Результаты. Методом накопительной культуры в жидкой минеральной среде с добавлением целлюлозы была выделена целлюлозолитическая микробная ассоциация, которая через 14 сут инкубации практически
А
Б
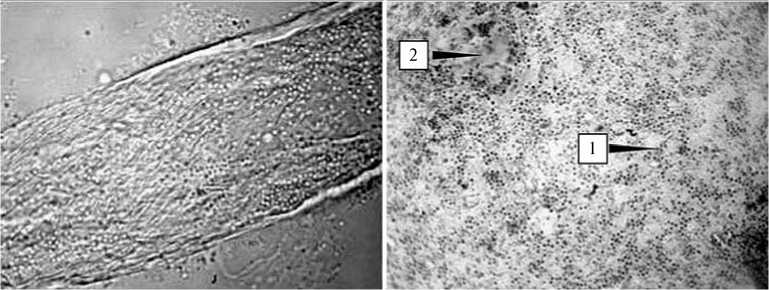
Рис. 1. Аэробная целлюлозолитическая ассоциация микроорганизмов, выделенная из тканей сфагнового мха Sfagnum fallax (H. Klinggr.) H. Klinggr.: A — колонизация бактериями волокон целлюлозы, Б — жидкая культура целлюлозолитической микробной ассоциации на 14-е сут роста; 1 — активно развивающиеся целлюлозолитические микроорганизмы, 2 — остатки деградированного целлюлозного волокна. Неокрашенный препарат; световая микроскопия, увеличение *1000.
полностью разрушала структуру субстрата и изменяла его физические свойства; в результате сама накопительная культура представляла собой смесь культуральной жидкости желтого цвета и остатков целлюлозных волокон. Дальнейшее микроскопическое исследование накопительной культуры показало, что целлюлозные волокна активно колонизируются комплексом микроорганизмов, представленных разными морфологическими типами, основу которого составляют грамотрицательные неспорообразующие палочки различной морфологии (рис. 1).
В результате ряда последовательных пересевов с культивированием в аэробных условиях в жидкой среде с периодическим встряхиванием было установлено, что изучаемая культура стабильна и активно деградирует целлюлозные волокна, разрушая структуру целлюлозного фильтра и окрашивая культуральную жидкость в желтый цвет. Сравнительный тест на целлюлазную активность в агаризованной среде выявил, что диаметр зоны деградации целлюлозы в варианте с исследуемой ЦМА составляет 70 мм, в то время как для контрольной культуры B . subtilis 4-13 он не превышал 30 мм.
Методом последовательных серийных разведений с высевом на ага-ризованную среду Гетченсона с 1 % микрокристаллической целлюлозы ассоциацию разделили на пять доминантных бактериальных изолятов (каждый способен расти в чистой культуре), и их культурально-морфологические и физиолого-биохимические свойства были охарактеризованы (табл. 1). По результатам молекулярно-генетической идентификации установлено, что в состав сообщества входят следующие микроорганизмы, различающиеся по таксономическому положению: B . cereus , Variovorax sp., Delftia sp., Flavobacterium sp., Rhodococcus erythropolis .
1. Физиолого-биохимические свойства доминантных компонентов изучаемой целлюлозолитической микробной ассоциации, выделенной из образцов сфагнового мха Sphagnum fallax (H. Klinggr.) H. Klinggr.
|
Характеристика |
1з is |
8 ■g |
A U |
S 1 Ьч К U |
S е* |
|
Рост при pH 5,0 |
+ |
+ |
+ |
+ |
+ |
|
Рост при 1 % NaCl |
+ |
+ |
+ |
+ |
+ |
|
Оптимум t, °С |
28 |
28 |
28 |
28 |
28 |
|
Разжижение желатина |
+ |
- |
- |
+ |
- |
|
Усвоение углеводов и их производных: |
|||||
|
целлюлоза |
- |
- |
- |
+ |
+ |
|
декстрин |
+ |
± |
- |
+ |
- |
|
D-мальтоза |
+ |
- |
- |
+ |
- |
|
D-трегалоза |
+ |
- |
- |
- |
+ |
|
D-целлобиоза |
+ |
- |
- |
+ |
- |
|
гентиобиоза |
+ |
- |
+ |
+ |
- |
|
сахароза |
+ |
- |
- |
+ |
+ |
|
D-тураноза |
+ |
- |
- |
- |
± |
|
D-рафиноза |
- |
- |
- |
+ |
- |
|
D-лактоза |
- |
- |
- |
- |
- |
|
D-мелибиоза |
± |
- |
- |
+ |
- |
|
a-D-глюкоза |
+ |
+ |
- |
+ |
- |
|
D-манноза |
- |
+ |
- |
+ |
- |
|
D-фруктоза |
+ |
+ |
+ |
+ |
+ |
|
D-галактоза |
- |
+ |
+ |
+ |
- |
|
D-фруктоза |
+ |
+ |
+ |
- |
- |
|
Ь-фруктоза |
+ |
+ |
+ |
+ |
- |
|
Ь-рамноза |
+ |
+ |
- |
+ |
- |
|
инозин |
+ |
+ |
- |
- |
- |
|
D-сорбитол |
- |
+ |
+ |
- |
+ |
|
D-маннитол |
- |
+ |
- |
- |
+ |
|
D-арабитол |
- |
+ |
- |
- |
+ |
|
глицерол |
+ |
+ |
- |
- |
+ |
|
инозитол |
+ |
- |
- |
- |
+ |
|
пектин |
+ |
- |
- |
+ |
+ |
Продолжение таблицы 1
Данные, полученные в микрополевом опыте с применением культуры изучаемого целлюлозолитического сообщества, а также B. subtilis 4-13 и микробного препарата баркон, свидетельствовали об их влиянии на про цессы гумификации и минерализации соломы в почве, что позволяет дать обоснованную агроэкологическую оценку эффективности использования соломы зерновых совместно с микробными культурами в специализиро ванном зерновом севообороте.
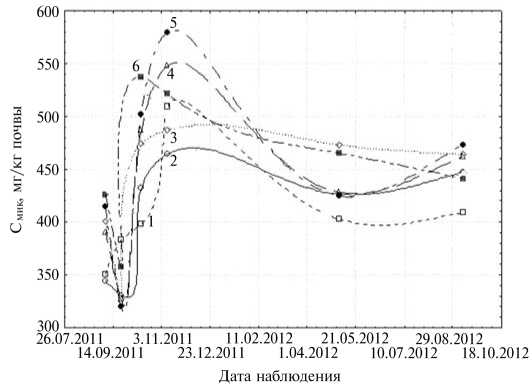
Рис. 2. Динамика содержания микробной биомассы (Смик) в пахотном слое дерново-подзолистой супесчаной почвы в зависимости от варианта использования соломы ячменя (сорт Зазерский 85) в сочетании с исследуемыми микробными культурами : 1 — без удобрений, 2 — солома 5 т/га, 3 — солома 5 т/га + N50, 4 — солома 5 т/га + N50 + препарат баркон, 5 — солома 5 т/га + N50 + Bacillus subtilis 4-13, 6 — солома 5 т/га + N50 + целлюлозолитическая микробная ассоциация (ЦМА), выделенная из образцов сфагнового мха Sphagnum fallax (H. Klinggr.) H. Klinggr. (микрополевой опыт, Владимирская обл., 2011-2012 годы).
Микробная биомасса может служить важным показателем, характеризующим биологическое состояние пахотных почв и отражающим влияние агротехнических факторов. Согласно результатам анализа, динамика содержания микробной биомассы (Смик) в пахотном слое почвы на делянке имела следующие особенности (рис. 2). Все варианты с применением культур микроорганизмов на 10-е сут после заделки соломы превосходили по величине Смик контроль на 15-30 %. В последующие два срока наблюдений (13 ок тября и 9 ноября) в этих вариантах поддерживались более высокие показатели с максимальными значениями в 5-м и 6-м вариантах (в среднем
529-541 мг/кг почвы, что на 10-13 % выше, чем в варианте, когда в почву вносили неинокулированую микробами солому). Осенью после уборки тритикале наибольшим содержанием углерода микробной биомассы Смик также характеризовались 5-й и 6-й варианты (соответственно с культурой B. subtilis 4-13 и ЦМА).
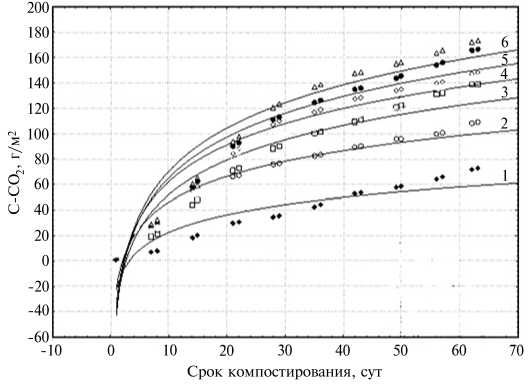
Рис. 3. Кумулятивные кривые эмиссии СО2 (С-СО 2 ) в зависимости от варианта использования соломы ячменя (сорт Зазер-ский 85) в сочетании с исследуемыми микробными культурами : 1 — без удобрений, 2 — солома 5 т/га, 3 — солома 5 т/га + N50, 4 — солома 5 т/га + N50 + препарат баркон, 5 — солома 5 т/га + N50 + Bacillus subtilis 4-13, 6 — солома 5 т/га + N50 + целлюлозолитическая микробная ассоциация (ЦМА), выделенная из образцов сфагнового мха Sphagnum fallax (H. Klinggr.) H. Klinggr. (микрополевой опыт, Владимирская обл., 2011-2012 годы).
Наблюдения за размерами эмиссии СО2 из почвы в динамике, начиная с 1-х сут после заделки соломы с биологическими препаратами, и расчет кумулятивных кривых эмиссии двуокиси углерода по вариантам опыта (рис. 3) показали, что за период наблюдений (63 сут) минимальное количество СО2 выделилось из почвы в контроле (вариант без удобрений, 72,5 г/м2). При внесении соломы анализируемый показатель возрос в 1,5 раза (до 109,42 г/м2). Добавка компенсирующей дозы минераль ного азота к соломе способствовала увеличению эмиссии углерода до 139,32 г/м2. Все использованные в опыте культуры микроорганизмов про явили высокую эффективность в отношении интенсификации разложения растительной биомассы соломы, что зафиксировано по увеличению объемов выделения СО2. За срок наблюдений в вариантах с внесением культур микроорганизмов объемы выделившегося CO2 были в сумме на 32-58 % выше, чем в случае, когда солому не инокулировали микроорганизмами и не добавляли компенсирующую дозу азота, и на 4-24 % выше по сравнению с вариантом, когда солому вносили совместно с N50. Согласно полученным данным, по интенсивности влияния на минерализационные потери СО2 в проведенном опыте культуры микроорганизмов можно расположить в последовательности: B. subtilis 4-13 > ЦМА > микробный препарат баркон.
Экспериментальные данные, полученные при исследовании дина мики содержания минерального азота в пахотном слое, свидетельствовали, что при добавлении компенсирующей дозы азота этот показатель значительно превышал контроль во все сроки отбора проб. Следует отметить вариант с применением ЦМА, в котором анализируемый показатель во все сроки оставался наибольшим. В результате изучения динамики численности ФГМ, участвующих в круговороте углерода и азота, было установлено, что инокуляция культурами микроорганизмов и заделка соломы значительно увеличивают популяцию агрономически полезных групп микроорганизмов, особенно по данным на 9 ноября 2011 года. При использовании ЦМА наблюдался существенный рост численности аммонифицирую- щих и амилолитических микроорганизмов, которая была максимальной в указанном варианте опыта (табл. 2).
2. Показатели биологического состояния дерново-подзолистой супесчаной почвы в зависимости от варианта использования соломы ячменя (сорт Зазер-ский 85) в сочетании с исследуемыми микробными культурами (микрополевой опыт, Владимирская обл., 2011-2012 годы)
|
Вариант |
Численность микроорганизмов, тыс. КОЕ/г почвы |
Км |
|||||
|
1 h S |
h S £ 5 & |
1 S О Д « о О R Д § 1 § Bog V Ц S У У У |
О Л |
& В S д |
8 s = и |
||
|
Без удобрений |
7934 |
17333 |
25,0 |
49,5 |
7,4 |
250 25 |
2,29 |
|
Солома 5 т/га |
17834 |
24700 |
36,7 |
73,7 |
15,5 |
1500 150 |
1,43 |
|
Солома 5 т/га + N 50 |
24767 |
40767 |
45,9 |
126,0 |
18,2 |
950 450 |
1,68 |
|
Солома 5 т/га + N 50 + препарат баркон |
18100 |
37167 |
37,7 |
92,2 |
31,3 |
45000 25 |
2,08 |
|
Солома 5 т/га + N 50 + Bacillus subtilis Ч-13 |
15700 |
28534 |
30,9 |
109,5 |
24,2 |
4500 250 |
1,81 |
|
Солома 5 т/га + N 50 + целлюлозолитиче- |
47734 |
81000 |
38,2 |
100,2 |
24,6 |
250 |
1,73 |
|
ская микробная ассоциация (ЦМА) |
95 |
||||||
|
Примечание. Км — коэффициент минерализации (над чертой — |
через 3 |
мес, под |
чертой — |
че- |
|||
|
рез 1 год). ЦМА выделена из образцов сфагнового мха Sphagnum fallax (H. Klinggr.) H. Klinggr. |
|||||||
Проведенный микробиологический анализ показал, что, несмотря на общее снижение численности выявляемых ФГМ (по сравнению с осенними сроками определения), в вариантах с применением культур микроорганизмов суммарная биологическая активность была выше, чем при заделке неинокулированной соломы. При использовании ЦМА отмечались более высокие значение коэффициента минерализации Км. Через 1 год после внесения соломы и культур микроорганизмов (3 октября 2012 года) различия в интенсивности микробиологических процессов нивелировались по всем вариантам, но анализируемый показатель оставался на 2839 % выше, чем в варианте без удобрений.
При проведении анализов определение общей численности протеолитических почвенных микроорганизмов на МПА было дополнено учетом r-стратегов, быстро развивающихся за счет легкодоступных соединений. Их относительно высокая доля от общего числа выделяемых на МПА микроорганизмов, которую мы отмечали в вариантах с культурами B . subtilis Ч-13 (52 %) и ЦМА (46 %), может свидетельствовать о более активном освоении внесенного органического субстрата и энергично протекающих процессах минерализации.
Влияние обработки соломы культурой целлюлозолитической микробной ассоциации отразилось на содержании углерода, экстрагируемого горячей водой (Сэгв). Наблюдалась тенденция к увеличению этого показателя весной 2012 года (4 мая) в вариантах с внесением инокулированной соломы по сравнению с вариантами, где послеуборочные остатки не инокулировались микробными культурами. В почве, отобранной после уборки тритикале, различия по вариантам не зафиксировали. При учете урожайности ярового сорта тритикале не выявили достоверных различий по вариантам опыта. Можно отметить тенденции к снижению урожайности при заделке соломы без компенсирующей дозы азота и к увеличению урожайности при использовании ЦМА и B. subtilis Ч-13 и (табл. 3).
-
3. Урожайность тритикале (яровой сорт Амиго) в зависимости от варианта использования соломы ячменя (сорт Зазерский 85) в сочетании с исследуемыми микробными культурами (микрополевой опыт, почва дерново-подзолистая супесчаная, Владимирская обл., 2012 год)
-
11. Kasana R., Sal wan R., Dhar H., Dutt S., Gulati A. A rapid and easy method for the detection of microbial cellulases on agar plates using Gram’s iodine. Curr. Microbiol., 2006, 57(5): 503-507.
-
12. Коростик Е.В., Пинаев А.Г., Ахтемова Г.А., Андронов Е.Е. Универсальные 16S рРНК праймеры BD1 для описания генетического разнообразия сообщества почвенных прокариот. Экологическая генетика, 2006, 4(4): 32-37.
-
13. Русакова И.В., Воробьев Н.И. Способ эффективного использования соломы в качестве удобрения с применением биопрепарата Баркон. Владимир, 2010.
-
14. Русакова И.В., Воробьев Н.И. Использование биопрепарата Баркон для иноку-лирования соломы, применяемой в качестве удобрения. Достижения науки и техники АПК, 2011, 8: 25-28.
-
15. Русакова И.В., Воробьев Н.И. Влияние биопрепарата Баркон на процессы гумификации соломы. Агрохимия, 2011, 1: 48-55.
-
16. Шарков И.Н. Определение интенсивности продуцирования СО2 почвой адсорбционным методом. Почвоведение, 1984, 7: 136-143.
-
17. Казеев К.Ш., Колесников С.И., Вальков В.Ф. Биологическая диагностика и индикация почв: методология и методы исследований. Ростов-на-Дону, 2003.
-
18. ГОСТ 26107-84 Почвы. Методы определения общего азота. М., 1984.
-
19. Доспехов Б.А. Методика полевого опыта (с основами статистической обработки результатов исследований). М., 1985.
|
Вариант |
Урожайность, г/м2 |
Изменение урожайности |
|
|
г/м2 |
% |
||
|
Без удобрений |
150 |
||
|
Солома 5 т/га |
143 |
-7 |
-5 |
|
Солома 5 т/га + N 50 |
158 |
+8 |
+5 |
|
Солома 5 т/га + N 50 + препарат баркон |
158 |
+8 |
+5 |
|
Солома 5 т/га + N 50 + Bacillus subtilis Ч-13 |
164 |
+14 |
+9 |
|
Солома 5 т/га + N 50 + целлюлозолитическая |
|||
|
микробная ассоциация (ЦМА) |
168 |
+18 |
+12 |
|
НСР „5 |
29,4 |
||
Примечание. ЦМА выделена из образцов сфагнового мха Sphagnum fallax (H. Klinggr.) H. Klinggr.
Таким образом, в условиях микрополевого опыта (2011-2012 годы) выделенная нами целлюлозолитическая микробная ассоциация (ЦМА) показала эффективность в отношении ускорения минерализации и гумификации пожнивных остатков ячменя, внесенных в пахотный слой дерново-подзолистой супесчаной почвы в качестве удобрения, что было зарегистрировано по следующим изменениям показателей: по увеличению численности микроорганизмов — деструкторов свежего органического вещества; по увеличению коэффициента минерализации; по росту содержания микробной биомассы, увеличению эмиссии СО2, повышению актуальной целлюлозолитической активности; по увеличению содержания легкоразла-гаемого органического вещества. Активность ЦМА была максимальной в начальные сроки после инокуляции и заделки соломы в почву.


