Актиномикоз длинных трубчатых костей и перипротезная инфекция актиномикотического происхождения
Автор: Туфанова О.С., Касимова А.Р., Антипов А.П., Анисимова Л.О., Козлова О.П., Божкова С.А.
Журнал: Кафедра травматологии и ортопедии @jkto
Рубрика: Оригинальное исследование
Статья в выпуске: 2 (52), 2023 года.
Бесплатный доступ
Введение. Остеомиелит длинных трубчатых костей конечностей и перипротезная инфекция (ППИ) актиномикотического происхождения встречается крайне редко. Подавляющее число публикаций посвящено актиномикотическому остеомиелиту нижней челюсти, костей лицевого отдела черепа, грудины и позвонков. Трудности в диагностике приводят к отсрочке назначения этиотропной терапии и ухудшению прогноза для таких больных. Цель исследования - оценить частоту выявления актиномицетов у пациентов с остеомиелитом длинных трубчатых костей и перипротезной инфекции и повысить информированность практикующих врачей об актиномикозе у пациентов ортопедического профиля. Материалы и методы. Проведен ретроспективный анализ частоты выделения Actinomyces spp. от пациентов, которые находились на лечении в отделениях центра с 01.01.2010 по 31.12.2022. Представлен клинический случай актиномикотического остеомиелита у пациентки, находившейся на лечении в отделении гнойной остеологии в 2022 г. Результаты. За исследуемый период было выявлено 98 положительных результатов посевов у 46 пациентов. Этиологическая значимость подтверждена у 11 из них (возбудитель идентифицирован в 3 и более образцах). Из них актиномикоз с крупных суставов и длинных трубчатых костей нижней конечности был выявлен у 6 пациентов, из которых было 2 мужчин, 4 женщин в возрасте от 45 до 85 лет. Все пациенты имели клинические и лабораторные признаки инфекционного процесса, им было проведено хирургическое вмешательство и назначена этиотропная антибактериальная терапия. В результате актиномикотического процесса ремиссия была достигнута у 5 пациентов, информация об исходе у 1 пациента не известна. Обсуждение. Актиномикотический остеомиелит длинных трубчатых костей- редкая форма заболевания, при которой часто возникают ошибки в диагностической и лечебной тактике. В литературе встречаются лишь описание единичных клинических случаев, причем частота встречаемости перипротезной инфекции данной этиологии выше, чем поражение нативных суставов. Заключение. В ходе исследования было выявлено всего 6 случаев актиномикотического поражения длинных трубчатых костей и перипротезной инфекции за 12 лет, благодаря правильной лечебной тактике удалось добиться ремиссии инфекционного процесса.
Актиномикоз, остеомиелит, перипротезная инфекция, костный актиномикоз, антибактериальная терапия
Короткий адрес: https://sciup.org/142238947
IDR: 142238947 | УДК: 617.3 | DOI: 10.17238/2226-2016-2023-2-47-55
Текст научной статьи Актиномикоз длинных трубчатых костей и перипротезная инфекция актиномикотического происхождения
Актиномицеты являются нормальными обитателями человеческого организма: они колонизируют поверхности зубов, слюнных желез, миндалин, входят в состав физиологической микробиоты кишечника, цервикального канала и влагалища [1; 2]. В результате снижения иммунной реактивности организма, нарушения целостности кожи и слизистых оболочек происходит локальное скопление актиномицетов, что может привести к развитию актиномикоза [3; 4]. Значимым фактором риска развития инфекционного процесса является наличие ассоциации актиномицетов с другими микроорганизмами, в 99% случаев актиномикоз – это микст-инфекция, где актино-мицеты играют ведущую роль [5].
Выделяют несколько форм актиномикоза: шейно-лицевой, органов грудной полости, брюшной полости (висцеральный) центральной нервной системы (встречается крайне редко), а также кожи, подкожно-жировой клетчатки, фасций, мышц и костных структур [2]. Для этого заболевания характерно медленно прогрессирующее течение, неспецифическая клиническая картина, что приводит к поздней диагностике и несвоевременно начатому лечению [6; 7]. Диагностика актиномикоза основывается на выявлении в материале из очагов поражения возбудителя при культуральном исследовании и/или нахождении характерных тканевых форм – друз (гранул) при микроскопии или гистологическом исследовании из отделяемого раны, гнойных полостей и пораженных структур, с удаленных конструкций и интраоперационного материала [8–11].
В настоящее время данные о распространенности актиномикоза опорно-двигательного аппарата (в том числе протезированных суставов) крайне ограничены. Подавляющее число публикаций посвящено актиномикотическому остеомиелиту нижней челюсти, костей лицевого отдела черепа, грудины и позвонков. Информация о первичном остеомиелите костей конечностей и перипротезной инфекции данной этиологии крайне скудна и представлена статьями, описывающими отдельные клинические случаи [12; 13].
Цель работы – оценить частоту выявления актиномицетов у пациентов с остеомиелитом длинных трубчатых костей и перипротезной инфекции и повысить информированность практикующих врачей об актиномикозе у пациентов ортопедического профиля.
Материалы и методы
Выполнен ретроспективный анализ частоты выделения Actinomyces sp. от пациентов, которые находились на лечении в отделениях центра с 1.01.2010 по 31.12.2022. Эпидемиологический анализ результатов бактериологических исследований интраоперационного материала (тканевые биоптаты, металлоконструкция, синовиальная жидкость, гематома) выполняли с применением программы «Система микробиологического мониторинга Микроб-2». Далее из перечня были исключены пациенты, с сомнительной этиологической значимостью возбудителя, а также пациенты, у которых инфекционный процесс не затрагивал кости (инфекция кожи и мягких тканей). В результате в исследование были включены 6 пациентов в возрасте от 45 до 78 лет. Данные лабораторного и инструментального обследования получены из медицинской документации.
Полученные данные регистрировали в виде электронных таблиц, визуализацию структуры данных и их анализ проводили с помощью программы MS Office Excel, 2007 (Microsoft, США), IBM SPSS STATISTICS (версия 26). Количественные показатели оценивали на предмет соответствия нормальному распределению с помощью критерия Шапиро-Уилка (при числе исследуемых менее 50). В случае отсутствия нормального распределения количественные данные описывали с помощью медианы (Me) и нижнего и верхнего квартилей (Q1-Q3). Категориальные данные описывали с указанием абсолютных значений и процентных долей.
Подробно описан клинический пример, пациентки пролеченной в отделении гнойной остеологии в 2022 году. Все пациенты при госпитализации подписали информированное добровольное согласие на публикацию результатов их лечения.
Результаты
За период 1.01.2010 по 31.12.2022 года было выявлено 98 случаев выделения Actinomyces sp. от 46 пациентов. Этиологическая значимость установлена у 11 пациентов, из них у 6 – диагностирован актиномикоз крупных суставов и длинных трубчатых костей. Доля пациентов мужского пола составила 33,4% (n=2). Медиана возраста составила 62,5 [Q1-Q3:52-78] года.
У всех пациентов на момент госпитализации был активный инфекционный процесс: у 4-х – диагностирована перипротез-ная инфекция (ППИ) тазобедренного (n=2) или коленного сустава (n=2) и в двух случаях – гонит. При поступлении у двух пациентов отмечался повышенный уровень лейкоцитов и СОЭ, медиана уровня лейкоцитов при поступлении составила – 8,8*109/л [Q1-Q3:5,3-11,8], медиана уровня СОЭ при поступлении составила 58 мм/час [Q1-Q3:7-67] . У трех пациентов отмечалось – повышение уровня СРБ, медиана данного показателя при поступлении составила 49 мг/л [Q1-Q3:27-78]. Основные характеристики пациентов представлены в таблице 1.
При дооперационном микробиологическом исследовании суставного аспирата ни у кого из пациентов не было получено роста Actinomyces sp . Все пациенты были прооперированы, в ходе операции проводился забор материала (тканевые биоптаты, удаленная металлоконструкция, синовиальная жидкость) для проведения микробиологического исследования. В 67% случаев (n=4) актиномицеты являлись единственным выделенным возбудителем, в остальных – выявлены полимикробные ассоциации со Staphylococcus epidrmidis и Campylobacter ureolitycus в диагностически значимом титре. У 5 пациентов актиномицеты были выделены из интраоперационно полученных тканевых биоптатов, у одного – из гематомы. 5 пациентов получали этиотропную антибактериальную терапию в соответствии с современными рекомендациями по ведению пациентов с актиномикозом.
На момент выписки у всех пациентов инфекционный процесс был купирован. Трём пациентам в последующем был выполнен 2-й этап лечения ППИ (ревизионное эндопротезирование (ЭП) сустава), одной пациентке выполнен артродез с последующим удалением аппарата внешней фиксации (АВФ) через 6 месяцев. Клинический исход 1 пациента не известен (контакт невозможен ввиду давности госпитализации и отсутствия контактных телефонов).
Основные характеристики пациентов
Таблица 1
|
Пациент |
Год |
Пол |
Возраст |
Лока-лиза-ция |
Диагноз |
Анализы при поступлении |
Выполненная операция |
Источник выделения МО |
Вид микроорганизма |
Исход |
||
|
WBC, x109/л |
СОЭ, мм/час |
СРБ, мг/л |
||||||||||
|
С |
2022 |
ж |
63 |
КС |
Гонит, остеомиелит бедра |
8,8 |
67 |
27 |
РХО, спейсер Артродез КС |
ТБ |
A.radingae |
Ремиссия |
|
С |
2017 |
ж |
85 |
КС |
Рецидив ППИ |
5,3 |
58 |
92 |
РХО, спейсер |
ТБ |
A.israelii |
Ремиссия |
|
У |
2016 |
м |
45 |
КС |
Рецидив ППИ |
12,9 |
2 |
78 |
РХО, установка спейсера |
гематома |
A.viscosus serovar 2 |
Ремиссия |
|
К |
2016 |
ж |
62 |
ТБС |
Рецидив ППИ |
- |
- |
- |
РХО, спейсер |
ТБ |
A.israelii |
Ремиссия |
|
К |
2014 |
м |
52 |
КС |
Болезнь Гоффа |
11,8 |
7 |
0,5 |
Удаление тела Гоффа из связки надколенника |
ТБ |
A.viscosus serovar 2 |
Ремиссия |
|
Ф |
2013 |
ж |
78 |
ТБС |
Рецидив ППИ |
4,0 |
74 |
49 |
РХО, спейсер |
ТБ |
A.odontoliticus |
Нет данных |
WBC – white blood cells (лейкоциты)
СОЭ – скорость оседания эритроцитов
СРБ – С-реактивный белок
МО – микроорганизм
РХО – радикальная хирургическая обработка
КС – коленный сустав
ТБС – тазобедренный сустав
ТБ – тканевые биоптаты
Клинический пример
Пациентка С. 64 года (рост 174 см, вес 61 см) поступила с жалобами на боль в области левого коленного сустава и наличие свищей в нижней трети бедра 11.07.2022 г. Со слов пациентки впервые боли в области левого бедра появились в детском возрасте, около 50 лет назад, когда ей впервые выставлен диагноз гематогенный остеомиелит бедренной кости. В условиях стационара была выполнена санирующая операция с наложением кокситной повязки. Первый рецидив гнойновоспалительного процесса развился спустя 13 лет, в связи с чем была выполнена радикальная хирургическая обработка гнойного очага. Впоследствии обострения случались 1-2 раза в год, стала отмечать появление свищей в области послеоперационных рубцов, неоднократно выполняли РХО. За последний год характер свищевого отделяемого изменился на гнойный, увеличился его объем, в связи с чем пациентка была госпитализирована в профильный стационар.
При поступлении в области левого бедра определяли умеренно болезненный инфильтрат плотной консистенции, множественные послеоперационные рубцы, в нижней трети левого бедра 3 свищевых хода с гнойным отделяемым, симптом флюктуации отрицательный. Снижение объема движений в левом коленом суставе до 5°. Лабораторно при поступлении: повышение уровня маркеров воспаления: СРБ 27 мг/л, СОЭ 67 мм/час, фибриноген 5,35 мг/л; признаки анемии хронического воспаления: гемоглобин 110 г/л, гематокрит 0,33. Пациентке выполнена рентгенография (рис.1) и компьютерная томография левого КС.
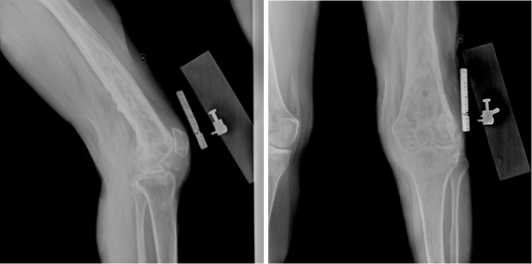
Рисунок 1. Рентгенограмма левого КС при поступлении: хронический остеомиелит левого бедра с участком периостита по задней поверхности левой бедренной кости в средней и нижней трети, деструкция мыщелков бедренной и большеберцовой костей, левосторонний гонит.
По результатам обследования был поставлен диагноз: хронический гематогенный остеомиелит 3А левого бедра. Комбинированная контрактура левого коленного сустава. Левосторонний гонит. Из сопутствующей патологии: хроническая анемия легкой степени, хронический поверхностный гастрит вне обострения.
20.07.2022 пациентке была выполнена РХО очага остеомиелита левого бедра, левого коленного сустава, установлены антимикробные спейсеры левого коленного сустава (рис. 2) и левой бедренной кости (в виде бус), импрегнированные ванкомицином, выполнено дренирование левого коленного сустава по Редону.
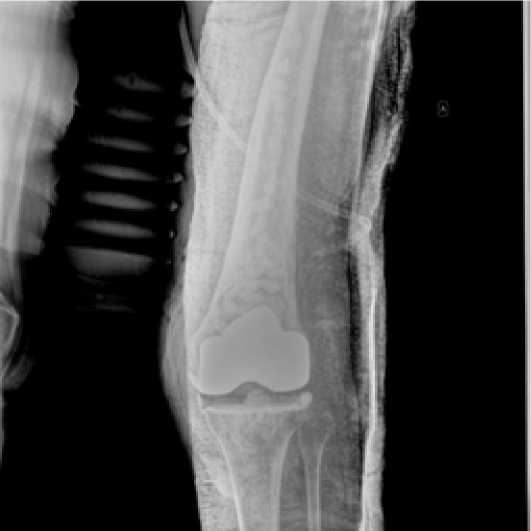
Рисунок 2. Рентгенограмма после установки спейсеров коленного сустава (артикулирующий) и бедренной кости (в виде бус) слева.
Интраоперационно выявлены признаки выраженного гнойного процесса, остеомиелита бедренной и большеберцовой костей, резкий зловонный запах при вскрытии канала бедренной кости. Проведен забор интраоперационного материала для проведения микробиологического и гистологического исследования. Объем интраоперационной кровопотери составил 300 мл. Со дня хирургического вмешательства проводилась стандартная эмпирическая антибактериальная терапия: ванкомицин 1,0 г 2 раза в сутки и левофлоксацин 0,5 г 2 раза в сутки внутривенно капельно в течение 8 суток. В послеоперационном периоде отмечали обильное геморрагическое отделяемое в объеме 150 мл ежедневно в течение 4 суток по дренажу и далее после его удаления – между швов. В связи с нарастанием анемии 3-х кратного были выполнены гемотрансфузии эритроцитарной массы, назначены внутривенные препараты железа и эритропоэтин.
На 8-ые сутки были получены результаты бактериологического исследования, согласно которым во всех 5 тканевых биоптатах был выявлен рост Actinomyces radingae и Campylobacter ureolitycus. По результатам микробиологического исследования врачом-клиническим фармакологом была проведена сме- на антибактериальной терапии на цефоперазон/сульбактам 4,0 г 2 раза в день и доксициклин 0,1 г 2 раза в день.
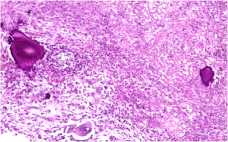
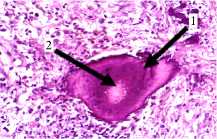
При гистологическом исследовании послеоперационного материала: рыхлая волокнистая соединительная ткань представлена преимущественно организующимся фибрином и грануляционной тканью, богатой сосудами, встречаются единичные мелкие костные секвестры. В центре одного из них наблюдали рассасывание костной ткани, признаки хронического гранулематозного воспаления с очагами гнойного расплавления и наличием одиночных актиномикотических друз, округлые оксифильные тельца и заметны мелкие базофильные зерна с отходящими от них нитями мицелия. Встречались костные секвестры без актиномикотических друз, а также остатки рассасывающихся обызвествленных секвестров в виде очажков кальциноза причудливой формы (рис. 3).
А)
В)
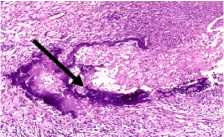
Рисунок 3. Микрофотографии тканевых биоптатов из области очага остеомиелита бедренной кости. Окраска гематоксилином и эозином. Цифровой микроскоп EVOS, увеличение х20 – А, В, Г, х40 – Б. А – Костный
Г)
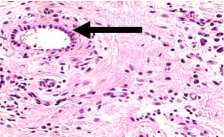
секвестр, в толще – актиномикотические друзы, Б – 1. Друзы актиномицетов в костном секвестре, 2. Очаг рассасывания костной ткани в центре секвестра,
В – Кальцификат на месте рассасывающегося секвестра с причудливым обызвествлением и рассасыванием костной ткани, Г – Сосуд с сочными, активными клетками эндотелия в окружении плазмоклеточной инфильтрации
На 9е сутки после операции зафиксировали отрицательную лабораторную динамику (нарастание СРБ со 112 мг/л до 200 мг/л) на фоне сохраняющегося геморрагического отделяемого, что расценили как рецидив инфекционного процесса. Было принято решение о проведении ревизионного хирургического вмешательства.
На 16-ые сутки после операции выполнили повторное хирургическое вмешательство – радикальная хирургическая обработка очага остеомиелита, удаление спейсеров левого коленного сустава и из канала бедренной кости, формирование артродеза левого коленного сустава в АВФ (рис.4). Объем интраоперационной кровопотери составил 250 мл. Антибактериальная терапия, назначенная со дня хирургического вмешательства, была скорректирована: цефоперазон/сульбактам и доксици- клин были отменены, назначены ампициллин/сульбактам 3,0 г 3 раза в сутки, клиндамицин 0,9 г 3 раза в сутки до выписки из стационара.
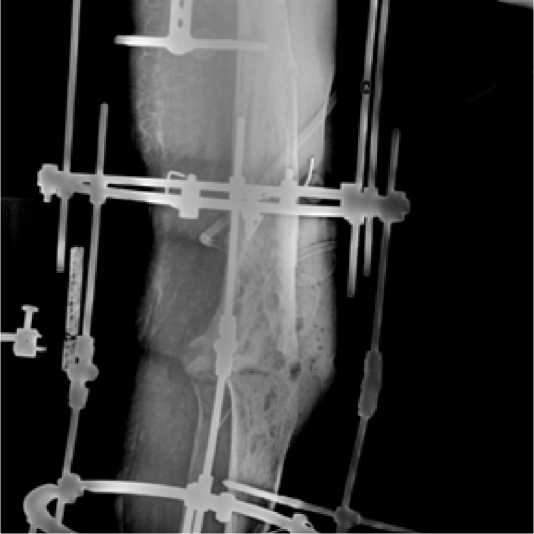
Рисунок 4. Рентгенограмма после формирования артродеза левого коленного сустава в АВФ.
В интраоперационных посевах тканевых биоптатов, забранных во время повторной операции, роста патогенной микрофлоры выявлено не было, что, вероятнее всего, было связано с проводимой антибактериальной терапией. В послеоперационном периоде на фоне антибактериальной терапии, обезболивания, местного лечении, коррекции анемии и физической реабилитации была достигнута положительная динамика. Рана заживала первично, контроль стабильности АВФ проводили 1раз в неделю. Общая продолжительность антибактериальной терапии от момента поступления составила 26 суток, признаков нежелательных реакций на лекарственные средства не было. На 9е сутки со дня повторного хирургического вмешательства пациентка была выписана на амбулаторное лечение с рекомендациями принимать амоксициллин/ клавулановую кислоту 1000 мг 2 раза в сутки и клиндамицин 300 мг 3 раза в день 2 месяца, обратиться на консультации в НИИ медицинской микологии им. П. Н. Кашкина, г. СПб с целью назначения длительной АБ терапии. Там ей был назначен амоксициллин в дозе 2 г в сутки длительно.
При динамическом наблюдении через 1, 3, 7 месяцев по данным контрольного осмотра общее самочувствие пациентки было удовлетворительным. Болевой синдром отсутствовал, показатели клинико-диагностических исследований были в пределах возрастной нормы. На компьютерной томографии области коленного сустава костно-травматических изменений в зоне сканирования выявлено не было. С учетом хронического рецидивирующего гнойно-воспалительного процесса провели оценку субпопуляционного состава лимфоцитов, уровня циркулирующих иммунных комплексов, основных классов иммуноглобулинов, фагоцитарной активности нейтрофилов, исследование макрофагальной активности (НСТ-тест). Отклонений от нормы получено не было. Общая продолжительность антибактериальной терапии составила 7 месяцев.
Демонтаж АВФ был рекомендован после формирования артродеза коленного сустава по результатам контрольных рентгенограмм, но не ранее, чем через 6 мес. По результатам контрольного осмотра пациентки через 4 и 6 месяцев с момента оперативного лечения данных за рецидив хронического инфекционного процесса не выявлено, уровень СРБ при последнем осмотре 5,4 мг/л, после чего в профильном отделении по месту жительства АВФ был демонтирован.
Обсуждение
Актиномикоз различных локализаций распространен во всех странах мира, при этом заболеваемость не зависит от возраста, социального статуса и соматического состояния пациентов [14]. В среднем частоту актиномикоза в развитых странах оценивают в 6 случаев на 10 000 населения, чаще он выявляется в крупных городах [6]. Однако заболевание распространено гораздо чаще, чем его фактически диагностируют. Это связано с особенностями его клинической картины, имитирующей неспецифические воспалительные процессы, туберкулез, неопластический процесс [15]. Это в свою очередь приводит к поздней диагностике, несвоевременному лечению, распространению объема поражения органов и тканей и нередко паллиативным, повторным оперативным вмешательствам, длительной нетрудоспособности, инвалидизации пациентов. Актиномикоз не имеет специфической клинической картины. При любой форме заболевания патогномоничными клиническими признаками являются плотный инфильтрат не имеющий четких анатомических границ, образование гнойных полостей, свищей с сукровичным отделяемым [6; 10]. В основе диагностики актиномикоза лежит выделение в материале из очага поражения возбудителя при бактериологическом исследовании или наличие актиномикотической друзы в микропрепаратах при гистологическом исследовании [8; 9].
Лечение больных актиномикозом должно быть комплексное и включать применение высокодозной антибактериальной терапии, хирургическое удаление очагов поражения, лечение фоновых заболеваний и снижение выраженности факторов риска. Актиномицеты чувствительны к широкому спектру антибактериальных препаратов. Препаратами первой линии терапии являются пенициллины, альтернативные препараты – эритромицин, тетрациклин, доксициклин, клиндамицин, цефалоспорины и карбапенемы [16].
Актиномикотический остеомиелит костей конечностей — это одна из самых редких форм этого заболевания [17]. В литературе описан случай успешного лечения остеомиелита бедренной кости у 52 летней пациентки с иммунодефицитом. Процесс был купирован после выполнения радикальной хирургической обработки очага и назначения антибактериальной терапии [18]. Lipton M. c коллегами описали случай остеомиелита большеберцовой кости у 50-ти летнего мужчины, успешно пролеченного пенициллинами [12]. В нашем центре мы наблюдали 2 случая актиномикоза коленного сустава и костей его образующих. Тактика лечения этих пациентов соответствовала общемировой практике. В одном случае пациент выписан на амбулаторное лечение с рекомендацией принимать антибактериальную терапию, рецидива инфекции не было. Во втором случае было принято решение об установке антимикробного спейсера с ванкомицином, с последующим выполнением артродеза КС. После состоявшегося артродеза пациентке выполнен демонтаж АВФ, наблюдается стойкая ремиссия. В нашем центре не было пациентов с первичным актиномикозом верхней конечности. Публикаций, описывающих актиномикоз длинных костей верхней конечности также не найдено.
Перипротезная инфекция вызванная актиномицетами более частая патология, чем первичный остеомиелит. Самое крупное исследование было проведено Rames Dagher с соавторами: за 47 лет было выявлено 11 случаев. В большинстве случаев был идентифицирован Actinomyces odonotlyticus. Средний возраст пациентов составил 71 год, а средний срок от первичного эндопротезирования до дебюта перипротезной инфекции составил 162 дня, при этом у 6 пациентов в анамнезе были эпизоды ППИ, вызванного иными микроорганизмами. Восьми пациентам была проведена двухэтапная санация очага инфекции с проведением антибиотикотерапии пенициллинами с благоприятным исходом [19].
Также опубликованы отдельные клинические случаи перипротезной инфекции актиномикотической этиологии. Чаще инфекционный процесс выявляли у пациентов после ТЭП тазобедренного сустава (5 случаев) [13; 20–22]. У 3 из 5 пациентов анамнезе были ревизионные вмешательства на суставе [13; 20; 21], у 2 — внутривенная наркомания [20; 21]. У одного из пациентов был диагностирован актиномикоз шейно-лицевой области, при этом глубокая инфекция в области хирургического вмешательства манифестировала у него на 37 сутки после первичного эндопротезирования [22]. Также был описан случай перипротезной инфекции после первичного эндопротезирования плечевого сустава, которая развилась через месяц после хирургического вмешательства [23].
В нашем исследовании были 2 пациента с перипротезной инфекцией коленного и 2 — тазобедренного суставов. У всех пациентов возбудитель был выделен при посеве интраоперационного материала, что в очередной раз подтверждает необходимость микробиологического исследования тканевых биоптатов и удаленных металлоконструкций. Все пациенты получали адекватную антибактериальную терапию на госпитальном и амбулаторном этапах. Троим выполнен второй этап лечения ППИ – удаление антимикробного спейсера, реимплантация эндопротеза.
Описанный нами клинический пример подтверждает мнение различных авторов о том, что актиномикоз — это заболевание, при котором воспалительный процесс медленнотекущий, но неуклонно прогрессирующий [4; 7]. Длительность заболевания нашей пациентки составила почти 50 лет, за которые ей проводились неоднократные санирующие вмешательства. При этом по мере прогрессирования заболевания рецидивы инфекционного процесса (с формированием свищей с отделяемым) учащались. Такое течение процесса соответствует литературным данным, для костных форм характерно образование гнойных полостей со множеством свищевых ходов [14].
Актиномицеты часто присутствуют в очаге инфекции в ассоциации с другими микроорганизмами [3; 5]. В клиническом примере, описанном нами, в интраоперационных посевах была выявлена микробная ассоциация Actinomyces radingae и Campylobacter ureolitycus во всех 5 тканевых биоптатах, что позволяет говорить о высокой этиологической значимости этих возбудителей в инфекционном процессе. Еще у двух пациентов актиномицеты присутствовали в ассоциации с грамположи-тельными микроорганизмами.
Лечение костного актиномикоза — это обязательное сочетание хирургического вмешательства и антибактериальной терапии [24]. В нашем клиническом примере пациентка со дня хирургического вмешательства получала эмпирическую антибактериальную терапию ванкомицином и левофлоксацином, в спектр которой не входят актиномицеты, в результате чего развился рецидив инфекционного процесса. После проведенного ревизионного вмешательства и назначения этиотропной антибактериальной терапии (ампициллин-сульбактам, клиндамицин), у нее отмечалась положительная динамика и на 9 сутки после ревизионного вмешательства она была выписана на амбулаторное лечение с рекомендациями продолжать АБТ.
Практикующим врачам необходимо знать о возможности развития актиномикотической ортопедической инфекции (остеомиелита и ППИ) и иметь настороженность в ее отношении. Кроме того, при подозрении на первичный костный туберкулез необходимо корректно выполнять дифференциальную диагностику с другими патологиями, так как противотуберкулезные препараты не активны в отношении Actinomyces sp .
Заключение
Актиномикотический остеомиелит – это хроническая инфекция с неуклонно прогрессирующим течением. Стоит учитывать возможность развития актиномикоза сустава и/или кости при указании в анамнезе на травму области поражения, протезирования при наличии неспецифической клинической картины, отсутствия ответа на лечение короткими курсами антибактериальной терапии. В ходе проведенного исследования были выявлены 6 пациентов с актиномикотическим поражением длинных трубчатых костей и перипротезной инфекцией за 12 лет. Все пациенты были прооперированы и получили этиотропную антибактериальную терапию в соответствии с современными клиническими рекомендациями, в результате чего ремиссии инфекционного процесса удалось добиться у 5 из них (исход у 1 пациента не известен). Своевременно поставленный диагноз и правильное лечение способствуют благоприятному прогнозу у таких больных.
Список литературы Актиномикоз длинных трубчатых костей и перипротезная инфекция актиномикотического происхождения
- Paulo C. O., Jordão S., Correia-Pinto J., Ferreira F., Neves I. Actinomycosis, a Lurking Threat: A Report of 11 Cases and Literature Review. Rev. Soc. Bras. Med. Trop. 2018; 51: 07–13. DOI: 10.1590/0037-8682-0215-2017.
- Яшнов А.А. и др. Актиномикоз человека современное представление // Современная наука: актуальные проблемы теории и практики. Серия: Естественные и технические науки. 2018; № 4: 196-201 [Yashnov А.А. [et al.] Human actinomycosis modern representation Modern science: actual problems of theory and practice. Series: Natural And Technical Sciences. 2018; № 4: 196-201]
- Al-Obaidy K., Alruwaii F., Al Nemer A., Alsulaiman R., Alruwaii Z., Shawarby M. A. Primary Gastric Actinomycosis: Report of a Case Diagnosed in a Gastroscopic Biopsy. BMC Clin. Pathol. 2015; 2(15). DOI: 10.1186/s12907-015-0002-8.
- Valour F., Sénéchal A., Dupieux C., Karsenty J., Lustig S., Breton P., Gleizal A., Boussel L., Laurent F., Braun E., Chidiac C., Ader F., Ferry T. Actinomycosis: Etiology, Clinical Features, Diagnosis, Treatment, and Management Infect. Drug Resist. 2014;7:183–197. DOI: 10.2147/IDR.S39601.
- Heitman Joseph., Mandell I.E., Bennett I.E., Dolin R. Principles and Practice of Infectious Diseases, Mycopathologia. 2000; 1(149).
- Sung H. Y., Lee I. S., Kim S. I., Jung S. E., Kim S. W., Kim S. Y., Chung M. K., Kim W. C., Oh S. T., Kang W. K. Clinical Features of Abdominal Actinomycosis: A 15-Year Experience of a Single Institute. J. Korean Med. Sci. 2011; 26 (7): 932–937. DOI: 10.3346/jkms.2011.26.7.932.
- Zamani F., Sohrabi M. Clinical, Endoscopic, and Histopathological Aspects of Sigmoid Actinomycosis; a Case Report and Literature Review. Middle East J. Dig. Dis. 2015; 7 (1): 41–44.
- Bennhoff D. F. Actinomycosis: Diagnostic and Therapeutic Considerations and a Review of 32 Cases. The Laryngoscope. 1984, 94 (9): 1198–1217. DOI: 10.1288/00005537-198409000-00013.
- Brook I. Actinomycosis: Diagnosis and Management. South. Med. J. 2008, 101 (10): 1019–1023. DOI: 10.1097/SMJ.0b013e3181864c1f.
- Wong V. K., Turmezei T. D., Weston V. C. Actinomycosis. BMJ. 2011: 343, d6099. DOI: 10.1136/bmj.d6099.
- Volante M., Contucci A. M., Fantoni M., Ricci R., Galli, J. Cervicofacial Actinomycosis: Still a Difficult Differential Diagnosis. Acta Otorhinolaryngol. Ital. Organo Uff. Della Soc. Ital. Otorinolaringol. E Chir. Cerv.- facc. 2005, 25 (2): 116–119.
- Lipton M., Sonnenfeld G. Actinomyces Meyeri Osteomyelitis: An Unusual Cause of Chronic Infection of the Tibia. Clin. Orthop. 1980, No. 148: 169–171.
- Wüst J., Steiger U., Vuong H., Zbinden R. Infection of a Hip Prosthesis by Actinomyces Naeslundii. J. Clin. Microbiol. 2000, 38 (2): 929–930. DOI: 10.1128/JCM.38.2.929-930.2000.
- Wallace R. J., Musher D. M. Actinomycosis: An Update. Int. J. Dermatol. 1977, 16 (3): 185–187. DOI: 10.1111/j.1365-4362.1977.tb01849.x.
- García-García A., Ramírez-Durán N., Sandoval-Trujillo H., Romero-Figueroa M. D. S. Pelvic Actinomycosis. Can. J. Infect. Dis. Med. Microbiol.J. Can. Mal. Infect. Microbiol. Medicale. 2017, 2017, 9428650. DOI: 10.1155/2017/9428650.
- Гилберт Д., Чемберс Г., Элиопулос Дж., Сааг M., Павиа Э., Блэк Д., Фридман Д., Ким К., Шварц Б. (Ред.). Антимикробная Терапия По Джею Сэнфорду 3-е Рус. Изд. / Пер. с Англ. В. А. Ананича, Н. В. Перву-Ховой. 2019: 784 [Chambers G., Iliopoulos J., Sahak M., Pavia E., Black D., Friedman D., Kim K., Schwartz B.(ed.). Antimicrobial therapy according to Jay Sanford / D. Gilbert, 3rd Russian ed./translated from English by V. A. Ananich, N. V. Pervukhova. 2019: 784]
- Козлова О. П., Мирзабалаева А.К., Климко Н. Н. Актиномикоз Органов Брюшной Полости И Малого Таза. Проблемы Медицинской Микологии. 2014, №3:16. [Kozlova O.P. Actinomycosis Of The Abdominal Cavity And Pelvis, Problems Of Medical Mycology. 2014; №3:16]
- Ryu D. J., Jeon Y. S., Kwon H. Y., Choi S. J., Roh T. H., Kim M. K. Actinomycotic Osteomyelitis of a Long Bone in an Immunocompetent Adult: A Case Report and Literature Review. BMC Musculoskelet. Disord. 2019, 20(1): 185. DOI: 10.1186/s12891-019-2576-2.
- Dagher R., Riaz T., Tande A. J., Osmon D. R., Jagtiani A., Steckelberg J. M., Mabry T., Berbari E. F. Prosthetic Joint Infection Due to Actinomyces Species: A Case Series and Review of Literature. J. Bone Jt. Infect. 2019; 4 (4): 174–180. DOI:10.7150/jbji.35592.
- Zaman R., Abbas M., Burd E. Late Prosthetic Hip Joint Infection with Actinomyces Israelii in an Intravenous Drug User: Case Report and Literature Review. J. Clin. Microbiol. 2002; 40 (11): 4391–4392. DOI: 10.1128/JCM.40.11.4391-4392.2002.
- Redmond S. N., Helms R., Pensiero A. A Case of Actinomyces Prosthetic Hip Infection. Cureus 2020; 12 (7), e9148. DOI: 10.7759/cureus.9148.
- Rieber H., Schwarz R., Krämer O., Cordier W., Frommelt L. Actinomyces Neuii Subsp. Neuii Associated with Periprosthetic Infection in Total Hip Arthroplasty as Causative Agent. J. Clin. Microbiol. 2009; 47 (12): 4183–4184. DOI: 10.1128/JCM.01249-09.
- Chen B. C., Kobayashi T., Ford B., Sekar P. Late Prosthetic Shoulder Joint Infection Due to Actinomyces Neuii in an Adult Man. BMJ Case Rep. 2020; 13 (9), e236350. DOI: 10.1136/bcr-2020-236350.
- Бурова С.А., Якобашвили Я.И., Сапунова Т.И., Локшина И.М. Хирургическое лечение актиномикоза // Успехи медицинской микологии. 2004; Т. 4: 246. [Burova S.A., Yakobashvili Ya.I., Sapunova T.I., Lokshina I.M. Surgical treatment of actinomycosis // Successes of medical mycology. 2004. Vol. 4: 246.]


