Активация сигнального пути интерферона-альфа ресвератролом, генистеином и кверцетином
Автор: Власова Ольга Александровна, Борунова Анна Анатольевна, Сафина Альфия, Сметанина Инна Васильевна, Лесовая Екатерина Андреевна, Белицкий Геннадий Альтерович, Заботина Татьяна Николаевна, Гурова Катерина, Кирсанов Кирилл Игоревич, Якубовская Марианна Геннадиевна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 1 т.18, 2019 года.
Бесплатный доступ
Ресвератрол, кверцетин и генистеин, относящиеся к полифенолам вторичных метаболитов растений, обладают антиканцерогенным и противовирусным эффектами, реализуемыми в результате их плейо-тропного действия на различные макромолекулы клетки. Эти соединения могут взаимодействовать с ДНК, не образуя ковалентные связи. При этом может происходить изменение пространственных, физико-химических и структурных характеристик ДНК, что может приводить к нарушению функциони-рования белков метаболизма ДНК и вызывать дестабилизацию хроматина. Такие эффекты были опи-саны для нового противоопухолевого препарата Кураксина CBL0137, причем индуцированная данным соединением дестабилизация хроматина приводила к активации сигнального пути интерферона-α. Используя клеточную линию HeLa с трансгенным флуоресцентным белком mCherry, содержащим в промоторной области консенсусный сайт связывания интерферона-α (ISRE), мы продемонстрировали дозозависимый стимулирующий эффект ресвератрола, кверцетина и генистеина на активность сигналь-ного пути интерферона-α. Использование прижизненной флуоресцентной микроскопии на клеточной линии HT1080 c трансгенным флуоресцентно-меченным гистоном H1.5 позволило продемонстриро-вать, что данные полифенолы вызывают перераспределение данного линкерного гистона в ядрах клеток. Полученные нами данные свидетельствуют о возможности существования ДНК-зависимого механизма реализации противоопухолевого действия растительных полифенолов и необходимости дальнейшего изучения влияния полифенолов на структуру хроматина и связанного с этим изменения функционирования генома, в частности регуляции сигнального пути интерферона-α.
Растительные полифенолы, ресвератрол, генистеин, кверцетин, интерферон-α, гистон н1, макромолекулы клетки, флуоресцентная микроскопия, ферменты метаболизма, histone н1
Короткий адрес: https://sciup.org/140254241
IDR: 140254241 | УДК: 577.3: | DOI: 10.21294/1814-4861-2019-18-1-50-55
Текст научной статьи Активация сигнального пути интерферона-альфа ресвератролом, генистеином и кверцетином
Анализу биологических эффектов ресвератрола, кверцетина и генистеина, вторичных метаболитов растений из группы полифенолов, посвящены мно‑ гочисленные исследования [1–3]. В экспериментах на грызунах эти соединения эффективно снижа‑ ют частоту возникновения и множественность опухолей толстой кишки, индуцированных 1,2‑ диметилгидразином или азоксиметаном, опухолей яичников, индуцированных 7,12‑диметилбенз(а) антраценом, и опухолей молочных желез, ин‑ дуцированных 7,12‑диметилбенз(а)антраценом и N‑метил‑N‑нитрозомочевиной, и др. [4–7]. Ресвератрол, кверцетин и генистеин обладают антипролиферативным, проапоптотическим, противовоспалительным и иммуномодулирующим эффектами [1, 2, 8, 9]. При этом для их действия в клетках млекопитающих характерна плейотроп‑ ность. В частности, ресвератрол имеет более 20 молекулярных мишеней, включая клеточные рецепторы, ферменты метаболизма гидрофобных ксенобиотиков, компоненты ряда сигнальных путей, транскрипционные факторы, ферменты метаболизма ДНК и системы эпигенетической регуляции транскрипции [1, 4, 10]. Аналогичные данные о существовании целого ряда молеку‑ лярных мишеней были продемонстрированы для генистеина и кверцетина [11, 12]. Плейотропность эффектов изучаемых полифенолов делает исклю‑ чительно сложной интерпретацию интегрального результата их воздействия на клетку, которая становится невозможной без использования соот‑ ветствующих баз данных [1]. Кроме того, ресвера‑ трол, кверцетин и генистеин представляют собой ДНК‑тропные соединения, способность которых к интеркаляции показана тушением флуоресценции в системе ДНК‑EtBr [13–15].
Эти данные, в сопоставлении с результатами исследований по влиянию интеркаляторов ДНК и УБЛ на структуру и свойства дуплекса [16], позволяют считать, что изучаемые нами поли‑ фенолы, взаимодействуя с ДНК, могут влиять на геометрические характеристики и термоди‑ намическую стабильность дуплекса, гибкость и физико‑химические свойства биополимера, а также вероятность формирования и стабилизации раз‑ личных альтернативных структур ДНК, таких как G‑квадруплексы, Н‑ДНК и круциформы. Кроме того, эти соединения могут экранировать опреде‑ ленные позиции по малой и большой бороздкам ДНК, конкурентно ингибируя работу ферментов «домашнего хозяйства». Всё это может влиять на процессы компактизации ДНК и трехмерную организацию эукариотического генома.
В настоящее время эффекты дестабилизации хроматина ДНК‑тропными агентами были описаны лишь для нового противоопухолевого препарата CBL0137 [17, 18] и ряда узкобороздочных лигандов (УБЛ) [19]. Причем при действии как CBL0137, так и УБЛ наблюдалось повышение уровня экспрес‑ сии ретротранспозонов и других повторяющихся последовательностей ДНК. Это, в свою очередь, должно приводить к активации сигнального пути интерферона‑α, как это было показано для CBL0137 [17]. Для изучения этих эффектов CBL0137 были получены модельные системы, позволяющие оценить запуск сигнального пути интерферона‑α с помощью репортерного анализа и изменения локализации гистона Н1 методом прижизненной флуоресцентной микроскопии. При изучении эффектов CBL0137 активность сигнального пути интерферона‑α оценивали в клетках HeLa по уров‑ ню экспрессии трансгенного флуоресцентного белка mCherry, имеющего в промоторной области консенсусный сайт связывания интерферона‑α (ISRE). Анализ локализации гистона H1 в ядрах обработанных клеток проводили на линии HT1080 с трансгенным гистоном Н1.5, флуоресцентно меченным mCherry [17, 18]. При этом активация сигнального пути интерферона‑α наблюдалась при тех же концентрациях CBL0137, которые вы‑ зывали изменение локализации гистона H1 в ядрах обработанных клеток. Эти данные согласуются с результатами исследования функций гистона Н1, демонстрирующими, что снижение содержания ряда изоформ Н1 в хроматин‑связанной фракции приводит к запуску экспрессии ретротранспозонов, а затем интерферон‑зависимых генов [20]. Исполь‑ зуя модельные системы, разработанные для анализа эффектов CBL0137 на интерфероновый сигналинг I типа и локализацию гистона H1, можно оценить наличие и ассоциацию аналогичных эффектов рас‑ тительных полифенолов, выявление которых будет свидетельствовать о целесообразности изучения механизмов действия этих соединений, связанных с нарушениями процессов компактизации ДНК и пространственной структуры хроматина.
Цель исследования – анализ влияния рас‑ тительных полифенолов ресвератрола, кверце‑ тина и генистеина на запуск сигнального пути интерферона‑α и локализацию гистона Н1.
Материал и методы
Клеточные линии. В работе использованы следующие клеточные линии: HT1080 (ATCC), HT1080‑H1‑mCherry, HeLa‑TI‑ISRE‑mCherry. По‑ следние две линии были получены в лаборатории К. Гуровой, как это было описано ранее [17]. Клетки культивировали в стандартных условиях (+37 °C, 5 % CO2) в культуральной среде DMEM (Dulbecco’s modified Eagle’s medium, двойная модификация среды Игла) с добавлением эмбрио‑ нальной телячьей сыворотки (10 %), L‑глутамина и смеси антибиотиков пенициллина‑стрептомицина (откуда реактивы).
ДНК-тропные соединения
В работе использовались следующие раститель‑ ные полифенолы: ресвератрол (Selleck Chemical LLC), кверцетин (Sigma Aldrich), генистеин (Sigma Aldrich).
Прижизненная клеточная микроскопия
Для данного исследования была использована клеточная линия HT1080 H1‑mCherry. Клетки культивировали в 48‑луночных планшетах с про‑ зрачным дном (Mat‑Tek Corporation (Ashland, MA, USA). Оценку влияния растительных полифенолов на состав клеточной популяции в зависимости от локализации гистона Н1.5 в ядрах клеток прово‑ дили через 24 ч после обработки с помощью инвер‑ тированного микроскопа Zeiss Axio Observer A1 с иммерсионным объективом NAchroplan 100×/1.25 и камерой Zeiss MRC5 с программным обеспечени‑ ем AxioVision Rel.4.8. В некоторых случаях перед анализом флуоресценции клетки фиксировались в 4 % параформальдегиде в течение 10 мин.
Проточная цитофлуориметрия
Клетки линии HeLa TI ISRE‑mCherry инкуби‑ ровали с ДНК‑тропными соединениями в течение 48 ч в стандартных условиях, затем снимали с под‑ ложки с помощью растворов Версена и Трипсина, центрифугировали 4 мин при 1100 об/мин и про‑ мывали осадок в однократном буфере PBS. Анализ распределения клеточной популяции по уровню флуоресценции проводили на проточном цитоме‑ тре BD LSRII UV A Cytometers (BD Biosciences, San Jose, CA, USA). Полученные данные анализи‑ ровали с помощью программы WinList 3D (Verity Software House, Topsham, ME, USA).
Статистическая обработка данных
Все эксперименты выполнены в трех биоло‑ гических повторах с анализом триплета проб в каждом из них. Средние значения и среднеква‑ дратичные отклонения рассчитывали с помощью пакета программ Microsoft Excel. Для определения статистической значимости выявленных различий использовали парный двухвыборочный t‑тест Стьюдента для средних.
Результаты и обсуждение
На первом этапе исследования была определе‑ на цитотоксичность ресвератрола, генистеина и кверцетина на клетки линий HeLa c ISRE‑mCherry и Н1080 Н1.5‑mCherry с помощью МТТ‑теста. Максимальные нетоксичные дозы при обработке клеток HeLa c ISRE‑mCherry в течение 48 ч со‑ ставили для ресвератрола и кверцетина 100 мкМ и 61 мкМ соответственно, а для генистеина IC20 – 111 мкМ. В связи с этим в качестве максимальных
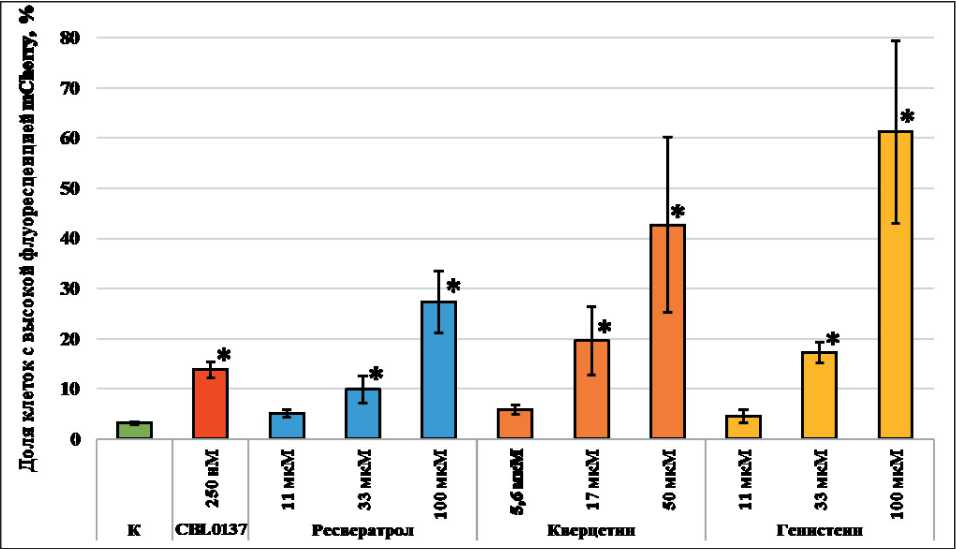
Рис. 1. Влияние ДНК-тропных фитонутриентов на экспрессию mCherry, находящегося под контролем ISRE.
Примечание: * – доля клеток с высокой флуоресценцией mCherry, статистически значимо превышающей контрольный уровень (p<0,05)
концентраций соединений при анализе их эффек‑ тов на активацию сигнального пути интерферона‑α использовали 100 мкМ для ресвератрола и гени‑ стеина и 50 мкМ для кверцетина.
Активацию сигнального пути интерферона‑α оценивали методом проточной цитофлуориметрии, учитывая экспрессию репортерного гена mCherry c ISRE в промоторной области через 48 ч после добав‑ ления в среду культивирования клеток анализируе‑ мого соединения. В качестве позитивного контроля использовали обработку клеток CBL0137 в дозе 0,25 мкМ. При обработке клеток HeLa‑ISRE‑mCher‑ ry ресвератролом в нетоксичных концентрациях 33 и 100 мкМ через 48 ч наблюдалось увеличение активности сигнального пути интерферона‑α в 3,3 и 9,0 раз соответственно (рис. 1).
При действии наименьшей концентрации ресве‑ ратрола (11 мкМ) увеличение доли клеток с флуо‑ ресценцией mCherry, превышающей контрольный уровень, составило 1,6 раза, однако это изменение не было статистически значимым.
Действие генистеина и кверцетина в концен‑ трациях 11 мкМ и 5,6 мкМ соответственно также не вызвало статистически значимого увеличения активности сигнального пути интерферона‑α, одна‑ ко имелась тенденция к увеличению доли клеток с высокой флуоресценцией mCherry (в 1,4 и 1,7 раза). При использовании генистеина в нетоксичных концентрациях (33 мкМ и 100 мкМ) наблюдалось увеличение доли клеток с высокой флуоресцен‑ цией mCherry – в 6,1 и 20,1 раза соответственно. Обработка клеток кверцетином в нетоксичной дозе 33 мкМ вызывала увеличение активности сигналь‑ ного пути интеферона‑α в 5,9 раза, а при действии 50 мкМ (IC20) – в 14,1 раза.
Таким образом, при обработке клеток HeLa‑ ISRE‑mCherry изучаемыми полифенолами расте‑ ний наблюдали дозозависимый эффект на уровень активности сигнального пути интерферона‑α.
Далее с помощью метода прижизненной флуоресцентной микроскопии оценивали влияние растительных полифенолов на состав клеточной популяции в зависимости от локализации гистона Н1.5 в ядрах клеток через 24 ч после обработки кле‑ ток соединениями в концентрациях, соответствую‑ щих IC50 при 48‑часовой обработке (рис. 2).
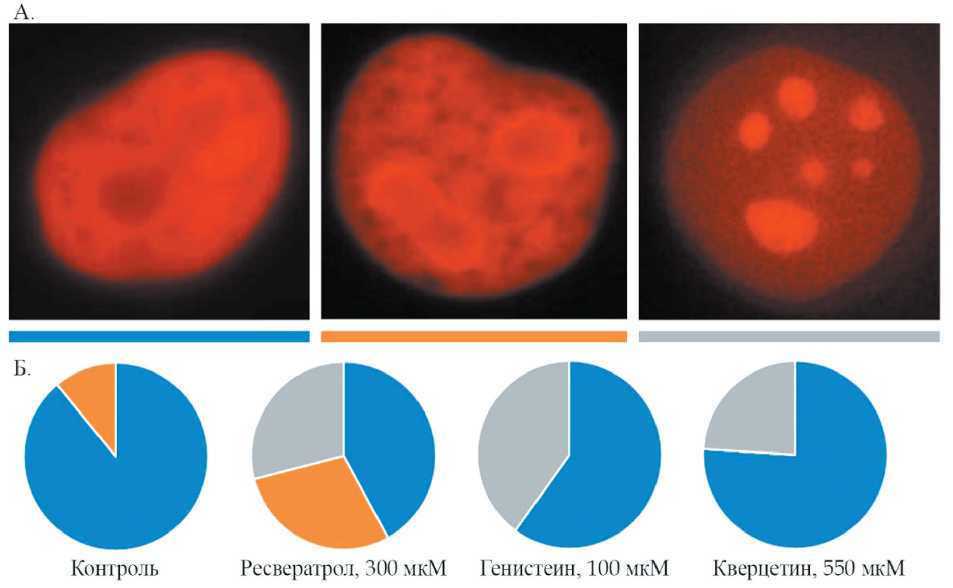
Рис. 2. Влияние ДНК-тропных соединений на локализацию гистона H1 через 24 ч после обработки клеток (синий – гистон H1.5 колокализован с хроматином, оранжевый – промежуточный тип, серый – гистон H1.5 преимущественно локализован в ядрышках):
А – метод прижизненной микроскопии клеток с флуоресцентно-меченным белком H1 (клеточная линия HT1080-H1-mCherry); Б – распределение ядер по типу локализации гистона H1.5
В образцах, не обработанных ДНК‑тропными соединениями, гистон H1.5 был колокализован с хроматином в 89 % ядер, промежуточный тип, при котором гистон частично находился в ядрышках, наблюдался в 11 % ядер, при этом ядер с ядрышко‑ вой локализацией гистонового белка H1 (3‑й тип) обнаружено не было. Наибольшие изменения в локализации гистона H1.5 вызвал ресвератрол в концентрации 333 мкМ: доля ядер с промежуточ‑ ным типом увеличилась до 29 %, при этом ещё в 29 % клеток наблюдалась ядрышковая локализация гистонового белка. При обработке клеток двумя другими агентами ядра с промежуточным типом локализации гистонового белка отсутствовали, в то же время доля клеток с интенсивным накоплением гистона Н1 в ядрышках для генистеина составила 40 %, для кверцетина – 24 %. Таким образом, изу‑ чаемые нами растительные полифенолы вызывали достаточно интенсивное изменение локализации гистона Н1.5 в ядрах клеток через 24 ч после начала обработки, что позволяет сделать вывод о наличии слабого хроматин‑дестабилизирующего эффекта у изученных соединений.
Наши данные об активации сигнального пути интерферона‑α ресвератролом и кверцетином согласуются с результатами исследований об активации этими соединениями экспрессии гена
Список литературы Активация сигнального пути интерферона-альфа ресвератролом, генистеином и кверцетином
- Pezzuto J.M. Resveratrol: Twenty Years of Growth, Development and Controversy. Biomol Ther (Seoul). 2018 Oct 11. DOI: 10.4062/biomolther.2018.176
- Russo M., Russo G.L., Daglia M., Kasi P.D., Ravi S., Nabavi S.F., Nabavi S.M. Understanding genistein in cancer: The «good» and the «bad» effects: A review. Food Chem. 2016 Apr 1; 196: 589-600. DOI: 10.1016/j.foodchem.2015.09.085
- Rauf A., Imran M., Khan I.A., Ur-Rehman M., Gilani S.A., Mehmood Z., Mubarak M.S. Anticancer potential of quercetin: A comprehensive review. Phytother Res. 2018 Nov; 32 (11): 2109-2130. DOI: 10.1002/ptr.6155
- Bishayee A. Cancer prevention and treatment with resveratrol: from rodent studies to clinical trials. Cancer Prev Res (Phila). 2009 May; 2 (5): 409-18. DOI: 10.1158/1940-6207.CAPR-08-0160
- Whitsett T.G.Jr., Lamartiniere C.A. Genistein and resveratrol: mammary cancer chemoprevention and mechanisms of action in the rat. Expert Rev Anticancer Ther. 2006; 6 (12): 1699-706. DOI: 10.1586/14737140.6.12.1699


