Активация синтеза внеклеточного матрикса дермы после термического ожога
Автор: Могильная Галина Михайловна, Фомичева Евгения Васильевна, Евглевский Андрей Александрович
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 1 т.31, 2023 года.
Бесплатный доступ
Известно, что заживление кожных ран различной этиологии - это многоступенчатый процесс, характеризующийся определенными межклеточными взаимодействиями, влияющими на адгезию клеток дермы, их миграцию и дифференцировку. Современная стратегия тканевой инженерии выступает за использование собственных клеток пациента для создания in vitro васкуляризованного внеклеточного матрикса, отличающегося отсутствием экзогенного материала, что приближает процесс регенерации к физиологическому. Целью настоящего исследования явилось изучение морфологических преобразований дермы в зоне ожога с использованием биодеградируемого кальцийсодержащего филлера, выступающего в роли динамичного и мультифункционального регулятора клеточной активности дермы. Исследование выполнено на 30 лабораторных аутбредных крысах. Всем животным был нанесен ожог третьей степени, затем животных разделили на две группы: контрольную и опытную. На 14-й день после нанесения ожога крысам опытной группы вводили инъекционный препарат импланта на основе гидроксиапатита кальция «Radiesse». В группе контрольных животных использовали стерильный физиологический раствор. Биологический материал забирали в сроки, соответствующие 2 и 4 месяцам. Для оценки морфологического состояния зоны ожога гистологические срезы препаратов кожи окрашивали гематоксилином и эозином, по Маллори, Массону и Ван-Гизон. Иммуногистохимически определяли также коллаген І и ІІІ типов. Полученные данные позволяют считать, что использование кальцийсодержащего филлера представляется перспективным для регенерации кожи после ожога и может обеспечить получение экстрацеллюлярного матрикса дермы, имеющего состав и архитектуру коллагеновой сети, приближенной к естественной. Дифференцированное выявление коллагенов I и III типов подтвердило активацию темпа неоколлагеногенеза фибробластами как дермы зоны ожога, так и зоны импланта к концу второго месяца. Оценка показателя тканевой энтропии подтверждает общность структурной организации естественной и восстановленной после ожога и применения препарата дермы. Предлагаемая в эксперименте стратегия с использованием собственных клеток организма для синтеза внеклеточного матрикса, аналогичного естественному, может явиться альтернативой существующим методам лечения ожогов.
Кожа, ожог кожи, дерма, синтез коллагена, филлеры
Короткий адрес: https://sciup.org/143180236
IDR: 143180236 | DOI: 10.20340/mv-mn.2023.31(1).691
Текст научной статьи Активация синтеза внеклеточного матрикса дермы после термического ожога
Могильная Г.М., Фомичева Е.В., Евглевский А.А. Активация синтеза внеклеточного матрикса дермы после термического ожога. Морфологические ведомости. 2023;31(1):691. (1).691
Mogilnaya GM, Fomicheva EV, Evglevskiy AA. The activation of the dermis extracellular matrix synthesis after the thermal burn. Morfologicheskie Vedomosti – Morphological newsletter. 2023;31(1):691. (1).691
Введение. Стадийность репарации кожи после ожоговой травмы описана в литературе достаточно подробно и постулируется как многоступенчатый процесс, включающий в себя такие фазы, как воспаление, пролиферация и ремоделирование [1–3]. Каждая из названных фаз протекает с участием различных клеток дермы, что приводит к формированию определенного морфологического градиента [4–8]. При этом началом процесса регенерации считается эффект «закрытия» фибробластами раневого повреждения путем синтеза ими экстрацеллюлярного матрикса дермы (далее - ЭЦМ). Введение в медицинскую практику современных методов лечения ожоговых травм с использованием биоинженерных заменителей кожной и клеточной терапии оставляют за собой проблему, связанную с восстановленными участками кожи, которые отличаются от здоровой степенью организации коллагеновой сети, не соответствующей здоровой дерме, а также отсутствием эластина, придатков кожи и полноценного эффекта дифференцировки фибробластов в миофибробласты и изменением характера ремоделирования дермы с формированием грубого рубца [9–15]. Для решения этой проблемы могут быть использованы препараты, способные восстанавливаться естественную архитектуру дермы. Такой подход представляется перспективным, ибо соответствует современной концепции регенеративной медицины, предлагающей использовать для реконструкции органов и тканей собственные ресурсы организма [16–18].
Целью исследования является изучение морфологических преобразований дермы в зоне ожога с использованием биодеградируемого инъекционный препарата-импланта на основе гидроксиапатита кальция «Radiesse», выступающего в роли динамичного и мультифункцио-нального регулятора клеточной активности дермы.
Материалы и методы исследования. Экспериментальное исследование выполнено на 30 самцах беспородных крыс массой 200–250 грамм. Животных содержали в виварии с регулируемым световым режимом и свободным доступом к пище и воде, что соответствует ГОСТу РФ 330442014 «Принципы надлежащей лабораторной практики». Содержание и дизайн исследований согласованы с локальным этическим комитетом Кубанского госмедуни-верситета (протокол № 54 от 11.10.2017). Исследование проводилось в течение 4 месяцев. Для моделирования ожоговой раны использовали латунный цилиндр с площадью рабочей поверхности 706 мм2 и массой 300 грамм, нагретый до 100 градусов в кипящей воде. Цилиндр прикладывался рабочей поверхностью к депилированной коже животного в области холки на 15 секунд, что обеспечивало формирование ожога III-й степени. Для анестезии использовали ингаляционный наркоз. Всех животных после ожога разделили на две группы: контрольную (10 животных) и опытную (20 животных). В рамках протокола эксперимента на 14 день после нанесения ожога крысам опытной группы вводили препарат «Radiesse». Введение филлера проводили субдермально в объеме 0,05 мл на границе визуально определяемой интактной кожи. Этот день считали точкой отсчета эксперимента. В группе контрольных животных использовали стерильный физиологический раствор.
Объектом морфологического и иммуногистохимического анализа явились фрагменты кожных покровов в центре раневого дефекта и в участках неповрежденной кожи по краям ожоговой раны. Биологический материал забирали в сроки, соответствующие 2 и 4 месяцам. Из парафиновых блоков препаратов кожи изготавливали серийные срезы толщиной 4–5 микрон с использованием ротационного микротома. Для оценки морфологического состояния зоны ожога срезы окрашивали гематоксилином и эозином, по Маллори, Массону и Ван-Гизон. Для избирательного выявления коллагенов использованы иммуногистохимические тесты с антителами к коллагену І и ІІІ типов. Общее содержание коллагена определяли путем компьютерной морфометрии срезов, окрашенных по Маллори. Полученные изображения подвергали морфометрии c использованием программы ImageJ, при этом измеряли площадь, занятую цветным продуктом химической реакции, соответствующую сум- марному содержанию коллагена. Результаты измерений выражали в квадратных мегапикселях. Величину структурной тканевой энтропии определялся по масштабированным до формата 640×480 мегапикселей микрофотографиям с использованием 16-цветной палитры [19]. Все данные подвергались статистической обработке. Проверку характера распределения вариационных рядов производили с помощью параметрического критерия Пирсона. Во всех исследованных вариационных рядах значения асимметрии и эксцессов немного отличались от нуля, поэтому можно было считать, что распределения показателей являются нормальными. Учитывая близость распределений значений к нормальному, дополнительно проводили сравнение средних величин по критерию Стьюдента на уровне различий р<0,05. Влияние фактора ожога на различие значений показателей по времени проводили с помощью однофакторного дисперсионного анализа по критерию Фишера на уровне различий р<0,001.
Результаты исследования и обсуждение. Проведенная нами сравнительная морфологическая характеристика изменений, наблюдаемых в дерме в ответ на введение препарата и после его двухмесячного пребывания в дерме показало наличие импланта, окруженного соединительнотканной капсулой. Имплант выглядит в виде совокупности микросфер округлой или овальной формы, ограниченных тонкими фибриллами и одним слоем плоских оксифильно окрашенных клеток. Содержимое микросфер отсутствует, лишь изредка в них определяется мелкодисперсная масса. Между микросферами визуализируется небольшое число клеток, окрашивающихся базофильно и оксифильно. Окраска по Маллори позволяет увидеть коллагеновые волокна, последних в зоне ожога достаточно много, они формируют пучки, местами разделенные миофибробластами и гладкомышечными клетками. Зона импланта сохранена и содержит много микросфер, вокруг каждой из них определяется интенсивно окрашенная капсула и содержимое микросфер (рис. 1). Клетки между микросферами округлой формы, некото- рые из них имеют пенистую цитоплазму (рис. 2). Эпидермис через 2 месяца после нанесения ожога восстановливает свою целостность и насчитывает от 5 до 6 четко дифференцированных слоев (рис. 3).
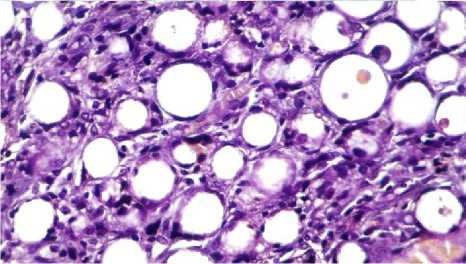
Рис. 1. Микрофото препарата кожи зоны импланта через 2 месяца после введения филлера. Окр. гематоксилином и эозином. Ув.: ×400
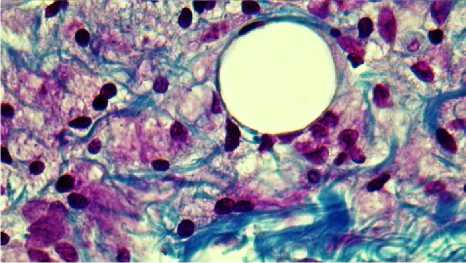
Рис. 2. Микрофото препарата кожи зоны импланта через 2 месяца после введения филлера. Окр. по Маллори. Ув.: ×400
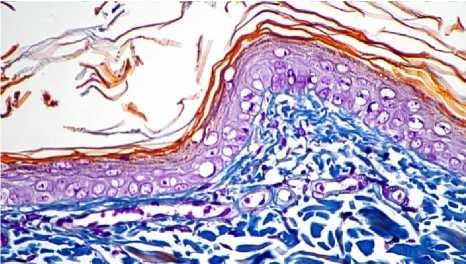
Рис. 3. Микрофото препарата кожи зоны введения импланта через 2 месяца. Окр. по Маллори. Ув.: ×400
При сравнении микропрепаратов кожи животных экспериментальной группы с пролонгированным до 4-х месяцев сроком пребывания в зоне дермы филлера, окрашенных по Маллори также сохраняется высокий уровень содержания коллагена, формирующего уже параллельно ориентированные фибриллярные пучки (рис. 4). Между коллагеновыми фибриллами можно видеть значительное число миофибробластов. Поверхностный ком-партмент дермы содержит сместившиеся в эту зону концевые отделы сальных желез. Эпидермис на участке ожога гипертрофирован и насчитывает до 6–7 клеточных рядов, которые покрывают высокие сосочки), меняющие рельеф поверхности кожи (рис. 4).
Дерма в зоне сосочкового слоя характеризуется наличием большого числа фибробластов, располагающихся между плотно упакованными пучками коллагена (рис. 5). Участок импланта локально не выявлялся из-за его биодеградации. Использование окраски по Ван-Гизон и Массону подтверждает выявленный эффект активации неоколлагеногенеза к сроку пребывания филлера в дерме до 2-х месяцев и сохранение его объема с последующим увеличением в условиях пролонгирования воздействия филлера до 4-х месяцев.
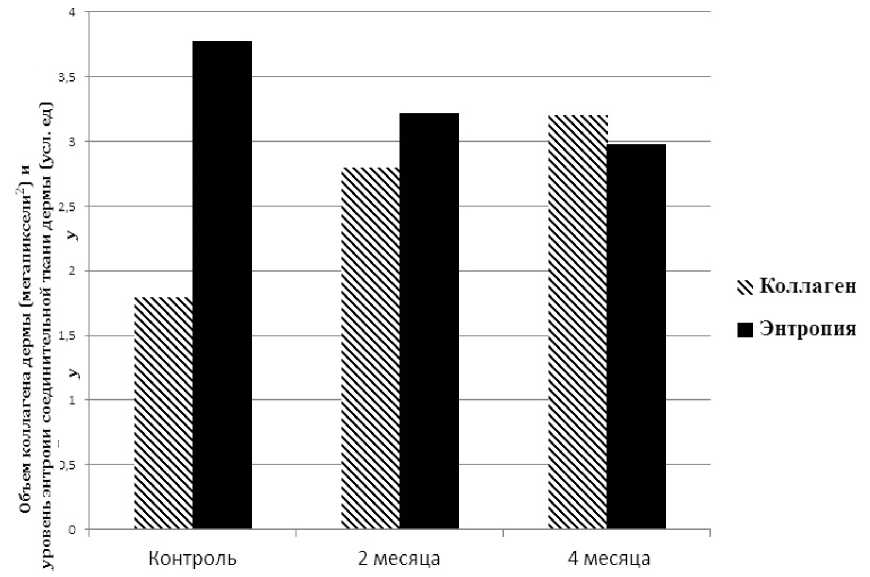
Проведенная морфометрия объема фибриллярного компонента экстрацеллюлярного матрикса показала, что в срок, соответствующий двум месяцам после введения импланта происходит увеличение содержания коллагена в среднем на 61%. К 4му месяцу эксперимента уровень содержания коллагена становился выше исходного на 87%.
Для оценки характера структурной организации вновь синтезированного фибриллярного компонента ЭЦМ нами был использован показатель энтропии, который является мерой функциональной целостности ткани и неупорядоченности морфологических систем в условиях нормы и патологии, что позволяет проводить сравнения и судить о динамике процесса. Оказалось, что участок дермы, регенерированный без импланта имеет показатель энтропии 3,78±0,13, что указывает на его дезорганизацию. Введение импланта заканчивается синтезом участка ЭЦМ с коэффициентом энтропии 2,98±0,06, что можно интерпрети- ровать как эффект установления в этой зоне дермы морфофункциональной стабильности (рис. 6).
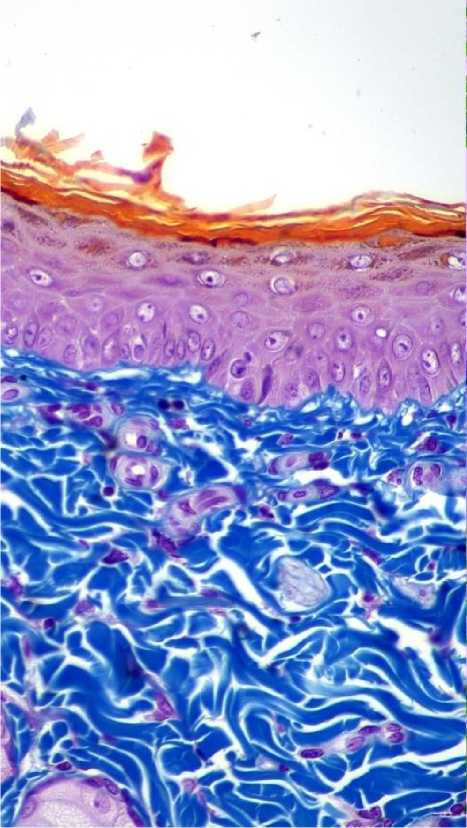
Рис. 4. Микрофото препарата кожи зоны введения импланта через 4 месяца. Окр. по Маллори. Ув.: х400
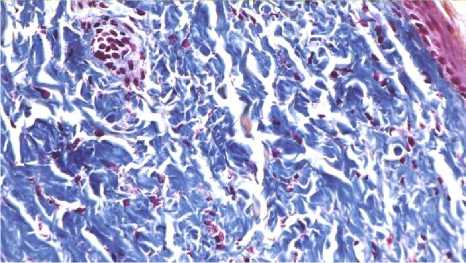
Рис. 5. Микрофото препарата кожи зоны введения импланта через 4 месяца. Окр. по
Маллори. Ув.: х400
Сроки исследования
Рис. 6. Динамика объема коллагена в экстрацеллюлярном матриксе и уровня структурной тканевой энтропии дермы в зоне термического ожога кожи контрольной и экспериментальной групп животных в различные сроки исследования
Изучение распределения коллагена с использованием иммуногистохимического метода позволило охарактеризовать типы синтезируемого коллагена. Так, оказалось, что имплант в срок, соответствующий двум месяцам, обеспечивает синтез коллагена I типа в количественном отношении больше обычного в 2 раза, что подтверждает эффект неоколлагеногенеза на фоне введения препарата. При этом наиболее высоким уровнем экспрессии проколлагена характеризуются клетки фибробласты. Отдельные участки аморфного компонента дермы окрашены диффузно и экспрессируют низкий уровень синтеза коллагена. В зоне импланта визуализируются микросферы, стенки их определяются за счет единичных, тонких, слабо окрашенных фибрилл. При выявлении коллагена I типа спустя 4 месяца после пребывания в зоне дермы импланта фибробласты выглядят более крупными с большим числом отростков, что указывает на активацию в них процесса экзоцитоза проколлагена. Повышение уровня экс- прессии коллагена I типа отмечается и в зоне ЭЦМ.
Коллаген III типа в срок, соответствующий 2 месяцам наблюдения, накапливается в дерме в большем количестве, чем коллаген I типа, в то же время зона экспрессии этих двух типов коллагена совпадает. Это, прежде всего, фибробласты, заполненные тропоколлагеном. Число этих клеток нарастает, но они мелкие, вытянутой веретеновидной формы с многочисленными отростками, заполненными секретом. В зоне импланта к этому сроку уровень экспрессии коллагена III типа умеренный. Обращает на себя внимание положительная реакция содержимого микросфер, которое выглядит в виде мелкодисперсной массы с умеренной экспрессией коллагена III типа. В условиях пролонгирования срока пребывания препарата филлера до 4 месяцев, уровень экспрессии коллагена III типа в зоне импланта не меняется, а в дерме над ним визуализируется большое число фибробластов с высоким уровнем экспрессии коллагена III типа.
Результаты наших экспериментов показали, что процесс регенерации ЭЦМ дермы, приуроченный к двум месяцам пребывания филлера в дерме, индуцирует эффект неоколлагеногенеза, регистрируемый при гистохимическом его выявлении по Маллори, при этом процесс неоколлагено-генеза с пролонгированным действием филлера до 4-х месяцев нарастает.
Дифференцированное выявление коллагенов I и III типов с использованием антител подтверждает активацию темпа неоколлагеногенеза фибробластами как дермы, так и импланта к концу второго месяца, причем этот факт прослеживается в распределении коллагена как I, так и III типа. Темп синтеза первого сохраняется достаточно высоким до 4-х месяцев пребывания филлера в дерме. Что же касается коллагена III типа, то отмечается усиление темпа синтеза его в зоне дермы к сроку, соответствующему 2-м месяцам, к 4-м месяцам синтез его в зоне импланта снижается. В самой дерме характер распределения коллагена III типа остается высоким и соответствует картине двух месяцев пребывания филлера в зоне ожога.
Заключение. Таким образом, полученные данные позволяют считать, что использование биодеградируемого препарата филлера на основе гидроксиапатита кальция «Radiesse» представляется перспективным для регенерации дермы после ожога и может обеспечить получение ЭЦМ дермы, имеющего состав и сборку коллагеновой сети, приближенной к естественной. Использование показателя энтропии подтверждает общность структурной организации дермы. Не исключено, что выявленный тип формирования ЭМЦ может обеспечить становление межклеточных коммуникаций для фибробластов, макрофагов и кератиноцитов, что обеспечит процесс модуляции синтезируемой дермы, аналогично имеющейся in vivо. Предлагаемая в эксперименте стратегия с использованием собственных клеток организма для синтеза внеклеточного матрикса, аналогичного естественному, может явиться альтернативой существующим методам лечения ожогов.
Список литературы Активация синтеза внеклеточного матрикса дермы после термического ожога
- Zhang X, Kang X, Jin L et al. Stimulation of wound healing using bioinspired hydrogels with basic fibroblast growth factor (bFGF). Int J Nano-med. 2018;(13):3897-3906. DOI: 10.214/IJN.S168998.
- Velnar T, Bunc G, Klobucar R et al. Biomaterials and host versus graft response: A short review. Bosn J Basic Med Sci. 2016;16(2):82-90. DOI: 10.17305/bjbms.2016.525
- Urciuolo F, Casale C, Imparato G et al. Bioengineered Skin Substitutes: The Role of Extracellular Matrix and Vascularization in the Heaking of Deep Wounds. J Clin Med. 2019;8:2083. DOI: 10.3390/jcm 8122083
- Hesketh M, Sahin KB, West ZE et al. Macrophage Phenotypes Regulate Scar Formation and Chronic Wound Healing. Int J Mol Sci. 2017;18:154. DOI: 10/3390/ijms18071545
- Zavgorodniaia MI, Makeva LV, Slavcheva OS et al. Cellular and molecular basics of the wound healing. Morphologia. 2016;10(3):19-23
- Gorokhova VS, Chernovol PA, Chenovol VP i dr. Variabel'nost' otveta trombotsitov na ADF: ot teorii trombogeneza k prakticheskomu prime-neniyu bogatoy trombotsitami plazmy. Klinicheskaya i laboratornaya diagnostika. 2016;61(6):363-367. In Russian
- Gilroy D, De Maeyer R. New insights into the resolution of inflammation. Semin Imminol. 2015;27(3):161-168. DOI: 10.1016/J.smim.2015.05.003.
- Donati G, Watt FM. Stem cell heterogeneity and plasticity in epithelia. Cell Stem Cell. 2015;16:465-476. DOI: 10.1016/j.stem 2015.04.014.
- Rittie L. Cellular mechanisms of skin repair in humans and other mammals. J. Cell Commun Signal. 2016;10(2):103-120. DOI: 10.1007/s12079-016-0330-1
- Motwani MP, Flint JD, De Maeyer RP et al. Novel translational model of resolving inflammation triggered by UV-killed E. coli. J Pathol Clin Res. 2016;2(3):154-165. DOI: 10.1002/cjp2.43
- Schlader ZJ, Vargas NT. Regulation of Body Temperature by Autonomic and Behavioral Thermoeffectors. Exerc. Sport Sci. Rev. 2019;47:116-126
- Lombardi B, Casale C, Imparato G et al. Spatiotemporal Evolution of the Wound Repairing Process in a 3D Human Dermis Equivalent. Adv. Healthc. Mater. 2017;6:1-11. DOI: 10.1249/jes 0000000000000180
- Martorina F, Casale C, Urciuolo F et al. In vitro activation of the neuro-transduction mechanism in sensitive organotypic human skin model. Biomaterials. 2017;113:217-229. DOI: j.biomaterials.2016.10.051
- Boyce ST, Lalley AL. Tissue engineered/ing of skin and regenerative medicine for wound care. Burns Trauma. 2018;6:1-10. DOI: 10.1186/s4038-017-0103-y
- Fetah K, Tebon P, Goudie MJ et al. The emergence of 3D bioprinting in organ-on-chip systems. Reports Prog. Biomed. Eng. 2019;1:012001. DOI: 10.1088/2516-1091ab 23df
- Tarassoli SP, Jessop ZM, Al-Sabah A et al. Skin tissue engineering using 3D bioprinting: An evolving research field. J. Plast. Reconstr. Aesthetic Surg. 2018;71:615-623
- Shukla Boulet LP. Airway remodeling in asthma: update on mechanisms and therapeutic approaches. Curr Opin Pulm Med 2018;24(1):56-62. DOI: 10.1097/ mcp. 0000000000000441
- Michalek IM, Lelen-Kaminska K, Caetano Dos Santos FL. Peptides stimulating synthesis of extracellular matrix used in anti-ageing cosmetics: are they clinically tested? A systematic review of the literature. Australas J Dermatol. 2019;60(4):e267-e271. DOI: 10.1111/ajd.13036
- Krasil'nikova SV, Eliseeva TI, Popov KS i dr. Mul'timorbidnost' patologii verkhnikh dykhatel'nykh putey u detey s bronkhial'noy astmoy. Pediatriya. 2018;97(2):19-26. In Russian. DOI: 10.24110/0031-403x-2018-97-2-19-26
- Avtandilov GG. Morfometriya. Rukovodstvo. Moskva: Meditsina, 1990.- 384s. In Russian


