Активность ферментов антиоксидантной защиты и анаэробного гликолиза в условиях температурного градиента у палеарктического Lymnaea stagnalis
Автор: Верещагина К.П., Лубяга Ю.А., Гурков А.Н., Щапова Е.П., Мадьярова Е.В., Кондратьева Е.М., Голубев А.П., Тимофеев М.А., Аксенов - Грибанов Д.В.
Журнал: Журнал стресс-физиологии и биохимии @jspb
Статья в выпуске: 4 т.9, 2013 года.
Бесплатный доступ
Целью настоящего исследования являлось проведение оценки активности ферментов антиоксидантной системы (пероксидазы, каталазы, глутатион S-трансферазы) и анаэробного гликолиза (лактатдегидрогеназы) в условиях температурного градиента у палеарктического вида гастропод Lymnaea stagnalis (Linnaeus,1758). В работе показано, что в условиях гипертермии у L. stagnalis происходит повышение активности пероксидазы, лактатдегидрогеназы и глутатион S-трансферазы, а также снижение активности каталазы. Таким образом, показано, что ферменты антиоксидантной системы (пероксидаза, каталаза, глутатион S-трансфераза) и анаэробного гликолиза (лактатдегидрогеназа) участвуют в механизмах адаптации у гастропод к меняющимся температурам среды.
Короткий адрес: https://sciup.org/14323815
IDR: 14323815
Текст научной статьи Активность ферментов антиоксидантной защиты и анаэробного гликолиза в условиях температурного градиента у палеарктического Lymnaea stagnalis
Целью настоящего исследования была оценка активности ферментов антиоксидантной системы (пероксидазы, каталазы, глутатион S-трансферазы) и анаэробного гликолиза (лактатдегидрогеназы) в условиях температурного градиента у палеарктического Lymnaea stagnalis .
МАТЕРИАЛЫ И МЕТОДЫ
В качестве объектов исследования были выбраны палеарктические брюхоногие моллюски, получившие широкое распространение в Прибайкальском регионе - Lymnaea stagnalis (Linnaeus,1758). Данный вид широко распространён не только в водоемах Палеарктики, но и населяет ряд изолированных мелководных заливов (соров) Байкала. Представители L. stagnalis предпочитают заросшие участки водоемов, встречается на растениях, вблизи от поверхности воды (Беркин и др., 2009; Тимошкин, 2009).
Гастроподы были собраны в водоеме, расположенном в черте г. Иркутска (N 52°26.83’, E104°28.13’). Перед экспериментом гастропод содержали в аэрируемых термостатах при температуре +6 (±0,5) °С в течение 7 суток. Содержание в лабораторных условиях не являлось стрессовым, гибель моллюсков в это время не отмечали. Во всех экспериментах использовали здоровых и активных особей.
В экспериментальном исследовании проведена экспозиция гастропод в условиях градиентной гипертермии от 6°С (средняя температура среды водоема, в котором проводили отлов моллюсков) до температуры, при которой отмечали гибель 50% особей (30°). Скорость изменения температуры составила
1оС•ч-1. Фиксацию материалов проводили в жидком азоте каждые 5°С (5 часов). Контрольные образцы зафиксированы непосредственно перед экспериментом при температуре акклимации (6°С).
Оценку активности ферментов антиоксидантной системы (пероксидазы, каталазы и глутатион S-трансферазы) проводили согласно модифицированным спектрофотометрическим методикам Drotar (1985), Aebi (1984) и Habig (1974) соответственно (Тимофеев, 2006; 2010). Определение активности лактатдегидрогеназы проводили энзиматическим спектрофотометрическим методом с применением стандарт-набора «ЛДГ-витал» (Vital-Diagnostics Spb).
Измерения проводили на спектрофотометре Cary 50 (Varian, США) при λ=340 нм для пероксидазы и лактатдегидрогеназы, при λ=240нм для каталазы и при λ=436 нм для глутатион S- трансферазы. Все эксперименты проведены в 5 биологических параллелях. Биохимический анализ каждой пробы проведен в 3-х аналитических измерениях. Оценку достоверности проводили, используя двувыборочный u-критерий Манна-Уитни. Статистический анализ проводили с использованием программы Statistica 8.0.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Результаты проведенного исследования представлены на рис. 1. Согласно полученным данным, активность пероксидазы у палеарктического L. stagnalis в контрольной группе составила 0,29 ±0,03 нКат/мг белка. В условиях повышения температуры среды у L. stagnalis отмечали повышение активности до
0,45 ±0,051 нКат/мг белка при достижении температуры среды 30°С.
Активность каталазы в контрольных образцах L. stagnalis составила 369,32 ±50,07 нКат/мг белка. При воздействии повышенной температуры на гастропод, у L. stagnalis происходило снижение активности каталазы при 10°С до 156,1 ± 45,14 нКат/мг белка и при 25-30°С до 179,6 ± 48,38 нКат/мг белка.
Как следует из представленных материалов, у L. stagnalis активность глутатион S-трансферазы в контрольных образцах составила 19,7±2,16 нКат/мг белка. При экспозиции гастропод L. stagnalis в условиях температурного градиента наблюдали увеличение активности фермента относительно контрольных значений при повышении температуры с 15 до 30°С. Максимальная активность глутатион S-трансферазы составила 26,5±2,39 нКат/мг белка и была отмечена при достижении температуры 25°С.
Согласно полученным материалам по оценке активности лактатдегидрогеназы, в контрольных образцах у палеарктического L. stagnalis активность фермента составила 0,017 ± 0,003 нКат/мг белка. Максимальная активность лактатдегидрогеназы - 0,024 ± 0,002 нКат/мг белка отмечена при температуре 20°С, после чего происходило снижение активности фермента до контрольных значений.
Таким образом, в работе показано, что в условиях температурного градиента у исследуемых гастропод происходят изменения активности ферментов антиоксидантной системы и анаэробного гликолиза. При гипертермии у L. stagnalis происходит повышение активности пероксидазы, лактатдегидрогеназы и глутатион S-трансферазы, и снижение активности каталазы. Это свидетельствует об активации антиоксидантой системы, необходимой для элиминации активных форм кислорода, интенсивно образующихся при стрессовых условиях. Причины снижения активности каталазы у палеарктического L. stagnalis, учитывая экологические характеристики вида и высокие показатели терморезистентности, вероятно связанны с попыткой организма перейти на менее энергозатратные механизмы поддержания жизнедеятельности.
Повышение температуры приводит к ряду структурно – функциональных перестроек клеточных мембран, что сопровождается накоплением вторичных продуктов перекисного окисления липидов (ПОЛ -триеновых коньюгатов, альдегидов и кетонов), на что косвенно указывает увеличение активности фермента глутатион-S-трансферазы у L. stagnalis. Это вероятно свидетельствует об усилении выведения токсичных продуктов ПОЛ, и поддержании внутриклеточной защиты от повреждения мембран (Pennec, 2003).
Повреждение мембран напрямую влияет на состояние энергетического обмена организмов. Так, при нарушении структуры мембран обеспечение работы электрон-транспортной цепи митохондрий становится невозможно, что заставляет организмы переходить на менее эффективные метаболические пути получения энергии. В частности – путь анаэробного гликолиза, одним из маркеров которого является активность фермента лактатдегидрогеназы. Увеличение активности лактатдегидрогеназы, сопровождающееся накоплением лактата, указывает на интенсификацию утилизации лактата с целью получения энергии на фоне общего угнетения метаболизма. В текущей работе, на примере L. stagnalis показано, что переключение метаболизма с эффективного аэробного на менее эффективный анаэробный является компенсаторным механизмом получения энергии в условиях энергодефицита (Тимофеев, 2010).
установлено, что активность каталазы и лактатдегидрогеназы у L. stagnalis значительно ниже, а активность пероксидазы и глутатион S – трансферазы, напротив, значительно выше, чем у байкальского B. ongurensis . Вероятно, это может быть связано с контрастно отличающимися условиями обитания и экологическими характеристиками исследованных видов.
Из сравнения показателей активности у ранее
Таким образом, в работе показано, что исследованного байкальского Benedictia ферменты антиоксидантной системы ongurensis (Axenov-Gribanov et al., 2013) и у (пероксидаза, каталаза, глутатион S-палеарктического L. stagnalis установлено, что у трансфераза) и анаэробного гликолиза гастропод разных экологических групп (лактатдегидрогеназа) участвуют в механизмах отличаются базовые (контрольные) показатели стресс-адаптации у палеарктических гастропод
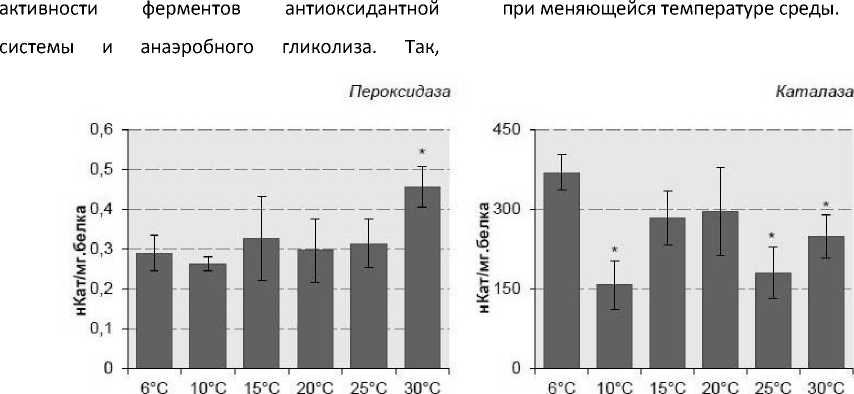
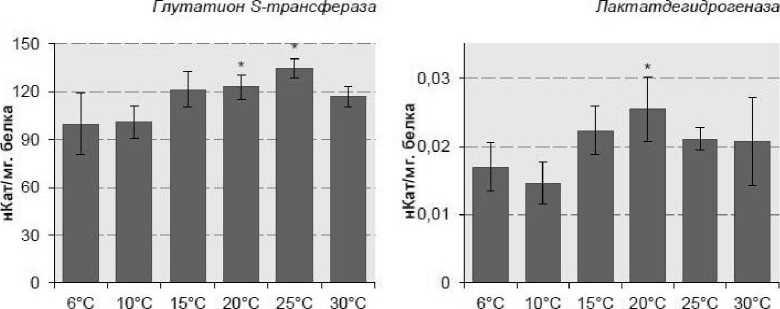
Рисунок 1. Активность ферментов антиоксидантной системы и анаэробного гликолиза у L. stagnalis в норме и при экспозиции в условиях температурного градиента (в нКат/мг белка).
Работа выполнена при частичной финансовой поддержке грантов РФФИ (12-04-31767 мол_а, 12-04-90039 Бел_а, 12-04-98062-р_сибирь_а, 11-04-91321-СИГ_а), грантов Президента РФ МК-5466.2012.4, МД-2063.2012.4, ФЦП «Научные и научно-педагогические кадры инновационной России», а также программы стратегического развития ИГУ. Авторы выражают особую благодарность Шахтановой Надежде Сергеевне за помощь в проведении данного исследования.
Список литературы Активность ферментов антиоксидантной защиты и анаэробного гликолиза в условиях температурного градиента у палеарктического Lymnaea stagnalis
- Aebi, H. (1984) Catalase in vitro. Methods Enzymol. 105, 121-126
- Axenov-Gribanov, D.V., Bedulina, D.S., Shatilina, Zh.M., Lubyaga, Y.A., Vereshchagina, K.P., Timofeyev, M.A. (2013) A cellular and metabolic assessment of the thermal stress responses in the endemic gastropod Benedictia limnaeoides ongurensis from Lake Baikal. J. Comparative biochemistry and physiology. (submitted)
- Drotar, A., Phelps, P., and Fall, R. (1985) Evidence for glutathione peroxidase activities in cultured plant cells. Plant Sci. 42, 35-40
- Habig, W.H., Pabst, M.J., and Jakoby, W.B. (1974) Glutathione S-transferases. The first enzymatic step in mercapturic acid formation. J. Biol. Chem. 249, 7130-7139
- Le Pennec, G., & Le Pennec, M. (2003). Induction of glutathione S-transferases in primary cultured digestive gland acini from the mollusk bivalve Pecten maximus L.: application of a new cellular model in biomonitoring studies. Aquatic toxicology, 64(2), 131-142
- Linnaeus C. (1758) Systema Naturae per regna tria naturae, secundum classes, ordines, genera, species, cum characteribus, differentiis, synonymis, locis. 10th edition. Vermes. Testacea: 700-781. Holmiae. (Salvius)
- Беркин, Н.С. И, Макаров, А.А., Русинек, О.Т. (2009) Байкаловедение. Иркутск: Изд-во Ирк. гос. ун-та, 291 с
- Константинов, А.С. (1986). Общая гидробиология. М.:ВШ. 4-e изд. 483c
- Тимофеев М.А. (2010) Экологические и физиологические аспекты адаптации к абиотическим факторам среды эндемичных байкальских и палеарктических амфипод: Дис. … Д-р. биол. Наук. ТГУ, Томск, 384с
- Тимошкин О. А., Провиз В. И., Ситникова Т. Я. (2009) Аннотированный список фауны озера Байкал и его водосборного бассейна. В 2 т. Новосибирск: Наука, 1083 с


