Активность ферментов дыхательной цепи митохондрий лейкоцитов крови в условиях токсического гепатита, индуцированного на фоне пищевого лишения белка
Автор: Волощук О.Н., Копыльчук Г.П.
Журнал: Журнал стресс-физиологии и биохимии @jspb
Статья в выпуске: 4 т.11, 2015 года.
Бесплатный доступ
Полное функционирование системы энергоснабжения лейкоцитов является одним из важнейших факторов эффективной работы системы иммунного контроля. Основными ферментами системы биотрансформации лейкоцитов являются NADH-убиквитинредуктаза, маркер комплекса I активности дыхательной цепи и сукцинатдегидрогеназа, ключевой фермент комплекса II дыхательной цепи. Цель исследования - изучить активность NADH-убиквитин-редуктазы и сукцинатдегидрогеназы митохондрий лейкоцитов крови в условиях токсического гепатита, индуцированного на фоне пищевого лишения белка. Показано, что в условиях ацетаминофен-индуцированного гепатита наблюдается восстановление ферментативной активности NADH-ubiquitin-редуктазы при фоновой активации сукцинат-зависимого пути митохондриального окисления. Сделан вывод, что пищевое лишение или белок является фактором, усугубляющим дисбаланс системы биотрансформации энергии в лейкоцитах крыс с токсическим гепатитом. Установленные изменения активности лейкоцитов в митохондриях с ключевыми энзимами дыхательной цепи можно рассматривать как один из механизмов, направленных на поддержание энергоснабжения лейкоцитов на уровне, достаточном для их функционирования. Результаты исследований могут быть использованы для биохимического обоснования терапевтических подходов к устранению и коррекции последствий нарушений энергетического метаболизма лейкоцитов в условиях гепатита, вызванного ацетаминофеном, усугубляемого лихорадкой пищевого белка.
Короткий адрес: https://sciup.org/14323978
IDR: 14323978
Текст научной статьи Активность ферментов дыхательной цепи митохондрий лейкоцитов крови в условиях токсического гепатита, индуцированного на фоне пищевого лишения белка
Метаболические превращения, происходящие в лейкоцитах периферической крови, отражают состояние обменных и регуляторных процессов в организме (Marchenko, Voloshchuk, 2014; Kramer et al. , 2014), а изучение активности отдельных звеньев энергетического обмена позволяет оценить эффективность функционирования системы биотрансформации энергии, обеспечивающей исполнение лейкоцитами своих функций. Полноценное функционирование системы энергообеспечения лейкоцитов является одним из необходимых условий эффективной работы системы иммунного надзора (MacIver et al. , 2008).
Центральными ферментами системы энергообеспечения лейкоцитов является NADH-убихинонредуктаза, маркер активности Комплекса I дыхательной цепи (Finel et al. , 1992), и сукцинатдегидрогеназа, ключевой фермент Комплекса II дыхательной цепи (Miles, 2003). NADH-убихинонредуктаза обеспечивает транспорт четырех протонов из матрикса в межмембранное пространство и восстановление убихинона (Sharova, Vekshin, 2004), сукцинатдегидрогеназа (сукцинат-КоQ-редуктаза) обеспечивает функционирование дополнительного пути для входа электронов в дыхательную цепь за счет окисления сукцината (Jones, Hirs, 2013).
На сегодня остается открытой и требует подробного изучения проблема биохимических механизмов формирования дисбаланса системы биотрансформации энергии в клетках иммунной системы в условиях лекарственного гепатита, формирующегося в условиях алиментарного дефицита белка.
Цель исследований – определение активности NADH-убихинонредуктазы [КФ 1.6.5.3] и сукцинатдегидрогеназы [КФ 1.3.5.1] митохондрий лейкоцитов в условиях ацетаминофен-индуцированного гепатита на фоне алиментарной депривации протеина.
MATERIALS AND METHODS
Исследования проводили на 27 белых нелинейных крысах массой 90-100 г и возрастом 22,5 месяца. Работу с животными осуществляли с учетом положений Хельсинской декларации Всемирной медицинской ассоциации от 1964 г., дополненной в 1975, 1983 и 1989 гг.
Крыс содержали по одной в пластмассовых клетках с песчаной подстилкой, доступ к воде ad libitum . Нормирование суточного рациона проводили с учетом принципа парного питания.
Исследования проводили на 3 группах животных: 1 – контроль (К); 2 – крысы с острым ацетаминофен-индуцированным гепатитом, содержащиеся на полноценном рационе (Г); 3 – крысы с ацетаминофен-индуцированным гепатитом, содержащиеся в условиях алиментарной депривации протеина (НПР+Г).
Животные 1-й и 2-й группы на протяжении 28 суток получали рацион, включающий 14 % протеина (в виде казеина), 10 % жиров и 76 % углеводов, сбалансированный по всем нутриентам (Reeves et al., 1993). Животные 3-й группы получали изоэнергетический рацион, содержащий 4,7 % белка, 10 % жиров, 85,3 % углеводов.
После четырехнедельного содержания крыс на экспериментальной диете моделирование ацетаминофен-индуцированного гепатита осуществляли путем введения per os ацетаминофена в дозе 1 г/кг массы животных в 2 % крахмальной взвеси на протяжении 2 дней с помощью специального зонда (Voloshchuk, Kopylchuk, 2015).
Цервикальную дислокацию крыс под легким эфирным наркозом осуществляли на 31 сутки эксперимента.
Выделение лейкоцитов периферической крови осуществляли с помощью метода седиментации в градиенте плотности фиколл-верографина (ρ = 1,077 г/мл). Жизнеспособность клеток, определяемая в тесте с трипановым синим, составляла не менее 97%.
Для выделения митохондриальной фракции суспензию лейкоцитов ресуспендировали в 5 объемах буфера, содержащего 0,25 М сахарозу, 10 мМ фосфата калия, 1 мМ ЭДТА (рН 7,2). Суспензию клеток гомогенизировали. Гомогенат центрифугировали при 800 g на протяжении 10 минут. Осадок центрифугировали при 8000 g 10 минут и ресуспендировали с буфером без ЭДТА (Biswas et al., 1997). Определение NADH-убихинонредуктазной активности проводили спектрофотометрически (Marchenko, Voloshchuk, 2014). NADH-убихинонредуктазную активность расчитывали с учетом коэффициента молярной экстинкции 6,22•103 М-1•см-1. Сукцинатдегид-рогеназную активность определяли по интенсивности восстановления феррицианида калия (Sharova, Vekshin, 2004). Содержание белка определяли по Лоури.
Статистическую значимость полученных результатов биохимических анализов оценивали с помощью непараметрического критерия Манна-Уитни с применением программы обработки статистических данных «Statistica 6.0».
RESULTS AND DISCUSSION
Результаты исследований показали, что в условиях ацетаминофен-индуцированного гепатита наблюдается нарушение функциональной активности энзиматических маркеров дыхательной цепи митохондрий лейкоцитов. Нами установлено торможение активности NADH-убихинонредуктазы лейкоцитов крыс с токсическим гепатитом в 1,3 раза по сравнению с показателями контрольной группы животных (рис. 1). Вероятно, причиной установленного факта является нарушение структурно-функциональной организации Комплекса І дыхательной цепи в данных экспериментальных условиях. Показано, что метаболит ацетаминофена – N-ацетил-р-бензохинонимин (NAPQI) способен связываться с остатками цистеина белков дыхательной цепи (Heard et al. , 2011). Учитывая, что структурными компонентами NADH-убихинонредуктазного комплекса являются железо-серные кластеры, возможно, одним из механизмов нарушения функциональной активности исследуемого фермента является образование комплексов
NAPQI-протеин. Сегодня образование ковалентных
комплексов
метаболитов
ацетаминофена с митохондриальными белками рассматривается как триггер первичной митохондриальной дисфункции, определяющий дисбаланс процессов энергообеспечения (Andringa et al., 2008).
В то же время у белок-дефицитных животных с токсическим гепатитом наблюдается практически десятикратное снижение активности NADH- убихинонредуктазы. Вероятно, такие изменения связаны с нарушением синтеза отдельных субъединиц NADH-убихинонредуктазного комплекса в условиях дефицита белка. Установленный факт свидетельствует, что в условиях токсического гепатита, усугубленного алиментарной белковой недостаточностью, в митохондриях лейкоцитов происходит нарушение способности транспортировать электроны в дыхательную цепь от NADH-зависимых субстратов.
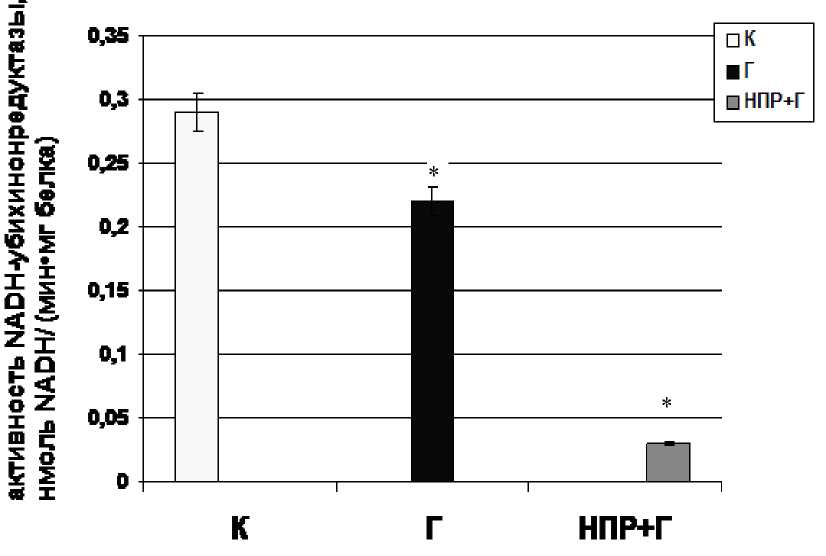
Figure 1. Активность NADH-убихинонредуктазы в митохондриальной фракции лейкоцитов периферической крови в условиях ацетаминофен-индуцированного гепатита на фоне алиментарной депривации протеина
Примечание (тут и далее):
К – крысы, содержащиеся на полноценном полусинтетическом рационе
Г – крысы с ацетаминофен-индуцированным гепатитом, содержащиеся на полноценном полусинтетическом рационе
НПР + Г – крысы с ацетаминофен-индуцированным гепатитом, содержащиеся на низкопротеиновом рационе
*- cтатистическая значимость различий между опытной и контрольной группой (Р < 0,05)
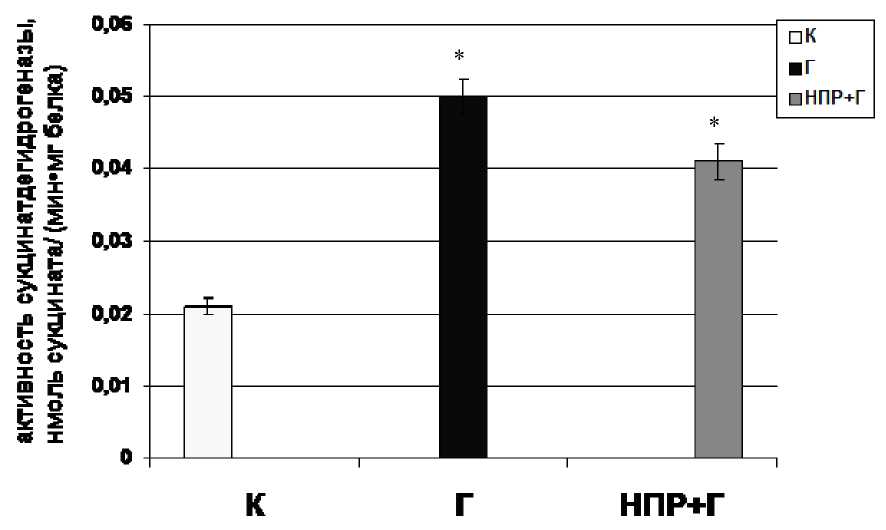
Figure 2. Активность сукцинатдегидрогеназы в митохондриальной фракции лейкоцитов периферической крови в условиях ацетаминофен-индуцированного гепатита на фоне алиментарной депривации протеина
Поэтому на следующем этапе исследований актуальным было изучение активности сукцинатдегидрогеназы лейкоцитов периферической крови у животных с токсическим гепатитом как посредника между FAD-зависимыми субстратами и дыхательной цепью. Именно активность сукцинатдегидрогеназы в значительной степени определяет скорость использования кислорода и синтеза АТР в митохондриях в условиях нарушения активности NADH-убихинонредуктазы (Cecchini, 2003). Результаты наших исследований показали, что у животных с ацетаминофен-индуцированным гепатитом, содержащихся в различных режимах белкового питания, происходит активация сукцинатзависимого пути окисления по сравнению с интактными животными (рис. 2). Вероятно, в условиях повышенной потребности в энергии, активация сукцинатдегидрогеназы позволяет сохранить энергосинтезирующую функцию цитохромного участка дыхательной цепи митохондрий лейкоцитов. Увеличение потока электронов через Комплекс ІІ дыхательной цепи митохондрий лейкоцитов на фоне нарушения работы Комплекса І, вероятно, отражает активацию компенсаторных метаболических потоков в условиях повышенной потребности в энергии и обеспечивает поддержание энергообеспечения лейкоцитов на уровне, достаточном для их функционирования.
Установленные закономерности работы ферментов дыхательной цепи митохондрий лейкоцитов могут быть основополагающими в обеспечении их функционирования в условиях токсического гепатита на фоне алиментарной депривации протеина.
Результаты исследований могут использоваться для биохимического обоснования терапевтических подходов к устранению и коррекции последствий нарушения энергетического обмена лейкоцитов в условиях ацетаминофен-индуцированного гепатита, усугубленного алиментарной депривацией протеина.
Список литературы Активность ферментов дыхательной цепи митохондрий лейкоцитов крови в условиях токсического гепатита, индуцированного на фоне пищевого лишения белка
- Andringa K.K., Bajt M.L., Jaeschke H., Bailey S.M. (2008) Mitochondrial Protein Thiol Modifications in Acetaminophen Hepatotoxicity: Effect on HMG-CoA Synthase. Toxicol. Lett., 177 (3). 188-197
- Biswas S., Ray M., Misra S., Dutta D.P., Ray S. (1997) Selective inhibition of mitochondrial respiration and glycolysis in human leukaemic leucocytes by methylglyoxol. J. Biochem., 323, 343-348
- Cecchini G. (2003) Function and structure of complex II of the respiratory chain. Annu. Rew. Biochem., 77, 77-109
- Finel M., Skehel J.M., Albracht S.P.J., Fearnley I.M., Walker J.E. (1992) Resolution of NADH:ubiquinone oxidoreductase from bovine heart mitochondria into two subcomplexes, one of which contains the redox centers of the enzyme. Biochemistry., 31, 11425-11434
- Heard K.J., Green J.L., James L.P., Judge B.S., Zolot L., Rhyee S., Dart R.C. (2011) Acetaminophencysteine adducts during therapeutic dosing and following overdose. BMC Gastroenterology, 11, 20-29
- Jones A.J.Y., Hirs J. (2013) A spectrophotometric coupled enzyme assay to measure the activity of succinate dehydrogenase. Analytical Biochemistry., 442, 19-23
- Kramer P.A., Ravi S., Chacko B., Johnson M.S., Darley-Usmar V.M. (2014) A review of the mitochondrial and glycolytic metabolism in human platelets and leukocytes: Implications for their use as bioenergetic biomarkers. Redox Biology, 2, 206-210
- MacIver N.J., Jacobs S.R., Wieman H.L., Wofford J.A., Coloff J.L., Rathmell J.C. (2008) Glucose metabolism in lymphocytes is a regulated process with significant effects on immune cell function and survival. J. Leukocyte Biol., 84 (4), 949-957
- Marchenko M.M., Voloshchuk O.N. (2014) The state of the energy-supply system of the blood leukocytes in the dynamics of guerin's carcinoma growth under the conditions of the low-level irradiation. Biomed. Chem., 60 (6), 631-635
- Miles B. (2003) The electron Transport Chain. LSM., 2, 1-11
- Reeves P.G., Nielsen F.H., Fahey G.C. (1993) AIN-93 Purified Diets for Laboratory Rodents: Final Report of the American Institute of Nutrition Ad Hoc Writing Committee on the Reformulation of the AIN-76A Rodent Diet. J. Nutr., 5, 1939-1951
- Sharova I.V., Vekshin N.L. (2004) Rotenone-insensitive NADH oxydation in mitochondrial suspension occurs by NADH dehydrogenase of respiratory chain fragments. Biophysic., 49, 814-821
- Voloshchuk O.N., Kopylchuk G.P. (2015) The Peculiarities of the Structural and Functional State of the Cytochrome Component of the Liver Mitochondrial Respiratory Chain under Conditions of Acetaminophen-Induced Hepatitis on the Background of Alimentary Protein Deprivation. Biophysics., 60 (3), 420-424


