Активность ферментов метаболизма активных форм кислорода и уровень световой эмиссии мицелия гриба Neonothopanus nambi при действии салициловой кислоты
Автор: Тюлькова Н.А., Бондарь В.С.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Биологические науки
Статья в выпуске: 2, 2017 года.
Бесплатный доступ
Проведена оценка активности ферментов метаболизма активных форм кислорода (АФК) - НАДФН-оксидазы, каталазы, супероксиддис-мутазы и пероксидазы и интенсивности све-товой эмиссии механически поврежденного мицелия светящегося гриба Neonothopanus nambi без и при добавках экзогенной салицило-вой кислоты (СК). Показано, что в условиях острого эксперимента, после повреждения образцов мицелия и последующей их инкубации в питательной среде, в течение короткого (6-7 часов) интервала времени наблюдается значительное (на 2 порядка и более) увеличе-ние уровня световой эмиссии гриба. Повыше-ние свечения регистрируется на фоне суще-ственного снижения в мицелии активности супероксиддисмутазы (СОД) и общей перокси-дазной активности. При этом уровень актив-ности НАДФН-оксидазы в грибе практически не меняется в течение всего эксперимента, а активность каталазы незначительно возрас-тает. Установлено, что добавка СК в среду инкубации заметным образом подавляет све-товую эмиссию мицелия N. nambi. При этом выявлено, что экзогенная СК активирует все изучаемые ферменты метаболизма АФК за исключением каталазы, активность которой несущественно снижается. Установлено, что эффекты СК являются дозозависимыми и на-растают с увеличением концентрации реа-гента. Совокупность полученных данных со-гласуется с высказанной нами ранее гипоте-зой, что грибное свечение является дополни-тельным механизмом антиоксидантной за-щиты от повреждающего действия АФК. На-блюдаемое в работе значительное увеличение световой эмиссии поврежденного мицелия при снижении активности СОД, особенно общей пероксидазной активности, может свиде-тельствовать о запуске в грибе этого меха-низма защиты от АФК, прежде всего от Н2О2 и иных пероксидных соединений.
Активные формы кисло-рода, светящиеся грибы, салициловая кисло-та, надфн-оксидаза, каталаза, супероксид-дисмутаза, пероксидаза
Короткий адрес: https://sciup.org/14084845
IDR: 14084845 | УДК: 577.334
Текст научной статьи Активность ферментов метаболизма активных форм кислорода и уровень световой эмиссии мицелия гриба Neonothopanus nambi при действии салициловой кислоты
Введение. Исследования светящихся высших грибов Neonothopanus nambi и Armillaria borealis позволили нам развить идею об участии активных форм кислорода (АФК) в механизме грибной люминесценции [1–7]. В этих работах было показано, что световая эмиссия грибного мицелия значительно возрастает при инкубации в деионизованной воде, механическом повреждении, радиационном облучении. Было установлено, что воздействие стрессовых факторов на гриб сопровождается не только увеличением интенсивности его люминесценции, но и активацией образования АФК и повышением общей пероксидазной и каталазной активностей [5, 7– 9]. Совокупность полученных данных позволила высказать гипотезу, что свечение грибов явля- ется дополнительным механизмом антиоксидантной защиты, нейтрализующим повреждающее действие АФК [5, 7–9].
Известно, что активация образования АФК является универсальной неспецифической ре-а к ц ией клетки на воздействие стрессовых факторов разной природы (физические, химические, биологические): температура, влажность, экотоксиканты, фитопатогены [10]. При этом известно, что незначительное повышение уровня АФК (как сигнальных молекул) индуцирует в клетке ряд молекулярных, биохимических и физиологических реакций, способствующих формированию адаптивных механизмов и повышению устойчивости организма [11–15]. В то же время слишком высокий уровень АФК может инициировать разветвленные цепи окислительных реакций, приводящих к повреждениям макромолекул (белки, ДНК), клеточных структур и в конечном итоге – к гибели клетки [15, 16]. Ключевая роль в регуляции стационарного уровня АФК в клетке принадлежит сбалансированному функционированию систем про- и антиоксидантной защиты. При этом антиоксидантная система включает ферменты и низкомолекулярные компоненты, которые нейтрализуют избыток АФК и обеспечивают защиту биологических структур клетки, замедляя (или предотвращая) окисление внутриклеточных органических соединений и участвуя в детоксикации вторичных метаболитов [15, 17].
Индукторами образования АФК в клетке являются многие соединения, которые активируют ее сигнальную систему и защитные реакции. В частности, салициловая кислота (СК) в настоящее время рассматривается как эндогенный, полифункциональный биорегулятор фенольной природы, принимающий участие в клеточном сигналинге, ростовых процессах и формировании адаптивных реакций растений [18, 19]. Известно, что СК сочетает в себе свойства сигнального посредника и антистрессового фитогормона [20–22]. Как полагают, важной функцией эндогенной СК является модификация эффектов АФК, что связано с ее разнонаправленным влиянием на ключевые про- и антиоксидантные ферменты.
Участие СК в реализации ответных реакций растений на действие абиотических стрессоров изучено в значительно меньшей степени, чем ответные реакции на инфицирование патогенами [23–25]. Тем не менее действие СК на устойчивость растений обычно связывают с инактивацией каталазы и соответствующим увеличением количества пероксида водорода [26]. В то же время показано, что формирование АФК-опосредованного сигнала у растений под действием СК сопровождается активацией ферментов, участвующих в метаболизме активных радикалов кислорода: НАДФН-оксидазы, суперок-сиддисмутазы и пероксидазы [16, 18, 27, 28].
Цель работы . Оценить уровень световой эмиссии мицелия гриба Neonothopanus nambi и активность ферментов, участвующих в метаболизме АФК (НАДФН-оксидаза, каталаза, супер-оксиддисмутаза, пероксидаза), без и при воздействии экзогенной салициловой кислоты в условиях стресса.
Материалы и методы. Исследования выполнены с образцами мицелия гриба N. nambi , выращенными на жидкой питательной карто-фельно-сахарозной среде по технологии, разработанной нами ранее [1]. Для исследований из полученного пленочного мицелия высекали диски диаметром 12 мм [8]. Диски помещали в свежую питательную картофельно-сахарозную среду, в которую добавляли СК до финальной концентрации в диапазоне 0,1–5,0 мМ. Исходный раствор СК был предварительно нейтрализован до нейтральных значений рН. Контрольными являлись диски мицелия, которые инкубировали в питательной среде без добавления СК. Через равные промежутки времени (через каждый час) измеряли уровень световой эмиссии образцов мицелия с помощью люминометра Glomax 20/20 (Promega, USA), калиброванного по радиоактивному стандарту Гастингса-Вебера (одна люминесцентная единица (LU) составляет 2.7 · 103 квантов в 1 секунду). Активность ферментов определяли в экстрактах из биомассы мицелия. Активность СОД определяли методом [29]. Для определения активности каталазы использовали метод [30]. Активность НАДФН-оксидазы определяли по методу [31]. Активность пероксидазы оценивали по интенсивности окисления о-фенилендиамина в присутствии
Н 2 О 2 [32]. Спектральные исследования образцов при определении активности ферментов проводили с помощью спектрофотометра UV-1800 (Shimadzu, Japan).
Результаты и их обсуждение. Как показали эксперименты (рис. 1), у контрольных образцов мицелия, помещенных в питательную среду, наблюдается значительное (на 2 порядка и более) увеличение уровня световой эмиссии – от 6,6 · 106 LU до 1,1 · 109 LU. Свечение мицелия достигает максимальных значений через 3 часа инкубации, после чего наблюдается его медленное снижение. Эти данные согласуются с результатами наших предыдущих исследований, в которых было установлено, что механическое повреждение мицелия N. nambi сопровождается увеличением его люминесценции [1, 6, 8]. В то же время из представленных данных следует, что наличие СК в инкубационной среде заметным образом подавляет свечение поврежденного мицелия. Этот эффект является дозозависимым – повышение концентрации СК приводит к большему снижению уровня световой эмиссии (рис. 1). Видно, что ингибирование люминесценции наблюдается практически сразу после помещения образцов мицелия в питательную среду, содержащую СК. При этом было установлено, что зависимость снижения свечения мицелия N. nambi от концентрации СК имеет экспоненциальный вид (рис. 2).
Исследования показали (рис. 3), что у контрольных образцов мицелия, вне зависимости от интенсивности их свечения при инкубации, уровень активности НАДФН-оксидазы практически не меняется в ходе всего эксперимента. Однако было показано, что в присутствии экзогенной СК активность фермента увеличивается и этот эффект возрастает с увеличением концентрации кислоты (рис. 3). Видно, что повышение активности фермента становится заметным уже при 0,1 мМ концентрации СК в среде инкубации. Наблюдаемая активация НАДФН-оксидазы в мицелии N. nambi может свидетельствовать, что в присутствии СК в поврежденном грибе происходит более интенсивная генерация супероксид анион радикала (О 2 -).
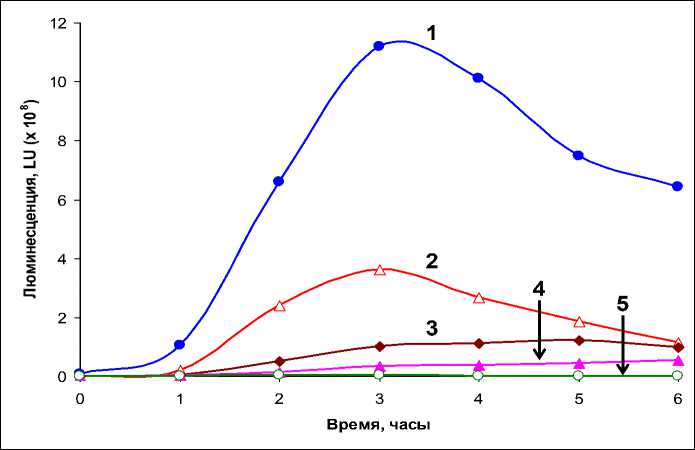
Рис. 1. Эффект салициловой кислоты (СК) на люминесценцию образцов мицелия N. nambi в зависимости от времени инкубации: 1 – контроль (без добавления СК); 2–5 – концентрация СК в инкубационной среде 0,1; 0,5; 1; 2; 5 и 5 мМ соответственно
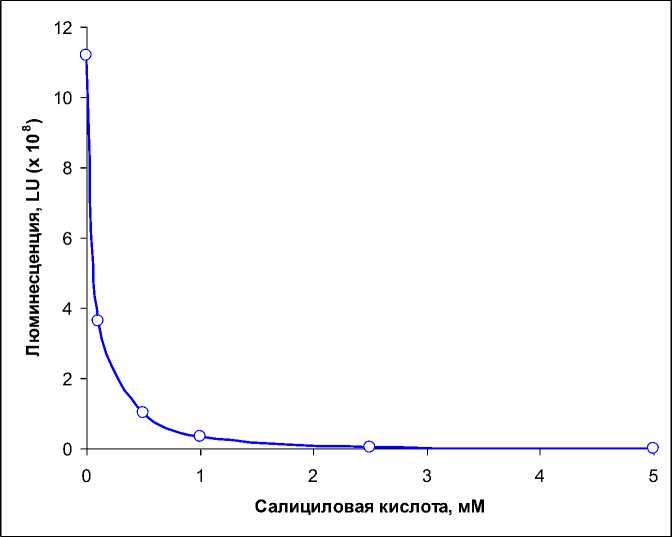
Рис. 2. Максимум интенсивности световой эмиссии мицелия N. nambi в зависимости от концентрации салициловой кислоты
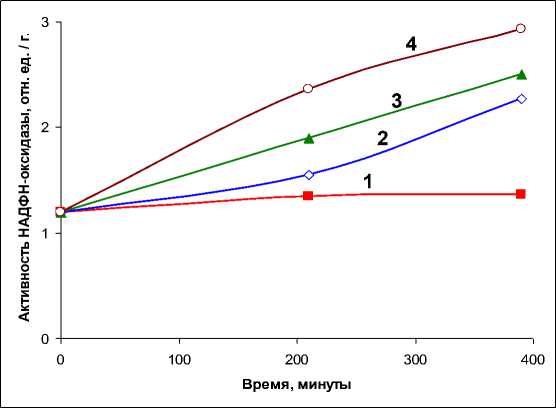
Рис. 3. Активность НАДФН-оксидазы в образцах мицелия N. nambi в зависимости от времени инкубации без (1) и при добавках (2–4) СК в инкубационную среду до концентрации 0,1, 0,5 и 1 мМ соответственно. Активность фермента представлена в относительных единицах на 1 грамм сырой биомассы мицелия
Активность СОД (рис. 4) в контрольных образцах мицелия снижается через 3 часа инкубации в 1,5 раза по сравнению с исходным уровнем и остается практически неизменной в течение последующих 3–4 часов. Из представленных данных видно, что наличие в инкубационной среде экзогенной СК в концентрации 0,1 мМ незначительно повышает уровень активности СОД. Однако при увеличении концентрации СК на порядок (1 мМ) активность СОД существенно возрастает через 3 часа инкубации мицелия (рис. 4). После этого активность СОД снижается до значений, соответствующих величине активности фермента в контрольном мицелии. Исходя из этого, можно предполагать, что в условиях острого эксперимента (травма) в короткие периоды времени (1–3 часа инкубации) под действием экзогенной СК происходит активация СОД. В свою очередь, это может свидетельствовать об активации образования пероксида водорода в грибе в этот период.
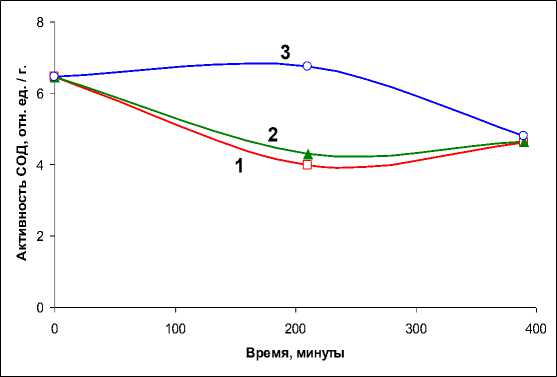
Рис. 4. Активность СОД в образцах мицелия N. nambi в зависимости от времени инкубации без (1) и при добавках (2, 3) СК в инкубационную среду до концентрации 0,1 и 1мМ соответственно. Активность фермента представлена в относительных единицах на 1 грамм сырой биомассы мицелия
В экспериментах были выявлены аналогичные изменения в общей пероксидазной активности (рис. 5). Из полученных данных следует, что в контрольных образцах мицелия уровень пероксидазной активности снижается практически в 2 раза через 3 часа инкубации, и эта тенденция сохраняется в последующие 3–4 инкубации. Однако в присутствии экзогенной СК уровень пероксидазной активности возрастает в 1,5–2 раза (рис. 5), что указывает на активацию данных ферментов в мицелии. Вероятно, наблюдаемое повышение общей пероксидазной активности может быть вызвано активацией образования в грибе пероксида водорода (см. предыдущий раздел) и, как следствие, необходимостью нейтрализации этой АФК. В условиях острого опыта этот эффект должен проявляться на ранних временных стадиях, что и наблюдалось экспериментально.
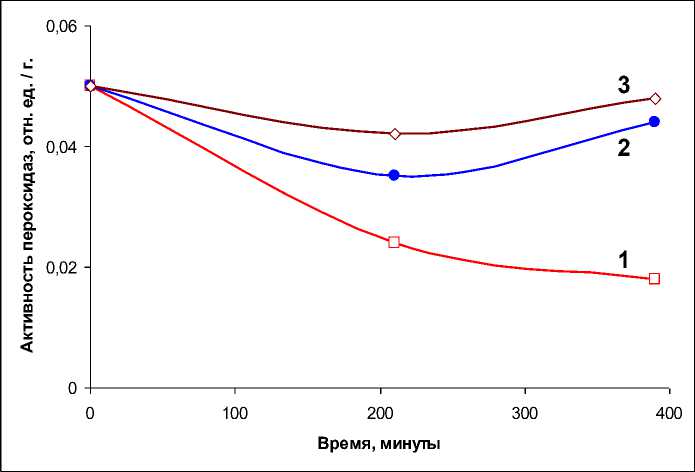
Рис. 5. Общая пероксидазная активность в образцах мицелия N. nambi в зависимости от времени инкубации без (1) и при добавках (2–4) СК в инкубационную среду до концентрации 0,5 и 1 мМ, соответственно. Пероксидазная активность представлена в относительных единицах на 1 грамм сырой биомассы мицелия.
Показано, что активность каталазы (рис. 6) в контрольных образцах механически поврежденного мицелия незначительно повышается через 1,5 часа инкубации. Затем активность фермента снижается и в последующие 3–4 часа инкубации практически не изменяется, хотя и отмечается некоторая тенденция к повышению уровня каталазной активности. Из представленных данных видно, что добавка СК в среду инкубации приводит к снижению активности фермента. По крайней мере, через 1,5 часа инкубации мицелия в присутствии СК наблюдается незначительное понижение уровня каталазной активности. Видно (рис. 6), что эффект является дозозависимым – при большей концентрации СК регистрируется меньшая активность фермента. В течение последующего периода инкубации активность фермента в контрольных и опытных образцах мицелия практически не различается.
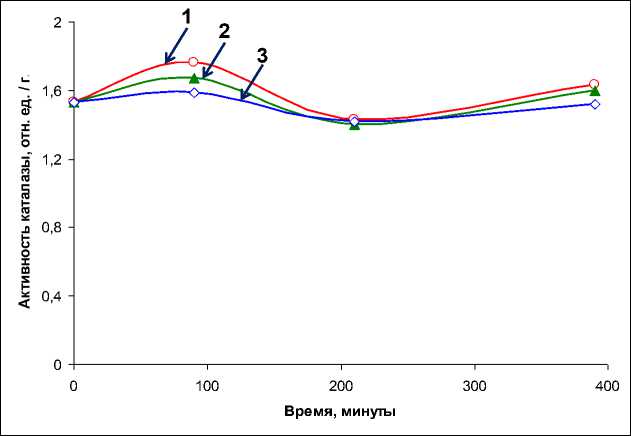
Рис. 6. Активность каталазы в образцах мицелия N. nambi в зависимости от времени инкубации без (1) и при добавках (2–3) СК в инкубационную среду до концентрации 0,5 и 5 мМ соответственно. Активность фермента представлена в относительных единицах на 1 грамм сырой биомассы мицелия
В завершение работы следует отметить, что во всех исследованных случаях при инкубации образцов мицелия в присутствии СК наблюдалось желто-коричневое окрашивание питательной среды, интенсивность которого возрастала в зависимости от времени инкубации и концентрации СК.
Заключение. Совокупность представленных в работе данных позволяет высказать несколько общих суждений и выводов. Показано, что в условиях острого эксперимента, после механического повреждения мицелия N. nambi и последующей его инкубации в питательной среде в течение короткого (6–7 часов) интервала времени, наблюдается значительное (на 2 порядка и более) увеличение уровня световой эмиссии гриба. Повышение интенсивности свечения регистрируется на фоне существенного снижения в мицелии активности СОД и общей пероксидазной активности. При этом уровень активности НАДФН-оксидазы в грибе практически не меняется в течение всего эксперимента, а активность каталазы незначительно возрастает. Установлено, что добавка экзогенной СК в среду инкубации заметным образом подавляет световую эмиссию мицелия N. nambi. При этом выявлено, что экзогенная СК активирует все изучаемые ферменты метаболизма АФК, за ис- ключением каталазы, активность которой несущественно снижается. Установлено, что эффекты СК являются дозозависимыми и нарастают с увеличением концентрации реагента. В целом представленные в работе данные согласуются с результатами других авторов, которые показали в исследованиях на растениях изменение активности ферментов метаболизма АФК под действием СК. В то же время полученные данные согласуются с высказанной нами ранее гипотезой, что грибное свечение является дополнительным механизмом антиоксидантной защиты от повреждающего действия АФК. Наблюдаемое в экспериментах значительное увеличение световой эмиссии мицелия при снижении активности СОД, и особенно общей пероксидазной активности, может свидетельствовать о запуске в грибе этого механизма защиты от АФК (прежде всего от избытка Н2О2 и иных перок-сидных соединений), которые могут нейтрализоваться в реакции свечения. В присутствии экзогенной СК ферменты метаболизма АФК активируются, следовательно, лидирующая роль в нейтрализации АФК осуществляется уже классической системой антиоксидантной защиты. Защитная функция системы излучения становится второстепенной, и свечение гриба снижается. Иным объяснением снижения свечения мицелия под действием СК может быть следующее. Общеизвестно, что СК является фенольным соединением и это позволяет рассматривать ее как субстрат для пероксидазных ферментов. Исходя из этого, экзогенная СК может осуществлять не только свою регуляторную функцию, активируя в мицелии ферменты метаболизма АФК, но и участвовать в нейтрализации активных радикалов кислорода (прежде всего, пероксида водорода) как субстрат в ферментативных реакциях с участием грибных пероксидаз (например, экстраклеточных). Известно, что защитное действие пероксидаз в значительной степени определяется их способностью окислять соединения фенольной природы до хинонов [33], которые являются хромогенами и составляют структурную основу пигментов. Вероятно, наблюдаемое нами в экспериментах окрашивание питательной среды при инкубации поврежденного мицелия в присутствии СК могло являться следствием окисления салициловой кислоты грибными пероксидазами.
Список литературы Активность ферментов метаболизма активных форм кислорода и уровень световой эмиссии мицелия гриба Neonothopanus nambi при действии салициловой кислоты
- Бондарь В.С., Пузырь А.П., Пуртов К.В. . О люминесцентной системе светя-щегося гриба Neonothopanus nambi//ДАН. -2011. -Т. 438. -№ 5. -С. 705-707.
- Bondar V.S., Shimomura O., Gitelson J.I. Lu-minescence of higher mushrooms//J. Sib. Fed. Univ. Biol. -2012. -V. 5. -№. 4. -P. 331-351.
- Бондарь В.С., Родичева Э.К., Медведева С.Е. . О механизме свечения гриба Neonothopanus nambi//ДАН. -2013. -Т. 449. -№ 2. -С. 223-227.
- Бондарь В.С., Пузырь А.П., Пуртов К.В. . Выделение люминесцентной систе-мы из светящегося гриба Neonothopanus nambi//ДАН. -2014. -Т. 455. -№ 3. -С. 346-348.
- Могильная О.А., Ронжин Н.О., Медведева С.Е. . Общая пероксидазная и ката-лазная активности светящихся базидиоми-цетов Armillaria borealis и Neonothopanus nambi в сравнении с уровнем световой эмиссии//Прикладная биохимия и микро-биология. -2015. -Т. 51. -№ 4. -С. 395-401.
- Medvedeva S.E., Artemenko K.S., Krivosheenko A.A. . Growth and light emission of luminous basidiomycetes cultivat-ed on solid media and in submerged culture//Mycosphere. -2014. -V. 5. -P. 565-577.
- Kobzeva T.V., Melnikov A.R., Karogodina T.Y. . Stimulation of Luminescence of myceli-um of luminous fungus Neonothopanus nambi by ionizing radiation//Luminescence. -2014. -V. 29. -P. 703-710.
- Тюлькова Н.А., Медведева С.Е., Бондарь В.С. Сравнительная оценка интенсивностей перекисного окисления липидов и свечения гриба Neonothopanus nambi//Вестник КрасГАУ. -2016. -№ 1. -С. 21-28.
- Mogilnaya O.A., Ronzhin N.O., Bondar V.S. Comparative evaluation of total peroxidase and catalase activities during light emission of luminous fungus Neonothopanus nambi//Mycosphere. -2016. -V. 7. -P. 499-510.
- Desican R., Mackerness S.A., Hancock J.T. . Regulation of the Arabidopsis transcriptome by oxidative stress//Plant Physiol. -2001. -V. 127. -P. 159-172.
- Тарчевский И.А. Сигнальные системы кле-ток растений. -М.: Наука, 2002. -294 с.
- Гесслер Н.Н., Аверянов А.А., Белозерская Т.А. Активные формы кислорода в регуля-ции развития грибов//Биохимия. -2007. -Т. 72. -№ 10. -С. 1091-1109.
- Vranova E., Inze D., Van Breuegegem F. Sig-nal transduction during oxidative stress//J. Exp. Bot. -2002. -V. 53. -P. 1227-1236.
- Jaspers P., Kangasjarvi J. Reactive oxygen species in abiotic stress signaling//Physiol. Plant. -2010. -V. 138. -P. 405-413.
- Колупаев Ю.Е., Карпец Ю.В. Активные формы кислорода при адаптации растений к стрессовым температурам//Физиология и биохимия культурных растений. -2009. -Т. 41. -№ 2. -С. 95-108.
- Карпун Н.Н., Янушевская Э.Б., Михайлова Е.В. Механизмы формирования неспеци-фического индуцированного иммунитета у растений при биогенном стрессе//Сель-скохозяйственная биология. -2015. -Т. 50. -№ 5. -С. 540-549.
- Apel K., Hirt H. Reactive oxygen species: me-tabolism, oxidative stress, and signal transduction//Annu. Rev. Plant Biol. -2004. -V. 55. -P. 373-399.
- Колупаев Ю.Е., Ястреб Т.О. Стресс-протекторные эффекты салициловой ки-слоты и ее структурных аналогов//Физио-логия и биохимия культурных растений. -2013. -Т. 45. -№ 2. -С. 113-126.
- Белых Ю.В., Кириллова Н.В., Спасенков А.И. Влияние салициловой кислоты на ан-тиоксидантную и прооксидантную активно-сти в растительных клетках//Вестник Санкт-Петербургского университета. -2009. -Вып. 2. -С. 145-151.
- Молодченкова О.О. Влияние салициловой кислоты на ответные реакции проростков кукурузы при абиотических стрессах//Вiсник Харкiвського нацiонального аграрно-го унiверситету. -2008. -Вип. 3(15). -С. 24-32.
- Абилова Г.А. Участие салициловой кислоты в системе антиоксидантной защиты у три-тикале при действии ZnSO4//Вестник Да-гестанского государственного университе-та. -2013. -Вып. 1. -С. 124-127.
- Фенько А.А., Репкина Н.С., Таланова В.В. Влияние салициловой кислоты на холодо-устойчивость проростков огурца//Тр. Ка-рельского научного центра РАН. -2015. -№ 11. -С. 26-34.
- Fujita M., Fujita Y., Noutoshi Y. . Cross-talk between abiotic and biotic stress respons-es: a current view from the points of conver-gence in the stress signalling networks//Curr. Opin. Plant Biol. -2006. -№ 9. -P. 436-442.
- Kaur N., Gupta A.K. Signal transduction path-ways under abiotic stresses in plant//Curr. Sci. -2005. -V. 88. -№ 11. -P. 1771-1780.
- Lushchak V.I. Adaptive response to oxidative stress: Bacteria, fungi, plants and animals//Comp. Biochem. Physiol. Part C. -2011. -V. 153. -P. 175-190.
- Chen Z., Silva H., Klessig D.F. Active oxygen species in the induction of plant systemic ac-quired resistance by salicylic acid//Science. -1993. -V. 262. -№ 5141. -P. 1883-1886.
- Barna B., Adam A.L., Gulner G. . Role of antioxidant systems and juvenility in tolerance of plants to diseases and abiotic stresses//Acta Phytopathol. Entomol. Hung. -1995. -V. 30. -P. 39-45.
- Rao M.V., Paliyaht G., Ormrod D.P. . Influence of salicylic acid on H2O2 production, oxidative stress, and H2O2-metabolizing en-zymes (salicylic acid-mediated oxidative dam-age requires H2O2)//Plant Physiol. -1997. -V. 115. -P. 137-149.
- Полесская О.Г., Каширина Е.И., Алехина Н.Д. Изменение активности антиоксидант-ных ферментов в листьях и корнях пшени-цы в зависимости от формы и дозы азота в среде//Физиология растений. -2004. -Т. 51. -С. 686-691.
- Aeby H. Catalase in vitro//Methods Enzymol. -1984. -V. 105. -P. 121-126.
- Вольский H.H., Козлов В.А., Лозовой В.П. Влияние гидрокортизона на продукцию су-пероксидного радикала фагоцитирующими клетками селезенки//Бюл. эксперимен-тальной биологии и медицины. -1987. -Т. 103. -№ 6. -С. 694-696.
- Wi S.J., Ji N.R., Park K.Y. Synergistic biosyn-thesis of biphasic ethylene and reactive oxy-gen species in response to hemibiotrophic phytophthora parasitica in tobacco plants//Physiol. Plant. -2012. -V. 159. -№ 1. -P. 251-265.
- Okey E.N., Duncan E.J., Sirju-Charran G. Phy-tophthora canker resistance in cacao: Role of peroxidase, polyphenoloxidase and phenylal-anine ammonialyase//J. Phytopathol. -1997. -V. 145. -№ 7. -P. 295-299.


