Активность ферментов поджелудочной железы у цыплят-бройлеров на разных этапах пищеварения
Автор: Вертипрахов В.Г., Грозина А.А., Долгорукова А.М.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Продуктивные животные: физиология пищеварения
Статья в выпуске: 4 т.51, 2016 года.
Бесплатный доступ
Поджелудочная железа - один из центральных органов пищеварительной системы. Клетки пищеварительных желез продуцируют гидролитические ферменты по общим законам синтеза белка, механизмы этого процесса детально изучены (R.M. Case, 1998). Однако существует срочный транспорт ферментов специализированными секреторными клетками (гландулоцитами), который представляет собой процесс их рекреции - поглощения эндогенных секреторных продуктов гландулоцитами из крови и последующего их выделения в неизменном виде в составе пищеварительных соков. То есть экзосекреты пищеварительных желез содержат два пула ферментов - синтезированных de novo и рекретированных. В классической физиологии секреции акцентируется внимание на первом пуле и, как правило, не принимается во внимание второй (Г.Ф. Коротько, 2013). Установлено, что поджелудочная железа при известных условиях не может синтезировать больше 25-50 % от общего количества панкреатических ферментов (S.S. Rotman с соавт., 2002). Поступление пищеварительных ферментов в кровь взаимосвязано с механизмом регуляции секреции поджелудочной железы. В последние годы возрастает интерес к изучению вопросов, связанных с циркуляцией панкреатических ферментов в организме человека и животных, поскольку они участвуют не только в пищеварении, но и обеспечивают регуляторные функции (R. Ramachandran с соавт., 2008; Г.Ф. Коротько, 2011; Р. Гружаускас с соавт., 2015). В настоящей работе представлены экспериментальные данные по определению активности панкреатических ферментов в соке поджелудочной железы, химусе 12-перстной кишки, плазме крови и помете у цыплят-бройлеров кросса Cobb 500. Физиологические опыты выполняли на двух группах цыплят по 3 гол. в каждой. Цыплятам в одной группе для получения химуса 12-перстной кишки вживляли фистулу напротив места впадения в 12-перстную кишку протоков поджелудочной железы и желчи. Первую порцию химуса собирали натощак, затем цыплят кормили (30 г комбикорма) и следующий сбор осуществляли через 1 и 2 ч. В другой группе изучали внешнесекреторную функцию поджелудочной железы на цыплятах-бройлерах (возраст 30 сут и старше) с хронической фистулой панкреатического протока, оперированных по методу Ц.Ж. Батоева и С.Ц. Батоевой (1970). Эта методика не имеет аналогов в мире и позволяет получать панкреатический сок во время опытов, а в остальной период направлять его в кишечник. В первые 30 мин опыта определяли количество панкреатического сока и его ферментативную активность натощак, затем давали 30 г корма. Далее панкреатический сок собирали каждые 30 мин, измеряли его количество и оценивали ферментативную активность. Также определяли активность панкреатических ферментов в плазме крови и в помете. Согласно полученным данным, наибольшее количество ферментов, участвовавших в кишечном пищеварении, производила поджелудочная железа: активность амилазы составила 4677±832,3 мг/(мл х мин), протеаз - 215±37,9 мг/(мл х мин), липазы - 3200±201,9 Е/л. С экскрементами выделялось относительно малое количество активных панкреатических ферментов. В кровь панкреатические ферменты поступали неравномерно: относительно химуса 12-перстной кишки наименьшая активность отмечалась в крови у липазы, средняя - у амилазы, достаточно высокая - у протеаз. Результаты физиологического опыта показали, что период сложнорефлекторной фазы регуляции панкреатической секреции у цыплят-бройлеров длился 120 минут с момента кормления, а затем по мере поступления кормовых масс из желудка начиналась нейрогуморальная фаза регуляции, обусловленная выделением в кровь гормонов секретина и панкреозимина. Динамика активности ферментов в кишечнике была аналогична динамике их активности в панкреатическом соке, хотя колебания дуоденальной активности амилазы, липазы и протеаз оказались выражены не так значительно. Установлено наиболее близкое амилазно-протеазное соотношение ферментов в панкреатическом соке и плазме крови, что может быть использовано при диагностике состояния поджелудочной железы.
Ферменты поджелудочной железы, панкреатический сок, ферменты кишечника, панкреатические ферменты в плазме крови, цыплята-бройлеры
Короткий адрес: https://sciup.org/142213958
IDR: 142213958 | УДК: 636.52/.58:591.132.5:591.133.2 | DOI: 10.15389/agrobiology.2016.4.509rus
Текст научной статьи Активность ферментов поджелудочной железы у цыплят-бройлеров на разных этапах пищеварения
Поджелудочная железа — один из центральных органов пищеварительной системы, который вырабатывает ферменты, гидролизующие все основные питательные вещества до мономеров, способных всасываться в кровь и лимфу. Клетки пищеварительных желез продуцируют гидролитические ферменты по общим законам синтеза белка. В настоящее время механизмы этого процесса детально изучены (1). Однако существует сроч-509
ный транспорт ферментов специализированными секреторными клетками (гландулоцитами), который представляет собой процесс их рекреции, то есть поглощения эндогенных секреторных продуктов гландулоцитами из крови и последующего выделения в неизменном виде в составе пищеварительных соков. Следовательно, экзосекреты пищеварительных желез содержат два пула ферментов — синтезированные de novo и рекретированные. В классической физиологии секреции акцентируется внимание на первом пуле и, как правило, не принимается во внимание второй (2-4). По итогам анализа энтеропанкреатической циркуляции панкреатических ферментов S.S. Rothman и соавт. (5) сделали вывод, что поджелудочная железа при известных условиях не может синтезировать больше 25-50 % от общего количества панкреатических ферментов.
Поступление пищеварительных ферментов в кровь взаимосвязано с механизмом регуляции секреции поджелудочной железы: во-первых, так поддерживается ферментный гомеостаз, во-вторых, возникает возможность рекреции ферментов из крови в качестве исходного материала для ацинарного аппарата поджелудочной железы (2). В этой связи в последние годы возрастает интерес к изучению вопросов, связанных с циркуляцией панкреатических ферментов в организме человека и животных, поскольку эти энзимы не только участвуют в пищеварении, но и обеспечивают регуляторные функции в организме (6-9). Кроме того, исследование циркуляции панкреатических ферментов в организме животных имеет важное значение для понимания дефицита ферментов в процессе пищеварения и их использования как биохимических маркеров при оценке состояния поджелудочной железы.
В научной литературе имеются данные по усвояемости аминокислот у птицы (10), морфометрическим (11) и цитологическим (12) показателям экзокринного отдела поджелудочной железы, активности ферментов в тканях поджелудочной железы (3, 13, 14). Однако панкреатические ферменты при этом изучались в опытах in vitro. Исследования пищеварения у кур в хроническом эксперименте с использованием фистульной методики за рубежом малочисленны (15, 16).
В настоящей работе мы впервые сопоставили активность панкреатических ферментов в соке поджелудочной железы, химусе 12-перстной кишки in vivo, а также в плазме крови и помете у современного кросса сельскохозяйственной птицы. Продолжая традицию русской физиологической школы академика И.П. Павлова, при изучении пищеварения использовали фистульный метод, который позволяет проанализировать регуляцию деятельности органа, не нарушая естественные физиологические и биохимические процессы, и выявлять механизм влияния различных факторов (добавок, кормов и т.д.) на уровне целостного организма. На наш взгляд, такой подход имеет наибольшее научное и практическое значение.
Цель работы — определение активности панкреатических ферментов в разных биологических средах у фистулированных цыплят-бройлеров.
Методика . Исследования проводили на мясных цыплятах кросса Cobb 500 в условиях вивария (Всероссийский научно-исследовательский и технологический институт птицеводства — ВНИТИП). Условия содержания и кормления бройлеров соответствовали нормам ВНИТИП. Физиологические опыты выполняли на двух группах цыплят (по 3 гол. в каждой).
В одной группе оперировали цыплят старше 20-суточного возраста для получения химуса 12-перстной кишки. При этом фистулу вживляли в 12-перстную кишку напротив места впадения в нее протоков поджелудочной железы и желчи. К исследованиям приступали через 3-5 сут, когда со-510
стояние здоровья цыплят восстанавливалось. Цыплят фиксировали в специальном станке. Первую порцию химуса собирали натощак, затем цыплята получали 30 г комбикорма, и следующий сбор осуществляли через 1 и 2 ч после кормления. Каждую порцию химуса (3-5 мл) центрифугировали, разводили раствором Рингера (1:50) и использовали для определения активности ферментов.
В другой группе изучали внешнесекреторную функцию поджелудочной железы на цыплятах-бройлерах (возраст 30 сут и старше) с хронической фистулой панкреатического протока, прооперированных по методу Ц.Ж. Батоева и С.Ц. Батоевой (17). Физиологический эксперимент продолжался 180 мин. В первые 30 мин опыта определяли количество панкреатического сока и его ферментативную активность натощак, затем давали 30 г корма. Далее панкреатический сок собирали каждые 30 мин, измеряли его количество и оценивали ферментативную активность.
Активность амилазы определяли по Смиту-Рою-Уголеву (18), протеаз — по гидролизу казеина при колориметрическом контроле (19), активность липазы — на биохимическом анализаторе Chem well 2900 (T) («Awareness Technology, Inc.», США) с использованием набора реагентов Human («HYMAH», Германия).
Кровь получали из подкрыльцовой вены после окончания физиологических опытов, добавляли гепарин, подвергали центрифугированию в течение 5 мин при 5000 об/мин и определяли активность панкреатических ферментов в плазме.
Активность ферментов в помете оценивали теми же методами в материале от цыплят, полученном после окончания физиологического опыта.
На каждом цыпленке было выполнено не менее 10 опытов.
Статистическую обработку результатов проводили общепринятыми методами с использованием t- критерия Стьюдента.
Результаты. Согласно полученным данным, наибольшее количество ферментов, участвовавших в кишечном пищеварении, производила поджелудочная железа (табл.).
Активность панкреатических ферментов в процессе пищеварения у цыплят-бройлеров кросса Cobb 500 ( M±m , физиологический опыт)
|
Показатель |
: А |
i Б i |
В |
i Г i |
А:Б:В:Г |
|
Амилаза, мг/(мл•мин) |
4677±832,3 |
1073±229,2 |
8±0,7 |
16±6,8 |
585:134:1:2 |
|
Липаза, E/л |
3200±201,9 |
3950±359,7 |
12±3,9 |
50±12,5 |
267:329:1:4 |
|
Протеазы, мг/(мл•мин) |
215±37,9 |
40±7,3 |
0,4±0,10 |
4±0,6 |
537:100:1:10 |
|
Амилаза/протеазы |
22:1 |
27:1 |
20:1 |
4:1 |
П р и м е ч а н и е. А — панкреатический сок, Б — химус 12-персной кишки, В — плазма крови, Г — по- мет. При вычислении соотношения активности в разных средах за 1 принимали показатель в сыворотке крови, при сравнении амилолитической и протеолитической активности — показатель по протеазам.
С экскрементами из организма выделялось относительно малое количество активных панкреатических ферментов. Так, в помете активность амилазы уменьшалась в 67 раз, липазы — в 79 раз, протеаз — в 10 раз по сравнению с 12-перстной кишкой. Эти данные подтверждают рекрецию ферментов, один из способов которой — возврат панкреатических энзимов через кишечник в кровь. Процесс аналогичен реабсорбции в почках, когда из первичной мочи необходимые организму питательные и минеральные вещества возвращаются в кровь. Однако панкреатические ферменты поступали в кровь неравномерно: относительно химуса 12-перстной кишки наименьшая активность отмечалась в крови у липазы, средняя — у амилазы, относительно высокая — у протеаз. По-видимому, это было связано со строением молекул ферментов (20-22). Об относительно большем выделении протеаз с пометом свидетельствовало и самое низкое амилазно-протеазное соотношение в помете (см. табл.).
Обсуждая полученные результаты, следует иметь в виду, что использованная нами методика наложения фистулы панкреатического протока не имеет аналогов в мире и позволяет получать панкреатический сок только в период физиологических опытов, а в остальное время направлять его по внешнему анастомозу в кишечник, что минимизирует последствия фистулирования и дает возможность изучать внешнесекреторную функцию поджелудочной железы продолжительное время на здоровой птице.
По сообщениям S.S. Rothman и соавт. (5), из тонкой кишки человека активно всасывается 50-65 % и более меченых и немеченых амилазы и химотрипсина, по данным H.C. Heinrich и соавт. (23) — 50-70 % трипсина. Согласно наблюдениям А.А. Алиева (24), из тонкой кишки в оттекающую от нее лимфу всасываются липаза, амилаза и мальтаза.
Что касается панкреатических ферментов в плазме крови, то ами- лаза и липаза находились в активном состоянии, а протеазы связывались с ингибиторами трипсина и не проявляли ферментативной активности (2, 20-22). Соотношение амилазы и протеаз в панкреатическом соке и плазме крови имели близкие значения, что можно использовать при диагностике состояния поджелудочной железы.
Существенные различия наблюдались в активности ферментов в панкреатическом соке и химусе 12-персной кишки. При выделении пан- креатического сока в кишку активность амилазы и протеаз снижалась примерно в 5 раз (см. табл.). Однако активность липазы в кишечнике была на уровне активности фермента в секрете поджелудочной железы (Р > 0,05). Это можно объяснить стимулирующим влиянием желчи, которая выделялась в кишечник одновременно с панкреатическим соком. Амилазно-протеазное соотношение увеличивалось в химусе кишечника по сравнению с панкреатическим соком, что могло быть связано с наличием дополнительных амилолитических ферментов слюны и кишечного сока.
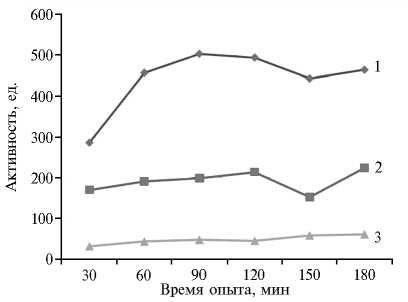
Рис. 1. Активность ферментов в панкреатическом соке после приема корма у цыплят кросса Cobb 500: 1 — амилаза, х 10 мг/(мл • мин); 2 — протеазы, мг/(мл • мин); 3 — липаза, х 50 Е/л (физиологический опыт).
Через 1 ч после приема корма активность амилазы панкреатического сока увеличивалась почти в 2 раза и сохранялась такой до конца опыта (рис. 1). Активность протеаз достигала максимальных значений через 1,5 ч после приема корма, увеличиваясь в 1,3 раза, затем этот показатель несколько снижался и вновь увеличивался до максимума в период, соответствующий нейрохимической фазе регуляции панкреатической секреции. Активность липазы увеличивалась постепенно, достигая максимальной отметки к концу опыта, когда она в 2,0 раза пре- вышала исходные значения (до кормления).
После приема корма кривые ферментативной активности резко устремлялись вверх (см. рис. 1). Такая реакция обусловлена сложнорефлекторной регуляцией панкреатической секреции. В этом случае на внешнесекреторную функцию железы оказывали влияние как условные сигналы (постановка в станок для опыта и т.д.), так и безусловные рефлексы (2528). Рефлекторная дуга последних начиналась с рецепторов в ротовой по-
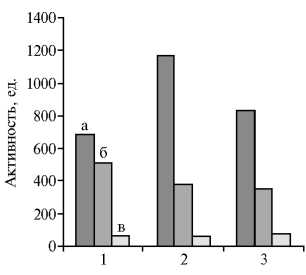
Рис. 2. Ферментативная активность химуса 12-перстной кишки у цыплят кросса Cobb 500 до кормления (1) , через 1 ч (2) и 2 ч после кормления (3) : а — амилаза, мг/(мл•мин); б — протеазы, х 0,1 мг/(мл^мин); в — липаза, х 50 Е/л (физиологический опыт).
Динамика ферментативной активности химуса и секрета поджелудочной железы несколько различалась (рис. 2). Наиболее интенсивно (в 1,7 раза) после приема корма увеличивалась амилолитическая активность. Активность липазы повышалась с 3450±370,2 до 4050±420,5 Е/л через 2 ч после приема корма. Протеолитическая активность химуса существенно не изменялась — с 51±17,9 до 35±10,2 мг/(мл•мин) к концу опыта.
Таким образом, у цыплят-бройлеров панкреатические ферменты из поджелудочной железы направляются в 12-перстную кишку, участвуя в гидролизе питательных веществ корма, а затем поступают в кровь. Незначительная часть активных ферментов удаляется из организма с пометом. Кормление служит мощным стимулом панкреатической секреции. Период сложнорефлекторной фазы регуляции поджелудочной железы у цыплят-бройлеров длится 120 мин с момента кормления. Динамика активности ферментов после приема корма в кишечнике аналогична динамике их активности в панкреатическом соке, хотя колебания дуоденальной активности амилазы, липазы и протеаз выражены не так значительно. Наиболее близкое амилазно-протеазное соотношение ферментов наблюдается в панкреатическом соке и плазме крови, что может быть использовано при диагностике состояния поджелудочной железы.
Список литературы Активность ферментов поджелудочной железы у цыплят-бройлеров на разных этапах пищеварения
- Case R.M. Pancreatic exocrine secretion: mechanisms and control. In: The pancreas/H.G. Beger et al. (еds.). Blackwell Science, Berlin, 1998. V. 1: 63-100.
- Коротько Г.Ф. Формирование ферментного компонента секретов пищеварительных желез (обзор). Физическая культура, спорт -наука и практика, 2013, 1: 51-57.
- Krogdahl A., Sell J.L. Influence of age on lipase, amylase, and protease activities in pancreatic tissue and intestinal contents of young turkeys. Poultry Sci., 1989, 68(11): 1561-1568 ( ) DOI: 10.3382/ps.0681561
- Romero L.F., Plumstead P.W. Bio-efficacy of feed proteases in poultry and their interaction with other feed enzymes. Zootechnica international, 2014, 36: 48-60.
- Rothman S.S., Liebow C., Isenman L. Conservation of digestive enzymes. Physiol. Rev., 2002, 82: 1-18 ( ) DOI: 10.1152/physrev.00022.2001
- Ramachandran R., Hollenberg M.D. Proteinases and signalling: pathophysiological and therapeutic implications via PARs and more. Br. J. Pharmacol., 2008, 153: 263-282 ( ) DOI: 10.1038/sj.bjp.0707507
- Kawabata A., Matsunami M., Sekiguchi F. Gastrointestinal roles for proteinase-activated receptors in health and disease. Review. Br. J. Pharmacol., 2008, 153: 230-240 ( ) DOI: 10.1038/sj.bjp.0707491
- Коротько Г.Ф. Рециркуляция ферментов пищеварительных желез. Краснодар, 2011.
- Гружаускас Р., Рацивичюте-Ступелиене А., Слаусгалвис В., Шашите В., Клишевичюте В., Ал-Сайфи Д., Штефан Б., Курклетис А. Здоровье поджелудочной железы птицы. Исследование биохимических маркеров крови. Мат. XVIII Межд. конф. «Инновационное обеспечение яичного и мясного птицеводства России». Сергиев Посад, 2015: 453-455.
- Японцев А.Э. Сравнение подходов к определению усвояемости аминокислот. Птицеводство, 2016, 2: 35-37.
- Сомова О.В. Морфометрические показатели экзокринного отдела поджелудочной железы кур в разные возрастные периоды. Ученые записки УО ВГАВМ, 2012, 48(1): 142-145.
- Сомова О.В., Гудков Ф.Д. Цитологические и цитохимические параметры экзокринного отдела поджелудочной железы у гусей в разные возрастные периоды. Ученые записки УО ВГАВМ, 2010, 46(1): 50-53.
- Эйнжел Р. Переваримость протеина и влияние протезы на переваримость аминокислот бройлерами, индейками и яичными курами. Zootecnica Международный птицеводческий журнал, 2013, 9(59): 32-44.
- Murai A., Satoh S., Okumura J., Furuse M. Factors regulating amylase secretion from chicken pancreatic acini in vitro. Life Sci., 2000, 66(7): 585-591 ( ) DOI: 10.1016/S0024-3205(99)00631-1
- Degolier T.F., Place A.R., Duke G.E., Carraway R.E. Neurotensin modulates the composition of pancreatic exocrine secretions in chickens. J. Exp. Zool., 1999, 283: 455-462.
- Ren L.Q., Zhao F., Tan H.Z., Zhao J.T., Zhang J.Z., Zhang H.F. Effects of dietary protein source on the digestive enzyme activities and electrolyte composition in the small intestinal fluid of chickens. Poultry Sci., 2012, 91(7): 1641-1646 ( ) DOI: 10.3382/ps.2011-02081
- Батоев Ц.Ж., Батоева С.Ц. Методика наложения фистул для изучения секреции поджелудочной железы и желчеотделения у птиц. Физиол. журн. СССР, 1970, 56(12): 1867-1868.
- Мерина-Глузкина В.М. Сравнительная оценка сахарифицирующего и декстринирующего методов при определении активности амилазы крови здоровых и больных острым панкреатитом. Лабораторное дело, 1965, 3: 142-146.
- Батоев Ц.Ж. Фотометрическое определение активности протеолитических ферментов в поджелудочной железе, соке по уменьшению концентрации казеина. Сб. науч. тр. Бурят. СХИ (Улан-Удэ), 1971, 25: 122-126.
- Richardson J., Viswanathan K., Lucas A. Serpins, the vasculature, and viral therapeutics. Front. Biosci., 2006, 11(1): 1042-1056 (doi: 10.2741/1862).
- Suzuki K. The multi-functional serpin, protein C inhibitor: beyond thrombosis and hemostasis. J. Thromb. Haemost., 2008, 6(12): 2017-2026 ( ) DOI: 10.1111/j.1538-7836.2008.03181.x
- Zavasnik-Bergant T. Cystatin protease inhibitors and immune functions. Front. Biosci., 2008, 1(13): 4625-4637 (doi: 10.2741/3028).
- Heinrich H.C., Gabbe E.E., Brüggemann J., Icagic F., Classen M. Enteropancreatic circulation of tripsin in man. Klin. Wochensch., 1979, 57: 1295-1297 ( ) DOI: 10.1007/BF01492985
- Алиев А.А. Лимфа и лимфообращение у продуктивных животных. Л., 1982.
- Уголев А.М. Эволюция пищеварения и принципы эволюции функций. Л., 1985.
- Климов П.К., Фокина А.А. Физиология поджелудочной железы. Регуляция внешнесекреторной функции. Л., 1987.
- Vertiprakhov V.G. Pancreatic exocrine function in hens with addition of lysine and methionine to their ration. Russian Agricultural Sciences, 2015, 41(2-3): 171-174 (doi: 10.3103/S1068367415020275).
- Вертипрахов В.Г. Физиологические основы использования белковых балансирующих добавок в рационе животных. Чита, 2012.
- Батоев Ц.Ж. Физиология пищеварения птиц. Улан-Удэ, 2001.


