Активность и состав лектинов клеточной стенки пшеницы при инфицировании грибными патогенами
Автор: Шаймуллина Гульназ Хидиятовна, Хусаинова Раиля Рафаиловна, Невмержицкая Юлия Юрьевна, Тимофеева Ольга Арнольдовна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Биотехнология
Статья в выпуске: 3-5 т.15, 2013 года.
Бесплатный доступ
Исследована гемагглютинирующая активность и молекулярный состав лектинов из клеток корней проростков озимой пшеницы сорта Мироновская 808 и Казанская 560, инфицированных возбудителями грибных заболеваний. Методами очистки и фракционирования белков выявлено увеличение количества белков клеточной стенки с агглютинирующей активностью у двух сортов озимой пшеницы, что свидетельствует об участии этих белков в механизмах защитного действия при патогенезе. Показано, что увеличение лектиновой активности является одной из защитных реакций растительного организма на действие патогенов и зависит от устойчивости сорта и воздействующего инфекционного агента.
Лектины, очистка, патоген
Короткий адрес: https://sciup.org/148202077
IDR: 148202077 | УДК: 581.1
Текст научной статьи Активность и состав лектинов клеточной стенки пшеницы при инфицировании грибными патогенами
Проблема инфекционных болезней растений пшеницы, приводящая к потерям урожая и ограничению объемов производства сельскохозяйственных культур, не нова, но в последнее время приобрела глобальный характер. Поэтому важное значение приобретает изучение молекулярных основ устойчивости растений к фитозаболеваниям, в частности, к грибным патогенам [1].
При инфицировании растений фитопатогенами лектинам отводят роль первичных агентов в узнавании участков сложных углеводов на поверхности клеток патогенов и дальнейшем развитии реакций сверхчувствительности. Гипотезы об участии лектинов в защите растений от болезнетворных агентов подкреплены данными о способности этих белков специфически взаимодействовать с поверхностью бактериальных клеток, спор и гиф грибов [2], что приводит к несовместимому или совместимому взаимодействию организмов, которое соответственно проявляется в индукции или в отсутствии защитной реакции растений на атаку патогена [3].
Одним из признаков активной реакции растений на инфицирование является количественное изменение содержания или активности лектиновых белков. В связи с этим, цель данной работы состояла в анализе уровня активности и молекулярного состава лектинов при формировании иммунного ответа разных сортов озимой пшеницы ( Triticum aestivum L.), инфицированных фитопатогенами Fusarium ( F. ) oxysporum Schlectend.:Fr., Cladosporium ( C .) graminum Cda., Alternaria spp . и Aspergillus ( A. ) niger .
Объектом исследования служили проростки озимой пшеницы (Triticum aestivum L.) сорта Мироновская 808 и Казанская 560. Семена перед
посевом стерилизовали в 96% этаноле и промывали стерильной дистиллированной водой. Далее семена опытного варианта замачивали на сутки в суспензии конидий с исходным титром (1-3)*104 КОЕ/см3 (КОЕ - колониеобразующие единицы). Инфицирование проводили двумя специфическими для пшеницы фитопатогенными грибами Fusarium (F.) oxysporum Schlectend.:Fr. и Cladosporium (C.) graminum Cda. и двумя неспецифическими – Alternaria spp . и Aspergillus (A.) niger . Растения выращивали в лабораторных условиях в кюветах на водопроводной воде при освещенности 100 Вт/м2 и 12-часовом фотопериоде в течение 7 сут.
Растворимые лектины экстрагировали 0,05н HCl, лектины клеточной стенки – 0,05% раствором тритона Х-100 по методу, описанному в ранее опубликованной работе [4]. Для определения количества белка использовали метод Bradford [5]. Активность лектинов определяли в планшетах для иммунологических исследований по их способности агглютинировать трипсинизированные эритроциты 1 группы крови. Лектиновую активность рассчитывали по минимальному количеству белка, вызывающему агглютинацию эритроцитов (мкг бел-ка/мл)-1. Эритроциты получали и трипсинизирова-ли по методу Луцика [6]. Гель-фильтрацию проводили на колонке с Sephadex G-150, которая позволила отделить лектины от значительного количества низкомолекулярных примесей непротеиновой природы. Результаты обработали статистически, их считали достоверными при уровне погрешности ≤5% по критерию Стьюдента.
Во время прорастания семян на ранних этапах развития проростка синтезируется значительное количество лектинов [7], также как это происходит в ходе нормального онтогенеза растений. В наших экспериментах при инфицировании фитопатогены уменьшали активность растворимых лектинов у двух сортов озимой пшеницы (рис. 1). Вероятно, ингибирующее действие фитопатогенов на актив- ность растворимых лектинов может быть обусловлено взаимодействием углеводсвязывающих центров этих белков с инфекционными структурами патогенов, в результате которого лектины не могут участвовать в агглютинации эритроцитов. При этом чувствительность активности растворимых лектинов к патогенам была меньше у Мироновской 808. Возможно, у Казанской 560 происходит более эффективная инактивация фитопатогенов за счет усиления взаимодействия лектиновых белков с углеводными гаптенами грибов.
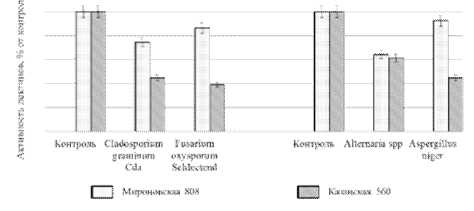
Рис. 1 . Активность растворимых лектинов озимой пшеницы сорта Мироновская 808 и Казанская 560 при инфицировании патогенными грибами
В литературе накоплено достаточное количество сведений, подтверждающих, что накопление лектинов тесно связано с индукцией устойчивого состояния растения-хозяина [8]. В наших опытах заражение растений специфическим фитопатогеном Cladosporium graminum Cda. приводило к значительному повышению активности лектинов клеточной стенки у растений двух сортов (рис. 2). При этом ответная реакция растений на Cladosporium graminum Cda. была выражена сильнее по сравнению с Fusarium spp. Fusarium spp. усиливал активность лектинов клеточной стенки только у сорта Мироновская 808. По-видимому, этот сорт более восприимчив к Fusarium spp. по сравнению с Казанской 560. Следует отметить, что и степень поражения этим патогеном растений Мироновской 808 была выше по сравнению с Казанской 560. При действии неспецифического возбудителя Alternaria spp. активность лектинов клеточной стенки снижалась, а Aspergillus niger не оказывал влияния на активность лектинов у двух сортов (рис. 2).
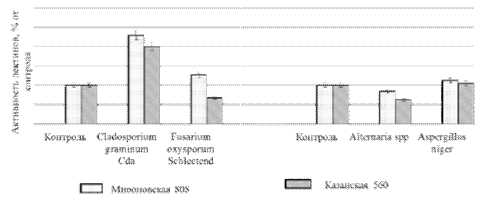
Рис. 2 . Активность связанных с клеточной стенкой лектинов озимой пшеницы сорта Мироновская 808 и Казанская 560 при инфицировании патогенными грибами
В следующей части работы с помощью гель- фильтрации мы провели хроматографическое разделение белков клеточной стенки корней проростков озимой пшеницы сортов Мироновская 808 и Казанская 560, инфицированных патогенными грибами.
У растений Мироновской 808 в контрольном варианте среди полученных белковых фракций лектиновая активность обнаруживалась во фракциях, содержащих белки с молекулярной массой 79, 69, 55, 45, 35 кДа (рис. 3). На основании работы Chivasa et al. [9], которые проанализировали белки клеточной стенки Arabidopsis thaliana , можно сделать некоторые предположения относительно обнаруженных нами лектинов клеточной стенки, поскольку белки арабидопсиса имеют состав, близкий к составу белков, которые характерны для других растений. Белок с молекулярной массой 35 кДа может быть классическим лектином пшеницы – агглютинином зародыша пшеницы (АЗП). АЗП, резкое накопление которого происходит при разных неблагоприятных условиях, относится к экскретируемым белкам, выделение которого в наружную среду может иметь значение для предохранения ослабленных растений от почвенной инфекции [8]. Обнаруженные нами белки наряду с лектиновой активностью, могут обладать ферментативной активностью. Например, белки с молекулярной массой 79 кДа и 45 кДа могут быть ГТФ-связывающими [9].
Патогенные микроорганизмы по-разному влияли на профиль элюции белков Мироновской 808 (рис. 3). Инфицирование неспецифическими грибами рода Alternaria приводило к исчезновению белков с молекулярной массой 79, 69 кДа и 45кДа. При этом в профиле элюции появились белки 85, 83, 71, 61, 59 кДа. В варианте с грибом Aspergillus niger не было только белков 69 кДа и 55 кДа, характерных для контрольных растений, при этом лектиновая активность обнаруживалась во фракциях 85, 83, 71, 61 кДа (эти же белки появлялись при действии Alternaria spp. ), а также белки 79, 51, 47, 38, 37, 33кДа и 29 кДа.
Кроме белков, выявленных у контрольных растений, в варианте с заражением Cladosporium gra-minum Cda. появились новые белки: 85, 81, 79, 51, 33 кДа и 29 кДа, а при действии Fusarium spp. мы обнаружили белки с молекулярной массой 87, 85, 75, 57, 55, 53, 45, 41, 35, 31 кДа (рис. 3).
В профиле элюции белков клеточной стенки контрольных растений сорта Казанская 560 лекти-новая активность была обнаружена во фракциях белков с молекулярной массой 79, 69, 61, 55, 45, 35 кДа. Заражение семян сорта Казанская 560 как специфическими, так и неспецифическими грибами вызывало изменение всего профиля элюции белков клеточной стенки (рис. 4).
В варианте с авирулентными микроорганизмами Alternaria spp. и Aspergillus niger значительно снизилось содержание высокомолекулярных белков, но возросла концентрация среднемолекулярных
а)
а)
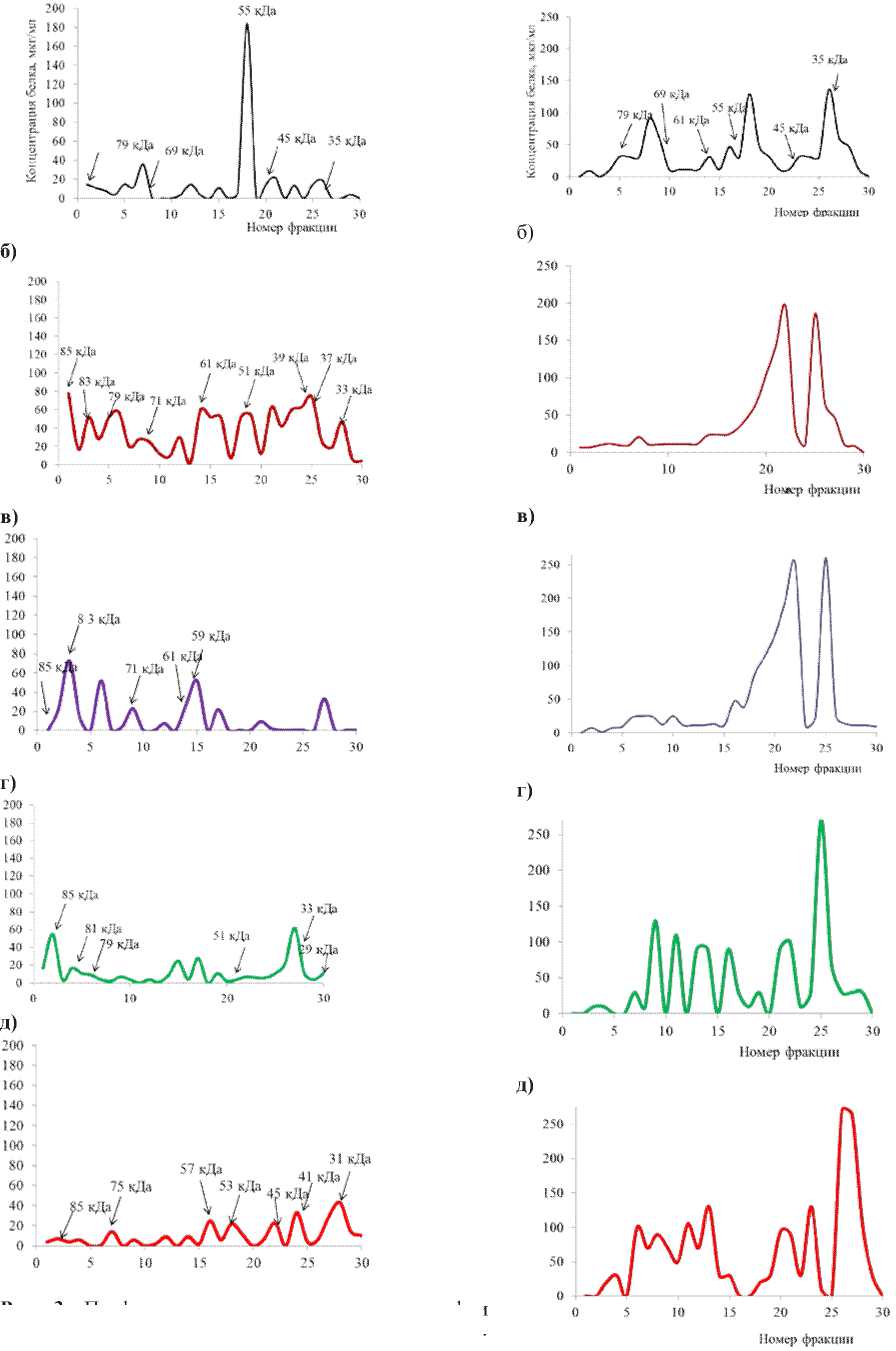
элюции при гель-хроматографии стенки проростков озимой пшени-
Рис. 3. Профиль белков клеточной цы Мироновская 808: а) контрольные растения, б) Aspergillus niger, в) Alternaria spp., г) Cladosporium gra-minum Cda. , д) Fusarium spp.
Рис. 4 . Профиль элюции при гель-хроматографии белков клеточной стенки проростков озимой пшеницы Казанская 560: а) контрольные растения, б) Aspergillus niger , в) Alternaria spp. , г) Cladosporium grami-num Cda., д) Fusarium spp .
полипептидов, которые формировали два характерных пика. При этом во всех выявленных фракциях наблюдалась лектиновая активность. Можно предположить, что индукция образования среднемолекулярных белков, обладающих лектиновой активностью, необходима для эффективного взаимодействия с авирулентными грибными патогенами.
Таким образом, обнаружено, что неспецифические микроорганизмы Alternaria spp. и Aspergillus niger вызывают у растений сорта Казанская 560 увеличение содержания среднемолекулярных лектиновых белков клеточной стенки, а специфические фитопатогены Cladosporium graminum Cda. и Fusarium spp. – высокомолекулярных лектиновых белков. По-видимому, эти две группы белков участвуют в узнавании и инактивации патогенов: среднемолекулярные взаимодействуют с авиру-лентными возбудителями, высокомолекулярные – с вирулентными.
-
1. Молодченкова О.О., Адамовская В.Г., Досенко В.Е., Тихонов П.С. Лектиновая активность и экспрессия генов лектина проростков пшеницы при инфицировании грибными патогенами и действии салициловой кислоты.// Вiсник Харкiвс. Нац. Агр. Ун-ту. Серiя Бiологiя.
2012. Т. 26. Bип. 2. С. 54-60.
-
2. Etzler M.E. Are lectins involved in plant-fungus interactions? // Phytopathology. 1981. V. 71. N 7. P. 744-746.
-
3. Белава В.Н., Зеленый С.Б., Панюта О.А.,Таран Н.Ю., Погребной П.В . Экспрессия генов лектинов и дефенсина у сортов пшеницы Мироновская 808 и Roazon при инфицировании Pseudocercosporella herpotrichoides // Biopolymers and Cell. 2010. V. 26. N. 1. P. 45-50.
-
4. Тимофеева О.А., Невмержицкая Ю.Ю., Московкина М.А. Активность и состав лектинов клеточной стенки пшеницы при действии низких температур и ингибиторов кальциевой сигнальной системы // Физиол. раст. 2010. Т. 57. № 2. С. 209-216.
-
5. Bradford M.M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding // Anal. Biochem. 1976. V. 72. P. 248-254.
-
6. Луцик М.Д., Панасюк Е.Н., Луцик А.Д . Лектины. Львов: Вища шк. Изд-во при Львов. ун-те, 1981. 156 с.
-
7. Lepekhin E.A., Yalovoi A.I., Rybak V.I . Activity and specificity carbohydrates in lectins of germinating maize grains // Russ. J. Plant Physiol. 1986. V. 33. N 2. P. 390-394.
-
8. Шакирова Ф.М. Неспецифическая устойчивость растений к стрессовым факторам и ее регуляция. Уфа: Гилем, 2001. 159 с.
-
9. Chivasa S., Ndimba B. K., Simon W . Proteomic analysis of the Arabidopsis thaliana cell wall // Electrophoresis. 2002. V. 23. P. 1754-1765.
LECTIN ACTIVITY AND COMPOSITION IN THE WHEAT CELL WALLS DURING INFECTION FUNGAL PATHOGENS
Список литературы Активность и состав лектинов клеточной стенки пшеницы при инфицировании грибными патогенами
- Молодченкова О.О., Адамовская В.Г., Досенко В.Е., Тихонов П.С. Лектиновая активность и экспрессия генов лектина проростков пшеницы при инфицировании грибными патогенами и действии салициловой кислоты.//Вiсник Харкiвс. Нац. Агр. Ун-ту. Серiя Бiологiя. 2012. Т. 26. Bип. 2. С. 54-60.
- Etzler M.E. Are lectins involved in plant-fungus interactions?//Phytopathology. 1981. V. 71. N 7. P. 744-746.
- Белава В.Н., Зеленый С.Б., Панюта О.А.,Таран Н.Ю., Погребной П.В. Экспрессия генов лектинов и дефенсина у сортов пшеницы Мироновская 808 и Roazon при инфицировании Pseudocercosporella herpotrichoides//Biopolymers and Cell. 2010. V. 26. N. 1. P. 45-50.
- Тимофеева О.А., Невмержицкая Ю.Ю., Московкина М.А. Активность и состав лектинов клеточной стенки пшеницы при действии низких температур и ингибиторов кальциевой сигнальной системы//Физиол. раст. 2010. Т. 57. № 2. С. 209-216.
- Bradford M.M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding//Anal. Biochem. 1976. V. 72. P. 248-254.
- Луцик М.Д., Панасюк Е.Н., Луцик А.Д. Лектины. Львов: Вища шк. Изд-во при Львов. ун-те, 1981. 156 с.
- Lepekhin E.A., Yalovoi A.I., Rybak V.I. Activity and specificity carbohydrates in lectins of germinating maize grains//Russ. J. Plant Physiol. 1986. V. 33. N 2. P. 390-394.
- Шакирова Ф.М. Неспецифическая устойчивость растений к стрессовым факторам и ее регуляция. Уфа: Гилем, 2001. 159 с.
- Chivasa S., Ndimba B. K., Simon W. Proteomic analysis of the Arabidopsis thaliana cell wall//Electrophoresis. 2002. V. 23. P. 1754-1765.


