Активность компонентов антиоксидантной защиты Raphanus sativus L. при выращивании на почве, загрязненной сульфатами свинца и кадмия
Автор: Еремченко О.З., Кусакина М.Г., Голева Т.Н.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Экология
Статья в выпуске: 1, 2014 года.
Бесплатный доступ
Исследована активность антиоксидантной защиты в редисе Raphanus sativus L. var. radicula Pers., произрастающем в условиях загрязнения почвы сульфатами свинца и кадмия. Редокс-ак-тивность в листьях редиса усиливалась с ростом дозы загрязнения. Повышенная активность ка-талазы и пероксидаз в растениях отмечена на вариантах загрязнения почвы сульфатом кадмия.
Загрязнение почв, тяжелые металлы, активные формы кислорода, пероксид водорода, пероксидазы, каталаза, аскорбиновая кислота, редокс-активность
Короткий адрес: https://sciup.org/147204662
IDR: 147204662 | УДК: 581.632.1
Текст научной статьи Активность компонентов антиоксидантной защиты Raphanus sativus L. при выращивании на почве, загрязненной сульфатами свинца и кадмия
Повышенное содержание тяжелых металлов в почвенной среде приводит к ингибированию роста, изменению интенсивности и направленности многих метаболических процессов в клетках растений. Известно, что тяжелые металлы при низкой концентрации выполняют роль важнейших микроэлементов, необходимых для нормального роста и развития растений. Однако остается неизвестной физиологическая роль Cd и Pb. При загрязнении растения поглощают эти элементы, избирательно аккумулируют в корнях и надземных вегетативных органах. При избыточном накоплении в растительных клетках свинца и кадмия нарушается гомеостаз и подавляются многие процессы метаболизма [Sanita di Toppi, Gabrielli, 1991; Серегин, Иванов, 2001]. Ингибирующее влияние Cd и Pb на активность большинства ферментов обусловлено как прямым связыванием с функциональными SH-группами белков, так и с нарушением ионного баланса за счет конкурентного снижения поглощения и нарушения транспорта Zn, Fe, Cu и др. [Титов, Таланова, Казнина, 2011].
Под влиянием неблагоприятных условий среды и, в частности, техногенного загрязнения в клетках растений происходит развитие окислительного стресса с избыточным образованием активных форм кислорода (АФК) [Зенков, Лапкин, Меньшикова, 2001; Чиркова, 2002; Га-рифзянов, 2012; Сигнальная роль ..., 2012]. К основным механизмам устойчивости растений к дей- ствию поллютантов относят активацию ферментов антиоксидантной защиты (супероксиддисмутаза, пероксидазы, каталаза и др.), а также накопление редокс-соединений (аскорбиновая кислота, глутатион, каротиноиды и др.), прерывающих цепи избыточного образования свободных радикалов [Fridovich, 1986, Кения, Лукаш, Гуськов, 1993; Mittler, 2002; Прадедова, Ишеева, Саляев, 2011].
Повышение активности компонентов антиоксидантной системы защиты может определять уровень адаптационных способностей растений к действию антропогенных загрязнителей. Однако особенности функционирования антиоксидантной системы растений в условиях загрязнения среды тяжелыми металлами изучены недостаточно. В связи с этим целью работы явилось исследование активности некоторых компонентов антиоксидантной защиты редиса посевного при выращивании на почве, загрязненной сульфатами свинца и кадмия.
Объект и методы исследования
Объектом исследований был редис посевной ( Raphanus sativus L. var. radicula Pers., Brassicaceae ) сорта Жара. Растения выращивали в условиях модельного эксперимента в течение 30 дней на агро-дерново-подзолистой почве на фоне внесения сульфатов свинца (1, 5 и 10 ПДК, при ПДК=100 мг/кг почвы) и кадмия (1, 50, 100 ПДК, при ПДК=3 мг/кг
почвы). Контролем служили растения, выращенные на незагрязненной почве. Повторность опытов – трехкратная. Определение массы и высоты надземной части растений проводили в 20-кратной повторности. Биохимические показатели устанавливали в 3-кратной повторности. Общее содержание перекисей определяли ферротиоционатным методом [Лу-каткин, 2002]; активность каталазы – газометрическим методом [Методы ..., 1987]; активность пероксидаз – по методу Бояркина [Методы ..., 1987]. Содержание аскорбиновой кислоты и общую редокс-активность изучали методом Петта – Прокошева [Практикум …, 1972].
Полученные результаты статистически обработаны с помощью компьютерной программы «Stadia 8.0»; были использованы дисперсионный и регрессионный анализы.
Результаты и их обсуждение
Загрязнение почвы солью свинца не оказало достоверного воздействия на высоту растений (рис. 1). В ряде работ показана низкая проникающая способность свинца в растительный организм [Ильин, 1991; Серегин, Иванов, 1997; Еремченко, Чудинова, 2012]. При невысоких концентрациях тяжелых металлов в клетке изменение физиологобиохимических реакций носит неповреждающий и обратимый характер. Согласованность метаболических процессов сохраняется, а иногда даже наблюдается интенсификация некоторых из них [Титов, Таланова, Казнина, 2011].
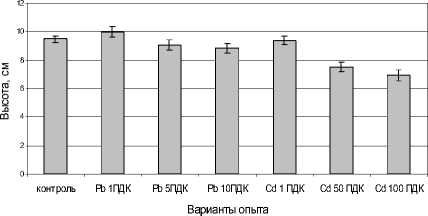
Рис. 1 . Влияние сульфатов свинца и кадмия на высоту растений редиса, см
Достоверное снижение высоты растений прослежено по вариантам Cd 50 и 100 ПДК (рис. 1). Торможение роста надземной части растений связывают как с непосредственным влиянием кадмия на клеточное деление, так и с нарушением общего метаболизма растений; отмечено уменьшение фотосинтезирующей поверхности, замедление скорости фотосинтеза, нарушение минерального питания, а также изменение гормонального баланса, в частности, увеличение количества абсцизовой кислоты [Иванов, Быстрова, Серегин, 2003; Титов, Казнина, Таланова, 2012].
Токсическое воздействие на массу растений оказало загрязнение Pb и Cd (табл. 2), однако исходя из внесенных доз солей, эффект действия кадмия проявлялся на порядок сильнее (рис. 2).
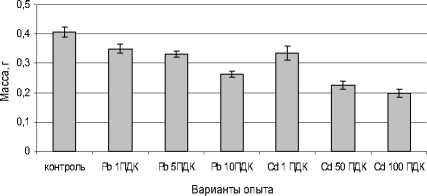
Рис. 2 . Влияние сульфатов свинца и кадмия на сырую массу надземной части растений, г
Как известно, поллютанты (в том числе тяжелые металлы) инициируют развитие в клетках живых организмов окислительного стресса, обязательным условием возникновения которого является избыточное образование активных форм кислорода, таких как супероксид-радикал (анион-ради-кал) О 2 •-, гидроперекисный радикал НО 2 •, гидрок-сил-радикал НО•, перекись водорода Н 2 О 2 , синглетный кислород 1О 2 . В результате повышенной генерации АФК в клетках происходят окисление липидов, углеводов, белков, повреждение ДНК и РНК, дезорганизация цитоскелета. Перекись водорода является относительно стабильным соединением (время жизни около 1 мс), способным диффундировать от места образования [Гарифзянов, 2012]. Её генерация может служить одним из биохимических показателей состояния растений в условиях нарушения внутриклеточных процессов.
Дисперсионный анализ подтвердил достоверное влияние фактора загрязнения почвы на содержание перекисей в листьях растений. В то же время количество перекисей зависело не только от их продуцирования, но и от эффективности работы антиоксидантной системы. На фоне действия соли свинца содержание перекисей в листьях растений повышено на вариантах 5 и 10 ПДК по сравнению с контрольными растениями (рис. 3).
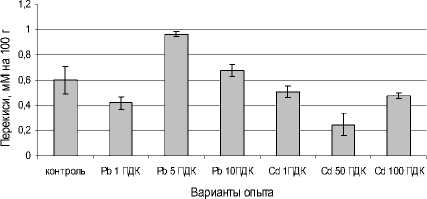
Рис. 3 . Влияние сульфатов свинца и кадмия на содержание перекисей в листьях редиса, мМ на 100 г сырой массы
Возможно, в этом случае накопление Н2О2 в клетках при стрессе связано с его сигнальной ро- лью, обеспечивающей включение защитных механизмов [Гамалей, Клюбин, 1996]. В вариантах с более токсичным кадмием содержание перекисей ниже контроля, по-видимому, из-за повышенной активности систем антиоксидантной защиты растений.
Избыток пероксида водорода, возникающий при действии стрессовых факторов, элиминируется каталазой и пероксидазами [Мирошниченко, 1992; Мерзляк, 1999; Роль систем …, 2008]. Наличие нескольких ферментов, выполняющих одну и ту же каталитическую функцию, расширяет адаптационный потенциал растений [Половникова, Воскресенская, 2008]. Каталаза преобразует перекись водорода в воду и молекулярный кислород. Она участвует в аскорбат-глутатионовом цикле, регулирующем окислительно-восстановительное равновесие в клетке. Поскольку каталаза и пероксидаза предотвращают избыточную аккумуляцию АФК и снижают вероятность развития окислительного стресса, изменения в их активности рассматривают как ранний и чувствительный индикатор токсичности тяжелых металлов [Иванов, Савочкин, Кузнецов, 2012].
В научной литературе отмечается разная реакция растений на воздействие поллютантов. В опытах М.Г. Половниковой и О.Л. Воскресенской [2008] при усилении загрязнения среды поллютантами наблюдалось снижение активности каталазы, особенно у менее устойчивого к антропогенному воздействию клевера лугового. В.О. Миттова и А.У. Игамбердиев [2000] считают, что в стрессовых условиях общая активность каталазы снижается, но увеличивается активность изоформ каталазы, обладающих пероксидазной активностью. Более высокий уровень активности каталазы в стрессовых условиях отмечен в исследованиях Т.В. Чирковой [2002] и П. Ахмада, К.А. Джамила, С. Шармы [2010].
Сульфат свинца в дозе Pb 1 ПДК не оказал достоверного влияния на активность каталазы в листьях растений (рис. 4). При повышенном загрязнении свинцом и наименьшей дозе кадмия зафиксировано снижение активности этого фермента. Вероятно, в адаптации растений на этом фоне имеют значения другие антиоксиданты. Под влиянием Cd 50 ПДК отмечено усиление активности каталазы в листьях растений в 1.5 раза по сравнению с контролем.
В результате поиска связей между биохимическими показателями установлена обратная экспоненциальная зависимость между общим количеством перекисей и активностью каталазы: y =e0,25 – 0.3х ; уровень значимости нулевой гипотезы P=0.0004; критерий Фишера F=11.3. Следовательно, чем выше активность каталазы, тем ниже содержание перекисей в листьях
В реализации адаптационного потенциала особая роль отводится пероксидазам (аскорбат-перок-сидаза, глутатион-пероксидаза, гваякол-пероксида-за и др.) – полифункциональной ферментной системе, которая способна реагировать на широкий спектр факторов, приводящих к нарушению обмена веществ у растений. Пероксидазы способны восстанавливать перекись водорода до воды, окисляя при этом различные соединения [Лукаткин, 2002].
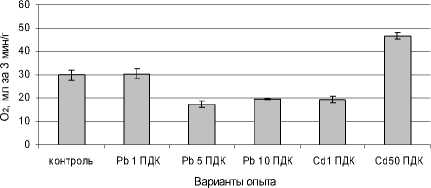
Рис. 4 . Влияние сульфатов свинца и кадмия на активность каталазы в листьях редиса, мл О 2 за 3 мин на 1 г сырой массы
Проведенные опыты показали, что внесение в почву сульфата свинца не сопровождалось усилением пероксидазной активности растений редиса (рис. 5). В варианте с внесением кадмия наблюдалось статистически достоверное увеличение активности пероксидаз по сравнению с контролем. Усиление активности пероксидаз при действии стресс-факторов и, в частности, тяжелых металлов, может быть связано с изменениями их компонентного состава. Ферменты находятся в клетке как в свободном, так и в связанном состоянии, а под влиянием стресса происходит увеличение доли свободных форм за счет освобождения из связанных форм [Рогожин, 2004].
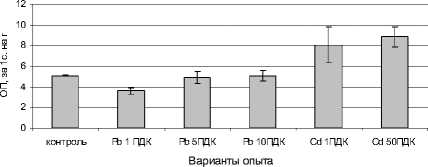
Рис. 5 . Влияние сульфатов свинца и кадмия на активность пероксидаз в листьях редиса, оптическая плотность (ОП) за 1 с на 1 г сырой массы
Повышение пероксидазной и каталазной активности в листьях редиса под влиянием CdSO 4 приводит к сохранению прооксидантно – оксидантного равновесия в биологических мембранах и свидетельствует об активации защитных механизмов от окислительного стресса, вызванного действием тяжелых металлов.
В целом следует отметить усиленные признаки развития окислительного стресса в редисе под влиянием соли кадмия. Кадмий обладает большой подвижностью в почве в широком диапазоне рН и способностью замещать в клеточном метаболизме такой важный биоэлемент, как цинк [Серегин, Иванов, 2001]. Ионы Cd чрезвычайно легко поглощаются растениями [Кабата-Пендиас, Пендиас, 1989], а Pb медленнее других тяжелых металлов поступает в растения и транспортируется в надземные органы [Серегин, Иванов, 1997]. Различия в степени ингибирующего действия исследуемых металлов могут быть связаны с эффективностью физиологических барьеров при поступлении микроэлементов в растение, с задержкой металлов в тканях корня или удалением их в вакуоли [Прасад, 2003].
Высокие параметры окислительно-восстановительных процессов в растениях являются показателем мобилизации защитных свойств организма. При окислительном стрессе ферментативная защита может дополняться протекторным действием низкомолекулярных антиоксидантов, таких как аскорбиновая кислота и глутатион, прерывающих цепь свободнорадикального окисления [Кения, Лукаш, Гуськов, 1993; Чиркова, 2002; Половникова, Воскресенская, 2008]. Аскорбиновая кислота реагирует с АФК, окисляясь при этом до моно - и де-гидроаскорбиновой кислоты.
В растениях редиса с увеличением загрязненности сульфатом свинца и кадмия повышалось содержание аскорбиновой кислоты, способной к восстановительным реакциям (рис. 6). Самый высокий уровень содержания аскорбиновой кислоты установлен при максимальных дозах тяжелых металлов – в 2 раза больше, чем в контроле. Накопление аскорбиновой кислоты может быть следствием интенсивности ее образования и/или освобождения из связанного состояния [Кения, Лукаш, Гуськов, 1993].
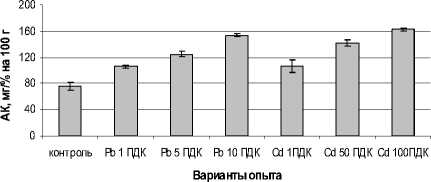
Рис. 6 . Влияние сульфатов свинца и кадмия на содержание свободной аскорбиновой кислоты (АК) в листьях редиса, мг/% сухой массы растений
С увеличением дозы кадмия и свинца повысилась и общая редокс-активность в листьях редиса по сравнению с контролем (рис. 7).
Выводы
-
1. Загрязнение почвы сульфатами свинца и кадмия оказало ингибирующее влияние на массу растений редиса. Достоверное уменьшение высоты растений отмечено в вариантах с солью кадмия, при дозах Cd 50 и 100 ПДК.
-
2. Достоверное накопление перекисей в надземных органах редиса установлено на вариантах загрязнения почвы сульфатом свинца в дозе 5 и 10 ПДК относительно контроля. На вариантах с сульфатом кадмия перекисей в листьях было меньше, чем на контроле.
-
3. При увеличении содержания сульфата кадмия в почве отмечено повышение активности каталазы и пероксидаз в листьях редиса по сравнению с контролем. При загрязнении почвы солью свинца активность каталазы в листьях редиса понижена, не отмечено усиления пероксидазной активности.
-
4. Установлено заметное усиление редокс-ак-тивности в листьях редиса в условиях загрязнения почвы свинцом и кадмием, что, вероятно, является одним из защитно-приспособительных реакций при избыточной генерации активных форм кислорода.
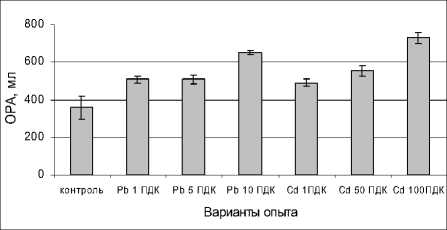
Рис. 7 . Влияние сульфатов свинца и кадмия на общую редокс-активность (ОРА) в листьях редиса, мл 0,001 н. KJO 3 /100г сухой массы
Список литературы Активность компонентов антиоксидантной защиты Raphanus sativus L. при выращивании на почве, загрязненной сульфатами свинца и кадмия
- Ахмад П., Джамил К.А., Шарма С. Влияние солевого стресса на систему антиоксидантной защиты, перекисное окисление липидов, ферментное окисление липидов, ферменты метаболизма пролина и метаболическую активность у двух генотипов шелковицы//Физиология растений. 2010. Т. 57, № 4. С. 547-555
- Гамалей И.А., Клюбин И.В. Перекись водорода как сигнальная молекула//Цитология. 1996. Т. 38. С. 1233-1247
- Гарифзянов А.Р. Образование перекиси водорода и проявление окислительного стресса в листьях древесных растений в условиях промышленного загрязнения//Фундаментальные исследования. Биологические науки. 2012. № 1. С. 151-155
- Еремченко О.З., Чудинова Л.А. Микроэлементный состав почв и растительности заповедной лесостепи в условиях техногенеза//Современные проблемы науки и образования. 2012. № 5. Статья № 279.
- Зенков Н.К., Лапкин В.З., Меньщикова Е.Б. Окислительный стресс: Биохимические и патофизиологические аспекты. М.: Наука, 2001. 343 с
- Иванов В.Б., Быстрова Е.И., Серегин И.В. Сравнение влияния тяжелых металлов на рост корня в связи с проблемой специфичности и избирательности их действия//Физиология растений. 2003. Т. 50, № 3. С. 445-454
- Иванов Ю.В., Савочкин Ю.В., Кузнецов Вл.В. Сосна обыкновенная как модельный объект для изучения механизмов адаптации хвойных к действию тяжелых металлов. 2. Функционирование антиоксидантных ферментов в сеянцах сосны в условиях хронического действия цинка//Физиология растений. 2012. Т. 59, № 1. С. 57-66
- Ильин В.Б. Тяжелые металлы в системе почва -растение. Новосибирск: Наука, 1991. 151 с.
- Кабата-Пендиас А., Пендиас Х. Микроэлементы в почвах и растениях. М.: Мир, 1989. 439 с.
- Кения М.В., Лукаш А.И., Гуськов Е.П. Роль низкомолекулярных антиоксидантов при окислительном стрессе//Успехи современной биологии. 1993. Т. 113, № 4. С. 456-470.
- Лукаткин А.С. Вклад окислительного стресса в развитие холодового повреждения в листьях теплолюбивых растений//Физиология растений. 2002. Т. 49, № 6. С. 878-885.
- Мерзляк М.Н. Активированный кислород и жизнедеятельность растений//Соросовский образовательный журнал. 1999. № 9. С. 20-26.
- Методы биохимического исследования растений/под ред. А.И. Ермакова. Л.: Агропромиздат, 1987. 430 с.
- Мирошниченко О.С. Биогенез, физиологическая роль и свойства каталазы//Биополимеры и клетка. 1992. Т. 8, № 6. С. 7-25.
- Миттова В.О., Игамбердиев У.А. Влияние солевого стресса на дыхательный метаболизм высших растений//Известия РАН. Сер. биол. 2000. №3. С. 322-328.
- Половникова М.Г., Воскресенская О.Л. Изменение активности компонентов системы антиоксидантной защиты и полифенолоксидазы у газонных растений на разных этапах онтогенеза в условиях городской среды//Физиология растений. 2008. Т. 55, № 5. С. 777-785.
- Прадедова Е.В., Ишеева О.Д., Саляев Р.К. Классификация системы антиоксидантной защиты как основа рациональной организации эксперимен-тального исследования окислительного стресса у растений//Физиология растений. 2011. Т. 58, № 2. С. 177-185.
- Практикум по физиологии растений. М.: Колос, 1972. 168 с.
- Прасад М.Н. Практическое использование растений для восстановления экосистем, загрязненных металлами//Физиология растений. 2003. Т. 50, № 5. С. 764-780.
- Рогожин В.В. Пероксидаза как компонент антиок-сидантной системы живых организмов. СПб.: ГЕОРД, 2004. 240 с.
- Роль систем антиоксидантной защиты при адаптации дикорастущих видов растений к солевому стрессу/А.В. Карташов, Н.Л. Радюкина, Ю.В. Иванов, П.П. Пашковский, Н.И. Шевякова, В.В. Кузнецов//Физиология растений. 2008. Т. 55, № 4. С. 516-522.
- Серегин И.В., Иванов В.Б. Гистохимические методы изучения распределения кадмия и свинца в растениях//Физиология растений. 1997. Т. 44, № 6. С. 915-921.
- Серегин И.В., Иванов В.Б. Физиологические аспекты токсического действия кадмия и свинца на высшие растения//Физиология растений. 2001. Т. 48, № 4. С. 606-630.
- Сигнальная роль активных форм кислорода при стрессе у растений/В.Д. Креславский, Д.А. Лось, С.Н. Аллахвердиев, Вл.В. Кузнецов//Физиология растений. 2012. Т. 59, № 2. С. 163-178.
- Титов А.Ф., Казнина Н.М., Таланова В.В. Устойчивость растений к кадмию. Петрозаводск: Карельский научный центр РАН, 2012. 55 с.
- Титов А.Ф., Таланова В.В., Казнина Н.М. Физиологические основы устойчивости растений к тяжелым металлам. Петрозаводск: Карельский научный центр РАН, 2011. 77 с.
- Чиркова Т.В. Физиологические основы устойчивости растений СПб.: Изд-во С.-Петерб. ун-та, 2002. 244 с.
- Fridovich I. Biological effects of the superoxide radical//Arch. Biochem. Biophys. 1986. Vol. 247, № 1. P. 1-11.
- Mittler R. Oxidative stress. Antioxidants and stress Tolerance//Trends plant Sci. 2002. Vol. 7. P. 405-410.
- Santa di Toppi, Gabrielli R. Response to Cadmium in Higher Plants/Environ//Exp. Bot. 1999. Vol. 41. P. 105-130.


