Активность лектинов проростков озимой пшеницы, выращеных на разнокачественом составе света в условиях засоления и действия тяжелых металлов
Автор: Якушенкова Татьяна Петровна, Тимофеева Ольга Арнольдовна, Зиатдинова Алина Александровна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Экология
Статья в выпуске: 3-5 т.15, 2013 года.
Бесплатный доступ
Показано,что свет различного спектрального состава регулирует активность лектинов корней проростков пшеницы под воздействием засоления и действия тяжелых металлов
Проростки пшеницы, спектральный состав света, тивность лектинов засоление, тяжелые металлы, активность лектинов, устойчивость растений
Короткий адрес: https://sciup.org/148202036
IDR: 148202036 | УДК: 57.042
Текст научной статьи Активность лектинов проростков озимой пшеницы, выращеных на разнокачественом составе света в условиях засоления и действия тяжелых металлов
Одним из важнейших факторов окружающей среды, регулирующих процесс жизнедеятельности растений, является свет. Хорошо известно, что свет обеспечивает не только осуществление фотосинтеза, но и действует прямо или косвенно на все процессы обмена веществ и жизнедеятельность растительного организма, в частности устойчивость растений. Свет действует на растительный организм полифункционально: является субстратом для фотосинтеза и оказывает мощное регуляторное воздействие на растение.
Для оценки качества и количества падающего света у растений имеются разнообразные рецепторы: криптохромы, фитохромы, фототропины.
Поглощая свет определенного спектрального диапазона, фоторецепторы вступают в фотохимические реакции с образованием первичных фотопродуктов. Последние участвуют в биохимических процессах клеточной регуляции, что приводит к развитию конечных фотобиологических эффектов.
В последнее время из различных видов растений выделены углеводсвязывающие белки – лектины. Физиологическая роль лектинов многообразна, они участвуют в межклеточном узнавании растениями фитопатогенов [1], обратимо взаимодействуют с фитогормонами [14], вовлекаются в формирование неспецифического адаптационного синдрома при низкотемпературном воздействии [9], в формировании ответных реакций при гипертермии, засухе и осмотическом шоке [17], засолении среды [15]. Все эти данные, по мнению Ф.М. Шакировой [14], позволяют рассматривать лектины как маркеры и участники системы формирования устойчивости растений.
Несмотря на детальное исследование физикохимических и биологических свойств многих лектинов, их физиологическая значимость для растений носит предположительный характер [14]. Данных о регуляторном влиянии света различного качества на устойчивость растений в литературе име-
Якушенкова Татьяна Петровна, к.б.н., старший преподаватель, е- mail: tyakushe@ ksu.ru; Тимофеева Ольга Арнольдовна, д.б.н., проф., зав. кафедрой; Зиатдинова Алина Александровна, студент ется недостаточно, и они носят эпизодический характер [3, 8, 18]. В связи с этим приобретают исключительную актуальность исследования механизмов фоторегуляторного влияния света различного качества на активность лектинов при действии засоления и солей тяжелых металлов.
Целью работы явилось изучение активности лектинов клеточной стенки и растворимых лектинов у проростков озимой пшеницы сорта Казанская 560 при выращивании на свету различного качества в условиях засоления среды и действия солей тяжелых металлов.
Объектом исследования служили корни семидневных проростков озимой пшеницы ( Triticum aestivum L.) сорта Казанская 560.
Семена перед посевом стерилизовали 2%-ным перманганатом калия (15 мин), промывали дистиллированной водой, проращивали в кюветах на влажной фильтровальной бумаге. Растения выращивали в кюветах на водопроводной воде (контроль). В качестве фактора засоления использовали NaCl в концентрации 150 мМ, в качестве действия тяжелых металлов – CuSO 4 в концентрации 1 мМ и CdSO 4 в концентрации 1 мМ (опыт). Водопроводную воду заменяли на растворы солей и тяжелых металлов на 5-е сут.
Растения проращивали в растильне, разделенной на три светоизолированных блока: 1-й – белый свет (источник освещения – люминесцентные лампы ЛДС-40), 2-й – синий свет (источник – люминесцентные лампы ЛГ-40, область пропускания 420-460 нм), 3-й – красный свет (источник – люминесцентные лампы ЛК-40, область пропускания 620-640 нм) при 12-часовом световом периоде.
Для экстрагирования растворимых лектинов навеску растительного материала (0,5 г корней) гомогенизировали в 5 мл 0,05н. HCl при соотношении навеска:среда 1:10, постоянно перемешивая в течение одного часа при t=40C. Известно, что лектины экстрагируются больше в кислой среде (0,05н. HCl), чем в нейтральной (0,01М фосфатнобуферная смесь (ФБС) [6]. Затем экстракт центрифугировали при 8000 об/мин в течение 10 мин и промывали половинным от исходного объемом соляной кислоты (2,5 мл). Надосадочные жидкости собирали, нейтрализовали 10%-ным раствором КОН в соотношении щелочь:экстракт 1:2, супернатант повторно центрифугировали и использовали для определения лектиновой активности. Осадок использовали для выделения лектинов клеточной стенки. Остаток после экстрагирования растворимых лектинов гомогенизировали в среде, содержащей 5 мМ ацетатный буфер (рН 4,6), 0,4 М сахарозы и центрифугировали при 8000 об/мин в течение 10 мин. Надосадочные жидкости сливали, а осадок последовательно промывали в средах, содержащих 5 мМ ацетатного буфера (рН 4,6), 0,6 М сахарозы/ 1М сахарозы и центрифугировали при 8000 об/мин в течение 10 мин. Далее осадок промывали на нейлоновой ткани большим количеством 5 мМ ацетатного буфера (рН 4,6). Из оставшегося на ткани твердого осадка, содержащего клеточные стенки, лектины экстрагировали исходной средой с добавлением (в конечной концентрации) 0,05% тритона Х-100 и 0,9% NaCl. Так как тритон Х-100 состоит из неионных детергентов на основе полиэтиленгликоля, которые растворяют мембрану и защищают компоненты мембраны алифатическими или ароматическими цепями, то он способствует вытеснению прочно связанного белка. Настаивали 3 ч при 1=200С и постоянном перемешивании, затем центрифугировали 10 мин при 8000 об/мин. Осадок отбрасывали, а супернатант (фракция, обогащенная лектинами клеточных стенок) использовали для определения активности лектинов. Белок определяли по методу Лоури.
Для идентификации лектиновой активности исследовали агглютинацию трипсинизированных эритроцитов человека I группы крови. Лектиновую активность определяли методом микротитрования. Реакцию проводили в специальных планшетах для иммунологических реакций с U-образными лунками. Для этого готовили серию последовательных двукратных разведений белкового эктракта лектинов (10 разведений) по 0,05 мл, в каждую лунку добавляли 0,05 мл 2%-ной суспензии эритроцитов и смесь оставляли при комнатной температуре на 60-120 мин.
Учитывали агглютинацию эритроцитов по форме осадка. Титр лектина характеризовался максимальным разведением или минимальной концентрацией его в растворе, при которой наблюдалась агглютинация эритроцитов. Активность лектинов выражали величинах, обратных минимальной концентрации белка, при которой отмечали реакцию гемагглютинации (мкг/мл)-1.
Все эксперименты проводились в трехкратной биологической повторности. Повторность в пределах одного опыта трехкратная.
Статистическую обработку экспериментальных данных проводили путем определения средних арифметических и их стандартных ошибок.
Засоление относится к числу распространенных неблагоприятных условий окружающей среды, приводящих к снижению интенсивности интегральных физиологических процессов в растениях [2, 11, 25]. Безусловно, растительные организмы вырабатывают в ответ на это воздействие разнообразные защитные механизмы, среди которых важное место отводят сдвигу в белковом спектре: на фоне снижения тотального синтеза белка наблюдается новообразование ряда пептидов [23], а также усиление синтеза некоторых белков, характерных для нормы [13, 16, 20, 21, 23] было показано, что воздействие 2%-го NaCl вызывало уже через 2 ч двукратное накопление АЗП в корнях проростков пшеницы и к 7 ч наблюдалось 5-кратное возрастание содержания этого белка. Это четко демонстрирует факт довольно значительного изменения в содержании лектина при солевом стрессе, что свидетельствует о вовлечении его в формирование быстрых АБК-регулируемых ответных реакций проростков пшеницы на это воздействие [13].
Предполагают, что засоление среды вызывает быстрое накопление АБК, которое может приводить к существенному сдвигу в белковом спектре клеток растений, в частности балансе [1, 23, 24].
Отмечают, что количественные изменения лектина в вегетирующих растениях пшеницы при стрессовых воздействиях могут контролироваться не только на транскрипционном, но и посттранскрипционном и посттрансляционном уровнях. Такая ситуация вполне возможна, поскольку лектин пшеницы является присущим для растений на протяжении всего онтогенеза и, скорее всего, определенный резерв лектиновых мРНК и предшественников АЗП всегда присутствует в клетках. Спектральный состав света в условиях засоления увеличивал активность как растворимых, так и связанных с клеточной стенкой лектинов (рис. 1, 2).
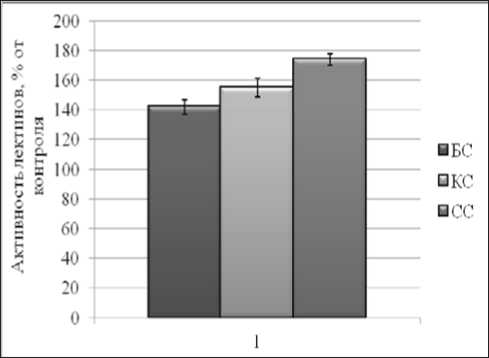
Рис. 1. Влияние 150 мМ NaCl [1] на активность растворимых лектинов в корнях проростков озимой пшеницы Казанская 560, выращенных на разнокачественном свету
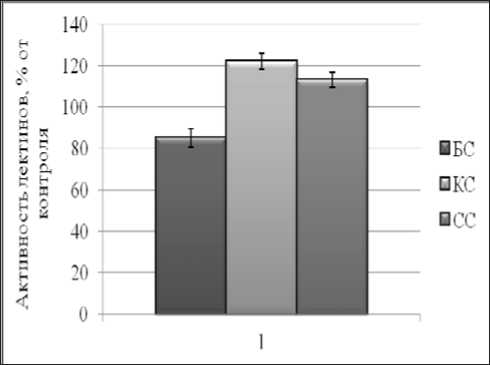
Рис. 2. Влияние 150 мМ NaCl [1] на активность лектинов клеточной стенки в корнях проростков озимой пшеницы Казанская 560, выращенных на разнокачественном свету
На активность растворимых лектинов в условиях засоления наиболее сильный эффект оказывал синий свет: наблюдалось увеличение до 174%. Такое же действие на лектины клеточной стенки оказывал красный свет – активность повышалась и составила 122% от контрольного уровня.
Возможно, что увеличение лектиновой активности под действием различного спектрального состава в условиях засоления происходит как за счет регуляции накопления лектина (например АЗП), так и, в большей степени, за счет ускорения созревания его предшественников, т.е. на посттрансляционном уровне.
Известно, что в процессе эволюции растения выработали целый ряд приспособительных механизмов, защищающих клеточный метаболизм от присутствующих в окружающей среде тяжелых металлов. К ним относятся: уменьшение поступления металлов в клетку, активация систем их выведения, изоляция в метаболически малоактивных соединениях и компартментах, изменения метаболизма, направленные на снижение токсического действия металлов или ликвидацию его последствий [12].
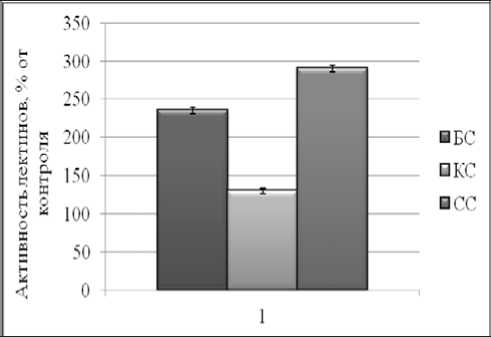
Рис. 3. Влияние 1 мМ CuSO4 [1] на активность растворимых лектинов в корнях проростков озимой пшеницы Казанская 560, выращенных на разнокачественном свету
Первым барьером на пути поступления ионов тяжелых металлов являются клеточные стенки корня. Данные многих авторов свидетельствуют о значительном накоплении тяжелых металлов именно в клеточной стенке [7]. При этом прочность связи различных ионов металлов с компонентами клеточной оболочки неодинакова. Она коррелирует с величиной констант стабильности (log K) комплексов металлов с карбоксильными группами углеводов. Для Cd равен 4 [22].
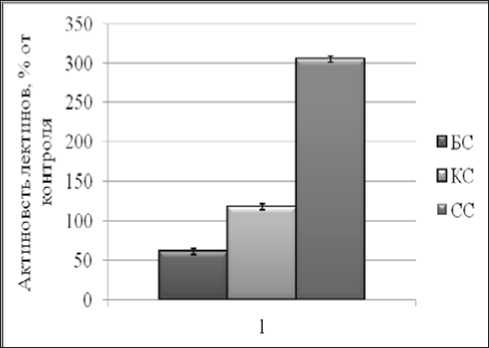
Рис. 4 . Влияние 1 мМ CuSO4 [1] на активность лектинов клеточной стенки в корнях проростков озимой пшеницы Казанская 560, выращенных на разнокачественном свету
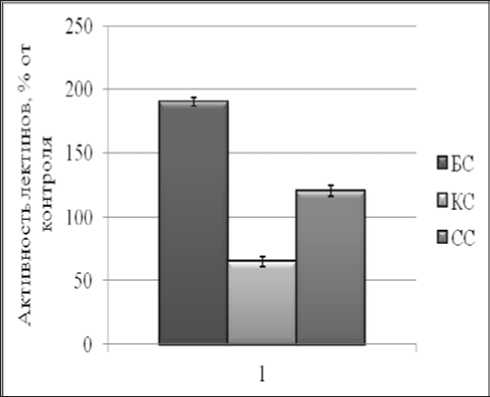
Рис. 5. Влияние 1 мМ CdSO 4 на активность растворимых лектинов в корнях проростков озимой пшеницы Казанская 560, выращенных на разнокачественном свету
Сродство других тяжелых металлов к полига-лактуроновой кислоте уменьшается в ряду: Pb > Cr > Cu > Ca > Zn. Сравнение констант стабильности показывает, что тяжелые металлы могут успешно конкурировать с кальцием за места связывания в «замковых зонах» пектинов. Таким образом, вероятно, что тяжелые металлы способны прочно связываться с SH-группами лектиновых белков и карбоксильными группами углеводных компонентов лектинов. Образование таких связей может нарушать конформационную структуру лектинов кле- точной стенки, а также их физико-химические свойства и углеводную специфичность, результатом этих событий будет ингибирование активности лектиновых белков. Кроме того, возможно, что высокая концентрация тяжелых металлов в клеточной стенке и свободном пространстве приводит к изменению углеводного состава клетки, в результате чего может накапливаться ряд углеводов, являющихся или же, наоборот, не являющихся специфическими гаптенами для исследуемых лектинов.
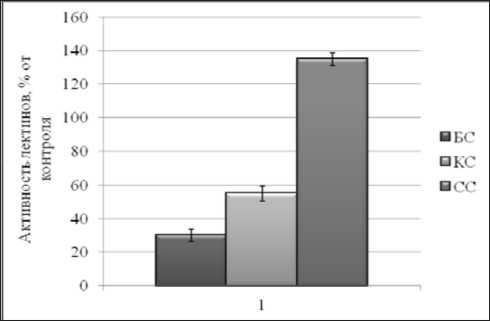
Рис. 6. Влияние 1 мМ CdSO 4 на активность лектинов клеточной стенки в корнях проростков озимой пшеницы Казанская 560, выращенных на разнокачественном свету
В таком случае увеличение или уменьшение связывания лектинов со специфичными для них сахарами также может изменять их активность.
Выращивание растений озимой пшеницы на среде с солями тяжелых металлов вызывало значительное возрастание активности растворимых лектинов, под которыми мы подразумеваем АЗП (Рис. 3,5). Вероятно, увеличение активности растворимых лектинов является транзитным и растет по мере развития повреждения растений от тяжелых металлов. В тоже время, известно, что АЗП является стрессовым белком, и увеличение его активности может свидетельствовать о вовлечении АЗП в защитные реакции к действию тяжелых металлов.
Изменение лектиновой активности, может быть следствием как трансляционных, так и посттрансляционных событий. Известно, что в ходе своего синтеза АЗП претерпевает сложный посттрансляционный процессинг, этапы которого были прослежены с использованием полученных к предшественникам АЗП антител, не преципитирующих зрелый белок [22]. В связи с этим, увеличение содержания лектинов может происходить за счет ранее синтезированных предшественников.
Попадая в клетку растения, часть ионов металлов связывается специфическими белками, названными металлотионеинами. Металлотионеины представляют собой низкомолекулярные белки (810 кД), в составе которых около 30% приходится на серосодержащую аминокислоту цистеин [19]. Механизм их действия заключается в связывании ионов тяжелых металлов сульфгидрильными группа- ми цистеина. Согласно сведениям литературы, в ответ на повышение концентрации тяжелых металлов в окружающей среде в растениях может синтезироваться довольно большое количество металло-тионеинов, что позволяет связывать до 60-100% металла [10]. Мы полагаем, что АЗП может участвовать в связывании тяжелых металлов и выведение их из клеток корней, что способствует уменьшению их концентрации на наружной поверхности клеток. В пользу этого предположения выступает способность АЗП в больших количествах выделяться в корневой чехлик/окружающую среду.
Под влиянием спектрального состава света увеличивалась активность лектинов корней проростков пшеницы, выращенных на СС, в условиях действия ТМ. Наибольшее увеличение в активности лектинов наблюдали под действием CuSO 4 (в 3 раза). Красный свет практически не влиял на активность лектинов при действии меди и уменьшал активность лектинов под воздействием кадмия. Возможно, что изменение активности лектинов под влиянием синего света обусловлено в первую очередь синтезом новых белков и их предшественников, обладающих агглютинирующей способностью, но не способных к прочному связыванию ТМ с SH-группами белков. В тоже время повышение активности лектинов может свидетельствовать об увеличении устойчивости растений к различным абиотическим стрессам [5]. Исходя из этого можно предположить, что синий свет положительно влиял на устойчивость проростков пшеницы при действии ионов меди и кадмия.
-
1. Антонюк Л.П., Игнатов В.В. О роли агглютинина зародыша пшеницы в растительно-бактериальном взаимодействии: гипотеза и экспериментальные данные в ее поддержку // Физиол. раст. 2001. Т. 48. № 3. С. 427-433.
-
2. Блехман Г.И. Синтез белка в условиях стресса // Успехи совр. биол. 1987. Т. 103. С. 340-353.
-
3. Креславский В.Д., Христин Н.И., Шабнова Н.И. ,Любимов В.Ю . Предоблучение отдельных листьев шпината красным светом повышает устойчивость фотосинтетического аппарата к УФ-радиации // Физиол. раст. 2012. Т. 59. № 6. С. 723-729.
-
4. Левчук А.Н., Войтович Е.Н., Лях В.А . // Физиол. раст. 2013. Т. 60. № 1. С. 75-81.
-
5. Луцик М.Д., Панасюк Е.Н., Луцик А.Д. Лектины. Львов: Высш. шк. Изд-во при Львов. ун-те, 1981. 156 с.
-
6. Серегин И.В., Иванов В.Б. Является ли барьерная функ- ция эндодермы единственной причиной устойчивости
ветвления корней к солям тяжелых металлов? // Физиол. раст. 1997. Т. 44. № 6. С. 922-925.
-
7. Сысоева М.И., Марковская Е.Ф., Шерудило Е.Г. Роль фитохрома в формировании холодоустойчивости растений огурца на свету и в темноте // Физиол. раст. 2013. Т. 60. № 3. С.386-392.
-
8. Тимофеева О.А. Лектины как активные компоненты адаптивных реакций озимой пшеницы к неблагоприятным условиям среды: Автореф. дис. … д-ра биол. наук. Уфа, 2009. 38 с.
-
9. Титов А.Ф., Таланова В.В., Казнина Н.М., Лайдинен Г.Ф. Устойчивость растений к тяжелым металлам / Под ред. Н.Н. Немова. Петрозаводск: КарНЦ РАН, 2007. 172 с.
-
10. Удовенко Г.В. Механизмы адаптации растений к стрессам // Физиол. и биохимия культ. раст. 1979. Т. 11. С. 99107.
-
11. Чиркова Т.В . Физиологические основы устойчивости растений. СПб.: Изд-во СПбГУ, 2002. 244 с.
-
12. Шакирова Ф.М . Неспецифическая устойчивость растений к стрессовым факторам и ее регуляция. Уфа: Гилем, 2001. 159 с.
-
13. Шакирова Ф.М . Современные представления о предполагаемых функциях лектинов растений // Журн. общ. биол. 2007. Т. 68. № 2. С. 98-114.
-
14. Шакирова Ф.М., Безрукова М.В., Хайруллин Р.М . Стимуляция увеличения уровня лектина в проростках пшеницы под влиянием солевого стресса // Изв. РАН Сер. биол. 1993. №. 1. С. 143-145.
-
15. Amitai-Zeigerson H., Scolnik C.A., Bar-Zvi D. Tomato Asr1 mRNA and protein are transiently expressed following salt stress, osmotic stress and abscisic acid // Plant Sci. 1995. V. 110. P. 205-213.
-
16. Cammue B.P.A., Broecaert W.F., Kellens T.S. Stress-indused accumulation of wheat germ agglutinin and abscisic acid in roots of wheat seedlings // Plant Physiol. 1989. V. 91. P. 1432-1435.
-
17. Foreman J., Johansson H., Hornitschek P., Josse E.M.,Fankhauser C., Halliday K.J. Light receptor action is
critical for maintaiming plant biomass at warm ambient temperatures // The Plant Journ. 2011. 65 (3). P. 444-452.
-
18. Gibson D.M., Sharon S.I., Hous K.J. A comparision of soy-been agglutinin in cultivars resistant and susceptible to Phy-tophtora megasperma var sojae // Plant Physiol. 1982. V. 70. P. 560-566.
-
19. Hurkman W., Tanaka C.K. The effects of salt on the pattern of protein synthesis in barley roots // Plant Physiol. 1987. V. 83. P. 517-524.
-
20. Hurkman W., Tanaka C.K . Effect of salt stress on germin gene expression in barley roots // Plant Physiol. 1996. V. 110. P. 971-977.
-
21. Mansfield M.A., Peumans W.J., Raikhel N.V . Wheat germ agglutinin is synthesized as a glycosylated precursor // Planta. 1988. V. 173. P. 482-489.
-
22. Ramagopal S. Salinity stress induced tissuespecific proteins in barley seedlings // Plant Physiol. 1987. V. 84. P. 324-331.
-
23. Singh P.S., Bhaglal P., Bhullar S.S. Wheat germ agglutinin (WGA) gene expression and ABA accumulation in the developing embryos of wheat ( Triticum aestivum ) in response to drought // Plant Growth Reg. 2000. Vol. 30. P. 145-150.
-
24. Sugino M., Hibino T., Tanako Y. et al . Overexpression of DnaK from a halotolerant cyanobacte-rium Aphanothece ha-lophytica acquires resistance to salt stress in transgenic tobacco plants // Plant Sci. 1999. V. 146. P. 81-88.
LECTIN ACTIVITY PROSTKI WINTER WHEAT GROWN ON DIFFERINT QUAILTY PART IN THE LIGHT OF SALINITY AND HEAVY METALS
Список литературы Активность лектинов проростков озимой пшеницы, выращеных на разнокачественом составе света в условиях засоления и действия тяжелых металлов
- Антонюк Л.П., Игнатов В.В. О роли агглютинина зародыша пшеницы в растительно-бактериальном взаимодействии: гипотеза и экспериментальные данные в ее поддержку//Физиол. раст. 2001. Т. 48. № 3. С. 427-433.
- Блехман Г.И. Синтез белка в условиях стресса//Успехи совр. биол. 1987. Т. 103. С. 340-353.
- Креславский В.Д., Христин Н.И., Шабнова Н.И.,Любимов В.Ю. Предоблучение отдельных листьев шпината красным светом повышает устойчивость фотосинтетического аппарата к УФ-радиации//Физиол. раст. 2012. Т. 59. № 6. С. 723-729.
- Левчук А.Н., Войтович Е.Н., Лях В.А.//Физиол. раст. 2013. Т. 60. № 1. С. 75-81.
- Луцик М.Д., Панасюк Е.Н., Луцик А.Д. Лектины. Львов: Высш. шк. Изд-во при Львов. ун-те, 1981. 156 с.
- Серегин И.В., Иванов В.Б. Является ли барьерная функция эндодермы единственной причиной устойчивости ветвления корней к солям тяжелых металлов?//Физиол. раст. 1997. Т. 44. № 6. С. 922-925.
- Сысоева М.И., Марковская Е.Ф., Шерудило Е.Г. Роль фитохрома в формировании холодоустойчивости растений огурца на свету и в темноте//Физиол. раст. 2013. Т. 60. № 3. С.386-392.
- Тимофеева О.А. Лектины как активные компоненты адаптивных реакций озимой пшеницы к неблагоприятным условиям среды: Автореф. дис. … д-ра биол. наук. Уфа, 2009. 38 с.
- Титов А.Ф., Таланова В.В., Казнина Н.М., Лайдинен Г.Ф. Устойчивость растений к тяжелым металлам/Под ред. Н.Н. Немова. Петрозаводск: КарНЦ РАН, 2007. 172 с.
- Удовенко Г.В. Механизмы адаптации растений к стрессам//Физиол. и биохимия культ. раст. 1979. Т. 11. С. 99-107.
- Чиркова Т.В. Физиологические основы устойчивости растений. СПб.: Изд-во СПбГУ, 2002. 244 с.
- Шакирова Ф.М. Неспецифическая устойчивость растений к стрессовым факторам и ее регуляция. Уфа: Гилем, 2001. 159 с.
- Шакирова Ф.М. Современные представления о предполагаемых функциях лектинов растений//Журн. общ. биол. 2007. Т. 68. № 2. С. 98-114.
- Шакирова Ф.М., Безрукова М.В., Хайруллин Р.М. Стимуляция увеличения уровня лектина в проростках пшеницы под влиянием солевого стресса//Изв. РАН Сер. биол. 1993. №. 1. С. 143-145.
- Amitai-Zeigerson H., Scolnik C.A., Bar-Zvi D. Tomato Asr1 mRNA and protein are transiently expressed following salt stress, osmotic stress and abscisic acid//Plant Sci. 1995. V. 110. P. 205-213.
- Cammue B.P.A., Broecaert W.F., Kellens T.S. Stressindused accumulation of wheat germ agglutinin and abscisic acid in roots of wheat seedlings//Plant Physiol. 1989. V. 91. P. 1432-1435.
- Foreman J., Johansson H., Hornitschek P., Josse E.M.,Fankhauser C., Halliday K.J. Light receptor action is critical for maintaiming plant biomass at warm ambient temperatures//The Plant Journ. 2011. 65 (3). P. 444-452.
- Gibson D.M., Sharon S.I., Hous K.J. A comparision of soybeen agglutinin in cultivars resistant and susceptible to Phytophtora megasperma var sojae//Plant Physiol. 1982. V. 70. P. 560-566.
- Hurkman W., Tanaka C.K. The effects of salt on the pattern of protein synthesis in barley roots//Plant Physiol. 1987. V. 83. P. 517-524.
- Hurkman W., Tanaka C.K. Effect of salt stress on germin gene expression in barley roots//Plant Physiol. 1996. V. 110. P. 971-977.
- Mansfield M.A., Peumans W.J., Raikhel N.V. Wheat germ agglutinin is synthesized as a glycosylated precursor//Plan-ta. 1988. V. 173. P. 482-489.
- Ramagopal S. Salinity stress induced tissuespecific proteins in barley seedlings//Plant Physiol. 1987. V. 84. P. 324-331.
- Singh P.S., Bhaglal P., Bhullar S.S. Wheat germ agglutinin (WGA) gene expression and ABA accumulation in the developing embryos of wheat (Triticum aestivum) in response to drought//Plant Growth Reg. 2000. Vol. 30. P. 145-150.
- Sugino M., Hibino T., Tanako Y. et al. Overexpression of DnaK from a halotolerant cyanobacterium Aphanothece halophytica acquires resistance to salt stress in transgenic tobacco plants//Plant Sci. 1999. V. 146. P. 81-88.


