Активность лизосомальных гидролаз у молоди кумжи (Salmo trutta L.) из приполярной реки Ольховка
Автор: Немова Нина Николаевна, Крупнова Марина Юрьевна, Вдовиченко Елизавета Андреевна, Ефремов Денис Александрович, Веселов Алексей Елпидифорович
Журнал: Ученые записки Петрозаводского государственного университета @uchzap-petrsu
Рубрика: Биология
Статья в выпуске: 4 (157), 2016 года.
Бесплатный доступ
Исследовали динамику активности лизосомальных ферментов (катепсинов В и D, ДНКазы и РНКазы) у молоди кумжи Salmo trutta L. возраста 0+, 1+, 2+, 3+ и 4+, отловленной в летний сезон (июнь 2015 года) в р. Ольховка, расположенной на Терском берегу Кольского полуострова (бассейн Белого моря). Показано, что динамика удельной активности лизосомальных гидролаз у молоди кумжи в речной период жизни коррелирует с интенсивностью роста молоди на разных этапах ее развития. Сравнительно высокие значения исследуемых ферментов обнаружены у сеголеток (личинок возраста 0+). У мальков кумжи возрастных групп 1+, 2+, 3+ и 4+ более высокие значения активности лизосомальных гидролаз (за исключением ДНКазы) обнаружены в печени в сравнении со скелетными мышцами. Эти результаты отражают участие лизосомальных ферментов нуклеинового и тесно связанного с ним белкового метаболизма в процессах роста и раннего развития лососевых рыб, особенно на этапе их выхода из нерестовых гнезд (0+).
Молодь кумжи, раннее развитие, лизосомальные протеиназы, лизосомальные нуклеазы
Короткий адрес: https://sciup.org/14751068
IDR: 14751068 | УДК: 577.152.34.032:597.553.2_113.32
Текст научной статьи Активность лизосомальных гидролаз у молоди кумжи (Salmo trutta L.) из приполярной реки Ольховка
Кумжа (Salmo trutta L., сем. Salmonidae) – пластичный вид со сложной популяционно-генетической структурой, представленный проходной, озерной и ручьевой формами, обитает в водоемах северного полушария (бассейн Атлантического океана) и является одним из ценнейших промысловых видов лососевых рыб [14]. Условия жизни в речной период чрезвычайно важны для пополнения популяции кумжи. Период раннего онтогенеза рыб характеризуется существенными морфологическими и функциональными преобразованиями, сопровождающи- мися кардинальными перестройками клеточного метаболизма [8]. Процессы роста и развития обеспечиваются деятельностью целого комплекса механизмов, среди которых особую роль играют биохимические механизмы обмена белковых и нуклеиновых компонентов клетки [22]. Лизосомы, содержащие комплекс гидролитических ферментов, способных расщеплять все органические компоненты клетки, выполняют важную реконструктивную и защитную функцию, обеспечивая метаболические превращения в организме, в том числе в периоды раннего развития и интенсивного роста [1], [3], [10]. Поэтому представлялось
интересным провести исследование динамики изменения активности лизосомальных ферментов в процессе роста молоди кумжи начиная с этапа выхода личинок из нерестовых гнезд и до возраста 4+.
В настоящей статье приводятся данные о динамике активности лизосомальных нуклеаз (РНКазы и ДНКазы) и протеиназ (катепсинов В и D) у кумжи разных возрастных групп (0+, 1+, 2+, 3+ и 4+), отловленной в одном биотопе – приполярной реке Ольховка (бассейн Белого моря).
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
В работе были использованы химические реагенты и субстраты протеиназ и нуклеаз, произведенные «Sigma-Aldrich» (США); приборы ЦКП НО ИБ КарНЦ РАН: гомогенизатор Tissue Lyser LT (Qiagen, Германия), центрифуга Allegra 64R (Beckman Coulter, США), термостатирующая водяная баня UT-4334 (Россия), спектрофотометр СФ-2000 (ЗАО «ОКБ-Спектр», Россия).
Материал
Отлов молоди кумжи разных возрастов проводили на пороговых и перекатных участках реки Ольховка в середине июня (температура воды 11,5 °С) с помощью аппарата электролова Fa-2 («Фирма», Норвегия). Состав и объем кормовой базы для молоди кумжи, ведущей в речных условиях оседлый образ жизни на индивидуальных микростациях на порогах и перекатах, идентичен и содержит различные виды воздушных и наземных насекомых, а также водных организмов – личинок ручейников, нимф поденок и веснянок [14]. Основной прирост молоди происходит летом, при температуре воды 10–17 °С. После вылова молодь выдерживали около суток в садках, затем помещали в жидкий азот и транспортировали в лабораторию для дальнейших биохимических исследований.
Количественное содержание растворимого белка в тканях (мг/г ткани) определяли по методу М. Бредфорд [19], используя в качестве стандарта бычий сывороточный альбумин.
Определение активности лизосомальных ферментов
Активность лизосомальных протеиназ. Цистеиновая протеиназа, катепсин В (КФ 3.4.22.1), и аспартатная, катепсин D (КФ 3.4.23.5), – основные протеиназы лизосом [18]. После гомогенизации образцов в соотношении 1 : 10 (вес/об.) в растворе 0,25 М сахарозы с добавлением 0,01 % Тритона Х-100 (Merck) (1200 об./мин, 60 с) и их центрифугирования (10 000 g, 30 мин), в супернатанте определяли активность катепсина В по расщеплению 0,065 M раствора этилового эфира гидрохлорида N-бензоил L-аргинина в 0,1 M ацетатном буфере (pH 5,0) [24] и катепсина D по гидролизу 1 %-го бычьего гемоглобина в 0,1 М ацетатном буфере (рН 3,6) согласно модифицированному методу Ансона [16]. Активность катепсинов B и D (ед. акт.) выражали в единицах изменения оптического поглощения при Е525 и Е280 соответственно, на 1 мг белка за 1 ч инкубации (37 °C).
Активность лизосомальных нуклеаз. Определение активности РНКазы (КФ 3.1.4.23) и ДНКазы (КФ 3.1.4.6) проводили по методам А. П. Левицкого с соавт. [4] и А. А. Покровского с соавт. [9]. В качестве субстратов использовали 0,1 % растворы РНК и ДНК в 0,2 М ацетатном буфере (pH 5,2 и 5,0 соответственно). Количество низкомолекулярных продуктов гидролиза нуклеиновых кислот определяли спектрофотометрически при 260 нм после осаждения нерасщепленных нуклеиновых кислот и их крупных фрагментов 0,5 М раствором хлорной кислоты или 0,25%-ным уранилацетатом в 0,5 М хлорной кислоте (для ДНК и РНК соответственно). Активность ферментов выражали в условных единицах (ед. акт.) изменения оптического поглощения при 260 нм в расчете на 1 мг белка за 1 ч инкубации (30 °C).
Полученные данные обработаны статистически с помощью Microsoft Office Excel 2007. Результаты представлены в виде средних и их ошибок (М ± m). Достоверность различий оценивалась по непараметрическому критерию U Вилкоксо-на – Манна – Уитни при уровне значимости р ≤ 0,05 [2].
Экспериментальные работы выполнены с использованием оборудования ЦКП Института биологии КарНЦ РАН.
РЕЗУЛЬТАТЫ
В табл. 1 приведены данные, свидетельствующие о том, что в течение первого года жизни
Таблица 1
Размерно-весовые характеристики молоди кумжи Salmo trutta L . , n = 5
|
Показатели |
Возраст |
||||
|
0+ |
1+ |
2+ |
3+ |
4+ |
|
|
Длина тела, см |
2,6 ± 0,10 |
5,4 ± 0,3 |
9,1 ± 0,4 |
13,3 ± 0,6 |
16,5 ± 0,2 |
|
Масса тела, г |
0,11 ± 0,1 |
1,5 ± 0,1 |
7,28 ± 0,6 |
22,56 ± 0,4 |
46,4 ± 0,5 |
|
n |
6 |
5 |
5 |
5 |
5 |
Таблица 2
Активность лизосомальных гидролаз (катепсинов и нуклеаз) у молоди кумжи разных возрастов; n = 5
|
Орган |
Возраст |
Активность ферментов, ед. акт. |
|||
|
Катепсин B |
Катепсин D |
Кислая РНКаза |
Кислая ДНКаза |
||
|
Личинка целиком |
0+ |
1,80 ± 0,10 |
2,00 ± 0,15 |
0,46 ± 0,06 |
0,16 ± 0,05 |
|
Печень |
1+ |
0,60 ± 0,0 |
0,30 ± 0,0 |
0,31 ± 0,00 |
0,07 ± 0,00 |
|
2+ |
0,50 ± 0,10 |
0,14 ± 0,03 |
0,20 ± 0,02 |
0,07 ± 0,02 |
|
|
3+ |
0,50 ± 0,02 |
0,25 ± 0,04 |
0,18 ± 0,01 |
0,07 ± 0,02 |
|
|
4+ |
0,55 ± 0,02 |
0,20 ± 0,06 |
0,14 ± 0,01 |
0,05 ± 0,00 |
|
|
Мышцы |
1+ |
0,47 ± 0,06 |
0,07 ± 0,01 |
0,17 ± 0,02 |
0,07 ± 0,02 |
|
2+ |
0,37 ± 0,06 |
0,04 ± 0,0 |
0,14 ± 0,03 |
0,07 ± 0,03 |
|
|
3+ |
0,33 ± 0,08 |
0,02 ± 0,0 |
0,11 ± 0,03 |
0,06 ± 0,01 |
|
|
4+ |
0,50 ± 0,07 |
0,003 ± 0,0 |
0,11 ± 0,01 |
0,05 ± 0,00 |
|
(от 0+ до 1+) масса тела молоди кумжи возрастает более чем в 10 раз. Затем масса исследуемой молоди увеличивается меньшими темпами: в возрасте 2+, 3+ и 4+ она выше по сравнению с сеголетками в 5, 3 и 2 раза соответственно. Длина молоди кумжи от стадии 0+ до 4+ увеличивается линейно примерно в 8 раз – от 2,6 до 16,5 см.
Результаты изучения динамики активности исследуемых лизосомальных гидролаз (катепсинов и нуклеаз) у молоди кумжи различных возрастов представлены в табл. 2.
Максимальная активность исследуемых ферментов обнаружена у молоди кумжи возраста 0+. В данной группе активность ферментов определяли в целом организме личинки, поскольку ее вес составлял всего 0,11 г (табл. 1), что не давало возможности препарировать ее органы. На последующих стадиях роста и развития молоди активность ферментов определяли в печени и скелетных мышцах, которые, как известно, составляют до 70 % веса тела личинки кумжи. Активность катепсинов В и D в печени и мышцах молоди кумжи по мере роста и развития от стадии 1+ до стадии 4+ изменялась незначительно с тенденцией к снижению и составляла от таковой на стадии 0+ (сразу после выхода из нерестовых гнезд) примерно 25 % для катепсина В, 2 и 11 % в печени и мышцах соответственно для катепсина D. Такие же возрастные тенденции были обнаружены в изменении активности лизосомальных нуклеаз: активность РНКазы и ДНКазы снижалась приблизительно на 43 и 28 % в печени и на 43 и 38 % в мышцах соответственно по отношению к таковой у личинок возраста 0+. При этом значения ДНКазной активности у молоди кумжи всех исследуемых возрастов были примерно втрое ниже РНКазной. В печени молоди всех возрастных групп была выявлена сравнительно более высокая активность изученных гидролаз, чем в мышцах. Эти изменения активности лизосомальных ферментов сопровождались увеличением содержания растворимого белка по мере роста и развития рыб (рисунок).
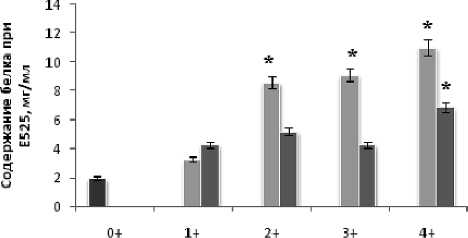
личинка целиком "печень "мышцы
Содержание растворимого белка у молоди кумжи разных возрастов (0+, 1+, 2+, 3+, 4+), n = 5
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Показанное увеличение массы тела кумжи по мере развития от сеголеток до пестряток и смолтов (2+…5+) отражает интенсивность роста молоди, напрямую связанную с накоплением костной и мышечной тканей, причем последняя играет особенно важную роль в ростовых процессах у рыб [20]. В данном исследовании показано, что наиболее значительный прирост массы тела наблюдается на первом году жизни молоди. Анализ данных показал, что темп роста молоди кумжи в данном регионе значительно выше, чем молоди атлантического лосося. Например, сеголетки рыб, выловленные в одни и те же сроки (сентябрь 2004 года) из близко расположенных водоемов, значительно различались по длине и массе. Длина АВ сеголетков кумжи из ручья Ольховка на 25 %, а вес на 133 % превышали аналогичные показатели сеголетков лосося из р. Ин- деры. Сходная картина наблюдалась и для более старших возрастных групп лососевых рыб. Так, пестрятки кумжи (1+) из ручья Собачий были больше по длине и массе (на 49 и 190 % соответственно) пестряток лосося из близко расположенного ручья Пятка. Ранее было показано [15], что в возрасте 2+ у молоди кумжи показатели длины и массы также выше, чем у лосося (на 58 и 338 % соответственно).
Процесс роста – преобразования пищевых веществ и энергии – имеет у рыб свои особенности, связанные с его недетерминированностью, в основе которой лежит преобладание синтетических процессов над катаболическими на протяжении всего жизненного цикла [5], [21], [23], [25]. Интенсивность белковой деградации служит регуляторным фактором недетерминированного роста рыб, свойственного большинству представителей класса Костистых рыб (Teleostei), включая лососевых. Синтезированные белки используются не только для построения структур и тканей молоди рыб, но и выполняют каталитическую и регуляторную функции в организме. Уровень активности основных лизосомальных протеиназ рыб – катепсинов В и D – у сеголеток (0+) кумжи имеет сравнительно высокие значения, свидетельствующие о высокой интенсивности лизосомального протеолиза, связанной, скорее всего, с задачами обеспечения «строительными блоками» (аминокислотами и пептидами) биосинтетических процессов накопления белка, необходимого для последующих структурных преобразований растущей молоди в период, когда завершается эндогенное питание и начинается переход на смешанное питание (при повышении температуры воды выше 11 °С, июнь, 500 градусо-дней). Далее, по мере роста и развития молоди кумжи, активность катепсинов в исследуемых органах изменяется незначительно (вариабельность 15–20 %), оставаясь на более низком уровне по сравнению с таковой у личинок после выклева и выхода из нерестовых гнезд (возраста 0+). В печени молоди кумжи всех изученных возрастов активность лизосомальных протеиназ, особенно катепсина D (в 5 раз), выше, чем в мышцах, что связано, вероятнее всего, с более высокой метаболической и функциональной (прежде всего синтетической) активностью печени.
Кислые нуклеазы (РНКаза и ДНКаза), локализованные в лизосомах, участвуют в расщеплении межнуклеотидных фосфодиэфирных связей в молекулах нуклеиновых кислот, которые, как известно, отвечают за передачу и хранение наследственной информации, а также ее реализацию в процессе трансляции, то есть биосинтеза белка в организме [11], [12], [17], [26]. Кислые нуклеазы осуществляют деградацию выполнивших свои функции биополимеров, тем самым обеспечивая организм компонентами для синтеза новых нуклеиновых кислот, принимающих участие в биосинтезе необходимых на новом этапе белковых веществ. Максимальная активность нуклеаз, так же как и протеиназ, обнаружена у сеголеток (0+) кумжи после их выхода из нерестовых гнезд. Ранее для молоди лосося было показано, что наиболее активные метаболические изменения связаны именно с ростом личинок в первый год жизни [5], [6], [7], [8], [13]. Можно полагать, что изменения уровня активности лизосомальных протеиназ (катепсинов В и D) и нуклеаз (РНКазы и ДНКазы) у молоди кумжи связаны с различиями в соотношениях процессов синтеза и деградации на разных стадиях развития личинок. В ранний период развития у рыб, как уже указывалось выше, преобладают синтетические процессы. Продукты, образующиеся при действии лизосомальных гидролаз у сеголеток кумжи, используются для компенсации пластических и энергетических затрат растущего организма, необходимых для метаболической перестройки при переходе от одной стадии развития мальков к другой. Успешная трансформация парров кумжи ведет к формированию смолтов, способных к миграции в море для последующего нагула.
ЗАКЛЮЧЕНИЕ
Выявленная динамика активности лизосомальных гидролаз у молоди кумжи в речной период жизни свидетельствует о наличии корреляции между активностью исследуемых ферментов и возрастом рыб, что указывает на участие лизосомальных ферментов в перестройках нуклеинового и тесно связанного с ним белкового обмена, сопровождающих процессы роста и раннего развития лососевых рыб, особенно на этапе выхода личинок из нерестовых гнезд.
* Работа выполнена при финансовой поддержке Российского научного фонда, проект №14-24-00102 «Лососевые рыбы Северо-Запада России: эколого-биохимические механизмы раннего развития».
Список литературы Активность лизосомальных гидролаз у молоди кумжи (Salmo trutta L.) из приполярной реки Ольховка
- Высоцкая Р. У., Немова Н. Н. Лизосомы и лизосомальные ферменты рыб. М.: Наука, 2008. 284 с.
- Гублер Е. В., Генкин А. А. Применение критериев непараметрической статистики для оценки различий двух групп наблюдений в медико-биологических исследованиях. М.: Медицина, 1969. 29 с.
- Дин Р. Процессы распада в клетке. М.: Мир, 1980. 120 с.
- Левицкий А. П., Барабаш Р Д., Коновец В. М. Сезонные особенности активности рибонуклеазы и α-амилазы слюны и слюнных желез у крыс линии Вистар//Биохимическая эволюция. Л.: Наука, 1973. С. 192-195.
- Лысенко Л. А., Канцерова Н. П., Крупнова М. Ю., Веселов А. Е., Немова Н. Н. Внутриклеточная белковая деградация в процессе роста Атлантического лосося Salmo salar L.//Биоорганическая химия. 2015. Т. 41. № 6. С. 717-724.
- Немова Н. Н., Крупнова М. Ю., Ефремов Д. А., Веселов А. Е. Активность лизосомальных протеиназ (катепсинов B и D) в мышцах молоди (0+, 1+, 2+) атлантического лосося из р. Варзуга//Труды КарНЦ РАН. Сер. Экспериментальная биология. 2015. № 11. С. 85-92.
- Немова Н. Н., Нефедова З. А., Мурзина С. А., Веселов А. Е., Рипатти П. О., Павлов Д. С. Влияние экологических условий обитания на динамику жирных кислот у молоди Атлантического лосося (Salmo salar L.)//Экология. 2015. № 3. С. 1-6.
- Озернюк Н. Д. Онтогенетические температурные адаптации ферментов пойкилотермных животных//Успехи современной биологии. 2004. № 6. С. 534-541.
- Покровский А. А., Арчаков А. И. Методы разделения и ферментной идентификации субклеточных фракций//Современные методы в биохимии. М.: Медицина, 1968. С. 5-59.
- Покровский А. А., Тутельян В. А. Изменение ферментов лизосом при белковой недостаточности//Биохимия. 1968. Т. 33. № 4. С. 809-816.
- Покровский А. А., Тутельян В. А. Лизосомы. М.: Наука, 1976. 351 с.
- Спирин А. С. Биосинтез белков, мир РНК и происхождение жизни//Вестник Российской академии наук. 2001. Т. 71. № 4. С. 320-328.
- Чурова М. В., Мещерякова О. В., Веселов А. Е., Немова Н. Н. Активность ферментов энергетического и углеводного обмена и уровень некоторых молекулярно-генетических показателей у молоди лосося (Salmo salar L.), различающейся возрастом и массой//Онтогенез. 2015. Т. 46. № 5. С. 304-312.
- Шустов Ю. А., Веселов А. Е. Питание и рост молоди озерной кумжи (Salmo trutta L. morphalacustris) в водоемах национального парка «Паанаярви»//Труды Карельского научного центра РАН. Сер. Экспериментальная биология. 2007. № 11. С. 142-146.
- Шустов Ю. А., Барышев И. А., Белякова Е. Н. Особенности питания молоди атлантического лосося Salmo salar L. в субарктической реке Варзуга и ее малых притоках (Кольский полуостров)//Биология внутренних вод. 2012. № 3. С. 66-70.
- Barrett A. J., Heath M. Lysosomal enzymes//Dingle J. T. (ed.). Lysosomes. A laboratory handbook. Amsterdam, 1977. P. 19-27.
- Bashan A., Yonath A. Correlating ribosome function with high-resolution structures//Trends in Microbiology. 2008. Vol. 16. № 7. P. 326-335.
- Bohley P. Intracellular proteolysis//Hydrolytic enzymes. Biomedical division. 1987. P. 307-332.
- Bradford M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding//Analit. Biochem. 1976. Vol. 72. P. 248-254.
- Bureau D., Hua K., Cho C. Y. Effect of feeding level on growth and nutrient deposition in rainbow trout (Oncorhynchus mykiss Walbaum) growing from 150 to 600 g.//Aquac. Res. 2006. Vol. 37. P. 1090-1098.
- Hagen O., Vieira V. L. A., Solberg S., Johnston I. A. Myotube production in fast myotomal muscle is switched-off at shorter body lengths in male than female Atlantic halibut (Hippoglossus hippoglossus L.) resulting in a lower final fiber number//J. Fish Biol. 2008. Vol. 73. P. 139-152.
- Hochachka P. W., Somero G. N. Biochemical adaptation/mechanisms and process in physiological evolution. 2nd edition. New York: Oxford University Press, 2002. 466 p.
- Lepage S. E., Bruce A. E. Characterization and comparative expression of zebrafish calpain system genes during early development//Dev. Dyn. 2008. Vol. 237. P. 819-829.
- Matsuda K., Misaka E. Studies on cathepsins of rat liver lysosomes. I. Purification and multiple forms//J. Biochem. 1974. Vol. 76. № 3. P. 639-649.
- Overturf K., Gaylor T. G. Determination of relative protein degradation activity at different life stages in rainbow trout (Oncorhynchus mykiss)//Comp. Biochem. Physiol. 2009. Vol. 152B. P. 150-160.
- Pizzo E., Varcamonti M., Maro A. D., Zanfardino A., Giancola C., D’Alessio G. Ribonucleases with angiogenic and bactericidal activities from the Atlantic salmon//FEBS Journal. 2008. Vol. 275. P. 1283-1295.


