Активность натуральных клеток-киллеров в биологических жидкостях у больных колоректальным раком и раком яичников
Автор: Юнусова Наталья Валерьевна, Стахеева Марина Николаевна, Афанасьев Сергей Геннадьевич, Цыденова Анастасия Александровна, Фролова Алена Евгеньевна, Молчанов Сергей Валерьевич, Коломиец Лариса Александровна, Чердынцева Надежда Викторовна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 1 т.16, 2017 года.
Бесплатный доступ
Цель исследования - сравнить показатели функциональной активности натуральных клеток-киллеров в зависимости от наличия злокачественного процесса и его распространенности. Материал и методы. В исследование были включены 10 больных раком яичников IIIC стадии, 5 больных с доброкачественными опухолями (ДО) яичника, 15 больных колоректальным раком TNMстадии. Контрольную группу 2-40-20 составили 5 обследованных здоровых доноров. Для оценки количества и функциональной активности NK-клеток периферической крови и асцитической жидкости (АЖ) выполнена многоцветная проточная цитометрия на цитофлуориметре FACS Canto II. результаты. Наличие злокачественного новообразования сопровождалось статистически значимым снижением в периферической крови относительного количества активированных NK-клеток, секретирующих гранзим В (GB) (CD56+CD107a+GB+PF-), и увеличением доли дегранулированных NK-клеток (CD56+CD107a+GB-PF-) по сравнению с соответствующими показателями у здоровых лиц. При этом отличительной особенностью больных раком яичников были низкие показатели общего количества NK-клеток в периферической крови (p
Рак яичников, колоректальный рак, натуральные киллеры, периферическая кровь, функциональная активность, асцит
Короткий адрес: https://sciup.org/140254092
IDR: 140254092 | УДК: [616.345+618.11]-006.6-003.2+616.155.32+577.2 | DOI: 10.21294/1814-4861-2017-16-1-45-52
Текст научной статьи Активность натуральных клеток-киллеров в биологических жидкостях у больных колоректальным раком и раком яичников
В процессах злокачественного роста (инвазивный рост, лимфогенное метастазирование) важную роль отводят состоянию иммунной системы и особенно функциональной активности натуральных киллеров. Натуральные или естественные киллеры (natural killer cells, NK-клетки) представляют гетерогенную субпопуляцию лимфоцитов системы врожденного иммунитета. NK-клетки составляют около 15 % всех циркулирующих лимфоцитов, они также были найдены в печени, селезенке, перитоне -альной жидкости [1, 2]. Многими клиническими и экспериментальными исследованиями показано, что важным условием высокой эффективности противоопухолевого лечения является адекватное состояние иммунной системы организма, в том числе и уровень функциональной активности NK [3–5].
Для реализации своих функций NK используют различные механизмы, однако важное значение придают контактному цитолизу, путем которого NK-клетки убивают чувствительные к лизису клетки мишени. Этот эффект реализуется с участием цитотоксических гранул, содержащих гранзимы, перфорин, гранулизин, катепсины и ассоциированные с лизосомами мембранные протеины LAMP, причем поверхностная экспрессия LAMP-1 (CD107a) в настоящее время является общепризнанным маркером дегранулирующих натуральных киллеров [6, 7]. Значение поверхностной и внутриклеточной экспрессии в биологии NK-клеток в настоящее время изучается. Показано, что снижение экспрессии LAMP-1 существенно замедляет движение литических гранул к синаптической щели, а также приводит к снижению концентрации в них перфорина, но не гранзима B. Снижение уровня перфорина в литических гранулах в комбинации с нарушением их движения в LAMP-1-дефицитных клеточных линиях приводит к невозможности секреции гранзима B и ингибированию NK-клеточной цитотоксичности [7].
Известно, что реализация цитотоксического действия клеток иммунной системы с опухолевыми клетками-мишенями реализуется локально - в местах опухолевого роста, что определяет прогностическую важность состояния местного иммунитета. Имеются сведения о значительных различиях в содержании NK, как и других клеточных популяций иммунной системы, в асцитической жидкости и в периферической крови у больных раком яичника. При этом прогностической ценностью обладает соотношение NK, находящихся в АЖ и в периферической крови [8]. При сравнении субпопуляций цитотоксических клеток в периферической крови и асците больных с эпителиальным раком яичника было показано, что субпопуляция NK клеток в периферической крови была значительно снижена (около 5 %) по сравнению с асцитом (11 %), причем в АЖ, по сравнению с кровью, доминировала популяция CD56bright NK. Кроме того, в АЖ выявлено значительно большее количество лимфоцитов, экспрессирующих NKG2D рецептор по сравнению с периферической кровью [9]. У больных колоректальным раком II и III стадии содержание NK-клеток было значительно ниже, чем у здоровых доноров [10, 11]. В других исследованиях было выявлено повышение процента периферических NK-клеток у больных колоректальным раком по сравнению со здоровыми лицами [12]. В периферической крови у больных раком толстой кишки NK-клетки демонстрируют измененный фенотип и дефекты в способности активировать дегрануляцию и IFNY—продукцию [13].
Таким образом, хотя в литературе имеются данные об общем количестве NK-клеток в биологических жидкостях и клеточных субпопуляциях NK-клеток при злокачественных новообразованиях толстой кишки и яичников, однако данные о функциональной активности NK-клеток практически отсутствуют, что и определило цель настоящего исследования.
Цель исследования – сравнить показатели функциональной активности натуральных клеток-киллеров в зависимости от наличия злокачественного процесса и его распространенности.
Материал и методы
В исследование были включены 10 больных c серозным и эндометриоидным раком яичников с распространенностью опухолевого процесса T 3 N 1 M 0 , по классификации FIGO (2009) - IlIC стадия и 5 больных с доброкачественными опухолями яичника (серозные и эндометриоидные цистадено-мы, ДО), у которых во время операции выявлялось наличие свободной жидкости в брюшной полости. Возраст больных раком яичника варьировался от 39 до 68 лет (средний возраст – 53,4 ± 3,5 года), больных с ДО – от 51 до 68 лет (средний возраст – 58,8 ± 2,8 года). Также клиническую группу составили 15 больных колоректальным раком (средний возраст – 58,8 ± 2,9 года), из них 6 мужчин и 9 женщин. У 9 больных распространенность процесса соответствовала T2-4N 0 M0, у 6 - T2 _4 N1 _ 2M 0 . Контрольную группу составили 5 здоровых доноров, средний возраст – 52,4 ± 4,5 года.
Забор клинического материала (периферическая кровь, асцитическая жидкость) проводился до начала какого-либо лечения в вакутейнеры с гепарином. Образцы АЖ были получены во время оперативного вмешательства (диагностическая лапароскопия, циторедуктивная операция) в объеме около 20 мл. Из образцов асцитической жидкости предварительно выделяли клеточную фракцию центрифугированием в течение 20 мин при 900 g, после чего удаляли эритроциты путем их лизирования. Клетки цельной крови и клетки, выделенные из асцита, инкубировали со следующими антителами: CD45, СD56, СD107a (LAMP-1), антителами к перфорину (PF) и гранзиму B (GB) (BD, США), при этом учитывалась концентрация таблица 1
Содержание nK-клеток и их субпопуляций в периферической крови у здоровых доноров, больных колоректальным раком и раком яичников, Me (25–75 %)
|
Клеточная популяция |
Контроль |
Рак яичников |
Колоректальный рак |
|
CD45+CD56+ |
12,3 (8,1–14,5) |
5,7 (2,9–6,7)* |
10,10 (7,9–13,4)** |
|
CD56+CD107a+ |
0,13 (0,1–0,5) |
2,75 (0,5–7,7)* |
0,65 (0,5–1,1) |
|
CD107а+GB+PF– |
15,57 (6,3–31,15) |
3,28 (0,4–16,4)* |
3,49 (0,2–18,2)* |
|
СD107а+GB+PF+ |
22,65 (0,9–49,37) |
32,32 (1,1–43,4) |
13,43 (0,8–50) |
|
СD107а+GB–PF– |
47,95 (7,8–87,2) |
59,24 (53,2–91,7)* |
78,51 (61,4–92,3)* |
|
СD107a+GB–PF+ |
6,62 (0,4–8,6) |
5,14 (0,5–25) |
4,58 (0,4–20) |
Примечание: * – различия статистически значимы по сравнению с показателями контрольной группы (р<0,05); ** – различия статистически значимы по сравнению с показателями у больных раком яичников (р<0,05); GB – гранзим B; PF – перфорин.
таблица 2
Содержание nK-клеток и их субпопуляций у больных колоректальным раком в зависимости от местной распространенности опухоли и наличия лимфогенного метастазирования, Me (25–75 %)
|
Клеточная популяция |
T2 |
T3–4 |
N |
N1-2 |
|
CD45+CD56+ |
9,1 (8,9–13,4) |
11,1 (7,9–12,9) |
10,10 (8,9–13,4) |
10,15 (7,1–14,15) |
|
CD56+CD107a+ |
0,7 (0,63–0,72) |
0,58 (0,5–1,3) |
0,65 (0,5–0,7) |
0,8 (0,35–1,25) |
|
CD107а+GB+PF– |
6,98 (2,7–19,1) |
0 (0–0)* |
5,81 (0,7–18,2) |
2,8 (0–7,0) |
|
СD107а+GB+PF+ |
6,14 (0,8–18,2) |
20,72 (8,4–41,9)* |
6,25 (3,5–18,2) |
14,3 (4,1–39,3) |
|
СD107а+GB–PF– |
87,5 (66,7–93,1) |
75,4 (71,4–80,3) |
77,5 (66,7–87,5) |
85,7 (60,7–97,1) |
|
СD107a+GB–PF+ |
5,16 (1,5–16,7) |
4,7 (0,7–20,4) |
4,5 (0,3–11,7) |
2,9 (0–7,6) |
Примечание: * – различия между группами статистически значимы (р<0,05); GB – гранзим B; PF – перфорин.
клеток в клеточной суспензии, полученной из АЖ [14]. Инкубация с двумя последними антителами проводилась после фиксации и пермеабилизации клеток при помощи набора Cytofix/Cytoperm kit (BD, США) (стандартный протокол). Для оценки количества и функциональной активности NK-клеток периферической крови и АЖ выполнена многоцветная проточная цитометрия на цитофлуориметре FACS Canto II.
Статистическую обработку проводили с применением пакета программ Statistica 8.0. В таблицах результаты представлены как медиана с интерквартильным размахом –25-й и 75-й процентили, Me (25–75 %). Значимость различий оценивали с помощью критерия Манна – Уитни и Краскал – Уоллиса.
Результаты
Сравнительная характеристика содержания NK-клеток и их функционального статуса в контрольной группе у больных раком яичника и колоректальным раком представлена в табл. 1. Содержание NK-клеток в периферической крови у здоровых доноров и больных колоректальным раком не различалось, в то время как в периферической крови при раке яичников оно существенно снижено. Менее 1 % от всей популяции натуральных киллеров в периферической крови были активированы - имели поверхностную экспрессию CD56+СD107a+ у здоровых доноров и у больных колоректальным раком, в то время как при раке яичников эта популяция была существенно выше. Субпопуляционный состав активирован- ных NK-клеток у здоровых доноров существенно отличался от больных злокачественными новообразованиями. У здоровых чаще выявлялась популяция СD107а+GB+PF- и реже субпопуляция СD107а+GB-PF-.
Сравнительная характеристика содержания NK-клеток и их субпопуляций у больных колоректальным раком в зависимости от размера опухоли и наличия лимфогенного метастазирования представлена в табл. 2. Анализ содержания NK-клеток и их субпопуляций в периферической крови у больных колоректальным раком показал, что при инвазивном росте NK-клетки у больных претерпевают функциональные изменения с уменьшением доли СD107а+GB+PF- и увеличением доли СD107а+GB+PF+ NK-клеток. При диссеминации опухолевых клеток по лимфатическим путям изменения количества и субпопуляций NK-клеток не происходит. Сравнительная характеристика содержания NK-клеток и их субпопуляций в выявляемой свободной жидкости в брюшной полости и периферической крови у больных с ДО и раком яичника представлена в табл. 3 и на рис. 1.
Как у больных с ДО, так и у больных с диссеминированными формами рака яичника количество NK-клеток и количество активированных киллеров в свободной жидкости в брюшной полости было существенно выше по сравнению с их количеством в периферической крови. Однако доля активированных киллеров в свободной жидкости в брюшной полости у больных с ДО был значительно выше, чем в асците, по сравнению с диссеминированными формами рака яичников. При ДО в таблица 3
Содержания nK-клеток и их субпопуляций в асцитической жидкости и периферической крови у больных с новообразованиями яичников, Me (25–75 %)
|
Клеточная популяция |
Биологический субстрат |
Доброкачественные опухоли |
Рак яичников |
|
CD45+CD56+ |
АЖ Кровь |
33,6 (26,85–55,85)# 3,1 (0,8–9,7) |
21,8 (7,2–57,1)# 5,7 (2,9–6,7) |
|
CD56+CD107a+ |
АЖ Кровь |
71,5 (64,0–85,3)*# 1,22 (0,8–5,6) |
25,0(24,2–36,4) 2,75 (0,5–7,7) |
|
CD107а+GB+PF– |
АЖ Кровь |
15,57 (1,32–56,4)# 42,4 (39,1–,47,5)* |
33,62 (28,4–52,2)# 2,73 (0,7–16,4) |
|
СD107а+GB+PF+ |
АЖ Кровь |
36,75 (18,6–61,4)* 44,8 (39,3–,6)* |
2,1 (0,2–13,6) 5,8 (0,4–42,7) |
|
СD107a+GB–PF– |
АЖ Кровь |
47,5 (23,1–60,8)# 0,62 (0,11–1,30)* |
38,5 (12,3–58,3)# 85,6 (54,7–95,8) |
|
CD107a+GB–PF+ |
АЖ Кровь |
0,125 (0,07–0,55)* 2,10 (0,40–3,81) |
11,82 (2,50–28,4) 4,28 (0,6–25) |
Примечание: * – различия статистически значимы по сравнению с показателями у больных раком яичников (р<0,05); # – различия статистически значимы по сравнению с показателями в периферической крови (р<0,05); GB – гранзим B; PF – перфорин.
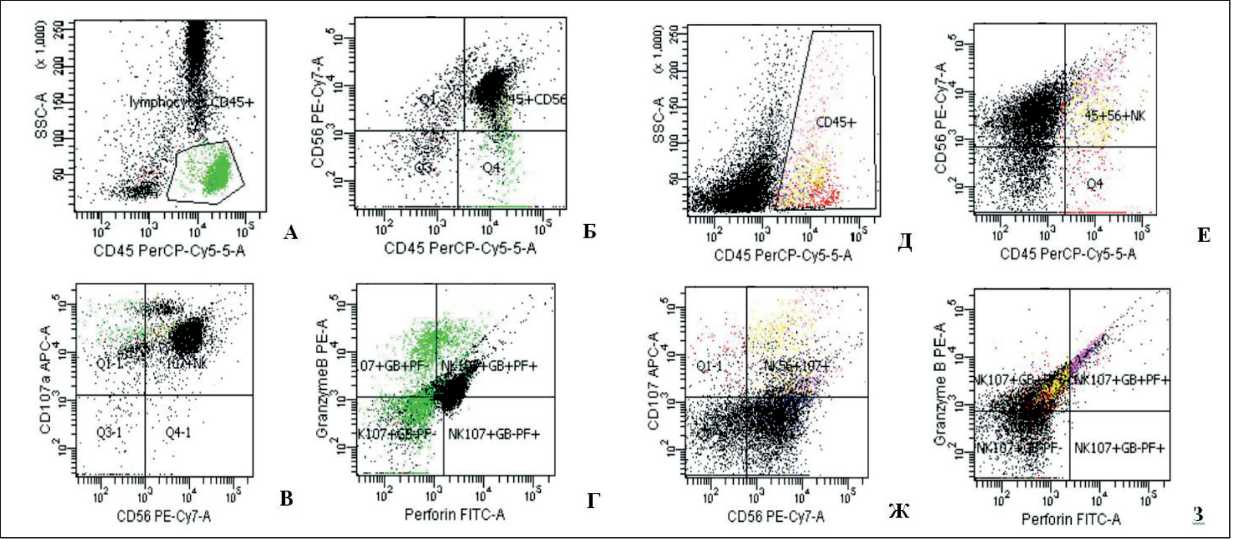
Рис. 1. Сравнение популяций NK-клеток в периферической крови и асцитической жидкости у больных РЯ, полученных при гей-тировании данных проточной цитофлюориметрии. Примечание: А, Д – популяция CD45+лейкоцитов в периферической крови и асците соответственно; Б, Е – популяция CD45+56+NK-клеток; В, Ж – популяция CD56+107+активированных NK-клеток;
Г, Е – популяции CD56+107+активированных NK-клеток, продуцирующих перфорин (PF) и гранизим В (GB)
периферической крови и в свободной жидкости в брюшной полости доминировала субпопуляция активированных киллеров, содержащая полный набор ферментов в литических гранулах, в то время как у больных раком яичников в периферической крови абсолютно доминировала СD107+GB-PF-популяция (85,6 %), а в АЖ с равной частотой встречались СD107+GB+PF- и СD107+GB-PF- популяции (в 33 и 38 % случаев соответственно).
Обсуждение
Полученные нами результаты по количеству NK-клеток в периферической крови больных колоректальным раком и раком яичника согласуются с данными литературы и дополняют их. Количество NK-клеток существенно снижается в перифери- ческой крови у больных с диссеминированными формами рака яичника [9]. Однако в отношении колоректального рака есть противоречивые данные как о снижении, так и о повышении количества NK-клеток периферической крови. В нашей работе существенных различий по сравнению со здоровыми донорами не выявлено. Важно также отметить, что хотя у больных раком яичников в периферической крови общее количество NK-клеток было снижено, однако процент активированных клеток, имеющих поверхностную экспрессию CD107a, был наивысшим среди всех групп.
Функциональная активность периферических NK-клеток у онкологических больных существенно изменена: снижен процент СD107а+GB+PF-клеток, а процент СD107а+GB-PF- NK повышен.
Популяцию СD107а+GB-PF-NK можно рассматривать и как пул функционально неполноценных клеток, не содержащих активных цитотоксических ферментов в литических гранулах, и как дегранулированные NK-клетки, поскольку, по данным A. Cohnen et al. (2013), поверхностно-экспрессирующийся СD107a защищает киллеры от апоптоза после дегрануляции [6].
Нами впервые показана связь функциональной активности NK-клеток периферической крови у больных колоректальным раком с инвазивным опухолевым ростом и лимфогенным метастазированием. При этом выявлена активация NK-клеток при увеличении размера опухоли с увеличением доли субпопуляций CD107а+GB+PF- и CD107а+GB+PF+NK-клеток. Несмотря на то, что лимфогенное метастазирование наряду с формированием гематогенных метастазов в печень является основной формой опухолевой прогрессии при раке толстой кишки, наличие или отсутствие лимфогенной диссеминации не оказало значимого влияния на количество и субпопуляционный состав NK-клеток.
Хотя количество NK-клеток в АЖ у больных раком яичника велико, мнения об их функциональной полноценности весьма противоречивы. В периферической крови и асците количество перфорин-позитивных и гранзим В-позитивных клеток у больных раком яичника существенно снижено. По данным S. Lukesova et al. (2013), в АЖ у больных раком яичника преобладает популяция CD56bright натуральных киллеров, обладающая слабой цитолитической активностью [9]. Считается, что популяции CD56bright и CD56dim отражают различные стадии дифференцировки и созревания лимфоцитов, CD56dim является более зрелой популяцией. Полагают, что в асцитической жидкости NK-клетки появляются из лимфатических узлов, вследствие их сдавления опухолевыми конгломератами и блокады оттока лимфы по лимфатическим путям. CD56bright составляют до 75 % всех NK-клеток в нормальных лимфатических узлах, они обладают слабой цитотоксичностью, но высокой цитокин-продуцирующей активностью, способны к контактному взаимодействию с дендритными клетками и играют важную роль в регуляции адаптивного иммунного ответа [14]. Еще в 2007 г. A. Bamias et al. показали существенную разницу в количестве и субпопуляционном составе (на основании сочетания поверхностных антигенов и рецепторов) лимфоцитов в периферической крови и АЖ у больных раком яичника с доминированием в асците субпопуляций Treg CD4+CD25+ и NKT-клеток с фенотипом СD3+CD56+ [8]. Выявлена ассоциация этих популяций с уровнем VEGF и ТNF alpha в АЖ, а также ассоциация с химиорезистентностью к препаратам платины [16]. Эти данные подтверждены исследованиями различных субпопуляций цитотоксических клеток в периферической крови и АЖ у больных раком яичников [9]. По нашим данным, уже у больных с ДО яичников, сопровождающимися накоплением свободной жидкости в брюшной полости, уровень NK-клеток в периферической крови существенно снижается, а в свободной жидкости увеличивается. Аналогичная тенденция выявлена и у больных раком яичников. Однако доля активированных, дегранулирующих NK-клеток в свободной жидкости в брюшной полости существенно выше у больных с ДО по сравнению с больными раком яичника. Выявленные различия функциональной активности NK-клеток в свободной жидкости в брюшной полости и периферической крови у больных раком яичников и ДО требуют дальнейшего изучения с исследованием рецепторного статуса лимфоцитов и, возможно, цитокин-продуцирующей функции NK-клеток.
В связи с постоянным накоплением данных о состоянии системы местного иммунитета у больных раком яичника, с развитием интраперитонеальной химиотерапии и интраперитонеальной иммунотерапии рака яичников [17], безусловно, представляются актуальными исследования по изучению субпопуляционного состава и функциональной активности NK-клеток с изучением возможных путей регуляции экспрессии рецепторов NK-клеток и их важнейших внутриклеточных компонентов.
Заключение
Наличие и распространенность злокачественного процесса оказывают выраженное влияние на содержание и функциональную активность NK-клеток. Увеличение размера первичной опухоли у больных колоректальным раком приводило к возрастанию в периферической крови доли активированных NK-клеток, содержащих гранулы цитолитических ферментов гранзима В и перфорина. Вместе с тем вовлечение лимфатических узлов в опухолевый процесс при колоректальном раке не оказывало влияния на содержание и активацию NK-клеток. Накопление свободной жидкости в брюшной полости как у больных с доброкачественными, так и у больных со злокачественными опухолями яичников сопровождается существенным снижением уровня NK-клеток в периферической крови и его увеличением в свободной жидкости и асците. Выявленные различия функциональной активности NK-клеток в свободной жидкости в брюшной полости и периферической крови у больных раком яичников и ДО требуют дальнейшего изучения с исследованием рецепторного статуса лимфоцитов и, возможно, цитокин-продуцирующей функции NK-клеток.
Исследование выполнено при финансовой поддержке Российского фонда фундаментальных исследований (номер гранта 17-04-00207a).
Список литературы Активность натуральных клеток-киллеров в биологических жидкостях у больных колоректальным раком и раком яичников
- Baginska J., Viry E., Paggetti J., Medves S., Berchem G., Moussay E., Janji B. The Critical Role of the Tumor Microenvironment in Shaping Natural Killer Cell-Mediated Anti-Tumor Immunity. Front Immunol. 2013 Dec 25; 4: 490. DOI: 10.3389/fimmu.2013.00490
- Larsen S.K., Gao Y., and Basse P.H. NK Cells in the Tumor Microenvironment. Crit Rev Oncog. 2014; 19 (1-2): 91-105.
- Apetoh L., Obeid M., Tesniere A., Ghiringhelli F., Fimia G.M., Piacentini M., Kroemer G., Zitvogel L. Immunogenic chemotherapy: discovery of a critical protein through proteomic analyses of tumor cells Cancer Genomics Proteomics. 2007 Mar-Apr; 4 (2): 65-70.
- Hannani D., Sistigu A., Kepp O., Galuzzi L., Kroemer G., Zitvogel L. Prerequisites for the antitumor vaccine-like effect of chemotherapy and radiotherapy. Cancer J. 2011; 17 (5): 351-8. d. DOI: 10.1097/PPO.0b013e3182325d4
- Стахеева М.Н., Чойнзонов Е.Л., Чижевская С.Ю., Бычков В.А. Взаимосвязь эффективности противоопухолевого лечения с состоянием иммунной системы у больных раком гортани и гортаноглотки. Медицинская иммунология. 2013; 15 (6): 553-62.


