Активность основных ферментов синтеза полиаминов в природных изолятах Escherichia coli
Автор: Ахова Анна Викторовна, Шегина Елена Сергеевна, Лаврикова Анастасия Леонидовна, Кузнецова Марина Валентиновна, Ткаченко Александр Георгиевич
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 3, 2019 года.
Бесплатный доступ
Исследована способность природных изолятов Escherichia coli, выделенных из разных мест обитания, декарбоксилировать лизин, орнитин и аргинин. Данный признак является широко распространенным среди E. coli, поскольку лишь у 7% изолятов не было выявлено способности декарбоксилировать ни одну из трех аминокислот. Способность декарбоксилировать аргинин встречалась реже, чем способность декарбоксилировать лизин или орнитин. Природные изоляты характеризовались разными комбинациями аргинин-, орнитин- и лизиндекарбоксилазной активностей. Наиболее часто встречалось сочетание лизиндекарбоксилазной и орнитиндекарбоксилазной активности, в то время как сочетание орнитиндекарбоксилазной и аргининдекарбоксилазной активности в отсутствие способности декарбоксилировать лизин не выявлено. Зависимости наличия способности декарбоксилировать ту или иную аминокислоту изолятом от источника выделения не установлено.
Кадаверин, путресцин, спермидин, декарбоксилаза, лизин, аргинин
Короткий адрес: https://sciup.org/147227091
IDR: 147227091 | УДК: 579.22 | DOI: 10.17072/1994-9952-2019-3-291-299
Текст научной статьи Активность основных ферментов синтеза полиаминов в природных изолятах Escherichia coli
Полиамины – природные поликатионы, необходимые для нормального развития эукариот, прокариот и вирусов, относятся к классу алифатических углеводородов с двумя и более амино- или иминогруппами в составе молекулы [Tabor, Tabor, 1985; Kusano et al., 2008; Pegg, 2016].
Качественный и количественный состав полиаминов варьирует у различных видов микроорганизмов, а также зависит от возраста культуры и условий культивирования [Tabor, Tabor, 1985]. Основными полиаминами Escherichia coli являются путресцин (1,4-диаминобутан), кадаверин (1,5-диаминопентан) и спермидин (N-(3-аминопропил)-1,4-диаминобутан) [Igarashi, Kashiwagi, 2010]. Кроме того, в клетках
E. coli при специфических условиях роста могут образовываться аминопропилкадаверин (N-(3-аминопропил)-1,5-диаминопентан), ацетилированные формы спермидина и путресцина, а также глутатио-нилспермидин [Tabor, Tabor, 1985; Chattopadhyay, Chen, Tabor, 2013]. Основные пути синтеза полиаминов в клетках E. coli представлены на рис. 1.
Первым этапом синтеза полиаминов является декарбоксилирование аминокислот-предшественников. Путресцин в клетках E. coli может синтезироваться двумя путями: 1) прямое декарбоксилирование орнитина при участии орнитиндекарбоксилазы (ОДК); 2) декарбоксилирование аргинина аргининдекарбоксилазой (АДК) с образованием
агматина, который затем гидролизуется агматину-реогидролазой (агматиназой) до мочевины и путресцина [Tabor, Tabor, 1985]. Кадаверин синтезируется в результате реакции декарбоксилирования лизина, катализируемой лизиндекарбоксилазой (ЛДК) [Sabo et al., 1974]. Спермидин синтезируется из L-метионина, который вначале аденилируется, а затем декарбоксилируется. В завершении полиамин-аминопропилтрансфераза синтеза
(спермидинсинтаза) переносит аминопропильную
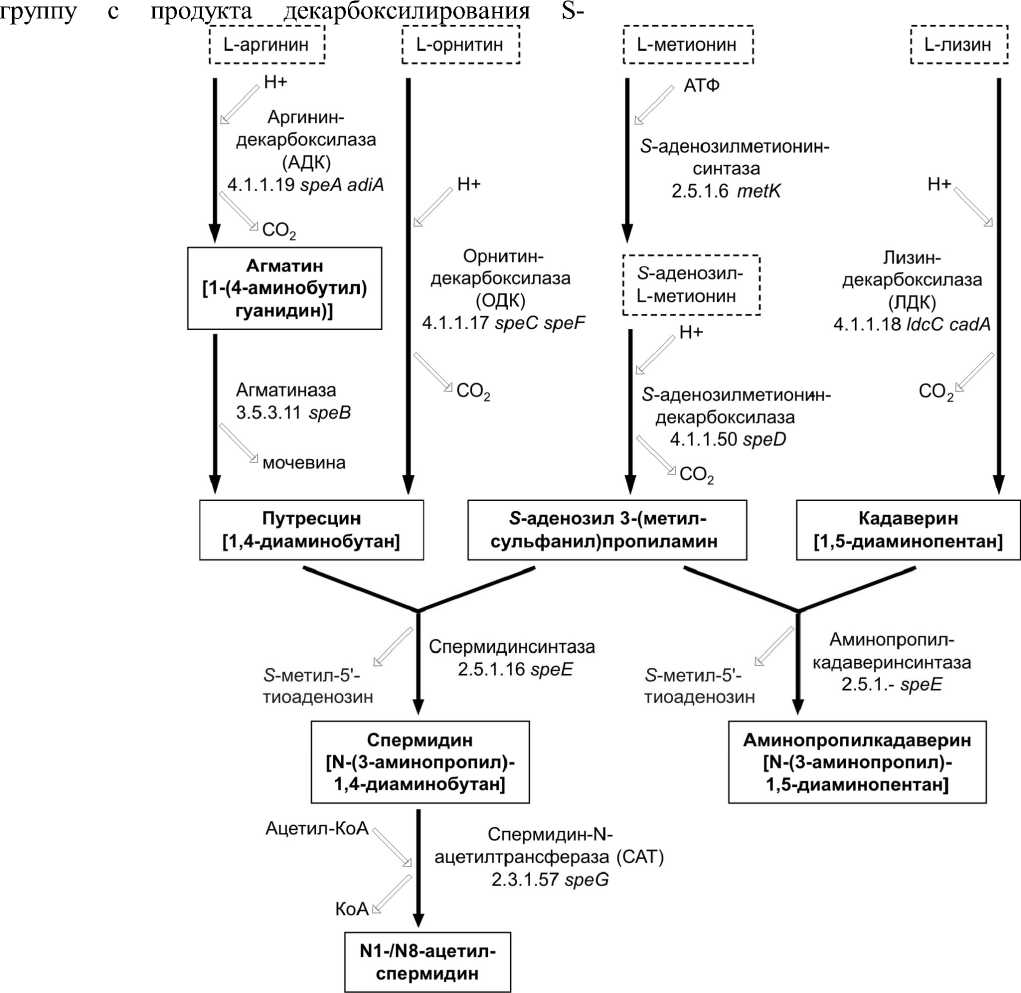
Рис. 1 . Основные метаболические пути синтеза полиаминов E. coli K12
Ферменты, катализирующие реакции декарбоксилирования аминокислот-предшественников, могут быть представлены в клетках в двух формах: биосинтетические (конститутивные) и биодеграда-тивные (индуцибельные) [Morris, Fillingame, 1974]. Изоформы различаются биохимическими свойствами, условиями активации и физиологическими функциями.
Индуцибельная форма АДК кодируется геном adiA и представляет собой гомодекамер, максимально активный при низких значениях рН (оптимум рН = 5.2) [Blethen, Boeker, Snell, 1968]. Повышение активности АДК AdiA наблюдается в клетках, выращенных на богатой среде (в присут- аденозилметионина на путресцин с образованием спермидина [Markham et al., 1980]. Полиамин-аминопропилтрансфераза также может катализировать присоединение аминопропильной группы к кадаверину с образованием аминопропилкадаве-рина и к спермидину с образованием спермина [Bowman, Tabor, Tabor, 1973]. Последняя реакция протекает с относительно низкой скоростью, и в обычных условиях накопление спермина за счет синтеза в клетках E. coli не происходит.
ствии избытка субстрата) при низких значениях рН и в условиях низкой аэрации. Физиологической ролью данного фермента является противодействие закислению цитоплазмы и поддержание гомеостаза рН внутри бактериальной клетки. По всей вероятности, аргинин-зависимая система кислото-устойчивости функционирует за счет удаления протонов водорода из клетки в составе продукта реакции декарбоксилирования аргинина – путресцина [Richard, Foster, 2004]. Ген speA кодирует конститутивную форму АДК, которая активна в форме гомотетрамера в слабощелочной и нейтральной среде (оптимум рН = 8.4). Для формирования тетрамера и проявления активности необхо- димы ионы Mg2+. Ингибитором АДК SpeA, как на уровне транскрипции, так и на уровне активности белка, выступает продукт катализируемой ею реакции – путресцин [Wu, Morris, 1973]. Биосинтетическая форма фермента экспрессируется вне зависимости от изменения рН и вовлечена в процесс биосинтеза полиаминов. АДК SpeA локализуется в районе клеточной оболочки и предпочтительно утилизирует аргинин, поступающий из среды [Buch, Boyle, 1985].
В клетках E. coli обнаружено две изоформы лизиндекарбоксилазы – LdcC и CadA (LdcI). Инду-цибельная форма ЛДК кодируется геном cadA и активна в форме гомодекамера. Индукция данной изоформы происходит при культивировании на богатой среде (в присутствии избытка субстрата) в условиях слабой аэрации и низких значений рН [Auger, Bennett, 1989; Meng, Bennett, 1992]. Кроме того, на Vibrio vulnificus показано, что данная лизиндекарбоксилаза входит в soxRS -регулон и индуцируется в ответ на супероксидный окислительный стресс [Pomposiello, Bennik, Demple, 2001; Kim, Choi, Lee, 2006]. Оптимум рН ЛДК CadA равняется 5.5, и данный фермент является частью лизин-зависимой системы кислотоустойчивости, которая работает по принципу, описанному выше для системы защиты, основанной на декарбоксилировании аргинина [Kanjee, Houry, 2013]. В регуляцию экспрессии cadA вовлечены различные транскрипционные регуляторы, а также алармон ppGpp, отрицательно регулирующий активность ЛДК CadA как на уровне экспрессии гена, так и на уровне активности белка [Kanjee et al., 2011]. Описанная несколько позднее лизиндекарбоксилаза LdcC, считающаяся конститутивным ферментом, проявляет активность в широком диапазоне рН, максимум которой приходится на значения, близкие к нейтральным (оптимум рН = 7.6) [Kikuchi, Kurahashi, Nagano, 1997; Lemonnier, Lane, 1998]. ЛДК LdcC, как и индуцибельная форма фермента, активна в виде гомодекамера. Известно, что промотор гена ldcC специфичен для σS-субъединицы РНК-полимеразы, и экспрессия данного гена повышается в стационарной фазе роста и под действием фторхинолоновых антибиотиков [Kikuchi, Kurahashi, Nagano, 1997; Шумков и др., 2010]. Ингибиторами активности данного белка являются путресцин и спермидин, а также (p)ppGpp [Wertheimer, Leifer, 1983; Kanjee et al., 2011].
Биосинтетическая и биодеградативная формы орнитиндекарбоксилазы кодируются генами speС и speF , соответственно, и функционируют в форме димеров. Обе изоформы ОДК наиболее активны в нейтральных и слабощелочных условиях (для SpeC оптимум рН = 8.1; для SpeF оптимум рН = 7) [Applebaum, Dunlap, Morris, 1977; Kanjee et al., 2011].
Экспрессия гена speC находится под контролем
RpoS, а также отрицательно регулируется ц-АМФ, Crp и ppGpp [Wright, Boyle, 1982]. Активность данной изоформы ОДК стимулируется ГТФ и ингибируется путресцином, спермидином и ppGpp [Holtta, Janne, Pispa, 1972; Applebaum, Dunlap, Morris, 1977]. Кроме того, в регуляцию активности ОДК вовлечена двухкомпонентная сигнал-проводящая система atoC-atoS [Kyriakidis, Tiligada, 2009]. Активность фермента SpeF положительно регулируется ди-, три-, тетра- и пентафосфатами гуанозина [Kanjee et al., 2011]. Считается, что ОДК SpeC вовлечена в процесс биосинтеза полиаминов, а физиологической функцией ОДК SpeF является деградация орнитина. Кроме того, предполагается, что данная орнитиндекарбоксилаза может быть частью системы кислотоустойчиво-сти, функционирующей при слабом кислотном стрессе [Kanjee, Houry, 2013].
В данной работе проведен анализ действия природных изолятов E. coli на способность декарбоксилировать лизин, орнитин и аргинин.
Материалы и методы исследования
В качестве объектов исследования использованы 62 природных изолята E. coli и штамм E. coli К12, полученный из Всероссийской коллекции микроорганизмов.
Природные изоляты E. coli были выделены из фекалий здоровых животных фермерских хозяйств Пермского края (5 культур выделены от коров, 5 – от кроликов и 4 – от свиней). Птичьи патогенные E. coli (n=33) изолированы из внутренних органов вынужденно убитой птицы (цыплят-бройлеров) в период 2016–2018 гг. (крупное птицеводческое хозяйство Пермского края). Клинические уропато-генные E. coli (n = 5) получены из материала (моча, катетеры) пациентов с инфекцией мочевыводящих путей (ИМВП), находившихся на стационарном (9 медицинских организаций) лечении в г. Перми в 2017 г. Симбионтные эшерихии (n = 10) изолированы от людей при диспансеризации в 2018 г. Все изоляты были идентифицированы согласно Приказу МЗ СССР №535 от 22.04.1985 г.
Бактериологическое исследование проводили с использованием среды МакКонки («Merck», США), идентифицируя бактерии с помощью диагностической системы «Еnterotest16» («Lachema», Чехия).
Определение декарбоксилазной активности проводили методом Мёллера с использованием декарбоксилазного бульона (ДК-бульона) («Sigma», Индия) – полноценной питательной среды, не содержащей изначально лизин, аргинин и орнитин [Moeller, 1955].
Для получения инокулята микроорганизмы, сохраняемые в полужидком Luria-Bertani-агаре («Amresco», США) засевали в 5 мл Luria-Bertani-бульона («Amresco», США) и культивировали без перемешивания при 37ºС в течение 18–20 ч. Полученные бактериальные культуры разводили в ДК-бульоне, содержащем 10 г/л лизина, аргинина или орнитина («Panreac», Испания), в соотношении 1:10. Культивирование проводили в лунках 96-луночного планшета (общий объем культуры – 200 мкл) без перемешивания при 37ºС. Изменение окраски регистрировали визуально каждый час в течение 6 ч. В качестве контроля бактерии параллельно выращивали на ДК-бульоне без добавления аминокислот.
Результаты
Наличие основных ферментов синтеза полиаминов было проанализировано у представителей E. coli , выделенных из разных мест обитания. В частности, исследованы обитатели кишечника здоровых сельскохозяйственных животных, культуры, изолированные из разных органов птицы при ко-либактериозе, а также симбионтные и уропатоген-ные эшерихии человека.
Определение декарбоксилазной активности проводили методом Мёллера с использованием в качестве селективной среды декарбоксилазного бульона (ДК-бульона) с добавкой лизина, аргинина или орнитина. Данный метод был разработан для идентификации энтеробактерий на основе их способности декарбоксилировать перечисленные выше аминокислоты. За счет наличия в составе ДК-бульона индикаторов рН бромкрезолового фиолетового и крезолового красного его цвет в процессе культивирования может изменяться от желтого (рН<7) до фиолетового (рН>7). В состав ДК-бульона входит декстроза, ферментация которой бактериями приводит к накоплению кислых продуктов обмена и снижению рН среды, что сопровождается появлением желтой окраски. Закисление среды стимулирует декарбоксилазную активность бактерий, что приводит к накоплению полиаминов и защелачиванию среды культивирования, которая в результате окрашивается в фиолетовой цвет [Moeller, 1955]. Таким образом, поскольку на первых этапах культивирования происходит закисление среды, данным методом определяется, в первую очередь, активность индуцибельных форм ферментов.
Способность декарбоксилировать орнитин, аргинин или лизин является широко распространенным признаком среди Escherichia coli , поскольку лишь у 7% изолятов не было выявлено способности декарбоксилировать ни одну из трех аминокислот. Из 62 исследованных изолятов лизиндекарбоксилазной активностью обладали 53, орнитиндекарбоксилазную активность проявляли 43 изолята, а способность декарбоксилировать аргинин была выявлена у 24 изолятов (таблица). Лабораторный штамм К12 проявлял лизиндекарбоксилазную активность.
Проявление декарбоксилазной активности (изменение окраски среды культивирования) природными изолятами E. coli
|
№ изо-лята / штамм |
ДК-бульон |
ДК-бульон + лизин |
ДК-бульон + орнитин |
ДК-бульон + аргинин |
|
Время, ч. |
||||
|
1 2 3 4 5 6 |
1 2 3 4 5 6 |
1 2 3 4 5 6 |
1 2 3 4 5 6 |
|
|
1 |
------ |
------ |
------ |
------ |
|
2 |
------ |
------ |
------ |
- - - + + + |
|
3 |
------ |
+ + + + + + |
------ |
------ |
|
4 |
------ |
------ |
------ |
------ |
|
5 |
------ |
------ |
------ |
------ |
|
6 |
------ |
------ |
------ |
- - - + + + |
|
7 |
------ |
+ + + + + + |
------ |
------ |
|
8 |
------ |
------ |
------ |
-----+ |
|
9 |
------ |
+ + + + + + |
- - + + + + |
------ |
|
10 |
------ |
- + + + + + |
- + + + + + |
------ |
|
11 |
------ |
- + + + + + |
------ |
------ |
|
12 |
------ |
------ |
------ |
------ |
|
13 |
------ |
------ |
------ |
-----+ |
Окончание таблицы
|
№ изо-лята / |
ДК-бульон |
ДК-бульон + лизин |
ДК-бульон + орнитин |
ДК-бульон + аргинин |
||||||||||||||||||||
|
штамм |
Время, ч. |
|||||||||||||||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
1 |
2 |
3 |
4 |
5 |
6 |
1 |
2 |
3 |
4 |
5 |
6 |
1 |
2 |
3 |
4 |
5 |
6 |
|
|
14 |
- |
- |
- |
- |
- |
- |
+ |
+ |
+ |
+ |
+ |
+ |
- |
+ |
+ |
+ |
+ |
+ |
- |
- |
- |
- |
- |
- |
|
15 |
- |
- |
- |
- |
- |
- |
+ |
+ |
+ |
+ |
+ |
+ |
- |
- |
+ |
+ |
+ |
+ |
- |
- |
- |
- |
- |
- |
|
16 |
- |
- |
- |
- |
- |
- |
+ |
+ |
+ |
+ |
+ |
+ |
- |
- |
+ |
+ |
+ |
+ |
- |
- |
- |
- |
- |
+ |
|
17 |
------ |
- |
+ |
+ |
+ |
+ |
+ |
- |
- |
+ |
+ |
+ |
+ |
- |
- |
- |
- |
- |
- |
|||||
|
18 |
------ |
- |
+ |
+ |
+ |
+ |
+ |
- |
- |
- |
+ |
+ |
+ |
- |
- |
- |
- |
- |
- |
|||||
|
19 |
------ |
- |
+ |
+ |
+ |
+ |
+ |
- |
- |
+ |
+ |
+ |
+ |
- |
- |
- |
- |
- |
- |
|||||
|
20 |
------ |
- |
+ |
+ |
+ |
+ |
+ |
------ |
------ |
|||||||||||||||
|
21 |
------ |
- |
+ |
+ |
+ |
+ |
+ |
------ |
------ |
|||||||||||||||
|
22 |
- |
- |
- |
- |
- |
- |
+ |
+ |
+ |
+ |
+ |
+ |
------ |
------ |
||||||||||
|
23 |
- |
- |
- |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
- |
- |
- |
+ |
+ |
+ |
- |
- |
- |
+ |
+ |
+ |
|
24 |
- |
- |
- |
- |
- |
- |
+ |
+ |
+ |
+ |
+ |
+ |
- |
- |
+ |
+ |
+ |
+ |
- |
- |
- |
- |
- |
- |
|
25 |
- |
- |
- |
- |
- |
- |
+ |
+ |
+ |
+ |
+ |
+ |
- - - - - + |
------ |
||||||||||
|
26 |
- |
- |
- |
- |
- |
- |
+ |
+ |
+ |
+ |
+ |
+ |
- |
- |
- |
- |
+ |
+ |
- |
- |
- |
- |
- |
- |
|
27 |
------ |
- |
- |
- |
+ |
+ |
+ |
- |
+ |
+ |
+ |
+ |
+ |
- |
- |
- |
+ |
+ |
+ |
|||||
|
28 |
------ |
- |
+ |
+ |
+ |
+ |
+ |
------ |
------ |
|||||||||||||||
|
29 |
- |
- |
- |
- |
- |
- |
+ |
+ |
+ |
+ |
+ |
+ |
- |
+ |
+ |
+ |
+ |
+ |
- |
- |
- |
- |
- |
- |
|
30 |
- |
- |
- |
- |
- |
- |
+ |
+ |
+ |
+ |
+ |
+ |
- |
- |
+ |
+ |
+ |
+ |
- |
- |
- |
- |
- |
- |
|
31 |
- |
- |
- |
- |
- |
- |
+ |
+ |
+ |
+ |
+ |
+ |
- |
+ |
+ |
+ |
+ |
+ |
- |
- |
- |
- |
- |
- |
|
32 |
------ |
------ |
- |
+ |
+ |
+ |
+ |
+ |
- |
- |
- |
- |
- |
- |
||||||||||
|
33 |
- |
- |
- |
- |
- |
- |
+ |
+ |
+ |
+ |
+ |
+ |
- |
- |
+ |
+ |
+ |
+ |
- |
- |
- |
+ |
+ |
+ |
|
34 |
- |
- |
- |
- |
- |
- |
+ |
+ |
+ |
+ |
+ |
+ |
- |
- |
+ |
+ |
+ |
+ |
- |
- |
- |
- |
- |
- |
|
35 |
- |
- |
- |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
- |
+ |
+ |
+ |
+ |
+ |
- |
- |
- |
+ |
+ |
+ |
|
36 |
- |
- |
- |
- |
- |
- |
+ |
+ |
+ |
+ |
+ |
+ |
------ |
- |
- |
- |
+ |
+ |
+ |
|||||
|
37 |
------ |
- |
+ |
+ |
+ |
+ |
+ |
- |
+ |
+ |
+ |
+ |
+ |
- |
- |
- |
- |
+ |
+ |
|||||
|
38 |
------ |
- |
+ |
+ |
+ |
+ |
+ |
- |
+ |
+ |
+ |
+ |
+ |
- |
- |
- |
- |
+ |
+ |
|||||
|
39 |
------ |
- |
+ |
+ |
+ |
+ |
+ |
- |
+ |
+ |
+ |
+ |
+ |
- |
- |
- |
- |
+ |
+ |
|||||
|
40 |
------ |
- |
+ |
+ |
+ |
+ |
+ |
- |
+ |
+ |
+ |
+ |
+ |
- |
- |
- |
- |
+ |
+ |
|||||
|
41 |
------ |
- |
+ |
+ |
+ |
+ |
+ |
- |
- |
- |
- |
+ |
+ |
- |
- |
- |
- |
+ |
+ |
|||||
|
42 |
------ |
- |
- |
+ |
+ |
+ |
+ |
- |
- |
- |
- |
- |
+ |
- |
- |
- |
- |
+ |
+ |
|||||
|
43 |
------ |
- |
- |
+ |
+ |
+ |
+ |
- |
+ |
+ |
+ |
+ |
+ |
- |
- |
- |
- |
- |
- |
|||||
|
44 |
------ |
- |
- |
+ |
+ |
+ |
+ |
- |
+ |
+ |
+ |
+ |
+ |
- |
- |
- |
- |
+ |
+ |
|||||
|
45 |
------ |
- |
- |
+ |
+ |
+ |
+ |
- |
- |
+ |
+ |
+ |
+ |
- |
- |
- |
- |
+ |
+ |
|||||
|
46 |
------ |
- |
+ |
+ |
+ |
+ |
+ |
- |
+ |
+ |
+ |
+ |
+ |
- |
- |
- |
- |
+ |
+ |
|||||
|
47 |
------ |
- |
+ |
+ |
+ |
+ |
+ |
- |
+ |
+ |
+ |
+ |
+ |
- |
- |
- |
- |
+ |
+ |
|||||
|
48 |
- |
- |
- |
- |
- |
- |
+ |
+ |
+ |
+ |
+ |
+ |
- |
+ |
+ |
+ |
+ |
+ |
- |
- |
- |
- |
- |
- |
|
49 |
- |
- |
- |
- |
- |
- |
+ |
+ |
+ |
+ |
+ |
+ |
- |
+ |
+ |
+ |
+ |
+ |
- |
- |
- |
- |
- |
- |
|
50 |
- |
- |
- |
- |
- |
- |
+ |
+ |
+ |
+ |
+ |
+ |
- |
+ |
+ |
+ |
+ |
+ |
- |
- |
- |
- |
- |
- |
|
51 |
------ |
- |
+ |
+ |
+ |
+ |
+ |
- |
+ |
+ |
+ |
+ |
+ |
- |
- |
+ |
+ |
+ |
+ |
|||||
|
52 |
------ |
- |
- |
+ |
+ |
+ |
+ |
- |
- |
- |
- |
+ |
+ |
- |
- |
+ |
+ |
+ |
+ |
|||||
|
53 |
------ |
- |
- |
+ |
+ |
+ |
+ |
- |
- |
- |
- |
+ |
+ |
- |
- |
+ |
+ |
+ |
+ |
|||||
|
54 |
------ |
- |
- |
+ |
+ |
+ |
+ |
- |
- |
- |
- |
+ |
+ |
- |
- |
+ |
+ |
+ |
+ |
|||||
|
55 |
------ |
- |
+ |
+ |
+ |
+ |
+ |
------ |
- |
- |
+ |
+ |
+ |
+ |
||||||||||
|
56 |
- |
- |
- |
- |
- |
- |
+ |
+ |
+ |
+ |
+ |
+ |
- |
- |
+ |
+ |
+ |
+ |
- |
- |
+ |
+ |
+ |
+ |
|
57 |
------ |
- |
- |
+ |
+ |
+ |
+ |
------ |
------ |
|||||||||||||||
|
58 |
- |
- |
- |
- |
+ |
+ |
- |
+ |
+ |
+ |
+ |
+ |
- |
+ |
+ |
+ |
+ |
+ |
- |
- |
- |
- |
+ |
+ |
|
59 |
- |
- |
- |
- |
+ |
+ |
- |
+ |
+ |
+ |
+ |
+ |
- |
+ |
+ |
+ |
+ |
+ |
- |
- |
- |
- |
+ |
+ |
|
60 |
- |
- |
- |
- |
+ |
+ |
- |
+ |
+ |
+ |
+ |
+ |
- |
+ |
+ |
+ |
+ |
+ |
- |
- |
- |
- |
+ |
+ |
|
61 |
------ |
- |
- |
+ |
+ |
+ |
+ |
- |
+ |
+ |
+ |
+ |
+ |
- |
- |
- |
- |
- |
- |
|||||
|
62 |
- |
- |
- |
- |
+ |
+ |
- |
+ |
+ |
+ |
+ |
+ |
- |
+ |
+ |
+ |
+ |
+ |
- |
- |
- |
- |
+ |
+ |
|
K12 |
------ |
- |
+ |
+ |
+ |
+ |
+ |
------ |
------ |
|||||||||||||||
Способность декарбоксилировать лизин у большинства исследованных изолятов определялась уже на 1–2 ч. культивирования. Орнитиндекарбоксилазная активность регистрировалась после двух часов культивирования, а способность декарбоксилировать аргинин – после 3 ч. с момента засева инокулята. Разница во времени активации для разных декарбоксилаз может быть связана с состоянием инокулята, в качестве которого использовались клетки в стационарной фазе роста, переход к которой является одним из условий индукции лизиндекарбоксилазы [Kikuchi, Kurahashi, Nagano, 1997]. С другой стороны, при культивировании бактерий на ДК-бульоне закисление среды происходит постепенно и индуцибельная аргининдекарбоксилаза, обладающая наиболее низким значением оптимума рН, должна активироваться позже других ферментов.
Природные изоляты характеризовались разными комбинациями аргинин-, орнитин- и лизиндекарбоксилазной активностей (рис. 2). Из всех исследованных изолятов 17 были способны декарбоксилировать все три аминокислоты. Два изолята проявляли лизиндекарбоксилазную и аргининдекарбоксилазную активности. Наиболее часто у природных изолятов встречалось сочетание лизиндекарбоксилазной и орнитиндекарбоксилазной активностей (24 изолята). Изолятов, обладающих орнитиндекарбоксилазной и аргининдекарбоксилазной активностью в отсутствие способности декарбоксилировать лизин, не выявлено.
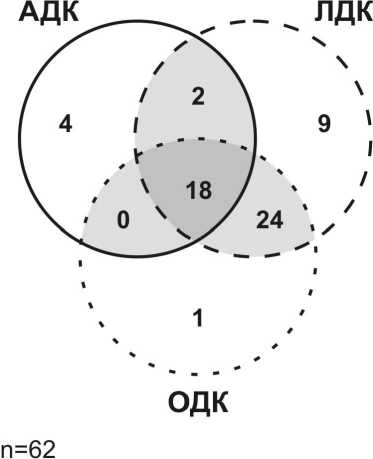
Рис. 2. Встречаемость аргинин-, орнитин- и лизиндекарбоксилазной активности в природных изолятах E. coli
Следует отметить, что использованный метод определения декарбоксилазной активности, по-видимому, применим только для высокоактивных ферментов. Об этом свидетельствует отсутствие изменения окраски среды при культивировании лабораторного штамма К12 на среде, содержащей орнитин и аргинин, несмотря на то, что в геноме данного микроорганизма присутствуют гены, кодирующие орнитин- и аргининдекарбоксилазы. Вероятно, в условиях наших экспериментов активность ферментов в клетках лабораторного штамма и накопление полиаминов в среде культивирования недостаточно велики для того, чтобы вызвать изменение ее окраски.
Таким образом, активность ключевых ферментов синтеза полиаминов обнаруживается у большинства представителей E. coli , изолированных из разных мест обитания. Способность декарбоксилировать аргинин встречается реже, чем способность декарбоксилировать лизин или орнитин. Зависимости наличия способности декарбоксилировать ту или иную аминокислоту изолятом от источника выделения не установлено. В результате работы были выявлены обладающие способностью декарбоксилировать лизин, аргинин и/или орнитин микроорганизмы, которые потенциально могут быть использованы в качестве продуцентов 1,5-диаминопентана и 1,4-диаминобутана.
Работа выполнена в рамках государственного задания, номер госрегистрации темы 01201353249.
Список литературы Активность основных ферментов синтеза полиаминов в природных изолятах Escherichia coli
- Шумков М.С. и др. Изменение экспрессии ldcC Escherichia coli как фактор адаптации к антибиотикам // Вестник Пермского университета. Сер. Биология. 2010. Вып. 1. С. 36-40.
- Applebaum D., Dunlap J., Morris D. Comparison of the biosynthetic and biodegradative ornithine decarboxylases of Escherichia coli // Biochemistry. 1977. Vol. 16, № 8. P. 1580-1584.
- Auger E., Bennett G. Regulation of lysine decarboxylase activity in Escherichia coli K-12 // Archives of Microbiology. 1989. Vol. 151, № 5. P. 466-468.
- Blethen S., Boeker E., Snell E. Arginine decarboxylase from Escherichia coli. I. Purification and specificity for substrates and coenzyme // Journal of Biological Chemistry. 1968. Vol. 243, № 8. P. 1671-1677.
- Bowman W., Tabor C., Tabor H. Spermidine biosynthesis. Purification and properties of propylamine transferase from Escherichia coli // Journal of Biological Chemistry.1973. Vol. 248, № 7. P. 2480-2486.
- Buch J., Boyle S. Biosynthetic arginine decarboxylase in Escherichia coli is synthesized as a precursor and located in the cell envelope // Journal of Bacteriology. 1985. Vol. 163, № 2. P. 522-527.
- Castanie-Cornet M. et al. Control of acid resistance in Escherichia coli // Journal of Bacteriology. 1999. Vol. 181. P. 3525-3535.
- Chattopadhyay M., Chen W., Tabor H. Escherichia coli glutathionylspermidine synthetase/amidase: phylogeny and effect on regulation of gene expression // FEMS Microbiology Letters. 2013. Vol. 338, № 2. P. 132-140.
- Höltta E., Jänne J., Pispa J. Ornitine decarboxylase from Escherichia coli: stimulation of the enzyme activity by nucleotides // Biochemical and Biophysical Research Communications. 1972. Vol. 47. P. 1165-1171.
- Igarashi K., Kashiwagi K. Modulation of cellular function by polyamines // International Journal of Biochemistry and Cell Biology. 2010. Vol. 42, № 1. P. 39-51.
- Kanjee U. et al. The enzymatic activities of the Escherichia coli basic aliphatic amino acid decarboxylases exhibit a pH zone of inhibition // Biochemistry. 2011. Vol. 50, № 43. P. 9388-9398.
- Kanjee U., Houry W.A. Mechanisms of acid resistance in Escherichia coli // Annual Review of Microbiology. 2013. Vol. 67. P. 65-81.
- Kikuchi Y., Kurahashi O., Nagano T. RpoSdependent expression of the second lysine decarboxylase gene in Escherichia coli // Bioscience, Biotechnology, and Biochemistry. 1997. Vol. 62, № 6. P. 1267-1270.
- Kim J., Choi S., Lee J. Lysine decarboxylase expression by Vibrio vulnificus is induced by SoxR in response to superoxide stress // Journal of Bacteriology. 2006. Vol. 188, № 24. P. 8586-8592.
- Kusano T. et al. Polyamines: essential factors for growth and survival // Planta. 2008. Vol. 228, № 3. P. 367-381.
- Kyriakidis D., Tiligada E. Signal transduction and adaptive regulation through bacterial two-component systems: the Escherichia coli AtoSC paradigm // Amino Acids. 2009. Vol. 37, № 3. P. 443-458.
- Lemonnier M., Lane D. Expression of the second lysine decarboxylase gene of Escherichia coli // Microbiology. 1998. Vol. 144, № 3. P. 751-760.
- Markham G. et al. S-adenosylmethionine synthetase from Eschericgia coli // Journal of Biological Chemistry. 1980. Vol. 255. P. 9082-9092.
- Meng S., Bennett G. Nucleotide sequence of the Escherichia coli cad operon: a system for neutralization of low extracellular pH // Journal of Bacteriology. 1992. Vol. 174, № 8. P. 2659-2669.
- Moeller V. Simplified tests for some amino acid decarboxylases and for the arginine dihydrolase system // Acta Pathologica et Microbiologica Scandinavica. 1955. Vol. 36. P. 158-172.
- Morris D., Fillingame R. Regulation of amino acid decarboxylation // Annual Review of Biochemistry. 1974. Vol. 43. P. 303-321.
- Pegg A. Functions of polyamines in mammals // Journal of Biological Chemistry. 2016. Vol. 291, № 29. P. 14904-14912.
- Pomposiello P., Bennik M., Demple B. Genome-wide transcriptional profiling of the Escherichia coli responses to superoxide stress and sodium salicylate // Journal of Bacteriology. 2001. Vol. 183, № 13. P. 3890-3902.
- Richard H., Foster J. Escherichia coli glutamate- and arginine-dependent acid resistance systems increase internal pH and reverse transmembrane potential // Journal of Bacteriology. 2004. Vol. 186, № 18. P. 6032-6041.
- Sabo D. et al. Purification and physical properties of inducible Escherichia coli lysine decarboxylase // Biochemistry. 1974. Vol. 13. P. 662-670.
- Tabor C.W., Tabor H. Polyamines in microorganisms // Microbiological Reviews. 1985. Vol. 49. P. 81-99.
- Wu W., Morris D. Biosynthetic arginine decarboxylase from Escherichia coli. Purification and properties // Journal of Biological Chemistry. 1973. Vol. 248, № 5. P. 1687-1695.
- Wendisch V. Microbial production of amino acidrelated compounds // Advances in Biochemical Engineering/Biotechnology. 2017. Vol. 159. P. 255-269.
- Wertheimer S., Leifer Z. Putrescine and spermidine sensitivity of lysine decarboxylase in Escherichia coli: evidence for a constitutive enzyme and its mode of regulation // Biochemical and Biophysical Research Communications. 1983. Vol. 114, № 2. P. 882-888.
- Wright J., Boyle S. Negative control of ornithine decarboxylase and arginine decarboxylase by adenosine-3,5-monophosphate in E. coli // Molecular and General Genetics. 1982. Vol. 186. P. 482-487.


