Активность пептидил-дипептидазы а в нервной ткани крыс при длительном действии ноотропных препаратов
Автор: Алексеева Людмила Владимировна, Гамзин Сергей Сергеевич
Журнал: Вестник Тверского государственного университета. Серия: Биология и экология @bio-tversu
Рубрика: Биохимия
Статья в выпуске: 1, 2016 года.
Бесплатный доступ
Изучено влияние ноотропных препаратов (пирацетам, фенотропил, ноопепт) на активность пептидил-дипептидазы А (ПДПА) в тканях крыс в условиях их длительного действия - каждые 24 ч на протяжении 14 суток. Наиболее высокая активность ПДПА наблюдалась в гипофизе через 24 ч и в стриатуме - через 72 ч после последней инъекции. Эта общая тенденция особенно ярко проявила себя после инъекции пирацетама. Полученные результаты изменений активности ПДПА могут служить одними из маркерных параметров реакции пептидергической системы на воздействие веществ с нейропротекторным действием, к которым и относятся ноотропные препараты.
Пептидил-дипептидаза а, ноотропные препараты, длительное действие
Короткий адрес: https://sciup.org/146116628
IDR: 146116628 | УДК: 61:577.1
Текст научной статьи Активность пептидил-дипептидазы а в нервной ткани крыс при длительном действии ноотропных препаратов
Введение. Пептидил-дипептидаза А (ангиотензин -превращающий фермент) относится к карбоксипептидазам, участвует в инактивации опиоидных и стресс-пептидов, отщепляя дипептиды с С-конца биологически активных пептидов. Активность этого фермента может служить маркерным тестом, отличающим животных, устойчивых и предрасположенных к стрессу (Вернигора, 2010).
Одной из групп фармакологических препаратов, обладающих нейропротекторным действием, являются ноотропные препараты (Воронина, 2000; Давыдова, 2001; Лапина, Золотарева, 2009; Золотарева, 2011; Ганцгорн, 2014). К их числу относят пирацетам, фенотропил, ноопепт.
Влияние этих препаратов на метаболические процессы может быть оценено с помощью биохимических тестов, в том числе статуса пептидергической системы. Проведение таких исследований сопособствует выявлению возможного нейрохимического механизма действия этих фармацевтических препаратов, а также служит базисом для дальнейшего углубленного экспериментального и клинического их изучения и оценки возможности и целесообразности разработки новых лекарственных препаратов для комплексной фармакотерапии и
Вестник ТвГУ. Серия "Биология и экология". 2016. № 1 фармакопрофилактики целого ряда заболеваний, в том числе неврологического профиля (Гамзин и др., 2015).
Целью настоящего исследования стало выяснение активности пептидил-дипептидазы А в тканях крыс при длительном действии ноотропных препаратов (пирацетам, фенотропил, ноопепт).
Методика. Эксперимент выполнен на 48 самцах белых беспородных крыс возрастом 3 мес и массой 250-300 г. Животные содержались в стандартных условиях вивария (температура 22-24 °C, относительная влажность воздуха 40-50%) с естественным световым режимом на сбалансированной диете при свободном доступе к воде, удовлетворяющей требованиям «Руководства по лабораторным животным и альтернативным моделям в биомедицинских технологиях» (Руководство..., 2010).
Для изучения влияния ноотропных лекарственных средств на активность пептидил-дипептидазы А (ПДПА) пирацетам вводили внутрибрюшинно в дозе 300 мг/кг (Назарова и др., 2007), фенотропил -в дозе 100 мг/кг (Белоусов, Мухина, 2005), ноопепт - в дозе 10 мг/кг (Коваленко и др., 2002) каждые 24 ч на протяжении 14 сут. Контрольные животные получали эквивалентный объем физраствора. Крыс выводили из эксперимента через 24 и 72 ч после последней инъекции путем декапитации.
После декапитации извлекали гипофиз, четверохолмие, продолговатый мозг, гипоталамус, гиппокамп, амигдалу, стриатум. Ткани погружали в физиологический раствор, охлажденный до 3 °C, после чего тщательно очищали их от оболочек и кровеносных сосудов. Активность пептидил-дипептидазы А (ПДПА) в отдела мозга определяли по образованию Gly-Arg из карбобензокси-Gly-Gly-Arg при pH 7,6 как активность, ингибируемую каптоприлом по методу Херста и Лавела-Смита (1981) (Supattapone et al., 1984), белок определяли методом Лоури (Lowry et al., 1951). Активность ПДПА выражали в нмоль образовавшегося продукта реакции за 1 мин инкубации в пересчете на 1 мг белка.
Статистическую обработку результатов исследования осуществляли с помощью пакетов программ: Microsoft Office Exel 2010 (Microsoft, CHIA), Statistica 6,0 (StatSoft, Inc., США) и BioStat 2009 Professional. Достоверность различий между группами определяли с использованием параметрического t-критерия Стьюдента (при р<0,05) для сравнения средних независимых выборок, с учетом предварительной проверки выборок на нормальность распределения. Результаты представлены в виде М ± т, где М - среднее, т -стандартная ошибка среднего. Критический уровень значимости при проверке статистических гипотез принимался равным р=0,05 (Р=95%).
Результаты и обсуждение. Активность ПДПА в нервной ткани крыс при длительном действии пирацетама представлена на рис. 1.
Гипофиз
Четверохолмие
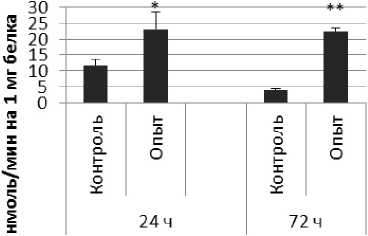
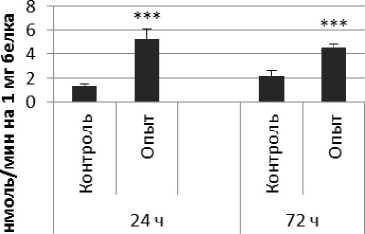
Продолговатый мозг
Гипоталамус
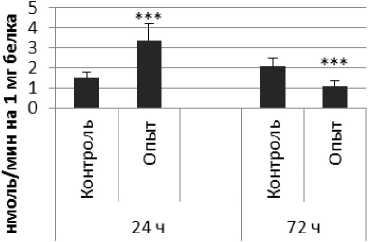
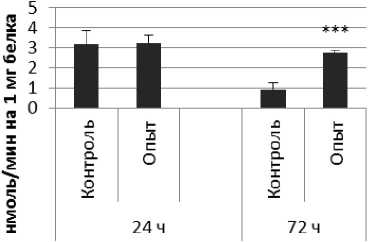
Гиппокамп
Амигдала
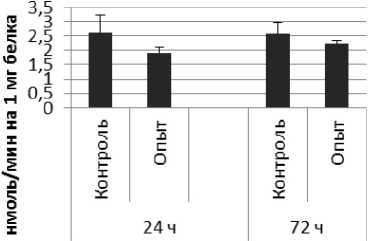
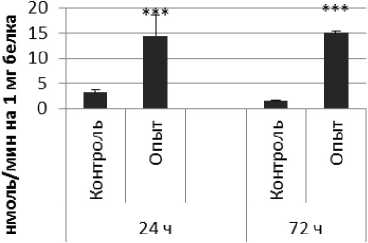
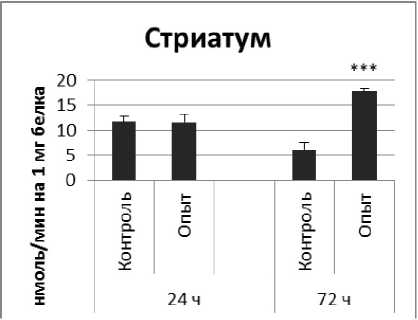
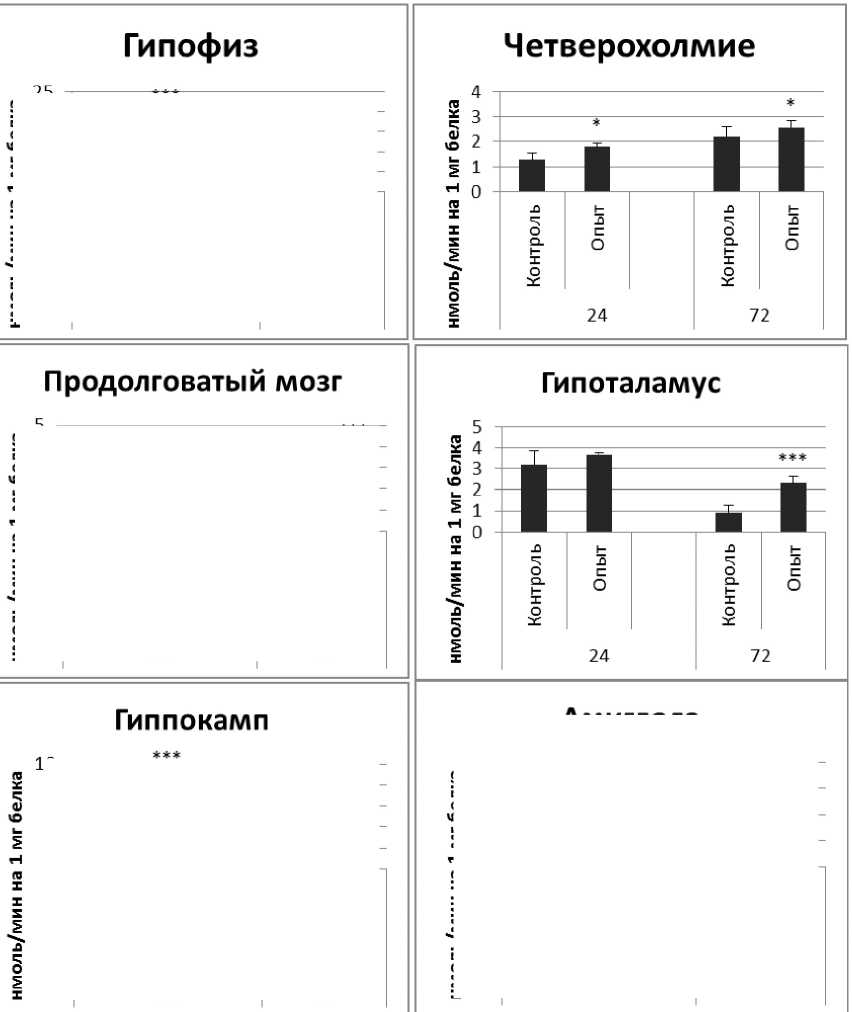
Рис. 1 . Активность ПДПА при действии пирацетама в нервной ткани крыс (нмоль продукта, образовавшегося за 1 мин инкубации на 1 мг белка, М ±ш, п=б; * - р<0,05, ** - р<0,01, *** р<0,001 относительно контроля).
Длительное введение пирацетама вызывало повышение активности пептидил-дипептидазы А в гипофизе в 2 раза через 24 ч после последней инъекции и в 5,8 раза - через 72 ч после последней инъекции препарата по сравнению с контрольной группой. В четверохолмии длительное введение пирацетама вызывало повышение активности ПДПА по сравнению с контрольной группой через 24 и 72 ч после последней инъекции в 4,2 и 2,1 раза соответственно. В продолговатом мозге обнаружено повышение активности ПДПА по сравнению с контролем в 2,2 раза через 24 ч после последней инъекции пирацетама и снижение активности исследуемого фермента в 1,9 раза через 72 ч после последней инъекции препарата. В гипоталамусе зафиксировано повышение активности ПДПА в 3 раза через 72 ч после последней инъекции пирацетама по сравнению с контрольной группой. По сравнению с контрольной группой животных, активность ПДПА в амигдале при длительном введении пирацетама оказалась выше в 4,5 и 10 раз через 24 и 72 ч после последней инъекции препарата соответственно. Стриатум ответил повышением активности пептидил-дипептидазы А в 2,9 раза через 72 ч после последней инъекции пирацетама по сравнению с контрольной группой животных.
Активность ПДПА в нервной ткани крыс при длительном действии ноопепта представлена на рис. 2. Длительное действие ноопепта вызывало повышение активности пептидил-дипептидазы А в гипофизе в 1,7 и 4 раза соответственно через 24 и 72 ч после последней инъекции препарата по сравнению с контрольной группой животных. В четверохолмии длительное воздействие ноопепта вызывало повышение активности ПДПА в 1,4 раза через 24 ч и 1,2 раза через 72 ч после последнего введения препарата по сравнению с контрольной группой. Продолговатый мозг ответил на длительное введение ноопепта повышением активности пептидил-дипептидазы А в 2,3 раза через 24 ч и 1,8 раза через 72 ч после последней инъекции препарата по сравнению с контролем. После последней инъекции ноопепта зафиксировано повышение активности ПДПА в гиппокампе в 3,2 раза через 24 ч, в стриатуме - через 72 ч по сравнению с контролем. В амигдале длительное действие ноопепта вызывало снижение активности ПДПА после последнего введения препарата в 1,6 раза через 24 ч и повышение активности фермента в 1,7 раза через 72 ч по сравнению с контрольной группой животных.
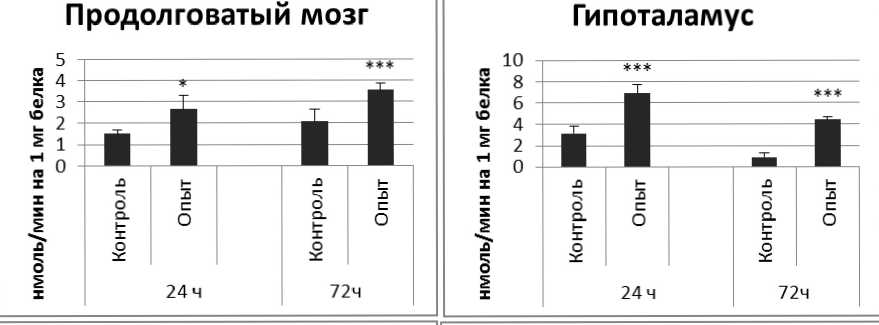
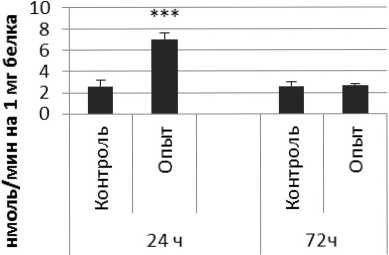
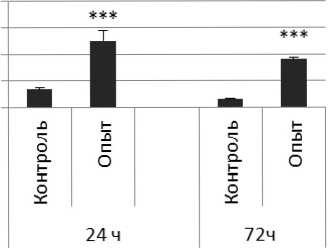
Активность ПДПА в нервной ткани крыс при длительном действии фенотропила представлена на рис. 3.
Стриатум
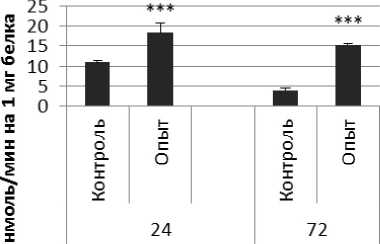
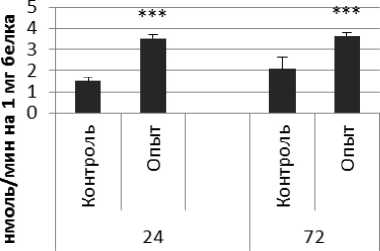
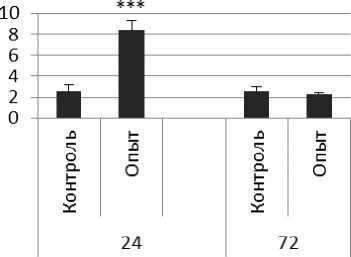
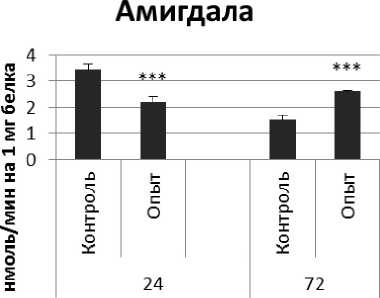
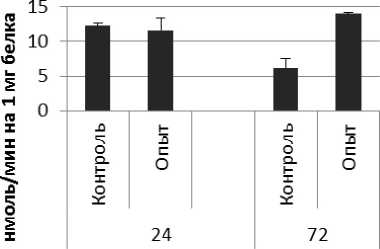
Рис. 2. Активность ПДПА при действии ноопепта в нервной ткани крыс (нмоль продукта, образовавшегося за 1 мин инкубации на 1 мг белка, М ±ш, п=6; * - р<0,05, ** - р<0,01, *** р<0,001 относительно контроля).
Гипофиз
Четверохолмие
Гиппокамп
Амигдала
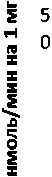
Стриатум
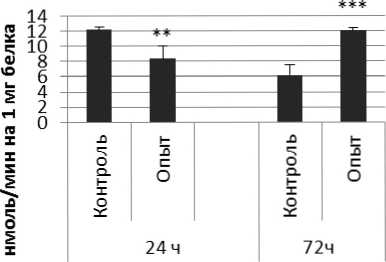
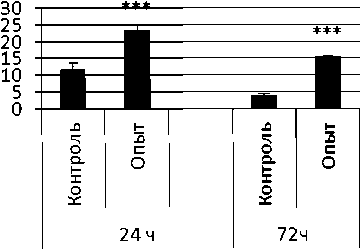
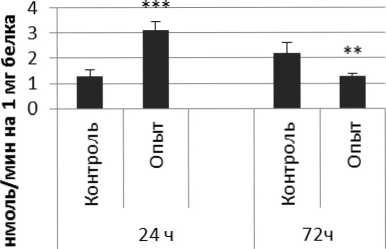
Рис. 3 . Активность ПДПА при действии фенотропила в нервной ткани крыс (нмоль продукта, образовавшегося за 1 мин инкубации на 1 мг белка, М ±ш, п=6; * - р<0,05, ** - р<0,01, *** р<0,001 относительно контроля).
Длительное введение фенотропила по сравнению с контрольной группой животных вызывало повышение активности пептидил-дипептидазы А в гипофизе в 2 раза через 24 ч и в 4 раза через 72 ч после последней инъекции препарата. Четверохолмие на длительное действие фенотропила по сравнению с контролем ответило повышением активности ПДПА в 2,5 раза через 24 ч после последнего введения препарата и снижением активности фермента в 1,7 раза через 72 ч после последней инъекции препарата. В продолговатом мозге отмечено повышение активности ПДПА в 1,7 раза через 24 и 72 ч после последней дозы препарата по сравнению с контрольной группой животных. В гипоталамусе зафиксировано повышение активности пептидил-дипептидазы А по сравнению с контролем через 24 и 72 ч соответственно в 2,2 и 4,9 раза после последней инъекции фенотропила. Гиппокамп обнаруживал повышение активности ПДПА по сравнению с контролем через 24 ч после последнего введения фенотропила в 2,7 раза. В амигдале длительное введение фенотропила по сравнению с контрольной группой животных вызывало повышение активности пептидил-дипептидазы А через 24 и 72 ч после последнего введения препарата в 3,7 и 6 раз соответственно. Длительное введение фенотропила по сравнению с контрольной группой живоных вызывало в стриатуме снижение активности пептидил-дипептидазы А через 24 ч в 1,5 раза и повышение активности фермента в 2 раза через 72 ч после последнего введения препарата.
Заключение. Ранее нами было показана актуальность исследований влияния синтетических ноотропных средств на активность металлозависимых протеиназ, так как этот процесс затрагивает механизмы нейтрометаболической стимуляции (Гамзин и др., 2015). Одним из направлений таких исследований может служить анализ активности металлокарбоксипептидаз при влиянии синтетических ноотропов, в условиях краткосрочного и длительного режимах их введения, у крыс.
Полученные в представленной работе результаты влияния синтетических ноотропных средств при длительном режиме их введения на активность пептидил-дипептидазы А (ПДПА) могут послужить одними из базисных для последующей разработки концепции нейрометаболической стимуляции организма в условиях их воздействия на него.
Выводы: 1. На длительное действие (каждые 24 ч на протяжении 14 суток) ноотропных препаратов (пирацетам, фенотропил, ноопепт) наиболее высокой активностью пептидил-дипептидазы А (ПДПА) ответили гипофиз и стриатум (при выведении крыс из эксперимента путем декапитации через 24 часа и через 72 ч после последней инъекции соответственно). 2. Выявленная общая тенденция особенно ярко проявила себя после инъекции пирацетама. 3. Динамика активности ПДПА может служить одним из маркерных тестов при реакции пептидергической системы на воздействие фармакологических препаратов, обладающих нейропротекторным действием.
Список литературы Активность пептидил-дипептидазы а в нервной ткани крыс при длительном действии ноотропных препаратов
- Вернигора А.Н. 2010. Влияние потребления этанола на активность карбоксипептидазы Н и ангиотензинпревращающего фермента в некоторых отделах мозга крыс с различной устойчивостью к стрессу//Известия ПГПУ им. В.Г. Белинского. Естественные науки. № 17 (21). С. 101-103.
- Воронина Т.А. 2000. Гипоксия и память. Особенности эффектов и применения ноотропных препаратов//Вестник Российской АМН. № 9. С. 27-34.
- Гамзин С.С., Алексеева Л.В., Лапина Г.П. 2015. Методологические аспекты биохимического и фармакологического анализа влияния ноотропов на пептидергическую систему и метаболизм в целом//Вестн. ТвГУ. Сер.: Биология и экология. № 3. С. 40-52.
- Ганцгорн Е.В. 2014. Комплексный анализ нейропротекторной активности ноотропов и их комбинаций с мелаксеном при экспериментальной ишемии головного мозга: автореф. дис. … канд. мед. наук. Волгоград. 27 с.
- Давыдова И.А. 2001. Клинико-фармакологические закономерности терапевтического действия препаратов с ноотропными свойствами: дис. … канд. мед. наук. М. 167 с.
- Золотарева Н.В. 2011. Регуляция каталитической активности алкогольдегидрогеназы фармакологическими препаратами Пирацетам, Зорекс и Унитиол: дис. … канд. биол. наук. Тверь. 189 с.
- Лапина Г.П., Золотарева Н.В. 2009. Пирацетам -регулятор каталитической активности алкогольдегидрогеназы печени лошади//Вестн. ТвГУ. Сер. Биология и экология. Вып. 11. № 2. С. 56-62.
- Руководство по лабораторным животным и альтернативным моделям в биомедицинских исследованиях. 2010/под ред. Н.Н. Каркищенко, С.В. Грачева. М.: Профиль-2С. 358 с.
- Lowry O.H., Rosebrought N.J., Farr A.G., Randall R.J. 1951. Protein measurement with the Folin phenol reagent//J. Biol. Chem. V. 193. No. 1. Р. 265-275.
- Supattapone S., Fricker L.D., Snyder S.H. 1984. Purification and characterization of a membrane-bound enkephalin-forming carboxypeptidase, “enkephalin convertase”//Neurochem. V. 42. No. 4. P. 1017-1023.


