Активность пероксидазы в органах и тканях деревьев березы повислой
Автор: Галибина Наталия Алексеевна, Целищева Юлия Леонидовна, Андреев Владимир Петрович, Софронова Ирина Николаевна, Никерова Михайловна
Журнал: Ученые записки Петрозаводского государственного университета @uchzap-petrsu
Рубрика: Биология
Статья в выпуске: 4 (133), 2013 года.
Бесплатный доступ
На деревьях березы повислой с разной степенью проявления узорчатости в структуре древесины в течение вегетационного сезона изучали активности кислых и основных пероксидаз во флоэмной и ксилемной частях камбиальной зоны. Для обеих форм березы повислой в тканях флоэмы активность пероксидазы была выше, чем в тканях ксилемы. Были выявлены отрицательные корреляции между активностью пероксидазы и интенсивностью камбиального роста. К июню, когда в стволовой части начинаются ростовые процессы, активность пероксидазы существенно снижалась по сравнению с маем, когда камбий еще неактивен. В конце июля продолжительные высокие температуры привели к существенному торможению камбиальной активности. При этом в ксилеме и во флоэме наблюдалось увеличение пероксидазной активности как для кислых, так и для основных форм фермента. Наличие высокой ферментативной активности обнаружено только в тканях ствола с узорчатым строением. У безузорчатых растений активность пероксидазы не изменялась. Обсуждаются возможные пути участия пероксидазы в процессах аномального морфогенеза древесных растений.
Карельская береза, пероксидазы, крахмал, пигменты
Короткий адрес: https://sciup.org/14750438
IDR: 14750438 | УДК: 581.1
Текст научной статьи Активность пероксидазы в органах и тканях деревьев березы повислой
Пероксидаза (1.11.1.7) – функционально очень лабильный фермент, способный выполнять многообразные функции в живых организмах. Основной функцией пероксидазы, наряду с супе-роксиддисмутазой и каталазой, является защита организма от вредного воздействия перекиси водорода и других активных форм кислорода, образующихся при окислительном стрессе [2], [24], [30]. Другой важной функцией этого фермента является непосредственное участие в процессах дифференциации тканей и органов высших наземных растений [17]. Поскольку субстратами пероксидазы могут быть фитогормоны (абсцизовая кислота, гибберелловая кислота, ауксин), фермент может регулировать состав физиологически активных веществ в тканях растения [14], [22].
Пероксидазе принадлежит ключевая роль в процессе лигнификации [3], [15], [16], [20], [21], который, в свою очередь, определяет некоторые различия между карельской березой ( Betula pendula var. carelica ) c аномальной узорчатой древесиной ствола и обычной березой повислой ( Betula pendula var. pendula ). Так, карельская береза отличается более высокой степенью жесткости структуры стенки ксилемных производных за счет увеличения лигнифика-ции [8].
У карельской березы при любом варианте скрещивания родительских форм в потомстве появляются особи как с узорчатой, так и без-узорчатой текстурой древесины. Для диагностики узорчатости в потомстве карельской березы был предложен метод определения активности пероксидазы лубяной ткани в одногодичных сеянцах в фазе глубокого покоя [13], но, несмотря на взаимосвязь данного фермента с ростовыми процессами в растительном организме и формированием аномальной структуры ствола, изучение активности пероксидазы в тканях и органах березы повислой ранее не проводилось. В связи с этим целью работы было изучить активность пероксидазы в тканях и органах у растений березы повислой с разной степенью узорчатости древесины.
ОБЪЕКТЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объектами исследования были 41-43-летние деревья обычной березы повислой ( Betula pendula Roth var. pendula ) и карельской березы ( B. pendula var. carelica ). Все растения произрастали в одинаковых почвенно-климатических условиях на Агробиологической станции Карельского научного центра РАН в 2 км от Петрозаводска (61o45‘ с. ш., 34o20’ в. д.).
Отбор образцов вели в течение 2010-2011 годов: май - распускание листьев (активный ксилемный транспорт); июнь - интенсивный прирост ксилемы (активный флоэмный транспорт ассимилятов к камбиальной зоне и ксилеме); июль – период активного роста, формирование вторичной клеточной стенки, в связи с отсутствием дождей и высокими температурами в это время имело место преждевременное торможение камбиального роста [7]; февраль – период покоя (из-за отрицательных температур транспорт отсутствует).
Из ствола берез препарировали ткани флоэмы и ксилемы. На анализ брали по три растения каждой формы березы.
Растительный материал растирали с жидким азотом, затем для получения экстракта ткани ксилемы и флоэмы гомогенизировали при 4 оС в буфере следующего состава: 50 мМ Hepes (pH = 7,5), 1 мМ ЭДТА, 1 мМ ЭГТА, 3 мМ DTT, 5 мМ MgCl2, 0,5 мМ PMS, экстрагировали 20 минут при 4 оС и центрифугировали при 10 000 g в течение 20 минут (центрифуга Sigma 2-16PK, Германия). Осадок троекратно промывали буфером. Осадок и объединенный супернатант диализовали при 4 оС в течение 18–20 часов против буфера для гомогенизации, разбавленного в 10 раз. Активность пероксидазы определяли в полученных после диализа ферментативных препаратах.
В качестве донора водорода использовали бензидин и гваякол, в качестве субстрата - перекись водорода.
Для определения активности пероксидазы в реакции окисления бензидина использовали реакционную смесь следующего состава: 50 мМ K, Na-фосфатный буфер (рН = 7,8), 2,5– 5 мМ перекись водорода и 34 мкМ бензидина. О ферментативной активности пероксидазы судили по интенсивности уменьшения оптической плотности в области поглощения бензидина (λ = 282 нм) и выражали ее таким образом: израсходовано мкмоль бензидина / г сырой ткани за минуту.
Состав реакционной смеси для определения активности пероксидазы в реакции окисления гваякола был следующий: 50 мМ K, Na-фосфатный буфер (рН = 5), 2,5-5 мМ перекиси водорода, 21,5 мМ гваякола. Ферментативную активность пероксидазы определяли по скорости образования продукта реакции тетрагваякола (с учетом коэффициента экстинкции ε470нм = 0,0266 мкМ-1см-1) и выражали следующим образом: образовалось мкмоль тетрагваякола / г сырой ткани за минуту.
Изменения электронных спектров поглощения реакционной смеси, содержащей ферментативный препарат из тканей ксилемы карельской березы, перекись водорода и гваякол (21,5 mM) или бензидин (33,6 мкМ), приведены в работе [1].
В листьях определяли содержание хлорофиллов и каротиноидов. Для этого замороженные высечки листьев растирали на холоде в 80 % ацетоне. Содержание хлорофиллов a и b и сумму каротиноидов определяли спектрофотометрически (спектрофотометр СФ 2000, Россия) в ацетоновой вытяжке при длинах волн 663 и 646 нм (хлорофиллы) и 470 нм (каротиноиды) [5]. Долю хлорофиллов в светособирающем комплексе (ССК) рассчитывали исходя из того, что весь Хл b находится в ССК, а соотношение хлорофиллов а / b в этом комплексе составляет 1,2 [27].
Крахмал из листьев и тканей извлекали хлорной кислотой [29], его содержание определяли по количеству образованной в результате кислотного гидролиза глюкозы глюкозооксидаз-ным методом.
Данные на графиках представляют средние арифметические значения, полученные из трех биологических и четырех аналитических повторностей опыта.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Активность пероксидазы в тканях ствола деревь ев березы повислой
Индивидуальные пероксидазы различаются по субстратной специфичности, что связано с изменением заряда и конфигурации фермента и субстрата при разных значениях рН [6]. Инкубационная среда в реакции окисления гваякола по значению рН ближе к рН-оптимуму для ва-куолярных пероксидаз и пероксидаз клеточных стенок, в то время как в реакции окисления бензидина условия соответствуют рН-оптимуму цитоплазматических пероксидаз.
В мае во флоэме у растений обычной березы повислой были обнаружены высокие активности пероксидазы как в реакции окисления гваякола, так и бензидина. В тканях ксилемы в этот период активности пероксидаз не определялись совсем (рис. 1). Причиной высокой активности пероксидазы может быть повышение субстратов, в том числе соединений фенольной природы. В мае во флоэме активируется гидролиз полимерных компонентов, в результате мобилизации запасных веществ образуется большое количество сахаров, основная масса которых со ксилемным соком поднимается к главным акцепторам асси-милятов – распускающимся листьям, но часть сахаров используется в клетке на метаболические нужды, в том числе на образование фенольных соединений.
В июне – июле интенсивно фотосинтезирующие листья являются донорами ассимилятов, а основным местом потребления метаболитов становится камбиальная зона и формирующиеся клетки ксилемы и флоэмы. В этот период у растений березы повислой в ксилеме обнаружена самая высокая активность сахарозосинтазы [7], благодаря которой сахароза интенсивно оттекает из флоэмы в камбиальную зону, где в результате ее метаболизации по сахарозосинтазному пути появляется большое количество УДФ-глю-козы, идущей на синтез компонентов клеточных стенок ксилемы. При этом в июне во флоэме происходило снижение активности гваяколовой и бензидиновой пероксидазы, в то время как в ксилеме эти пероксидазы начинали проявлять незначительную активность (рис. 1а, б).
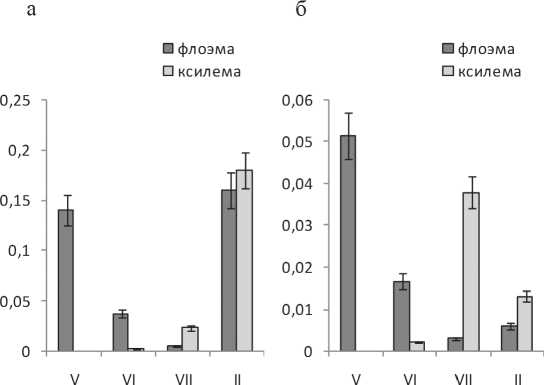
Рис. 1. Активность пероксидазы в тканях ствола растений B. pendula var. pendula в реакции окисления гваякола (а) и бензидина (б). По оси абсцисс – время взятия образцов (месяц), по оси ординат – активность фермента: а – мкмоль образовавшегося тетрагваякола на 1 г сырой ткани за минуту, б – мкмоль израсходованного бензидина на 1 г сырой ткани за минуту
Середина и конец июля в нашем исследовании – это период торможения деятельности камбия, вызванного погодными условиями. Так, отсутствие дождей в течение июля и высокие температуры привели к преждевременному торможению камбиального роста и снижению активности сахарозосинтазы в ксилеме [7].
В этот период у обычной березы повислой во флоэме происходило дальнейшее снижение активности пероксидазы, в то время как в ксилеме ее активность возрастала, особенно в реакции окисления бензидина. Так, активность бензидиновой пероксидазы в ксилеме в июле была самой высокой за весь сезон (рис. 1б). В феврале растения находились в состоянии вынужденного покоя, то есть все изменения в метаболических процессах были обусловлены в первую очередь влиянием внешних факторов, таких как свет и температура. Как во флоэме, так и в ксилеме в этот период активности пероксидаз в реакции окисления бензидина были невысоки (рис. 1б), в то время как активность гваяколовых пероксидаз в тканях ствола была довольно высокой (рис. 1б). Вероятно, у обычной березы повислой в период вынужденного покоя пероксидазы клеточных стенок и вакуолярные пероксидазы, в отличие от цитоплазматических, принимают активное участие в метаболических процессах.
Таким образом, получено, что активность пероксидазы находится в обратной корреляции с ростовыми процессами.
У растений карельской березы активности пероксидаз как в реакции окисления гваякола (рис. 2а), так и в реакции бензидина (рис. 2б) были примерно в 10 раз выше по сравнению с обычной березой повислой. Высокая активность пероксидазы может быть причиной увеличения у карельской березы жесткости структуры клеточной стенки по сравнению с обычной березой, как было показано нами ранее [8].
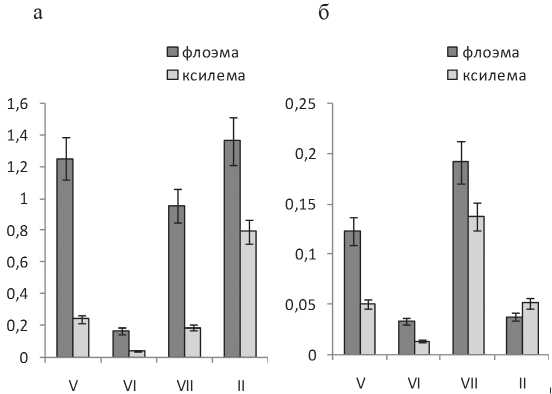
Рис. 2. Активность пероксидазы в тканях ствола растений B. pendula var. carelica в реакции окисления гваякола (а) и бензидина (б). Обозначения, как на рис. 1
Именно пероксидаза участвует в укреплении клеточной стенки растений путем катализа полимеризации фенольных соединений с образованием лигнина и суберина [19], [23], [25], [31] и их кросс-связывания с такими структурными белками, как экстенсин [18] и гидроксипролин-богатые белки [28].
Еще одна отличительная особенность карельской березы – это существенное возрастание в июле в тканях флоэмы активности всех форм пероксидаз (рис. 2а, б). Повышение пероксидазной активности при торможении камбиального роста у узорчатых растений может быть связано с возрастанием утилизации сахарозы на синтез соединений фенольной природы.
Тот факт, что у обычной березы повислой не происходило возрастания пероксидазной активности в период снижения камбиального роста во флоэме, может свидетельствовать о включении у нее избытка сахаров в другие метаболические процессы. Известно, что хорошим индикатором изменения условий среды является крахмал [11], который может временно депонироваться в растении при избытке метаболитов. Крахмал накапливается в виде слоистых зерен различного размера, и поскольку зерна не могут передвигаться из клетки в клетку, то крахмал обнаруживается именно там, где он синтезируется [10].
В мае – июне в тканях ствола у двух форм березы повислой не обнаруживалось большого количества крахмала (рис. 3). При снижении камбиальной активности у 40-летних растений его количество возрастало у карельской березы во флоэме (рис. 3а), а у обычной березы – во флоэме и ксилеме (рис. 3). Особенно существенное увеличение содержания крахмала происходило во флоэме у обычной березы повислой, его значения достигали 50 мг/г (рис. 3).
а б
□ var. carelica □ var. carelica
□ var.pendula Dvar.pendula
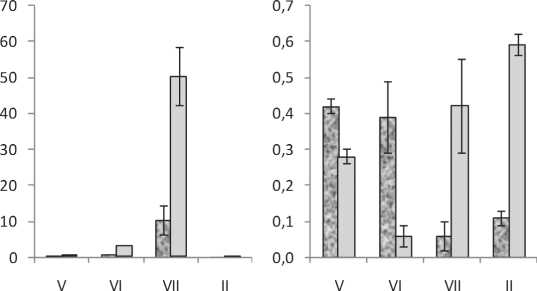
Рис. 3. Содержание крахмала (мг/г сухой ткани) во флоэме (а) и ксилеме (б) у растений березы повислой. По оси абсцисс – время взятия образцов (месяц)
Таким образом, временно образующийся во флоэме избыток метаболитов по причине торможения камбиального роста у обычной бере- зы повислой откладывается в виде крахмала, а у карельской березы, вероятно, идет синтез вторичных метаболитов, в котором пероксидаза принимает активное участие.
Динамика активности пероксидазы в листьях
У 40-летних деревьев березы повислой в июне в листьях, которые выступают в качестве донора вновь синтезированных органических веществ, активность пероксидазы (рис. 4) была значительно ниже, чем в тканях флоэмы и ксилемы (рис. 1а, 2а) в этот период.
Длительное действие высоких температур в июле и отсутствие дождей, приведшее к временному снижению камбиальной активности, не могли не сказаться и на метаболическом статусе листьев. Так, активность фермента в листьях B. pendula var. pendula снизилась в семь раз, в то время как у B. pendula var. carelica активность пероксидазы почти не изменилась (рис. 4).
-
□ var. pendula
-
□ var. carelica
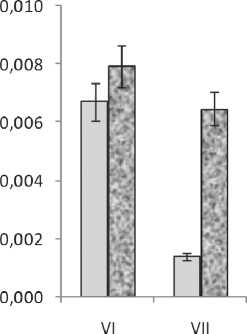
Рис. 4. Активность пероксидазы (образуется мкмоль тетрагваякола на 1 г сырой ткани за минуту) в листьях у растений березы повислой в период активного роста (VI – июнь, VII – июль)
Известно, что при действии неблагоприятных факторов [26], в том числе повышенной температуры [32], [33], в клетках растений развивается окислительный стресс, связанный с повышенной продукцией активных форм кислорода (АФК). Наряду с антиоксидантными ферментами, к которым относится пероксидаза, у растений к важным низкомолекулярным антиоксидантам относятся пигменты [12].
Изучение изменения содержания пигментов в листьях карельской березы показало, что длительное действие высоких температур приводило к снижению суммарного содержания хлорофиллов ( хл а + хл b ) (рис. 5а) и каротиноидов (рис. 5б) примерно в 1,5 раза. Следует отметить, что в листьях обычной березы повислой не происходило достоверных изменений в количестве фотосинтезирующих пигментов (рис. 5а, б).
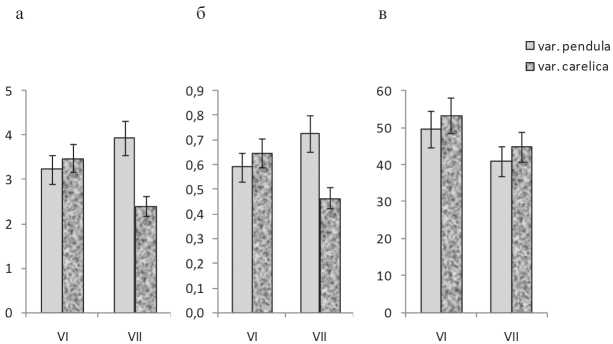
Рис. 5. Содержание хлорофиллов ( хл а + хл b ) (а), каротиноидов (б) (мг/г сухой ткани) и количество пигментов в светособирающем комплексе (%) (в) в листьях растений березы повислой в период активного роста (VI – июнь, VII – июль)
Устойчивость фотосинтетического аппарата растений формируется за счет изменения концентрации и перераспределения зеленых и желтых пигментов в ССК [4]. У обеих форм растений березы повислой к июлю наблюдалось снижение количества хлорофиллов примерно в 1,2 раза по сравнению с июнем в составе ССК (рис. 5в), что в условиях повышенных температур можно рассматривать как адаптивную реакцию, позволяющую избежать фотоингибирования путем уменьшения количества поглощаемого света [9].
Подводя итог, можно заключить, что в ответ на длительное влияние высоких температур на фоне отсутствия дождей, приведшее к торможению камбиального роста ствола, у двух форм березы повислой в листовом аппарате происходили разные изменения. У обычной березы повислой снижение доли хлорофиллов в ССК сопровождалось возрастанием суммы хлорофиллов и содержания каратиноидов при существенном снижении активности пероксидазы. У карельской березы снижение доли хлорофиллов в ССК, наоборот, происходило на фоне снижения содержания пигментов, при этом активность пероксидазы почти не изменялась.
Таким образом, в результате проведенного исследования было установлено, что в аномальных по строению тканях ствола карельской березы активность пероксидазы значительно превосходит таковую в тканях обычной березы повислой. Наблюдаемые изменения активности фермента на разных фазах развития указывают на его активное участие в метаболических процессах и свидетельствуют о перспективности выбранного направления исследований. Настоящую работу можно рассматривать как первое приближение к пониманию функциональной роли пероксидазы в процессах, предшествующих и сопровождающих нарушение морфогенеза у древесных растений.
Список литературы Активность пероксидазы в органах и тканях деревьев березы повислой
- Андреев В. П., Соболев П. С., Зайцев Д. О., Галибина Н. А., Зыкина Н. С., Плясунова Л. Ю., Романова М. И. Взаимодействие цинк-тетрафенилпорфина, бромистого пропаргила и пероксидазы хрена с анилинами//Ученые записки Петрозаводского государственного университета. Сер. «Естественные и технические науки». 2011. № 6 (119). C. 7-15.
- Андреев И. М. Функции вакуоли в клетках высших растений//Физиология растений. 2001. Т. 48. С. 777-778.
- Андреева В. А. Фермент пероксидаза: участие в защитном механизме растений. М.: Наука, 1988. 129 с.
- Бухов Н.Г. Динамическая световая регуляция фотосинтеза//Физиология растений. 2004. Т. 51. С. 825-837.
- Гавриленко В. Ф., Жигалова Т. В. Большой практикум по фотосинтезу. М.: Издательский центр «Академия», 2003. 256 с.
- Газарян И. Г., Хушпульян Д. М., Тишков В. И. Особенности структуры и механизма действия пероксидазы растений//Успехи биологической химии. 2006. Т. 46. С. 303-322.
- Галибина Н. А., Красавина М. С., Новицкая Л. Л., Софронова И. Н. Ферменты метаболизации сахарозы при формировании аномалий карельской березы//Структурные и функциональные отклонения от нормального роста и развития растений под воздействием факторов среды: Материалы междунар. конф. Петрозаводск: Карельский научный центра РАН, 2011. С. 79-84.
- Галибина Н. А., Теребова Е. Н. Свойства клеточных оболочек тканей ствола Betula pendula Roth//Дендроэкология и лесоведение: Материалы всероссийской конф. Красноярск: Институт леса им. В. Н. Сукачева СО РАН, 2007. С. 32-35.
- Дымова О. В., Гриб И., Головко Т. К., Стржалка К. Состояние пигментного аппарата зимне-и летнезеленых листьев теневыносливого растения Ajuga reptans//Физиология растений. 2010. Т. 57. С. 809-818.
- Кретович В. Л. Биохимия растений. М.: Высш. шк., 1986. 503 с.
- Новицкая Ю. Е. Особенности физиолого-биохимических процессов в хвое и побегах ели в условиях Севера. Л.: Наука, 1985. 116 с.
- Полесская О. Г., Каширина Е. И., Алехина Н. Д. Изменение активности антиоксидантных ферментов в листьях и корнях пшеницы в зависимости от формы и дозы азота в среде//Физиология растений. 2004. Т. 51. С. 686-691.
- Попов В. К., Авраменко Р С., Филоненко Е. В. Способ диагностики узорчатой древесины карельской березы//Описание изобретения к патенту Российской Федерации. 1996. № 2063679.
- Рогожин В. В. Пероксидаза как компонент антиоксидантной системы живых организмов. СПб.: ГИОРД, 2004. 240 с.
- Черепанова Е. А. Хитин-специфичные пероксидазы растений: Дис.. канд. биол. наук. Уфа, 2005. 275 с.
- Шарова Е. И. Клеточная стенка растений. СПб.: Изд-во СПбГУ, 2004. 156 с.
- Borсhert R. Time course and spatial distribution of phenylalanine ammonia lyase and peroxidase activity in wounded potato tuber tissue//Plant Physiol. 1978. Vol. 62. P. 789-793.
- Brownleader M. D., Hopkins J., Mobasheri A. et al. Role of extension peroxidase in tomato (Lycopercicon esculentum Mill.) seedling growth//Planta. 2002. Vol. 210. P. 668-676.
- Dehon L., Macheix J. J., Durand M. Involvement of peroxidases in the formation of the brown coloration of heartwood in Juglans nigra//Journal of Experimental Botany. 2002. Vol. 53. P. 303-311.
- Donaldson L. A. Lignification and lignin topochemistry -an ultrastructural view//Phytochem. 2001. Vol. 57. P. 859-873.
- Fry S. C. Phenolic components of the primary cell wall and their possible role in the hormonal regulation of growth//Planta. 1979. Vol. 146. P. 343-351.
- Gove J. P., Hoyle M. C. The isozymic similarity of indoleacetic acid oxidase to peroxidase in bich and horseradish//Plant Physiol. 1975. Vol. 56. P. 684-687.
- Hawkins S., Boudet A. Defense lignin and hydroxycinnamyl alcohol dehydrogenase activities in wounded Eucalyptus gunnii//Forest Path. 2003. Vol. 33. P. 91-104.
- Jansen M. A. K., Van den Noort R. E., Tan M. Y. et al. Phenol-oxidizing peroxidases contribute to the protection of plants from ultraviolet radiation stress//Plant Physiol. 2001. Vol. 126. P. 1012-1023.
- Kawano T. Roles of the reactive oxygen species-generating peroxidase reactions in plant defense and growth induction//Plant Cell Rep. 2003. Vol. 21. P. 829-837.
- Kuzniak E. Transgenic plants: an insight into oxidative stress tolerance mechanisms//Acta physiol. Plant. 2002. Vol. 24. P. 97-113.
- Lichtenthaler H. K. Vegetation stress: an introduction to the stress concept in plants//J. Plant Physiol. 1996. Vol. 148. P. 4-14.
- McDougall G. J. Cell-wall proteins from Sitka spruce xylem are selectively insolubilised during formation of dehydrogenation polymers of coniferyl alcohol//Phytochem. 2001. Vol. 57. P. 157-163.
- Pucher G. W., Leavenworth C. S., Vickery H. B. Determination of starch in plant tissues//Analyt. Chem. 1948. Vol. 20. P. 850-853.
- Rizhsky L., Hallak-Herr E., Van Breusegem F. et al. Double antisence plants lacking ascorbate peroxidase and catalase are less sensitive to oxidative stress than single antisense plants lacking ascorbate peroxidase or catalase//Plant J. 2002. Vol. 32. P. 329-342.
- Wallace G., Fry S. C. Action of diverse peroxidases and laccases on six wall-related phenolic compounds//Phytochemistry. 1999. Vol. 52. P. 769-773.
- Zang J., Kirkham M. B. Drought-stress induced changes in activities of superoxide dismutase, catalase and peroxidase in wheat species//Plant cell physiol. 1994. Vol. 35. P. 785-791.
- Zhang J., Kirkham M. B. Enzymatic Responses of the Ascorbate-Glutathione Cycle to Drought in Sorghum and Sunflower Plants//Plant Sci. 1996. Vol. 113. P. 139-147.


