Активность протеасом в тканях злокачественных опухолей различных локализаций
Автор: Спирина Людмила Викторовна, Кондакова Ирина Викторовна, Усынин Евгений Анатольевич, Коломиец лариса александровнА., Чойнзонов Евгений Лхамацыренович, Мухамедов Марат Рафкатович, Чернышова Алена Леонидовна, Шарова Н.П.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 5 (35), 2009 года.
Бесплатный доступ
В результате проведенного исследования активности протеасом у больных злокачественными опухолями различных локализаций установлены разнонаправленные их значения. В ткани опухоли почки происходило снижение активности про- теасом по сравнению с окружающей неизмененной тканью. При раке мочевого пузыря активность ферментов в опухоли не отличалась от их активности в окружающей ткани. В опухолевой ткани эндометрия и в плоскоклеточных карциномах головы и шеи активность протеасом была повышена по сравнению с окружающей неизмененной тканью. Увеличение активности протеасом при злокачественных новообразованиях обусловлено увеличением активности пула 20S-протеасом.
Активность протеасом, 20s протеасомы, 26s протеасомы, рак почки, рак мочевого пузыря, рак эндометрия, плоскоклеточные карциномы головы и шеи
Короткий адрес: https://sciup.org/14055183
IDR: 14055183 | УДК: 616-006.6:577.156
Текст научной статьи Активность протеасом в тканях злокачественных опухолей различных локализаций
Развитие злокачественных новообразований тесно связано с комплексом протеаз, получивших название «раковый деградом», которые определяют такие важные свойства опухолей, как инвазия и метастазирование [13]. Кроме того, внутриклеточные протеолитические системы, расщепляя регуляторные и сигнальные белки, принимают участие в различных процессах – пролиферации, апоптозе и др. Наиболее важную роль в деградации белков клетки играет протеасомная система, которая представляет собой внутриклеточный ферментативный комплекс, отвечающий за специфический протеолиз белков. Протеасома обладает трипсиноподобной, химотрипсиноподобной, каспазной активностями. Выделяют 20S и 26S пулы протеасом [4, 8, 17]. Полный протеолиз происходит в 26S протеасоме, однако каталитической активностью обладает также 20S пул. Узнавание белков-мишеней, подлежащих расщеплению, осуществляется компонентами, не принадлежащими протеолитическому комплексу, а именно, убиквитинами и белками, их переносящими [3, 16]. 26S протеасомы осуществляют убиквитин- и АТФ-зависимый протеолиз благодаря наличию в их составе 19S-субчастицы, способной распознавать убиквитинированные белки, а также расплетать их и проталкивать в протеолитическую камеру [8, 16]. 20S протеасо-мы гидролизуют белки, главным образом, с поврежденной третичной структурой независимо от убиквитина [11].
Протеасомы играют важную роль в поддержании функциональной активности клеток, в частности в регуляции работы сигнальных систем, которые активируются при взаимодействии ростовых факторов с соответствующими рецепторами [10, 12]. Нарушение в функционировании протеасомного комплекса связано со многими патологиями и имеет большое значение в развитии онкологических заболеваний. В экс- периментальных условиях показано изменение активности и состава пула 26S протеасом в онкогенезе [2]. В настоящее время активно изучается роль убиквитинзависимого протеолиза в патогенезе злокачественных образований различных локализаций, в частности предстательной железы [14], молочной железы [7], кишечника [18] и др. Однако в этих исследованиях большое внимание уделяется изучению убиквитинирова-ния белков, в то время как активность протеасом исследована недостаточно.
В связи с этим целью данной работы явилось изучение изменения активности протеасомной системы при раке почки, мочевого пузыря, эндометрия и при плоскоклеточном раке головы и шеи.
Материал и методы исследования
В исследование были включены 12 больных раком почки T2–3N0–1M0–1 (средний возраст – 53,4 ± 3,1 года), 13 больных раком мочевого пузыря T2–3N0M0 (средний возраст – 56,0 ± 2,3 года), 7 больных раком эндометрия T1–2N0M0 (средний возраст – 66,57 ± 2,1 года) и 12 больных с опухолями гортани и гортаноглотки T1–4N0–2M0 (средний возраст – 57,7 ± 2,19 года), проходивших комбинированное лечение в клиниках НИИ онкологии СО РАМН, г. Томск. Материалом исследования являлись опухолевая ткань почки, мочевого пузыря, эндометрия, гортани и гор-таноглотки и визуально не измененная ткань, находящаяся на расстоянии не менее 1 см от границы опухолей. В 10 случаях опухоли почки диагностирован светлоклеточный почечноклеточный рак, в 2 – папиллярный почечноклеточный рак. В группе больных со светлоклеточным раком почки регионарные и отдаленные метастазы имели 2 больных. Среди больных раком мочевого пузыря не было больных с регионарными метастазами. Больные раком эндометрия были распределены по стадиям заболевания следующим образом: 5 пациентов имели IB стадию, 2 – II стадию. При гистологическом исследовании ткани рака эндометрия верифицирован эндометриоидный рак в 6 образцах и в 1 случае – неэндометриоидный рак. Опухоли головы и шеи представляли собой плоскоклеточную карциному гортани и гортаноглотки. Регионарные лимфогенные метастазы имели 7 больных опухолями головы и шеи
Получение осветленных гомогенатов. Замороженную ткань (100 мг) гомогенизировали в жидком азоте, затем ресуспендировали в 300 мкл 50 мМ трис-HCl буфера (pH=7,5), содержащего 2 мМ АТФ, 5 мМ хлорид магния, 1 мМ дитиотреитол, 1мМ ЭДТА и 100 мМ хлорид натрия. Гомогенат центрифугировали 60 мин при 10000g и 4оС. Супернатант (осветленный гомогенат) использовали для определения активности протеасом.
Фракционирование протеасом. Все процедуры проводили при 4°С. 100 мг ткани гомогенизировали в жидком азоте, затем ресуспендировали в 1000 мкл 50 мМ трис-HCl буфера (pH=7,8), содержащего 2 мМ АТФ, 5 мМ хлорид магния, 1мМ ЭДТА и 100 мМ хлорид натрия. Гомогенат центрифугировали 60 мин при 10000g и 4оС на микроцентрифуге Eppendorf Centrifuge 5415R (Германия). Белки осветленных гомогенатов фракционировали с помощью сульфата аммония в два этапа. Фракцию, обогащенную 26S-протеасомами, получали добавлением сульфата аммония до 40 % насыщения, фракцию 20S-протеасом – добавлением сульфата аммония до 70 % насыщения [1]. Сульфат аммония до 40 % насыщения вносили порциями в течение 20 мин на магнитной мешалке. После полного растворения сульфата аммония препарат перемешивали в течение 20 мин, затем центрифугировали при 12500 об/мин в течение 20 мин, осадок растворяли в 250 мкл 20 мМ Трис- HCl буфера (pH 7,5), содержащего 2 мМ АТФ, 5 мМ хлорид магния, 1мМ ЭДТА и 20 % глицерин. К полученной надосадочной жидкости добавляли сульфат аммония до 70 % насыщения. Процедуру высаливания проводили так же, как указано выше. Осадок растворяли в 250 мкл 20 мМ Трис-HCl буфера (pH 7,5), содержащего 1мМ ЭДТА и 20 % глицерин.
Определение активности протеасом. Активность тотального пула протеасом, содержащего формы 26S и 20S, определяли в осветленных гомогенатах опухолевых и неизмененных тканей по гидролизу флуорогенного олигопептида Suc-LLVY-AMC, утилизирующегося химотрип-синподобными центрами протеасом [5]. Активность пулов 26S и 20S протеасом определяли в соответствующих фракциях, полученных из опухолевых и неизмененных тканей. Реакционная смесь для определения активности тотального пула протеасом и пула 26S протеасом содержала
20 мМ Tris-HCl (pH 7,5), 1 мМ дитиотрейтола, 30 мкМ Suc-LLVY-AMC, 5 мМ MgCl2 и 1 мМ АТФ. Реакционная смесь для определения активности пула 20S протеасом имела такой же состав за исключением MgCl2 и АТФ. Реакцию проводили при 370С в течение 20 мин. Образовавшийся продукт регистрировали на флуориметре «Hitachi-850» (Япония) при длине волны возбуждения 380 нм и эмиссии 440 нм. За единицу активности протеасом принимали количество фермента, при котором гидролизуется 1 нмоль Suc-LLVY-AMC в течение 1 мин. Удельную активность протеасом выражали в единицах активности на 1мг белка. Содержание белка определяли по методу Лоури [15].
В таблице все результаты представлены как m±M, где m – среднее выборочное, M – ошибка среднего. Значимость различий исследовали при помощи непараметрического критерия Манна– Уитни. Степень и значимость корреляционной связи между показателями оценивали с помощью коэффициента Спирмена. Статистическую обработку результатов проводили с применением пакета статистических программ Statistica 6.0.
Результаты и обсуждение
В результате проведенного исследования выявлено, что протеасомная активность в ткани рака почки значительно выше, чем в прилегающей ткани (таблица). Следует отметить, что на активность протеасом существенное влияние оказывал гистологический тип рака почки. При выделении группы с почечноклеточным светлоклеточным раком протеасомная активность в ткани опухоли была достоверно ниже (в 4,3 раза) по сравнению с неизмененной тканью (37,5 ± 5,0×103Ед/мг белка). При папиллярном варианте рака почки активность была повышена до 237,4×103 Ед/мг, что требует дополнительного исследования. Снижение активности ферментов в ткани светлоклеточного рака почки, вероятно, ассоциировано с дефектом E3 лигазы, фермента внутриклеточной убиквитин-зависимой системы [6, 12].
Протеасомная активность в ткани мочевого пузыря не отличалась от этого показателя в неизмененной ткани (таблица).
В ткани рака эндометрия активность про-теасом была достоверно выше по сравнению с неизмененной тканью (соответственно 65,11 ± 16,94×103 Ед/мг белка и 30,48 ± 1,14×103 Ед/мг белка). В случае неэндометриодного рака активность ферментов повышалась до 150×103 Ед/мг белка.
Активность протеасом в ткани плоскоклеточных карцином головы и шеи была достоверно выше по сравнению с ее активностью в неизмененной ткани (таблица). Для изучения особенностей высокой активности протеасом в опухолях данной локализации было проведено фракционирование протеасом. На рис. 1 представлена активность 26S и 20S пулов про-теасом в неизмененной и опухолевой тканях. В опухолевой ткани была отмечена трехкратная разница между активностями различных пулов протеасом, в то время как в неизмененной ткани активность 26S пула была незначительно ниже 20S пула. Активность 20S фракции в опухолевой ткани была выше на 11,85×103 Ед/мг белка по сравнению с активностью фракции в неизмененной ткани. Однако различий в активности 26S-протеасом в опухолевой и неизмененной тканях не обнаружено. Следовательно, рост активности протеасом в опухолевой ткани происходит за счет 20S фракции. При изучении связи показателей внутриклеточного протеолиза и протеолиза в отдельных фракциях в опухолевой
Протеасомная активность при раке почки, мочевого пузыря, эндометрия и при плоскоклеточных карциномах головы и шеи
Таблица
|
Вид опухоли |
n |
Протеасомная активность неизмененной ткани, ×103 Ед/мг белка |
n |
Протеасомная активность ткани опухоли, ×103 Ед/мг белка |
|
Рак почки |
6 |
117,6 ± 17,3 |
12 |
50,7 ± 46,2* |
|
Рак мочевого пузыря |
5 |
43,6 ± 10,5 |
13 |
47,2 ± 6,8 |
|
Рак эндометрия |
7 |
30,5 ± 1,1 |
7 |
65,1 ± 16,9* |
|
Плоскоклеточные карциномы головы и шеи |
3 |
14,4 ± 0,7 |
12 |
35,5 ± 4,6* |
Примечание: * – различия статистически значимые (p<0,05).
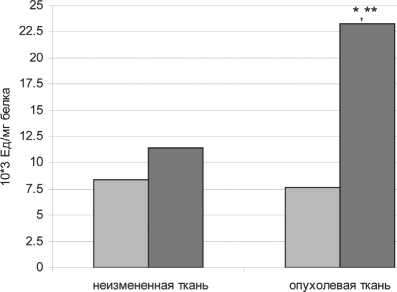
□ Фракция 26S □ Фракция 20S
Рис. 1. Активность 26S и 20S протеасом в неизмененной и опухолевой ткани (плоскоклеточный рак головы и шеи). Примечание: * – значимость различий между активностью 20S протеасом неизмененной и опухолевой ткани (p<0,05);
** – значимость различий между активностью 26S и 20S протеасом опухолевой ткани (p<0,05)
ткани показана зависимость общей активности протеасом от активности 20S фракции (R=0,86; p=0,0001). Известно, что 20S протеасома способна разрушать мелкие пептиды [9]. Вероятно, накопление ростовых факторов, метаболитов и других биологически активных веществ приводит к стимуляции внутриклеточного протеолиза и усиленной сборке мультикаталитических субъединиц ферментов. Однако сборка 26S-протеасом требует большого временного периода, поэтому расщепление пептидов в опухолях преимущественно происходит в 20S-протеасомах.
Таким образом, в результате проведенного исследования активности протеасом у больных злокачественными опухолями различных локализаций установлены разнонаправленные их значения. В ткани опухоли почки наблюдается более высокая активность протеасом в окружающей ткани, по сравнению со злокачественной, что, вероятно, может служить признаком распространенности процесса. При переходноклеточном раке мочевого пузыря не было выявлено различий в активности про-теасом опухоли и в неизмененной ткани. В опухолевой ткани эндометрия и при плоскоклеточных карциномах головы и шеи происходит увеличение активности протеасом в опухоли по сравнению с окружающей тканью. Активация внутриклеточного специфического протеолиза связана с увеличением активности пула 20S СИБИРСКИЙ ОНКОЛОГИЧЕСКИЙ ЖУРНАЛ. 2009. №5 (35)
протеасом, который осуществляет разрушение поврежденных белков, метаболитов и биологически активных пептидов, регулируя множество процессов, важных для развития опухолей.
Работа частично выполнена при финансовой поддержке Российского фонда фундаментальных исследований (грант № 08–04–00616а)


