Активность протолитических ферментов растений под воздействием лектинов эндофитных и эпифитных штаммов Azospirillum
Автор: Аленкина С.А., Никитина В.Е.
Журнал: Журнал стресс-физиологии и биохимии @jspb
Статья в выпуске: 2 т.12, 2016 года.
Бесплатный доступ
Мы изучили способность лектинов, изолированных от поверхности двух штаммов азотфиксирующих почвенных бактерий рода Azospirillum, A. brasilense Sp7 (эпифит) и A. brasilense Sp245 (эндофит), чтобы показать, оказывают регулирующее действие на активность пектинолитических ферментов в корнях саженцев пшеницы. Результаты исследований показали, что изучаемые лектины могут вызывать индукцию активности полигалактуроназы, пектинэстеразы, пектатлязы из клеточной стенки растения, тем самым обеспечивая проникновение бактерий в растительные ткани, а также индукцию ответов растений, которые в сочетании с стимулирующий рост бактерий, способствует формированию стабильности и продуктивности растений.
Короткий адрес: https://sciup.org/14323991
IDR: 14323991
Текст научной статьи Активность протолитических ферментов растений под воздействием лектинов эндофитных и эпифитных штаммов Azospirillum
Бактерии рода Azospirillum (альфа-субкласс протеобактерий) известны много лет как улучшающие рост растений ризобактерии (plant growth promoting rhizobacteria - PGPR) (Okon, Vanderleyden, 1997).
Бактерии обладают рядом очень важных свойств для эффективного ассоциативного взаимодействия с растениями - способностью к азотфиксации, продукции фитогормонов, солюбилизации фосфатов, улучшению водного и минерального статуса, продукции ряда соединений, увеличивающих мембранную активность и пролиферацию тканей корневой системы, уменьшать влияние стрессоров на растение и осуществлять контроль многочисленных фитопатогенов (Bashan et al. , 2004). Они были изолированы из ризосферы многих трав и злаков, произрастающих как в тропическом так и в умеренном климате. Азоспириллы, в основном колонизируют поверхность корня, и лишь некоторые штаммы способны проникать во внутренние ткани корня (Steenhoudt, Vanderleyden, 2000; Saikia et al. , 2012). Вопросы, связанные с проникновением бактерий в ткани корня растений являются одними из невыясненных в исследовании азотфиксирующих бактериально-растительных ассоциаций.
Фитопатогенные и мутуалистические микроорганизмы, такие как Rhizobium и Azospirillum являются известными продуцентами ферментов деградирующих пектин клеточной стенки растений (Khammas et al., 1989). В тоже время показана способность ризобий за счет Nod фактора индуцировать активность этих ферментов в самой растительной клетке на начальных этапах взаимодействия (Xie et al., 2012).
С действием пектолитических ферментов связывают не только процессы разрушения пектиновых веществ при проникновении и продвижении по тканям растения, но и изменение проницаемости для воды и ионов. Повреждающее действие пектолитических ферментов вызывает сдвиг физиологических процессов и развитие в тканях растения ответных реакций, соотношение которых может определять исход взаимоотношений между организмами.
Как показано в большинстве случаев, пектинолитические ферменты растений, являются гликопротеинами и, следовательно, несут детерминанты специфичности (Albersheim, Valent, 1978). Присутствие в молекулах пектолитических ферментов углеводов (Cervone et al. , 1981) может обусловливать специфическое взаимодействие с лектинами, в том числе бактериальными.
Никитина с соавт. (1996) показала присутствие на поверхности клеток азоспирилл лектинов, вовлеченных в бактериальную адгезию к корням. С поверхности двух отличающихся по способу колонизации растений штаммов ассоциативных азотфиксирующих бактерий -A. brasilense Sp7 и A. brasilense Sp245 были изолированы лектины, являющиеся гликопротеинами с различными молекулярными массами и углеводной специфичностью (Никитина с соавт., 2005; Шелудько с соавт., 2009). Было показано, что лектины азоспирилл являются полифункциональными молекулами. Помимо адгезивной функции, они способны влиять на метаболизм растительной клетки - стимулировать прорастание семян (Никитина с соавт., 2004), проявлять по отношению к растительной клетке митогенную и ферментмодифицирующую активности (Alen’kina et al., 2006; Чернышева с соавт., 2005), изменять содержание стрессовых метаболитов в растительной клетке, что свидетельствует о способности лектинов выступать в качестве индукторов адаптационных процессов корней проростков пшеницы (Alen’kina et al., 2014).
В связи с вышесказанным, целью данной работы была сравнительная оценка способности лектинов A. brasilense Sp7 и A. brasilense Sp245 оказывать регулирующее воздействие на активность пектинолитических ферментов в корнях проростков пшеницы.
MATERIALS AND METHODS
В работе были использованы лектины двух штаммов бактерий рода Azospirillum – A. brasilense Sp7 (эпифитный) полученный из Института микробиологии им. С.Н. Виноградского РАН (г. Москва) и A. brasilense Sp245 (эндофитный) из коллекции микроорганизмов ИБФРМ РАН. Выращивание культур, выделение и очистку лектинов проводили, как описано ранее (Никитина с соавт. , 1996; Шелудько с соавт. , 2009).
В работе использовали 3-х суточные проростки пшеницы Саратовская 29. Корни после экспозиции с препаратами лектинов (концентрации лектинов 5-40 мкг/мл, максимальное время инкубации – 1 ч), гомогенизировали в 0.15 М фосфатном буфере (рН 7.8). Гомогенат центрифугировали при 7000g, надосадочную жидкость использовали для определения активности ферментов.
Активность полигалактуроназы, пектатлиазы и пектинэстеразы определяли по описанной методике (Ермаков с соавт. , 1987). Активность ферментов выражали числом единиц активности фермента в 1 г сырой массы корней.
Полученные результаты подвергали статистической обработке. Доверительные интервалы определяли для 95% уровня значимости.
RESULTS AND DISCUSSION
Результаты проведенных исследований показали, что изучаемые лектины в концентрациях от 5 до 20 мкг/мл после 1ч воздействия на корни проростков пшеницы способны вызывать индукцию активности полигалактуроназы, пектинэстеразы, пектатлиазы -ферментов пектинолитического комплекса клеточной стенки растений. Самой эффективной оказалась концентрация обоих лектинов 10 мкг/мл. Наибольший эффект наблюдался по отношению к полигалактуроназе, увеличение активности для лектинов A. brasilense Sp7 и Sp245 составляло 80 и 150%, соответственно. Несколько меньшим оказалось влияние лектинов на активность пектатлиазы. В данном случае увеличение активности составило 50% для лектина A. brasilense Sp7 и 100% для лектина A. brasilense Sp245. Самым незначительным было влияние лектинов на активность пектинэстеразы. Лектин эпифитного штамма вызывал увеличение активности фермента на 10%, эндофитного штамма на 50%. Результаты продемонстрировали наиболее высокую индуцирующую активность лектина эндофитного штамма Sp245 по отношению ко всем изучаемым ферментам, что по-видимому связано со способностью данного штамма проникать внутрь корня.
Таким образом, полученные данные свидетельствуют о том, что лектины азоспирилл способны вызывать индукцию пектинразрушающих ферментов самих растений, являющихся одним из основных факторов, способствующих разрушению клеточных стенок и внедрению микроорганизмов в ткани растения и в этом прослеживается сходство с бобово-ризобиальным симбиозом (Xie et al., 2012).
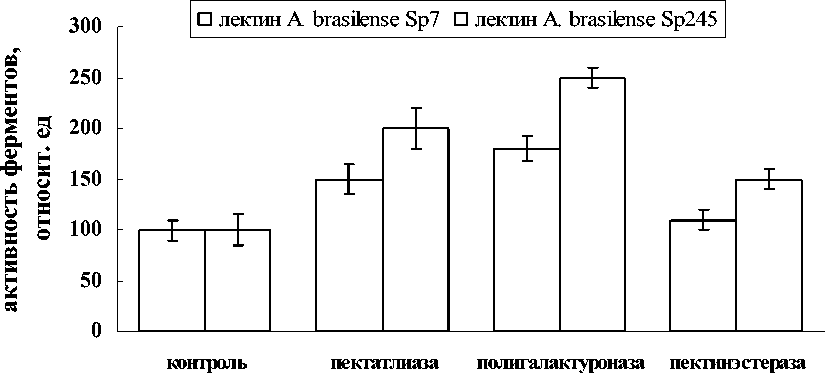
Figure 1. Влияние лектинов A. brasilense Sp7 и Sp245 на активность пектолитических ферментов корней проростков пшеницы. Контроль-корни: активность пектатлиазы – 20 ед/г сырой массы, полигалактуроназы – 10 ед/г сырой массы, пектинэстеразы – 25 ед/г сырой массы. Концентрация лектинов – 10 мкг/мл. Время инкубации – 1ч.
Роль пектолитических ферментов не ограничена только процессами разрушения пектиновых веществ, происходящих при проникновении и продвижении микроорганизмов по тканям растения. Повреждающее действие пектолитических ферментов вызывает в клетке сдвиг физиологических процессов и развитие ответных реакций в тканях растения. Соотношение этих реакций, скорость и интенсивность могут определять исход взаимоотношений между организмами. Клеточная стенка растений рассматривается как "депо" ферментов: в ней обнаружен целый ряд ферментов, в том числе и пероксидазы. Показано, что пероксидазы локализованы в свободном пространстве клеточной стенки, а также связаны ионными или ковалентными связями (Mader et al.,1980; Sasaki et al., 2008). Многие исследователи наблюдали активирование и освобождение пероксидаз, локализованных в клеточных стенках, при действии пектолитических ферментов (Гладких и др., 1979). С действием пероксидаз связывают образование этилена (Lund, Mapson, 1970) и перекиси водорода (Bhattachrjee, 2005), оказывающих токсическое действие на ткани растения, окисление индолилуксусной кислоты (ИУК), изменяющее гормональный баланс в клетках (Cheng, Song, 2006). Полагают, что растворенные и активированные пероксидазы, связанные с клеточными стенками, вызывают в клетках хозяина развитие метаболических изменений, нарушающих скоординированные физиологические процессы в клетках.
Вероятно, вышесказанное объясняет тот факт, что лектин A. brasilense Sp7, штамма, не обладающего способностью проникать в ткани растения, также как и лектин A. brasilense Sp245 (эндофитного штамма) способен вызывать, хотя и в меньшей степени, индукцию пектолитических ферментов растительной клетки.
Полученные результаты и предыдущие данные, свидетельствующие о способности лектинов азоспирилл вызывать спектр ответных биохимических реакций, являющихся частью сигнальных систем (Alen’kina et al. , 2014), дают основания полагать, что лектины азоспирилл могут индуцировать развитие ответных реакций в растениях, что в сочетании с ростстимулирующим эффектом бактерий способствует формированию устойчивости и продуктивности растений.
Список литературы Активность протолитических ферментов растений под воздействием лектинов эндофитных и эпифитных штаммов Azospirillum
- Ермаков А.И., Арасимович В.В., Ярош Н.П., Перуанский Ю.В., Луковникова Г.А., Иконникова М.И. (1987) Методы биохимического исследования растений Л.: Агропромиздат
- Гладких Т.А., Давыдова М.А., Молдосанова Г.А., Васильева К.В., Метлицкий Л.В. (1979). Действие препаратов пектин-трансэлиминазы Verticillium dahliae Klebahn на ткани и растения хлопчатника. Прикл. биохимия и микробиология, 15(2), 194-205
- Никитина В.Е., Аленькина С.А., Пономарева Е.Г., Савенкова Н.Н. (1996) Изучение роли лектинов клеточной поверхности азоспирилл во взаимодействии с корнями пшеницы. Микробиология, 65, 165-170
- Никитина В.Е., Богомолова Н.В., Пономарева Е.Г., Соколов О.И. (2004) Влияние лектинов азоспирилл на способность семян к прорастанию. Известия РАН. Серия биологическая, 4, 431-435
- Никитина В.Е., Пономарева Е.Г., Аленькина С.А. Лектины клеточной поверхности азоспирилл и их роль в ассоциативных взаимоотношениях с растениями. Молекулярные основы взаимоотношений ассоциативных микроорганизмов с растениями/Под ред. В.В. Игнатова.-М.: Наука, 2005. 70-97
- Чернышева М.П., Аленькина С.А., Никитина В.Е., Игнатов В.В. (2005) Внеклеточные протеолитические ферменты штамма Azospirillum brasilense Sp7 и регулирование их активности гомологичным лектином. Прикл. биохимия и микробиология, 41, 444-448
- Шелудько А.В., Пономарева Е.Г., Варшаломидзе О.Э., Ветчинкина Е.И., Кацы Е.И., Никитина В.Е. (2009) Гемагглютинирующая активность и подвижность бактерий Azospirillum brasilense в присутствии разных источников азота. Микробиология, 6, 749-756
- Albersheim P., Valent B. (1978) Host-pathogen interactions in plants. J Cell Biology, 78, 627-643
- Alen’kina S.A., Payusova O.A., Nikitina V.E. (2006) Effect of Azospirillum lectins on the activities of wheat-root hydrolytic enzymes. Plant and Soil, 283, 147-151
- Alen’kina S.A., Bogatyrev V.A., Matora L.Yu., Sokolova M.K., Chernysheva M.P., Trutneva K.A., Nikitina V.E. (2014) Signal effects of the lectin from the associative nitrogen-fixing bacterium Azospirillum brasilense Sp7 in bacterial-plant root interactions. Plant and Soil, 381, 337-349
- Bashan Y., Holguin G., de-Bashan L.E. (2004) Azospirillum-plant relationships: physiological, molecular, agricultural, and environmental advances (1997-2003). Can. J. Microbiol., 50, 521-577
- Bhattachrjee S (2005). Reactive oxygen species and oxidative burst: Roles in stress, senescence and signal transduction in plant. Current Science, 89, 1113-1121
- Cervone F., Anderbhan T., Corn R. H. A., Wood R. K. S. (1981) Effects of french bean tissue on Colletotrichum lindemuthianum polygalacturonase. Phytopathol. Z., 102, 238-246
- Cheng Y, Song C (2006). Hydrogen peroxide homeostasis and signaling in plant cells. Sci China C Life Sci., 49, 1-11
- Khammas K.M., Ageron., Grimond P.A., Kaiser P. (1989) Azospirillum irakense spp. nov., a nitrogen-fixing bacterium associated with rice roots and rhizosphere soil. Res. Microbiol., 140, 679-693
- Lund B.M., Mapson L.W. (1970) Stimulation by Erwinia carotovora of the synthesis of ethylene in cauliflower tissue. Biochem. J., 119, 251-263
- Mader M., Ungemach J., Schlop P. (1980) The role of peroxidase isozyme groups of Nicotiana tabacum in hydrogen peroxide formation. Planta, 147(5), 467-470
- Okon Y., Vanderleyden J. (1997) Root-associated Azospirillum species can stimulate plants. ASM News, 63, 366-370
- Sasaki S., Nonaka D., Wariishi H., Tsutsumi Y., Kondo R. (2008) Role of Tyr residues on the protein surface of cationic cell-wall-peroxidase (CWPO-C) from poplar: potential oxidation sites for oxidative polymerization of lignin. Phytochemistry, 69, 348-355
- Saikia S.P., Bora D., Goswami A., Mudoi K.D., Gogoi A. (2012) A review on the role of Azospirillum in the yield improvement of non leguminous crops. African J. Microbiol. Res., 6, 1085-1102
- Steenhoudt O., Vanderleyden J. (2000) Azospirillum, a free-living nitrogen-fixing bacterium closely associated with grasses: genetic, biochemical and ecological aspects. FEMS Microbiol. Rev., 24, 487-506
- Xie F., Murray J.D., Kim J., Heckmann A.B., Edwards A., Oldroyd G.E.D., Downiе J. A. (2012) Legume pectate lyase required for root infection by rhizobia. PNAS, 109, 633-638


