Активность системы липопероксидации на фоне применения комплекса реабилитации у спортсменов с патологией суставов нижних конечностей
Автор: Манаева Надежда Ивановна, Сумная Дина Борисовна, Кинзерский Антон Александрович, Садова Валентина Алексеевна, Титухов Ренат Юрьевич, Гурова Наталья Евгеньевна
Журнал: Человек. Спорт. Медицина @hsm-susu
Рубрика: Восстановительная и спортивная медицина
Статья в выпуске: 3 т.22, 2022 года.
Бесплатный доступ
Цель: изучить состояние процессов липидной пероксидации и определить клинико-биохимические маркеры патологии суставов нижних конечностей для составления программы и оценки эффективности реабилитации пациентов. Материалы и методы. На базе клиники профессора Кинзерского, ООО «CNS», ООО «СОНАР», кафедры спортивной медицины и физической реабилитации, кафедры биохимии и НИИ олимпийского спорта «УралГУФК» проходили курс реабилитации 74 спортсмена, из них 22 с острой стадией болезни Осгуда - Шлаттера (БОШ). У всех спортсменов исследовалось в сыворотке крови содержание витамина Д, АСТ, АЛТ, СРБ и ревматоидный фактор, содержание продуктов перекисного окисления липидов (ПОЛ) и Fe2+-аскорбат-индуцированное ПОЛ, всем назначался курс плазмотерапии по технологии PRP, кинезиотейпирование, инструментальная мобилизация мягких тканей, динамическая нейромышечная стабилизация. Результаты. Биохимические исследования показали наличие у спортсменов с БОШ дефицит витамина Д, меди, ионизированного кальция (при нормальных показателях общего кальция), фосфора, цинка, повышение уровня щелочной фосфатазы при нормальных показателях АсАТ и АлАТ, СРБ и ревматоидного фактора. До реабилитации было выявлено (p function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Патология суставов нижних конечностей у спортсменов, болезнь осгуда -шлаттера, хондропатия бугристости большеберцовой кости, реабилитация, липопероксидация
Короткий адрес: https://sciup.org/147239591
IDR: 147239591 | УДК: 616.72-007.248-577.125 | DOI: 10.14529/hsm220321
Текст научной статьи Активность системы липопероксидации на фоне применения комплекса реабилитации у спортсменов с патологией суставов нижних конечностей
N.I. Manaeva, ,
D.B. Sumnaya, ,
A.A. Kinzersky, ,
V.A. Sadova, ,
R.Yu. Titukhov, ,
N.E. Gurova, ,
Введение. Болезнь Осгуда – Шлаттера встречается у 12,9 % подростков, активно занимающихся спортом [5, 6]. В 2019 году Guld-hammer S. et al., опубликовали результаты наблюдения за пациентами, которые 4 года назад имели в анамнезе картину БОШ. Участники сообщили о продолжительности симптома OSD в течение 90 месяцев, причем 42,9 % сообщили о ежедневной боли в колене [3]. Несвоевременная диагностика БОШ и отсутст- 174
вие адекватного лечения помимо образования несросшихся костных фрагментов деформаций бугристости большеберцовой кости приводят к остеоартрозу коленного сустава у лиц молодого возраста [10]. При болезни Осгуда – Шлаттера (хондропатии бугристости большеберцовой кости) мы имеем дело с асептическим неспецифическим воспалением, где в первую очередь происходят изменения на клеточном уровне гомеостаза [4, 7]. Так, пер- вой реагирует система перекисного окисления липидов [2]. Клиницисты используют ультразвуковые данные для отслеживания течения данной патологии [14, 17]. Среди них могут быть тендопатия собственной связки наколенника, ее утолщение, утолщение сухожилий четырехглавой мышцы бедра, реактивный бурсит, отек хряща и неоваскуляризация в области бугристости [8, 16]. Все эти изменения появляются в моменте, когда уже идет активный воспалительный процесс [19]. На рентгенограмме коленного сустава может быть костная неровность с фрагментацией на большеберцовом бугорке, кортизированный костный фрагмент, превосходящий бугристость большеберцовой кости. В месте введения сухожилия надколенника также может наблюдаться умеренный отек мягких тканей, но выпота из сустава нет [1, 15]. МРТ в сагиттальной плоскости у пациентов с БОШ может выявить увеличение дистальных аспектов сухожилия надколенника, очаги гетеротопического окостенения с низкой интенсивностью сигнала и неравномерность или увеличение бугристости большеберцовой кости [2, 9]. Изменения на рентгенограммах и МРТ обнаруживаются также на поздних стадиях, когда уже происходят необратимые изменения в тканях [12, 18]. Отсутствие единой точки зрения на этиологию и патогенез этой болезни обуславливает применение подчас нерациональных методов лечения, нередко с невысокой эффективностью, что требует совершенствования методов реабилитации [18]. БОШ – это преимущественно самоограничивающийся апофизит большеберцового бугорка и прилежащего сухожилия надколенника у молодых активных пациентов с открытыми зонами роста. Профилактические стратегии включают растяжение четырехглавой мышцы и подколенного сухожилия и поэтому должны быть реализованы в повседневной практике для детей, которые регулярно занимаются спортом. В лечении и реабилитации широко используются различные медикаменты (противовоспалительная терапия), массаж, ЛФК и кинезиотейпирование [11]. Также описано применение инъекций аутоплазмы, обогащенной тромбоцитарной массой (АПОТМ) в область поражения [13]. Для спортсменов вопрос о необходимости сокращения сроков лечения и возвращения к тренировкам наиболее актуален, что заставляет клинициста по- стоянно искать новые, более эффективные методики реабилитации [12].
Материалы и методы исследования. На базе учебного центра Клиники профессора Кинзерского и ООО «Центр нейромышечной стабилизации», кафедры спортивной медицины и физической реабилитации, кафедры биохимии и НИИ олимпийского спорта ФГБОУ ВО «Уральский государственный университет физической культуры» проходили курс обследования и реабилитации 74 спортсмена, из них 22 с острой стадией болезни Осгуда – Шлаттера (БОШ). Исследование проводилось до и на 3-й неделе от начала реабилитации.
Критерии включения в исследование:
-
1) возраст спортсменов 11–19 лет;
-
2) отсутствие клинико-лабораторных маркеров острого инфекционного процесса, аутовоспалительного состояния и обострения хронических заболеваний;
-
3) подтвержденный диагноз хондропатии бугристости большеберцовой кости;
-
4) добровольное согласие пациента (его представителей);
-
5) отсутствие противопоказаний для применения различных методов реабилитации.
Критерии исключения:
-
1) спортсмены с установленным диагнозом «остеоартроз коленных суставов»;
-
2) неактивная стадия бош по клиникоинструментальным данным;
-
3) низкая комплаентность участника.
Всем спортсменам данной группы (n = 22) назначался курс плазмотерапии по технологии PRP Cortexil, классическое кинезиотейпи-рование комбинированным способом, ИММТ обеих нижних конечностей, после купирования острого болевого синдрома проводилась динамическая нейромышечная стабилизация (DNS). Кроме того, спортсменам назначался комплекс препаратов магния, витамина Д3, омеги-3, который составлялся индивидуально в зависимости от показателей, полученных в результате биохимического исследования.
Группа контроля (здоровые спортсмены) – 18 человек идентичного возраста.
Методы исследования. Спортсмены были осмотрены ревматологом и ортопедом, проведена дифференциальная диагностика (клиническая, лабораторная, инструментальная) хондропатии с другими аутоимунными, аутовоспалительными и инфекционными заболеваниями опорно-двигательного аппарата.
Пациентам проводились:
-
1) УЗИ коленных суставов с эластомет-рией на аппарате экспертного уровня Samsung Xario 2000. Рентгенография коленных суставов, МРТ;
-
2) лабораторное исследование осуществлялось в сети клиник ИНВИТРО, клинике Южно-Уральского государственного медицинского университета: общеклиническое исследование крови, СОЭ, СРБ, ревматидный фактор, АЦЦП, АМЦВ, креатинин, мочевина, АсАт, АлАт, общий и ионизированный кальций, фосфор, электролиты, билирубин и его фракции, общий белок и его фракции, коагулограмма, витамины группы В, витамин Д, магний. В сыворотке крови исследовалось содержание первичных, вторичных и конечных продуктов липопероксидации и Fe2+-аскорбат-индуцированное ПОЛ спектрофотометрическим методом;
-
3) гониометрия, тестирование по шкале оценки качества жизни SF 36, визуальная оценка боли по шкале ВАШ.
После суммации всех данных составлялся план реабилитации конкретного спортсмена: медикаментозное лечение (противовоспалительная терапия), кинезиотейпирование, фасциальные манипуляции, проведение инъекции обогащенной аутоплазмы в область поражения под ультразвуковым контролем, лечебная физкультура. Введение обогащенной тромбоцитами аутоплазмы по технологии Cortexil проводилось периартикулярно, курс из 3 инъекций 1 раз в 7 дней. Над областью поражения накладывались кинезиотейпы лимфодре- нажной и поддерживающей техникой для улучшения микроциркуляции и лимфотока. Совмещение этих двух техник позволило отменить применение НПВП для купирования болевого синдрома в связи с его отсутствием на фоне выраженного лимфодренажного и обезболивающего эффекта кинезиотейпирования.
Результаты исследований и их обсуждение. До начала реабилитации показатель шкалы боли по ВАШ был в среднем 7 ± 1,25, что соответствовало выраженной боли. Спортсмены клинически отмечали достоверное уменьшение болевого синдрома в среднем на 3 ± 0,5 сут (p < 0,05) от начала реабилитации. Через неделю от первого реабилитационного комплекса уровень ВАШ достоверно снизился и был 2 ± 0,25 (p < 0,05). При оценке данного показателя через месяц от первого посещения достоверно купирован болевой синдром (p < 0,05) в области коленного сустава (ВАШ = 0). При проведении гониометрии у пациентов с БОШ было выявлено, что среднее значение угла сгибания в коленных суставах составляло 90 ± 5,25°. Угол сгибания в коленных суставах достоверно увеличился в динамике через 4 недели от первичного осмотра в среднем на 10 ± 2,5° и составил 105 ± 4,5° (p < 0,05), против 110° группы контроля.
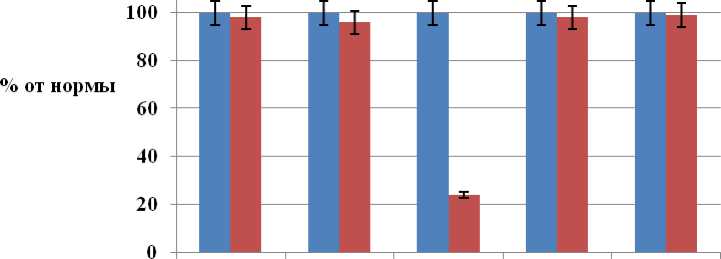
Биохимические исследования показали (рис. 1) наличие у спортсменов с БОШ дефицит витамина Д, меди, магния, ионизированного кальция (при нормальных показателях общего кальция), фосфора, цинка, повышение уровня щелочной фосфатазы при нормальных показателях АсАТ и АлАТ. Дефицит витами-
ACT А.ТГ Витамин Д РФ СРВ
Рис. 1. Наиболее значимые биохимические показатели в сыворотке крови в норме и у исследуемых пациентов с БОШ
Fig. 1. The most important serum biochemical parameters in healthy subjects and in patients with OSD
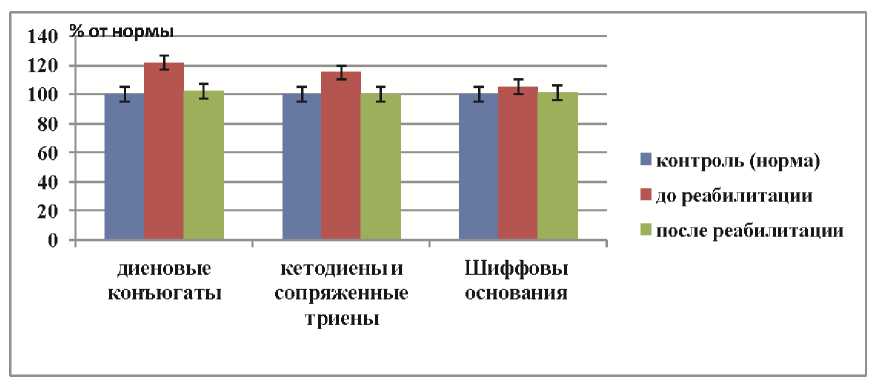
Рис. 2. Содержание в сыворотке крови первичных, вторичных и конечных продуктов перекисного окисления липидов до и после реабилитации
Fig. 2. Serum levels of primary, secondary and final products of lipid peroxidation before and after rehabilitation
■ контроль
■ группа с БОШ
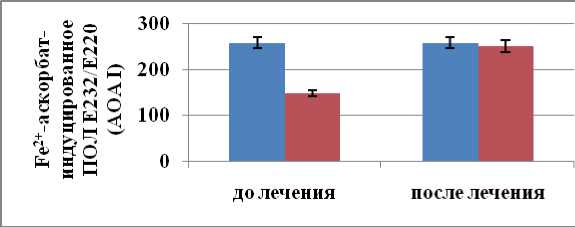
Рис. 3. Антиоксидантная активность сыворотки (АОАI) у спортсменов с БОШ на фоне реабилитации
Fig. 3. Serum antioxidant activity in athletes with OSD during rehabilitation на Д3 и магния был выявлен у всех обследованных спортсменов (74 человека).
Также произведена оценка содержания в сыворотке крови продуктов перекисного окисления липидов до и после восстановительного курса.
До реабилитации было выявлено (p < 0,05) спектрофотометрическим методом повышение содержания первичных и вторичных продуктов ПОЛ соответственно в 1,22 ± 0,061 и 1,15 ± 0,058 раза по сравнению с группой контроля. Эти изменения коррелировали (r = = –0,765–0,801) с ультразвуковыми и клиническими данными (выявлялась обратная зависимость: чем выше содержание продуктов ПОЛ в сыворотке крови, тем выраженнее болевой синдром, ограничение движений и вы-раженней отек и явления асептического воспаления по данным УЗИ в зоне пораженного сустава. После проведенной реабилитации через 3 недели от ее начала у пациентов с БОШ выявлялось значительное достоверное
(p < 0,05) снижение концентрации первичных, вторичных, конечных продуктов перекисного окисления липидов до показателей группы контроля (рис. 2). Данные изменения процессов липопероксидации происходили на фоне улучшения клинической картины в виде купирования болевого синдрома, увеличения объема движений и двигательной активности в целом.
Антиоксидантная активность сыворотки (рис. 3) у спортсменов с БОШ достоверно ниже нормы в 1,81 ± 0,091 раза (p < 0,05). После проведенной реабилитации антиоксидантная активность сыворотки возрастает в 1,7 ± 0,085 раза достоверно не отличается от группы контроля (p < 0,05). По данным сонографии, у спортсменов данной группы с БОШ уменьшались проявления заболевания в среднем на 5 ± 0,5 сут от первой инъекции аутоплазмы и полное купирование БОШ – к 4-й неделе от начала реабилитации. Причем использование кинезиотейпирования комбини- рованным методом отменяло применение НПВП в связи с отсутствием болевого синдрома. Все спортсмены данной группы вернулись к прежнему режиму тренировок в среднем через 18 ± 2,75 дня. Назначение спортсменам комплекса препаратов магния, витамина Д3, омеги-3, который составлялся индивидуально в зависимости от показателей, полученных в результате биохимического исследования, позволило восстановить дефицит данных веществ, что также важно для нормального функционирования опорно-двигательного аппарата.
Заключение. У спортсменов с БОШ наблюдается повышение активности системы перекисного окисления липидов. Данные изменения обнаруживаются на самой ранней стадии БОШ, что может применяться в качестве скрининга хондропатии у спортсменов, когда показатели активности воспалительного процесса (СОЭ, СРБ, ревматоидный фактор) еще не отличаются от нормы. В этот период уже имеются четкие признаки активности процесса на УЗИ, но они могут еще отсутствовать на рентгенографии.
Измерение содержания продуктов перекисного окисления липидов в сыворотке крови может быть использовано для оценки эффективности реабилитации при болезни Осгуда – Шлаттера. Эти изменения коррелируют с ультразвуковыми и клиническими данными. Во время интенсивного тренировочного процесса необходимо контролировать у спортсменов содержание витамина Д3 и магния, и своевременно проводить коррекцию дефицита. Дефицит витамина Д3 и магния был выявлен у всех обследованных спортсменов (74 человека).
Список литературы Активность системы липопероксидации на фоне применения комплекса реабилитации у спортсменов с патологией суставов нижних конечностей
- Бегун, П.И. Биомеханика опорно-двигательного аппарата человека: моногр. / П.И. Бегун, A.B. Самсонова. - СПб.: Кинетика, 2020. - 179 с. - (Биомеханика).
- Васильев, О.С. Методические рекомендации по практическому применению комплекса методик ранней диагностики, реабилитации, медико-биологическому сопровождению и профилактике состояний, связанных с «болезнями роста» у юных спортсменов: метод. рек. / под ред. проф. В.В. Уйба / О.С. Васильев. - М. : ФМБА России, 2019. - 78 с.
- Горбатенко, А.И. Использование обогащенной тромбоцитами аутоплазмы в консервативном лечении болезни Осгуда - Шлаттера у детей / А.И. Горбатенко // Вопросы практической педиатрии. - 2017. - Т. 12, № 3. - С. 66-71. - DOI: 10.20953/1817-7646-2017-3-66-71
- Горбатенко, А.И. Остеохондропатии у детей - поиск эффективных методов лечения / А.И. Горбатенко//Науч. мед. журнал «Морфология». - 2018. - № 3, Т. 153. - С. 78.
- Ермекова, М.А. Болезнь Осгуд - Шлаттера: возможности визуальной диагностики / М.А. Ермекова, М.Т. Алиякпаров, Т.И. Ромащенко // Караганд. гос. мед. университет. журн. «Медицинские новости». - 2017. - № 2. - С. 55-58.
- Кинзерский, А.Ю. Ультразвуковое исследование при травмах и заболеваниях коленного сустава: практ. рук. /А.Ю. Кинзерский. - Челябинск: Челяб. гос. мед. акад., 2010. - С. 26-29.
- Кумачный, А.Л. Способы и методы лечения болезни Осгуда - Шляттера с помощью оздоровительной физкультуры /А.Л. Кумачный, М.С. Москаленко, Ю.И. Шульгов // Символ науки. -2017. - № 6. - С. 113-116.
- Манаева, Н.И. Преимущества ультразвуковой диагностики для определения признаков хондропатии бугристости большеберцовой кости у детей на ранней стадии / Н.И. Манаева, Д.Б. Сумная, Р.Ю. Титухов //International Science Project. - 2020. - No. 35, Part 1. - P. 11.
- Сравнительная эффективность применения аутоплазмы и гиалуронатов у молодых пациентов при остеоартрите коленных суставов на фоне перенесенной хондропатии бугристости большеберцовой кости / Н.И. Манаева, Д.Б. Сумная, Е.В. Быков, Н.Е. Гурова // DIZZW 2020 (Germany). - 2021. - Vol. 1, no. 9. - Р. 26-30.
- Clinics in diagnostic imaging / F. Marino et al. // Radiol Med. - 2021. - Vol. 126 (8). -Р. 1085-1094.
- Gaschler, M.M. Lipid peroxidation in cell death / M.M. Gaschler, B.R. Stockwell // Biochem Biophys Res Commun. - 2017, Jan 15. - Vol. 482 (3). - P. 419-425.
- https://www.invitro.ru/analizes/for-doctors/2569/.
- Ladenhauf, H.N. Osgood-Schlatter disease: a 2020 update of a common knee condition in children / H.N. Ladenhauf, G. Seitlinger, D.W. Green // Singapore Med J. - 2019. - Vol. 60 (12). -P. 610-615. '
- Long-term Prognosis and Impact of Osgood-Schlatter Disease 4 Years After Diagnosis: A Retrospective Study / Clara Guldhammer, Michael Skovdal Rathleff, Hans Peter Jensen, Sinead Holden // Orthop J Sports Med. - 2019. - Vol. 7. - P. 12.
- Midtiby, S.L. Effectiveness of interventions ^ for treating apophysitis in children and adolescents: protocol for a systematic review and network meta-analysis / S.L. Midtiby, N. Wedderkopp, R.T. Larsen // Chiropr Man Therap. - 2018. - P. 26-41.
- Rathleff, M.S. Knee pain in children and adolescents /M.S. Rathleff, C.L. Straszek, L. Blond // Ugeskr Laeger. - 2019. - Vol. 25. - P. 181. ''
- Siddiq, M.A.B. Osgood-Schlatter Disease Unveiled Under High-frequency Ultrasonogram / M.A.B. Siddiq // Orthop J Sports Med. - 2018. - Oct 04. - P. 10.
- T2-mapping MRI evaluation of patellofemoral cartilage in patients submitted to intra-articular platelet-rich plasma (PRP) injections / F. Cobianchi Bellisari, L. De Marino, F. Arrigoni et al. // Radiol Med. - 2021. - Vol. 126 (8). - P. 1085-1094.
- Ultrasonography of the Osgood-Schlatter disease / K. Mahlfeld, R. Kayser, J. Franke, H. Merk // Ultraschall. Med. - 2001. - No. 22. - P. 182-185.


