Активность сукцинат- и лактатдегидрогеназы лимфоцитов, индуцированные АФК нейтрофилов и повреждение ДНК лейкоцитов в крови облучённых ионами углерода мышей
Автор: Хундерякова Н.В., Заичкина С.И., Дюкина А.Р., Митрошина И.Ю., Медведева В.П., Королева М.А., Кузнецова Е.А.
Рубрика: Научные статьи
Статья в выпуске: 4 т.32, 2023 года.
Бесплатный доступ
В настоящее время большое практическое значение представляют исследования, проводимые в целях совершенствования радиотерапии опухолей с применением ускоренных тяжёлых ионов, поскольку основную энергию они отдают в конце пробега в пике Брэгга, что увеличивает тяжесть радиационного поражения опухоли и позволяет минимизировать повреждение окружающих здоровых тканей. В данной работе определяли уровни активности лактатдегидрогеназы (ЛДГ) и сукцинатдегидрогеназы (СДГ) лимфоцитов, соотношение ЛДГ/СДГ, индуцированных активных форм кислорода (АФК) нейтрофилов и повреждений ДНК (%TDNA) лейкоцитов в крови через 1 сут после облучения мышей ускоренными ионами углерода с энергией 450 МэВ/нуклон в дозах 0,2-2 Гр в пике Брэгга. Обнаружили: активность СДГ увеличивалась при дозах 0,2-1 Гр и резко снижалась при дозе 1,5 Гр у всех мышей. При понижении активности СДГ у животных компенсаторно увеличивался гликолиз (активность ЛДГ), что, по-видимому, связано с развивающейся митохондриальной дисфункцией иммунных клеток. %TDNA лейкоцитов увеличивался в зависимости от дозы и сопровождался снижением функциональной активности нейтрофилов - уменьшалась зимозан-индуцированная продукция АФК. Таким образом, на фоне повышенного %TDNA и понижения активности СДГ большое значение приобретает гликолиз. Применённые методы являются высокочувствительными и могут быть использованы для выявления индивидуальных различий у животных, являющихся биологическими моделями в доклинических исследованиях.
Ускоренные ионы углерода, сукцинатдегидрогеназа, лактатдегидрогеназа, активные формы кислорода, повреждения днк
Короткий адрес: https://sciup.org/170201861
IDR: 170201861 | УДК: 591.111.1:577.346:599.323.4 | DOI: 10.21870/0131-3878-2023-32-4-123-133
Текст научной статьи Активность сукцинат- и лактатдегидрогеназы лимфоцитов, индуцированные АФК нейтрофилов и повреждение ДНК лейкоцитов в крови облучённых ионами углерода мышей
В настоящее время большой интерес вызывает использование ускоренных тяжёлых ионов в радиотерапии опухолей. Клинические данные, полученные в специализированных центрах Японии и Германии при облучении онкологических пациентов ионами углерода, позволяют рассматривать этот вид излучения как перспективный, с благоприятными исходами и приемлемой токсичностью [1]. Изучение последствий воздействия ускоренных тяжёлых ионов на живые организмы актуально и в связи с планируемыми длительными космическими полётами. Космическое излучение может вызывать повреждения как прямым воздействием на молекулы ДНК, так и косвенно – через свободные радикалы. Известно, что в результате облучения тяжёлыми частицами в клетках увеличивается выход как свободных радикалов (например, активных форм кислорода и азота), так и генотоксичных молекулярных продуктов, таких как, например, H 2 O 2 [2-4]. Воздействие активных форм кислорода/азота (АФК/А) может приводить к различным повреждениям ДНК: разрывам цепей, повреждениям оснований и нуклеотидов [1, 4]. Известно также, что при облучении ускоренными ионами образуются сложные кластерные повреждения ДНК, которые трудно поддаются репарации или вовсе не репарируются. Кроме того, в результате воздействия
Хундерякова Н.В.* – ст. науч. сотр., к.б.н.; Заичкина С.И. – вед. науч. сотр., к.б.н.; Дюкина А.Р. – ст. науч. сотр., к.б.н.; Митрошина И.Ю. – науч. сотр., к.б.н.; Медведева В.П. – ст. лаборант; Королева М.А. – ст. лаборант; Кузнецова Е.А. – зав. лаб., к.б.н. ИТЭБ РАН.
ионизирующей радиации развивается дисфункция митохондрий и антиоксидантной системы клетки. Окислительные изменения могут продолжаться в течение нескольких дней и месяцев после первоначального воздействия, предположительно из-за непрерывного образования АФК/А [4]. Нами обнаружено длительное сохранение высокого уровня повреждений ДНК лейкоцитов к 75-м суткам после 12С-облучения мышей в пике Брэгга (6 Гр), что указывало на значительное повреждение клеток из разных клеточных пулов системы крови [5].
Повреждения ДНК являются биологическим индикатором таких процессов, как окислительный стресс, репарация ДНК и клеточная гибель. Уровни повреждений ДНК в лейкоцитах крови облучённых мышей в данной работе оценивали методом ДНК-комет. Щелочная версия этого метода позволяет выявить суммарный уровень повреждений ДНК: одно-, двунитевые разрывы и щелочелабильные (апуриновые/апиримидиновые) сайты [6]. Сохранение целостности ДНК в облучённой клетке часто ассоциировано с генерацией АФК. Несмотря на то, что мощным источником АФК в клетке являются митохондрии, их эффективное функционирование необходимо для обеспечения энергией репарационных процессов [4]. Исходя из этого, в представленной работе была проведена оценка активности ключевых ферментов дыхания митохондрий – сукцинатдегидрогеназы (СДГ) и гликолиза в цитозоле – лактатдегидрогеназы (ЛДГ), которые являются биомаркерами аэробного и анаэробного метаболизма в лимфоцитах крови [7, 8]. Поскольку сохранение нарушений окислительного метаболизма в пострадиационный период связано с хроническими воспалительными реакциями [4], то определяли также и уровень люминол-зависимой, зимозан-индуцированной продукции АФК в нейтрофилах. Используя животных в качестве биологических моделей, мы старались учитывать динамику индивидуальных изменений изучаемых показателей. В связи с этим, целью работы явилась оценка функционального состояния лейкоцитов крови по критериям: активности СДГ (митохондриального дыхания) и активности ЛДГ (гликолиза), соотношения ЛДГ/СДГ, индукции АФК в нейтрофилах и повреждений ДНК в лейкоцитах крови у индивидуальных мышей через 1 сут после их облучения (0,2-2 Гр) ускоренными ионами углерода с энергией 450 МэВ/нуклон в пике Брэгга.
Материалы и методы
Животные. Использовали белых беспородных мышей-самцов линии SHK в возрасте 8-9 недель, массой 30 ± 4 г. Животные содержались в стандартных условиях вивария Института теоретической и экспериментальной биофизики, Пущино (ИТЭБ РАН). Мышей содержали на 12-часовом свето-темновом режиме со свободным доступом к пище и воде. Мышей выводили из эксперимента декапитацией.
Облучение животных. В исследование было включено 29 мышей, разделённых на шесть групп в зависимости от дозы облучения (одна группа не облучена – контрольная). Мышей облучали ионами углерода в модифицированном (расширенном) пике Брэгга в дозах 0,2; 0,5; 1,0; 1,5 и 2,0 Гр (4-6 мышей в группе) на ускорительном комплексе У-70 (ИФВЭ НИЦ «Курчатовский институт», Протвино) в соответствии с [5]. Все биологические показатели лейкоцитов крови регистрировались через 1 сут после облучения всего тела животных.
Измерение активности СДГ и ЛДГ в лимфоцитах. Измерение активности дегидрогеназ по восстановлению нитросинего тетразолия (НСТ) проводили в свежеприготовленных мазках крови. Через 1-1,5 ч после забора крови мазки крови фиксировали 60% ацетоном, забуференным 10 мМ HEPES, в течение 30 с при комнатной температуре (рН 5,2-5,5), промывали и сушили. Эта мягкая фиксация ацетоном модулирует проницаемость мембраны иммобилизованных клеток для субстратов и никотинамидадениндинуклеотида (НАД). Фиксированный мазок инкубировали в течение 1 ч при 37 °С на водяной бане в среде, содержащей (в мМ/л) 125 KCl, 10 HEPES и 1,22 НСТ (рН 7,2±0,05). Во всех процедурах использовалась бидистиллированная вода. Добавление 5 мМ янтарной кислоты является основным тестом, характеризующим активность СДГ. Образец для оценки активности ЛДГ содержал 5 мМ молочной кислоты, 5 мМ малоновой кислоты и 0,5 мМ НАД. В цитобиохимических исследованиях восстановление НСТ на эндогенных субстратах снижается после добавления селективного ингибитора СДГ (малоновой кислоты); поэтому к образцу для измерения активности ЛДГ добавляли 5 мМ малоновой кислоты, чтобы исключить окисление микромолярных концентраций эндогенной янтарной кислоты. После инкубации мазки окрашивали 0,5% нейтральным красным в течение 8 мин. После окрашивания мазки исследовали под световым микроскопом (Leica DM2000 с цветной камерой Leica DFC425) при увеличении х1000 в условиях масляной иммерсии. Из каждого мазка отбирали по 50 лимфоцитов. Для поиска и захвата клеток использовалось программное обеспечение Bloodrunner. Для количественного морфологического анализа цветных изображений была разработана специальная программа Cell Composer, рассчитывали концентрацию продукта восстановления НСТ диформазана (в мкм2) в каждой клетке. Из-за большого размера выборки средние значения для каждого животного были статистически значимыми (p<0,001) во всех случаях. Результаты представлены отдельно для каждого животного в виде среднего значения в каждой пробе. Стандартное отклонение (SD) и ошибку среднего (M) рассчитывали на основании всей совокупности оценок количества диформазана.
Определение уровня зимозан-индуцированных АФК. Уровень продукции АФК в цельной крови измеряли методом люминол-зависимой зимозан-индуцированной хемилюминесценции (ХЛ) на 12-канальном приборе CHEMILUM-12 (Россия) по ранее описанной методике [9]. Измеряли уровень спонтанной ХЛ цельной крови, характеризующий базальный уровень активации нейтрофилов, а для определения резервных возможностей активации нейтрофилов проводили стимуляцию кислородного обмена с использованием опсонизированного зимозана. В качестве усилителя ХЛ использовали люминол. Опсонизированный зимозан использовали для индукции респираторного взрыва. Усиление ХЛ, индуцированное опсонизированным зимозаном, оценивали по отношению индуцированной ХЛ к спонтанной (Sind/spont), обозначаемому как индекс активации. Величины светлой площади под кривой определяли для спонтанной и индуцированной ХЛ (Sspont, Sind), а также индекс активации (AI) как отношение Sind/Sspont, характеризующий усиление ХЛ.
Метод ДНК-комет. Уровень повреждения ДНК в лейкоцитах мышей определяли щелочным вариантом метода в соответствии с [5]. Использовали стандартный фосфатно-солевой буфер (PBS), рН=7,2, содержащий 0,001 моль/л ЭДТА (PBS-EDTA). Вкратце, цельную кровь мышей разводили 1:5 PBS-EDTA и смешивали с равным объёмом 1% лекгоплавкой агарозы при 37 oC. Смесь наносили на стёкла, на которые был предварительно нанесён и высушен слой нормальной агарозы. После охлаждения и затвердевания слоя агарозы с клетками на его поверхность наносился новый слой 0,5% легкоплавкой агарозы. Стёкла помещали в лизирующий раствор (2,5 моль/л NaCl, 0,1 моль/л ЭДТА, 0,01 моль/л Трис-HCl, pH=10, 1% Triton X-100) при 4 oC на 20-24 ч. Затем стёкла переносили в щелочной раствор А (0,3 моль/л NaCl, 0,001 моль/л ЭДТА, pH>13) и инкубировали в течение 20 мин. Затем их помещали в электрофоретическую камеру и подвергали электрофорезу в течение 20 мин при 4 oC (напряжённость электрического поля 2 В/см). После электрофореза стёкла промывали дистиллированной водой и окрашивали в течение 1 ч PBS, содержащим 2,0 мкг/мл бромистого этидия. Препараты анализировали под флуоресцентным микроскопом ЛЮМАМ И-3 (ЛОМО, Санкт-Петербург). Уровень повреждений ДНК выражали в процентах ДНК в хвосте кометы (%TDNA) [6]. Базальный (контрольный) уровень повреждения ДНК в лейкоцитах крови определяли у необлучённых мышей. Для каждой экспериментальной единицы анализировали по три стекла.
Статистический анализ. Статистическую обработку данных проводили с помощью лицензионного программного обеспечения Microsoft Office Exсel 2007 и Statistica 10.0. Различие с использованием t-критерия Стьюдента (двупарный с неравным отклонением) считали статистически достоверным при значении р<0,05.
Результаты
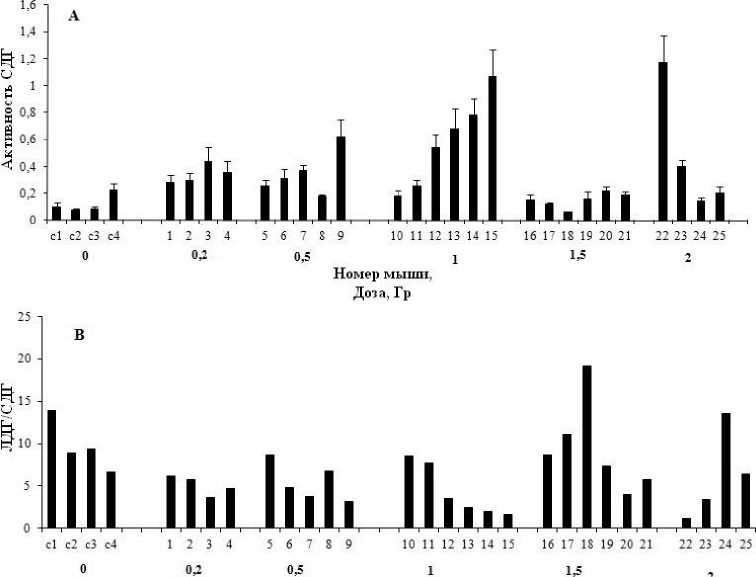
Через 1 сут после облучения мышей в дозах 0,2-2 Гр изучали изменение активностей СДГ и ЛДГ в лимфоцитах, уровни АФК в нейтрофилах, а уровни повреждений ДНК – в лейкоцитах периферической крови одних и тех же животных. Для оценки энергетического состояния лимфоцитов были определены активности ключевого фермента митохондрий – СДГ и цитозольного фермента гликолиза – ЛДГ, а также соотношение ЛДГ/СДГ (рис. 1). Видно, что среднее значение активности СДГ увеличивалось в 3-5 раз в зависимости от дозы (0,2-1 Гр), в то же время внутри каждой группы животных при одной и той же дозе облучения активности СДГ и ЛДГ не были одинаковы (рис. 1а). Различия между мышами 1 и 3, 1 и 4, 5 и 9, 10 и 12, 10 и13, 10 и 14, 10 и 15, 16 и 17 статистически достоверны (p ≤ 0,05). При увеличении дозы до 1,5 Гр наблюдалось ингибирование активности СДГ во всей группе. При 2 Гр у одного животного (мышь № 22) активность СДГ увеличилась примерно в 5 раз по сравнению с контролем, а у трёх животных была снижена примерно до такого же уровня, как в группе при 1,5 Гр. На рис. 1б представлены дозовые зависимости отношения ЛДГ/СДГ у этих же мышей.
Соотношение ЛДГ/СДГ рассматривали в качестве показателя преобладания гликолиза над митохондриальным дыханием. Из рис. 1 видно, что у мышей, облучённых в дозе 1,5 Гр, резкое падение активности СДГ приводило к существенному увеличению значения ЛДГ/СДГ. Несмотря на то, что наблюдалось большое разнообразие ЛДГ/СДГ у индивидуумов при одной и той же дозе, у всех животных при уменьшении активности СДГ регистрировалось увеличение ЛДГ/СДГ.
На рис. 2 показан уровень продукции АФК в цельной крови животных при дозах 0,2-2 Гр. Видно, что индекс активации зимозан-индуцированной ХЛ нейтрофилов у всех животных снижался в зависимости от дозы.
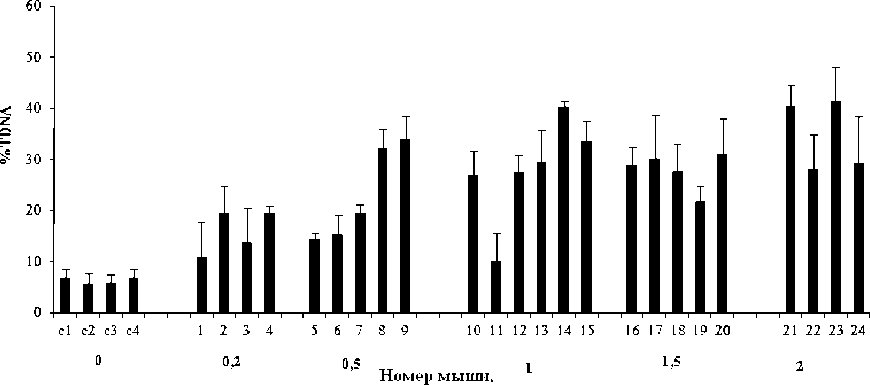
На рис. 3 представлены %TDNA лейкоцитов у индивидуальных животных, облучённых в дозах 0,2-2 Гр.
Номер мыши. Доза, Гр
Рис. 1. Зависимость активности СДГ (а) и отношения активностей ЛДГ/СДГ (б) в лимфоцитах крови мышей от дозы облучения ионами углерода в пике Брэгга.
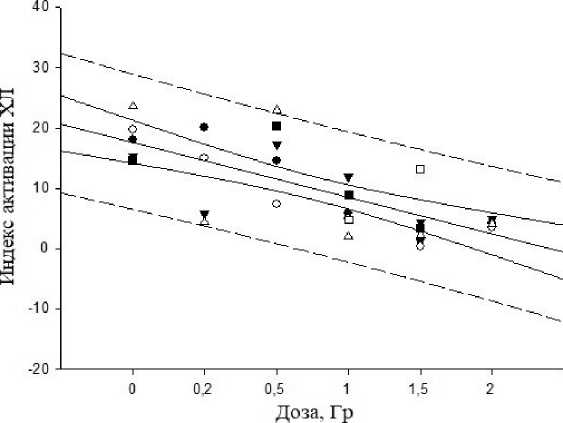
Рис. 2. Зависимость величины индекса активации хемилюминесценции в цельной крови индивидуальных животных от дозы облучения ионами углерода в пике Брэгга. Пунктирные линии – предсказательный интервал, чёрные линии – доверительный интервал (confidence intervals). Данные расположились линейно y=b 1 x+b 0 (коэффициент детерминации r=0,5) с коэффициентом угла наклона 3,05.
Доза. Гр
Рис. 3. Зависимость уровней повреждений ДНК (%TDNA) лейкоцитов крови у индивидуальных животных от дозы облучения ионами углерода в пике Брэгга (M ± SD).
Видно, что %TDNA увеличивался с ростом дозы, но у разных животных по-разному. Так, при дозе 0,5 Гр %TDNA у мышей № 8 и 9 (среднее значение %TDNA=32,9 ± 1,2%) достоверно отличался (p=0,01) от такового у мышей № 5, 6 и 7 (среднее значение %TDNA=16,4 ± 2,7%). При дозе 1 Гр у мышей № 10, 12-14 %TDNA достоверно отличался от такового у мыши № 11 (р<0,05). При дозах 1,5 и 2 Гр %TDNA оставался высоким. Достоверных отличий между индивидуумами при 1,5 Гр не наблюдалось, также их не было и при 2 Гр.
Обсуждение
Энергетическое обеспечение репарационных процессов в облучённых клетках осуществляется как за счёт работы митохондрий, так и гликолиза. Активность СДГ через 1 сут после облучения у индивидуумов увеличивалась в зависимости от дозы до 1 Гр и сопровождалась увеличением повреждений ДНК, что, по-видимому, свидетельствует об активной работе митохондрий и возросших потребностях клеток в энергозатратах при дозах 0,2-1 Гр. В этот срок, как было показано ранее, в клетках костного мозга 12С-облучённых мышей наблюдался высокий уровень экспрессии генов, вовлечённых в апоптоз и контроль клеточного цикла (BBC3, CDKN1A); при этом снижалось количество лейкоцитов в крови [5]. При увеличении дозы до 1,5 Гр наблюдался резкий спад активности СДГ у всех мышей в группе (рис. 1) при одновременном увеличении уровня гликолиза (ЛДГ/СДГ), что свидетельствует о существенных переменах в клеточном метаболизме при этой дозе. Очевидно, что при большей дозе облучения (1,5 Гр) через 1 сут более активно развивается митохондриальная дисфункция, чем при дозах 0,2-1 Гр, что приводит в этот срок к апоптозу и уменьшению количества лейкоцитов в кровяном русле. При снижении работы митохондрий замещающую функцию берёт на себя гликолиз. Сравнивая изменения активности СДГ с соответствующими величинами ЛДГ/СДГ у индивидуумов, видно, что у животных с высокой активностью СДГ регистрировалось уменьшение соотношения ЛДГ/СДГ при всех дозах. И, наоборот, при уменьшении активности СДГ регистрировалось увеличение ЛДГ/СДГ у этих же мышей.
Очевидно, что разнонаправленные изменения уровней повреждений ДНК у индивидуумов и активностей СДГ и ЛДГ связаны с различными потребностями клеток при регуляции обеспечения энергией, необходимой для восстановительных процессов и, возможно, со случайным распределением очагов поражений в клетках при прохождении пучка ускоренных ионов. Наблюдаемые эффекты через 1 сут после облучения опосредуются и клеточным обменом. Считают, что радиационно-индуцированный окислительный стресс может распространяться от клеток-мишеней к нецелевым клеткам-свидетелям через механизмы межклеточной коммуникации. Потомство этих клеток-свидетелей также испытывает нарушения окислительного метаболизма [4]. Поскольку при 2 Гр наблюдается разный ответ СДГ и ЛДГ/СДГ у разных животных, то очевидно, что доза 1,5 Гр существенна для выявления изучаемых показателей. Интересно отметить, что в лейкоцитах гамма-облучённой крови человека (0,1-1 Гр) через 5 ч после облучения увеличивались уровни экспрессии ряда генов, ответственных за контроль клеточного цикла и репарацию ДНК (CDKN1A, GADD45A, P53), а при 2 Гр наблюдалось их уменьшение; авторы этот факт никак не объясняют [10]. Очевидно, что выявленные зависимые от дозы в интервале 0,2-2 Гр изменения СДГ и ЛДГ обусловлены дисфункцией митохондрий. Разный уровень радиационного ответа по критериям активностей СДГ, ЛДГ и %TDNA у индивидуумов, облучённых в одной и той же дозе (рис. 1, 3), по-видимому, ассоциирован как с их генетическими и эпигенетическими особенностями, так и с составом субпопуляций лейкоцитов, основное количество которых у мышей представлено лимфоцитами. Несмотря на то, что лимфоциты считаются наиболее радиочувствительными среди лейкоцитов, всё же у мышей (как и у человека) после облучения (изучалось воздействие фотонов) выявляются субпопуляции лимфоцитов с разной радиочувствительностью [11]. Кроме того, Вилкинсом с соавт. удалось выявить при Х-облучении (1 Гр) разных субпопуляций лейкоцитов крови человека различные уровни апоптотических клеток у гранулоцитов, мононукле-аров, В-лимфоцитов, натуральных киллеров, CD4+ и CD8+ Т-лимфоцитов через 30 ч после облучения. Причём, эти различия были как в группе, так у индивидуальных животных [12]. Можно полагать, что у 12С-облучённых мышей индивидуальные различия %TDNA и активностей СДГ и ЛДГ так же зависят от соотношения разных субпопуляций лейкоцитов у индивидуумов.
Обнаруженное увеличение %TDNA лейкоцитов крови сопровождалось уменьшением зимозан-индуцированной способности нейтрофилов продуцировать АФК в зависимости от дозы (рис. 2), что указывает на снижение их резервных возможностей. По-видимому, это уменьшение продукции АФК может быть также обусловлено снижением количества нейтрофилов в пострадиационном периоде. Так, было показано, что через 1 сут после воздействия на мышей гамма-лучей или протонов в дозе 2 Гр снижалось количество циркулирующих в крови нейтрофилов [13, 14]. Дозозависимое уменьшение уровня продукции внутриклеточных АФК наблюдали и другие исследователи через 1 сут после гамма-облучения фибробластоподобных клеток человека. Однако, уровни митохондриальных АФК начинали увеличиваться лишь к началу вторых суток. При этом увеличивалась фрагментация митохондрий, что свидетельствовало о развитии митоходриальной дисфункции через 1 сут после облучения [15].
Таким образом, нами обнаружены существенные индивидуальные различия у 12С-облучён-ных животных по уровням повреждений ДНК, зимозан-индуцированных АФК, митохондриального дыхания и гликолиза в клетках крови. Исходя из представленных данных видно, что в пострадиационном периоде на фоне повышенного уровня повреждений ДНК и нарушения деятельности митохондрий (определённой по критерию активности СДГ) большое значение приобретает гликолиз. Можно полагать, что гликолиз служит не только в качестве дополнительного энергетического источника; возможно, что некоторые гликолитические ферменты могут быть ассоциированы с повреждениями и репарацией ДНК. Например, у известной как фермент гликолиза глице-ральдегид-3-фосфатдегидрогеназы выявлено много клеточных функций, не связанных с гликолизом, но связанных с её участием в ДНК-зависимых процессах [16].
Работа выполнена в рамках Государственного задания ИТЭБ РАН № 075-0102523-01.
Список литературы Активность сукцинат- и лактатдегидрогеназы лимфоцитов, индуцированные АФК нейтрофилов и повреждение ДНК лейкоцитов в крови облучённых ионами углерода мышей
- Mohamad O., Sishc B.J., Saha J., Pompos A., Rahimi A., Story M.D., Davis A.J., Kim D.W.N. Carbon ion radiotherapy: a review of clinical experiences and preclinical research, with an emphasis on DNA damage repair //Cancers (Basel). 2017. V. 9, N 6. P. 66. DOI: 10.3390/cancers9060066.
- Moreno-Villanueva M., Wong M., Lu T., Zhang Y., Wu H. Interplay of space radiation and microgravity in DNA damage and DNA damage response //NPJ Microgravity. 2017. V. 3. P. 14. DOI: 10.1038/s41526-017-0019-7.
- Vavitsas I., Kalachani K. Cosmic radiation and its effects on technology and health //10th Jubilee International Conference of the Balkan Physical Union, AIP Conf. Proc. 2019. V. 2075, N 1. P. 200018. DOI: 10.1063/1.5099028.
- Azzam E.I., Jay-Gerin J.P., Pain D. Ionizing radiation-induced metabolic oxidative stress and prolonged cell injury //Cancer Lett. 2012. V. 327, N 1-2. P. 48-60.
- Kuznetsova E.A., Sirota N.P., Mitroshina I.Y., Pikalov A.B., Smirnova E.N., Rozanova O.M. DNA damage in blood leukocytes from mice irradiated with accelerated carbon ions with an energy of 450 MeV/nucleon //Int. J. Radiat. Biol. 2020. V. 96, N 10. P. 1245-1253.
- Collins A.R., Oscoz A.A., Brunborg G., Gaivão I., Giovannelli L., Kruszewski M., Smith C.C., Stetina R. The comet assay: topical issues //Mutagenesis. 2008. V. 23, N 3. P. 143-151.
- Kondrashova M., Zakharchenko M., Khunderyakova N. Preservation of the in vivo state of mitochondrial network for ex vivo physiological study of mitochondria //Int. J. Biochem. Cell Biol. 2009. V. 41, N 10. P. 2036-2050.
- Хундерякова Н.В., Захарова Н.М. Оценка активности сукцинатдегидрогеназы и лактатдегидрогеназы в лимфоцитах крови у якутских сусликов Spermophilus undulatus при гибернации и в активном состоянии //Бюллетень экспериментальной биологии и медицины. 2020. Т. 169, № 4. С. 426-430.
- Заичкина С.И., Дюкина А.Р., Розанова О.М., Романченко С.П., Сирота Н.П., Кузнецова Е.А., Симонова Н.Б., Сорокина С.С., Закржевская Д.Т., Юсупов В.И., Багратишвили В.Н. Сочетанное воздействие низкоинтенсивного гелий-неонового лазера и рентгеновского излучения на in vivo клеточный ответ цельной крови и лимфоидных органов у мышей //Бюллетень экспериментальной биологии и медицины. 2016. Т. 161, № 5. С. 621-624.
- Saini D., Shelke S., Mani Vannan A., Toprani S., Jain V., Das B., Seshadri M. Transcription profile of DNA damage response genes at G₀ lymphocytes exposed to gamma radiation //Mol. Cell Biochem. 2012. V. 364, N 1-2. P. 271-281.
- Суворова Л.А., Нугис В.Ю. Динамика лейкоцитов и лейкограммы после однократного облучения человека в дозах менее 1 Гр //Медицинская радиология и радиационная безопасность. 2012. Т. 57, № 1. С. 30-38.
- Wilkins R.G., Wilkinson D., Maharaj H.P., Cybulski M.B, McLeanet J.R. Differential apoptotic response to ionizing radiation in subpopulations of human white blood cells //Mutat. Res. 2002. V. 513, N 1-2. P. 27-36.
- Romero-Weaver A.L., Wan X.S., Kennedy A.R. Kinetics of neutrophils in mice exposed to radiation and/or granulocyte colony-stimulating factor treatment //Radiat. Res. 2013. V. 180, N 2. P. 177-188.
- Sanzari J.K., Wan X.S., Krigsfeld G.S., Wroe A.J., Gridley D.S., Kennedy A.R. The effects of gamma and proton radiation exposure on hematopoietic cell counts in the ferret model //Gravit. Space Res. 2013. V. 1, N 1. P. 79-94.
- Kobashigawa S., Suzuki K., Yamashita S. Ionizing radiation accelerates Drp1-dependent mitochondrial fission, which involves delayed mitochondrial reactive oxygen species production in normal human fibroblast-like cells //Biochem. Biophys. Res. Commun. 2011. V. 414, N 4. P. 795-800.
- Косова А.А., Ходырева С.Н., Лаврик О.И. Роль глицеральдегид-3-фосфатдегидрогеназы в репарации ДНК //Биохимия. 2017. Т. 82, № 6. С. 859-872.


