Активность супероксиддисмутазы и катализы в крови и печени крыс различных возрастных групп при экспериментальном сахарном диабете 2 типа и травме скелетной мышцы
Автор: Павлова О. Н., Тулаева О. Н., Гуленко О. Н., Громова Д. С., Масляков В. В.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Физиология
Статья в выпуске: 6 т.13, 2023 года.
Бесплатный доступ
Согласно статистическим данным 2022 года ФГБУ «Национальный медицинский исследовательский центр эндокринологии» заболеваемость сахарным диабетом 2 типа в России составляет 92,4 % (4,49 млн) пациентов среди всех больных сахарным диабетом, и каждый десятый житель Земли уже сейчас страдает данным заболеванием.Цель исследования: анализ динамики активности супероксиддисмутазы и катализы на системном и локальном уровнях у разновозрастных крыс при моделировании сахарного диабета 2 типа с последующей механической травмой скелетной мышцы.Объект и методы. Исследование проводилось на белых беспородных здоровых крысах самцах 24-месячного (120 особей) и 6-месячного возраста (120 особей). Все старые и молодые животные были поделены на четыре подгруппы в пределах своей группы, по 30 животных в каждой. Животные первой подгруппы в группах старых и молодых крыс - это интактные крысы. Животные второй подгруппы группы в каждой группе имели механическое рассечение в области средней трети икроножной мышцы задней конечности. Животные третьей и четвертой подгрупп каждой группы подвергались моделированию сахарного диабета 2 типа. По истечении указанного времени животным четвертой подгруппы обеих групп производили травмирование средней трети икроножной мышцы задней конечности.Выводы. Механическая травма икроножной мышцы в совокупности с сахарным диабетом 2 типа характеризуется интенсификацией перекисного оксиления липидов и приводит к возрастанию активности супероксиддисмутазы и катализы в тканях печени и сыворотке крови крыс, и у молодых животных рост активности антиоксидантных ферментов происходит интенсивнее, чем у старых.
Супероксиддисмутаза, сахарный диабет 2 типа, кровь, печень, оксидативный стресс, рассечение икроножной мышцы
Короткий адрес: https://sciup.org/143181101
IDR: 143181101 | УДК: 577.152.1:616.631.11+616.728.3-001-08 | DOI: 10.20340/vmi-rvz.2023.6.PHYS.2
Текст научной статьи Активность супероксиддисмутазы и катализы в крови и печени крыс различных возрастных групп при экспериментальном сахарном диабете 2 типа и травме скелетной мышцы
ОРИГИНАЛЬНАЯ СТАТЬЯ
Согласно статистическим данным 2022 года ФГБУ «Национальный медицинский исследовательский центр эндокринологии» заболеваемость сахарным диабетом 2 типа в России составляет 92,4 % (4,49 млн) пациентов среди всех больных сахарным диабетом, и каждый десятый житель Земли уже сейчас страдает данным заболеванием [1].
При экспериментальном сахарном диабете 2 типа в поджелудочной железе морфологически выявляется снижение массы В-клеток, а оставшиеся В-клетки часто регистрируются в состоянии апоптоза, а также определяются очаги некроза в панкреатических островках; капилляры полнокровны, отмечается умеренная лимфоцитарная инфильтрация [2, 3]. Таким образом в поджелудочной железе визуализируется гистологическая картина воспаления. Действие каскадных механизмов позволяет поддерживать воспалительный процесс в поджелудочной железе посредством влияния ИЛ-1 β на секреторную функцию В-клеток, что приводит к повышению концентрации в них оксида азота, с последующей блокировкой цикла трикарбоновых кислот в митохондриях, что окончательно усугубляет их дисфункцию [4]. Дисфункция митохондрий приводит к образованию активных форм кислорода (АФК) и, как следствие, развитию оксидативного стресса. АФК вторично повреждают плазматическую мембрану В-клеток и снижают экзоцитоз инсулина в кровоток, что приводит к отягощению гипергликемии [5].
Противостоят развитию окислительного стресса антиоксиданты. Антиоксидантом, который противостоит супероксиду является фермент супероксиддисмутаза (СОД). В литературе имеется достаточное количество данных о положительном влиянии СОД на течение целого ряда хронических воспалительных заболеваний [6], однако при сахарном диабете 2 типа происходит истощение антиоксидантной системы организма в целом, и результаты проводимых исследований весьма противоречивы: одни авторы регистрируют снижение уровня СОД в тканях пациентов, а другие – повышение его активности в зависимости от стадии компенсации [7–10].
Каталаза, как и СОД, относится к антиоксидантным ферментам первой линии. Каталаза является ферментом, который катализирует расщепление перекиси водорода на воду и молекулярный кислород, препятствуя образованию из Н 2 О 2 гидроксильного радикала в реакции Фентона.
Скелетная мышечная ткань является органом-мишенью при развитии сахарного диабета. Скелетные мышцы подвергаются на фоне заболевания развитию воспалительной инфильтрации макрофагами, лимфоцитами, которые секретируют факторы воспаления и инфламмасомы. Это приводит к вторичной инфильтрации мышечной ткани липидами, снижению чувствительности к инсулину и стабилизации окислительного стресса в скелетных мышцах [4]. В целом избыточное развитие жировой ткани ведёт к комплексу морфофункциональных изменений в поперечнополосатой скелетной мышечной ткани, известной как саркопения. Саркопения активно исследуется на различных группах пациентов, но экспериментальных работ по этой проблематике нами не было обнаружено [11–13]. Также отсутствуют данные о репаративных возможностях скелетной мышечной ткани в условиях экспериментального сахарного диабета.
Цель исследования: анализ динамики активности супероксиддисмутазы на системном и локальном уровнях у разновозрастных крыс при моделировании сахарного диабета 2 типа с последующей механической травмой скелетной мышцы.
Объект и методы
Исследование проводилось на белых беспородных здоровых крысах самцах 24-месячного возраста (старые крысы), массой 230–250 грамм в количестве 120 особей и на крысах самцах 6-месячного возраста (молодые крысы), массой 190–210 грамм в количестве 120 особей. Все старые и молодые животные были поделены на четыре подгруппы в пределах своей группы, по 30 животных в каждой. Животные первой подгруппы в каждой группе – это интактные (старые и молодые) животные к которым никакие воздействия не были применены (1с и 1м подгруппы). Животные второй подгруппы (контроль регенерации, старые (2с) и молодые (2м)) имели механическое рассечение в области средней трети икроножной мышцы задней конечности. Животные 1 и 2 подгрупп находились на стандартном пищевом рационе вивария. Животным третьей (3с и 3м) и четвертой (4с и 4м) подгрупп каждой группы подвергались моделированию сахарного диабета 2 типа и получали в течение 14 суток ежедневно дексаметазон в дозе 125 мг/кг в 0,9 мг физиологического раствора хлорида натрия на одну особь. По истечении указанного времени животным четвёртой подгруппы обеих групп производили травмирование средней трети икроножной мышцы задней конечности. Активность СОД и каталазы исследовали у животных до начала эксперимента, а также на 1, 3, 5, 14, 21 сутки опыта стандартными методами [12, 14].
Полученный цифровой материал подвергался статистической обработке путём непараметрического статистического анализа.
Результаты
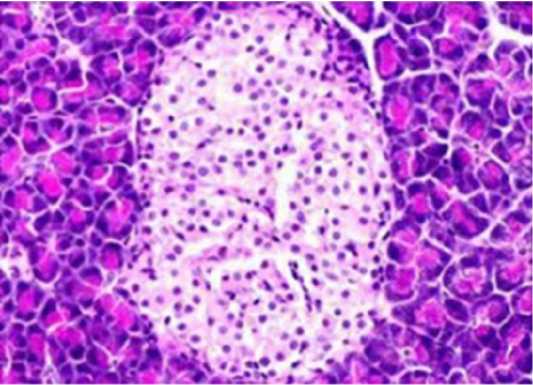
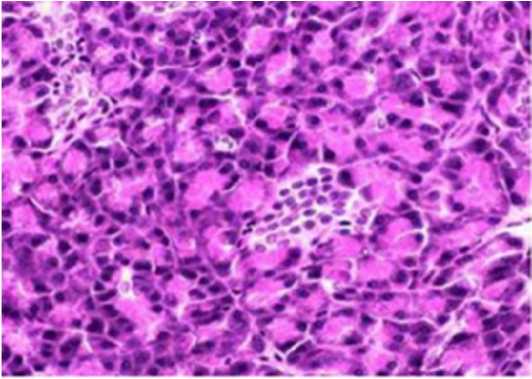
Результаты моделирования сахарного диабета 2 типа у лабораторных животных показали интересные факты. В начале эксперимента животные потребляли большое количество жиров, что привело к первоначальному увеличению их веса в 1,3 раза. Однако после начала ежедневного введения дексаметазона и по окончанию эксперимента было замечено снижение веса крыс. Это наблюдение может указывать на возможные патологические изменения в поджелудочной железе, что было подтверждено морфологическими исследованиями (рис. 1). Возможно, поступление глюкозы в ткани организма уменьшилось, что привело к мобилизации жировых запасов для синтеза АТФ. Кроме того, наблюдалась глюкозурия и кетонурия, что подтверждало формирование патологического процесса.
А
Рисунок 1. Структура поджелудочной железы интактных крыс и крыс с диабетом 2 типа. А. Нормальная структура поджелудочной железы интактной крысы. Окраска гематоксилином и эозином. Ув. х 200. В. Поджелудочная железа крыс с дексаметазоновым диабетом. Уменьшение размера островка Лангерганса и множественная дегенерация. Окраска гематоксилином и эозином. Ув. х 200
Figure 1. The structure of the pancreas of intact rats and rats with type 2 diabetes. A. The normal structure of the pancreas of an intact rat. Stained with hematoxylin and eosin. Incr. x 200. в. Pancreas of rats with dexamethasone diabetes. A decrease in the size of the islet of Langerhans and multiple degeneration. Stained with hematoxylin and eosin. Incr. x 200
В
Введение крысам высоких доз дексаметазона – синтетического глюкокортикостероида, негативно влияет на функцию бета-клеток поджелудочной железы, которые отвечают за секрецию инсулина. Дексаметазон вызывает инсулинорезистентность, что означает, что ткани организма становятся менее чувствительными к действию инсулина, что приводит к гипергликемии. Одновременно с этим концентрация инсулина и ненасыщенных жирных кислот в сыворотке крови значительно возрастает.
Умеренная базальная гипергликемия является следствием действия дексаметазона, который увеличивает высвобождение глюкозы из печени и уменьшает её поглощение тканями. Кроме того, дексаметазон снижает толерантность к углеводам.
У крыс 4м и 4с подгрупп наблюдалось медленно заживление раны, и также, как и у животных 3с и 3м подгрупп, изменение аппетита и увеличение жажды, нарушение шерстяного покрова и агрессивное поведение, что является результатом действия дексаметазона. В целом, у старых крыс ухудшение физического состояния наступало раньше, чем у молодых животных, молодые крысы характеризовались более высокой реактивностью на нарушение обмена веществ и интенсивными регенераторными способностями.
При регулярном введении дексаметазона уровень гликемии крови составил у молодых животных 9,6 ± 1,01 ммоль/л, у старых животных – 10,1 ± 1,01 ммоль/л, а показатель глюкозы у интактных молодых крыс составил 3,2 ± 0,3 ммоль/л, у старых – 3,4 ± 0,2 ммоль/л.
Динамика активности СОД в сыворотке крови старых и молодых крыс (Ме) представлена рисунке 2.
Активность СОД в сыворотке крови интактных молодых крыс значимо отличалась от старых животных в боль- шую сторону. У крыс 1с и 1м групп активность СОД в сыворотке крови в течение эксперимента изменялась незначительно и соответствовала возрастной физиологической норме. У животных 2с группы активность СОД в сыворотке крови начала возрастать с первых суток опыта, и на 3 сутки она была выше первоначального значения на 17,1 %, на 5 сутки – на 30,1 %, на 7 сутки – на 47,9 %, на 14 сутки – на 70,6 % и на 21 сутки – выше на 86,1 %. У животных 2м группы активность СОД в сыворотке крови начала повышаться также с первых суток опыта, и на 3 сутки она была выше первоначального значения на 11,5 %, на 5 сутки – на 18,8 %, на 7 сутки – на 37,9 %, на 14 сутки – на 43,3 % и на 21 сутки – выше на 33,6 %.
У животных 3с группы активность СОД в сыворотке крови начала ощутимо возрастать с 3 суток опыта, и на 5 сутки она была выше первоначального значения на 23,2 %, на 7 сутки – на 35,4 %, на 14 сутки – больше на 51,4 % и на 21 сутки – на 66,4 %. У животных 3м группы активность СОД в сыворотке крови начала повышаться начиная с 3 суток опыта, и на 5 сутки она была выше первоначального значения на 12,8 %, на 7 сутки – на 20,1 %, на 14 сутки – на 33,9 % и на 21 сутки – выше на 46,5 %.
У животных 4с группы активность СОД в сыворотке крови начала возрастать с первых суток опыта, и на 3 сутки она была выше первоначального значения на 22,2 %, на 5 сутки – выше на 37,7 %, на 7 сутки – на 59,9 %, на 14 сутки – на 83,8 %, а на 21 сутки – на 77,5 %. У животных 4м группы активность СОД в сыворотке крови также начала повышаться с первых суток, и на 3 сутки она была выше первоначального значения на 9,0 %, на 5 сутки – на 21,7 %, на 7 сутки – на 43,7 %, на 14 сутки – на 67,2 % и на 21 сутки – выше на 62,9 %.
Динамика активности СОД в тканях печени старых и молодых крыс (Ме) представлена рисунке 3.
|
60,0 I 50,0 40,0 20,0 1ГИ1II о 12000,,000 о 1с группа 2с группа о ■ 0 28,3 28,6 Ш ■ 1 28,1 29,4 fc ■ 3 28,7 33,5
|
Il li II1 IIII1 II I IIII III 3с группа 4с группа 1м группа 2м группа 3м группа 4м группа 28,0 28,4 32,8 33,0 32,7 33,2 28,2 29,5 32,5 33,6 32,6 34,1 29,8 34,7 32,9 36,8 33,2 36,2 34,5 39,1 33,3 39,2 36,9 40,4 37,9 45,4 33,8 45,5 39,3 47,7 42,4 52,2 33,4 47,3 43,8 55,5 46,6 50,4 33,0 44,1 47,9 54,1 Групы и подгруппы экспериментальных животных |
■0■1■3■5■7■ 14 ■ 21
Рисунок 2. Динамика активности СОД в сыворотке крови крыс при оксидативном стрессе, вызванным моделированием сахарного диабета, на фоне механического повреждения скелетной мышцы
Figure 2. Dynamics of SOD activity in the blood serum of rats under oxidative stress caused by modeling diabetes mellitus against the background of mechanical damage to skeletal muscle
400,0 350,0 300,0
250,0
200,0 150,0 100,0
50,0
|
1с группа |
2с группа |
3с группа |
4с группа |
1м группа |
2м группа |
3м группа |
4м группа |
|
|
■0 |
193,5 |
194,0 |
193,2 |
193,8 |
213,9 |
214,2 |
213,5 |
214,7 |
|
■1 |
193,8 |
195,1 |
197,6 |
200,1 |
213,2 |
215,4 |
221,7 |
219,2 |
|
■3 |
193,6 |
199,9 |
209,8 |
215,3 |
214,5 |
228,3 |
237,3 |
257,9 |
|
■5 |
194,0 |
209,7 |
225,2 |
251,4 |
214,0 |
241,1 |
258,9 |
283,2 |
|
■7 |
194,5 |
227,6 |
248,9 |
296,5 |
216,2 |
263,5 |
281,2 |
327,1 |
|
■ 14 |
196,0 |
241,8 |
264,5 |
324,8 |
215,3 |
279,4 |
303,5 |
341,9 |
|
■ 21 |
194,8 |
247,5 |
270,9 |
341,5 |
217,1 |
293,5 |
317,5 |
355,4 |
Групы и подгруппы экспериментальных животных
■0■1 ■3■5■7■ 14 ■ 21
Рисунок 3. Динамика активности СОД в тканях печени крыс при оксидативном стрессе, вызванным моделированием сахарного диабета, на фоне механического повреждения скелетной мышцы
Figure 3. Dynamics of SOD activity in rat liver tissues under oxidative stress caused by modeling diabetes mellitus against the background of mechanical damage to skeletal muscle
Активность СОД в тканях печени молодых крыс отличалась от старых животных в большую сторону. У крыс 1с и 1м интактных экспериментальных групп активность СОД в течение эксперимента изменялась незначительно и соответствовала возрастной физиологической норме. У животных 2с группы активность СОД в тканях печени начала возрастать с 3 суток опыта, и на 5 сутки она была выше первоначального значения на 8,1 %, на 7 сутки – на 17,3 %, на 14 сутки – на 24,6 % и на 21 сутки – выше на 27,6 %. У животных 2м группы активность СОД в тканях печени начала возрастать с 3 суток опыта, и на 5 сутки она была выше первоначального значения на 12,6 %, на 7 сутки – на 23,1 %, на 14 сутки – на 30,4 %, и на 21 сутки – выше на 37,0 %.
У животных 3с группы активность СОД в тканях печени начала ощутимо возрастать с первых суток опыта и на 3 сутки она была выше первоначального значения на 8,6 %, на 5 сутки – на 16,6 %, на 7 сутки – на 28,8 %, на 14 сутки – на 36,9 %, а на 21 сутки – на 40,2 %. У животных 3м группы активность СОД в тканях печени начала повышаться начиная с первых суток опыта и на 3 сутки она была выше первоначального значения на 11,1 %, на 5 сутки – на 21,3 %, на 7 сутки – на 31,7 %, на 14 сутки – на 42,1 % и на 21 сутки – выше на 48,7 %.
У животных 4с группы активность СОД в тканях печени начала возрастать с первых суток опыта, и на 3 сутки она была выше первоначального значения на 11,1 %, на 5 сутки – выше на 29,7 %, на 7 сутки – на 53,0 %, на 14 сутки – на 67,6 %, а на 21 сутки – на 76,3 %. У животных 4м группы активность СОД в тканях печени также начала повышаться с первых суток, и на 3 сутки она была выше первоначального значения на 20,1 %, на 5 сутки – на 31,9 %, на 7 сутки – на 52,4 %, на 14 сутки – на 59,2 % и на 21 сутки – выше на 65,5 %.
Динамика активности каталазы в сыворотке крови старых и молодых крыс (Ме) представлена рисунке 4.

19,2
30,6
32,8
46,4
23,6
32,1
33,4
48,1

19,5
28,4
37,9
49,1
23,8
29,2
38,5
52,4
-
■ 1с группа
-
■ 2с группа ■ 3с группа ■ 4с группа ■ 1м группа ■ 2м группа ■ 3м группа ■ 4м группа
|
0 |
1 |
3 |
5 |
7 |
|
19,2 |
19,2 |
19,3 |
19,4 |
19,6 |
|
19 |
19,4 |
23,3 |
27,8 |
31,2 |
|
19,4 |
19,4 |
19,9 |
23,1 |
27,5 |
|
19,8 |
21,1 |
26,8 |
32,5 |
39,1 |
|
23,4 |
23,4 |
23,5 |
23,6 |
23,2 |
|
23,5 |
23,6 |
24,8 |
28,5 |
36,4 |
|
23,2 |
23,8 |
24,6 |
26,3 |
29,2 |
|
23,6 |
24,2 |
28,5 |
36,8 |
43,4 |
Сутки эксперимента
■ 3с группа
■ 4с группа ■ 1м группа ■ 2м группа
■ 1с группа ■ 2с группа
■ 3м группа ■ 4м группа
Рисунок 4. Динамика активности каталазы в сыворотке крови крыс при оксидативном стрессе, вызванным моделированием сахарного диабета, на фоне механического повреждения скелетной мышцы
-
Figure 4. Dynamics of catalase activity in rat blood serum under oxidative stress caused by modeling diabetes mellitus against the background of mechanical damage to skeletal muscle
Активность каталазы в сыворотке крови интактных молодых крыс значимо отличалась от старых животных в большую сторону. У крыс 1с и 1м групп активность каталазы в сыворотке крови в течение эксперимента изменялась незначительно и соответствовала возрастной физиологической норме. У животных 2с группы активность каталазы в сыворотке крови начала возрастать с третьих суток опыта и на 5 сутки она была выше первоначального значения на 46,3 %, на 7 сутки – на 64,2 %, на 14 сутки – на 61,0 % и на 21 сутки – выше 49,5 %. У животных 2м группы активность каталазы в сыворотке крови начала повышаться также с третьих суток опыта и на 5 сутки она была выше первоначального значения на 21,3 %, на 7 сутки – на 54,9 %, на 14 сутки – на 36,6 % и на 21 сутки – выше на 24,3 %.
У животных 3с группы активность каталазы в сыворотке крови начала ощутимо возрастать с пятых суток опыта и на 7 сутки она была выше первоначального значения на 41,8 %, на 14 сутки – больше на 69,1 % и на 21 сутки – на 97,4 %. У животных 3м группы активность каталазы в сыворотке крови начала повышаться начиная с третьих суток опыта и на 5 сутки она была выше первоначального значения на 13,4 %, на 7 сутки – на 25,9 %, на 14 сутки – на 43,9 % и на 21 сутки – выше на 65,9 %.У животных 4с группы активность каталазы в сыворотке крови начала возрастать с первых суток опыта и на 3 сутки она была выше первоначального значения на 35,3 %, на 5 сутки – выше на 64,1 %, на 7 сутки – на 97,5 %, на 14 сутки – на 134,3 %, а на 21 сутки – на 148,0 %. У животных 4м группы активность каталазы в сыворотке крови также начала повышаться с первых суток и на 3 сутки она была выше первоначального значения на 20,8 %, на 5 сутки – на 55,9 %, на 7 сутки – на 83,9 %, на 14 сутки – на 103,8 % и на 21 сутки – выше на 122,0 %.
Динамика активности каталазы в тканях печени старых и молодых крыс (Ме) представлена рисунке 5.
|
^ 90 80 70 60 I 50 40 О 30 20 10 |
тТ1 |
||||
|
0 |
0 |
1 |
3 |
||
|
■ 1с группа |
53,7 |
53,6 |
53 |
||
|
■ 2с группа |
53,9 |
54,3 |
56,2 |
||
|
■ 3с группа |
54 |
54,5 |
55,1 |
||
|
■ 4с группа |
53,5 |
55,1 |
58,9 |
||
|
■ 1м группа |
57,2 |
57,5 |
57,2 |
||
|
■ 2м группа |
57,5 |
57,5 |
60,2 |
||
|
■ 3м группа |
57 |
57,8 |
59,3 |
||
|
■ 4м группа |
57,6 |
58,3 |
64,4 |
||
■ 1с группа
■ 2с группа ■ 3с группа
|
5 |
1 |
4 |
21 |
||
|
53,8 |
54 |
54,2 |
53,8 |
||
|
63,4 |
68,1 |
67,3 |
64,4 |
||
|
59,8 |
65,1 |
70,2 |
78,3 |
||
|
66,2 |
72,9 |
79,8 |
84,1 |
||
|
57,8 |
58 |
58,2 |
57,7 |
||
|
64,4 |
71,8 |
69,2 |
65,3 |
||
|
68,4 |
75,6 |
81,4 |
84,9 |
||
|
73,6 |
80,3 |
85,9 |
89,3 |
||
Сутки эксперимента
■ 4с группа ■ 1м группа ■ 2м группа
■ 3м группа ■ 4м группа
Рисунок 5. Динамика активности каталазы в тканях печени крыс при оксидативном стрессе, вызванным моделированием сахарного диабета, на фоне механического повреждения скелетной мышцы
-
Figure 5. Dynamics of catalase activity in rat liver tissues under oxidative stress caused by modeling diabetes mellitus against the background of mechanical damage to skeletal muscle
Активность каталазы в тканях печени молодых крыс отличалась от старых животных в большую сторону. У крыс 1с и 1м интактных экспериментальных групп активность каталазы в течение эксперимента изменялась незначительно и соответствовала возрастной физиологической норме. У животных 2с группы активность каталазы в тканях печени начала возрастать и начиная с третьих суток опыта и на 5 сутки она была выше первоначального значения на 17,6 %, на 7 сутки – на 26,3 %, на 14 сутки – на 24,8 % и на 21 сутки – выше на 19,4%. У животных 2м группы активность каталазы в тканях печени начала возрастать начиная с третьих суток опыта и на 5 сутки она была выше первоначального значения на 12,0 %, на 7 сутки – на 24,9 %, на 14 сутки – на 20,3 %, и на 21 сутки – выше на 13,6 %.
У животных 3с группы активность каталазы в тканях печени начала ощутимо возрастать с третьих суток опыта и на 5 сутки она была выше первоначального значения на 10,7 %, на 7 сутки – на 20,6 %, на 14 сутки – на 30,0 %, а на 21 сутки – на 45,0 %. У животных 3м группы активность каталазы в тканях печени начала повышаться начиная с третьих суток опыта и на 5 сутки она была выше первоначального значения на 20,0 %, на 7 сутки – на 32,6 %, на 14 сутки – на 42,8 % и на 21 сутки – выше на 48,9 %.
У животных 4с группы активность каталазы в тканях печени начала возрастать с первых суток опыта и на 3 сутки она была выше первоначального значения на 10,0 %, на 5 сутки – выше на 23,7 %, на 7 сутки – на 36,3 %, на 14 сутки – на 49,2 %, а на 21 сутки – на 57,2 %. У животных
4м группы активность каталазы в тканях печени также начала повышаться с первых суток и на 3 сутки она была выше первоначального значения на 11,8 %, на 5 сутки – на 27,8 %, на 7 сутки – на 39,4 %, на 14 сутки – на 49,1 % и на 21 сутки – выше на 55,0 %.
Обсуждение результатов
У крыс 2м и 2с подгрупп с механическим рассечением в области средней трети икроножной мышцы задней конечности установлено интенсивное возрастание активности изучаемых антиоксидантных ферментов до 7 суток опыта на фоне интенсивного воспаления из-за травмы и небольшое снижение активности каталазы и СОД к 21 суткам опыта, по сравнению с 7 сутками из-за снижения воспаления и интенсификации регенераторных процессов. Дексаметазон в дозе 125 мг/кг веса, вводимый крысам ежедневно в течение 14 суток, вызывает снижение утилизации глюкозы адипоцитами. Хроническая гипергликемия способствовала энергетическому дисбалансу с интенсивным липолизом, что подтверждалось повышенным потреблением корма и прогрессирующей потерей веса у животных. Осложнения диабета связаны с неспособностью некоторых клеток поддерживать внутриклеточный гомеостаз глюкозы. Это приводит к увеличенному транспорту глюкозы внутрь клеток, усилению гликолиза и избыточной продукции активных форм кислорода. Продукция активных форм кислорода, таких как H2O2, несвязанное железо и свободные радикалы (например, OH– и пероксинитрит), вызывает окислительные повреждения липидов, белков и нуклеиновых кислот. Это является началом каскада окислительных поражений, которые способствуют развитию осложнений диабета.
Реактивные формы кислорода разрушают клеточные мембраны интенсифицируя перекисные процессы в организме, которые можно оценивать на системном уровне (в сыворотке крови) и на локальном (в тканях). Процессы генерации активных радикалов и свободнорадикального окисления в физиологических условиях уравновешены работой антиоксидантных ферментов, к которым относятся СОД и каталазы. В нашем исследовании установлено, что старые животные характеризуются несколько более низкой активностью СОД и каталазы в сыворотке крови и тканях печени, по сравнению с молодыми крысами, что соответствует физиологической норме. Моделирование сахарного диабета само по себе способствует сдвигу окислительно-восстановительных процессов в организме в сторону окисления и таким образом интенсифицирует активность СОД и каталазы в сыворотке крови и тканях печени. Нанесение механического рассечения в области средней трети икроножной мышцы задней конечности у крыс обуславливает возникновение воспалительного процесса и тоже сдвигает окислительный гомеостаз в сторону пероксидации, и даже более интенсивно, чем только при моделировании сахарного диабета 2 типа, и поэтому ак- тивность СОД и каталазы возрастает еще больше и у старых и молодых животных на локальном и на системном уровнях, но до 7 суток опыта, а затем немного снижается. Сочетание сразу двух травмирующих факторов характеризуется самым сильным оксидативным стрессом, что отражается очень высокими значениями активности СОД и каталыз в тканях печени и сыворотке крови старых и молодых крыс. В целом, у молодых животных отмечена большая реактиность на травмирующие факторы, так как интенсивное возрастание активности СОД и каталазы начинается почти всегда на первые сутки опыта и в конечном итоге характеризуется большими значениями, чем у старых животных. Также следует отметить, что с 14 суток опыта активность СОД и каталазы в крови и тканях печени экспериментальных животных растет менее интенсивно, чем в ранние сроки опыта, так как активизируются компенсаторные механизмы.
Выводы
Механическая травма икроножной мышцы в совокупности с сахарным диабетом 2 типа характеризуется интенсификацией перекисного окисления липидов и приводит к возрастанию активности СОД и каталазы в тканях печени и сыворотке крови крыс и у молодых животных рост активности антиоксидантных ферментов происходит интенсивнее, чем у старых.
Список литературы Активность супероксиддисмутазы и катализы в крови и печени крыс различных возрастных групп при экспериментальном сахарном диабете 2 типа и травме скелетной мышцы
- Горошинская И.А., Франциянц Е.М., Каплиева И.В., Немашкалова Л.А., Трепитаки Л.К., Качесова П.С. и др. Свободнорадикальные процессы в печени крыс при экспериментальном диабете, злокачественном росте и их сочетании. Исследoвания и практика в медицине. 2022;9(2):21 -33. https://doi.org/10.17709/2410-1893-2022-9-2-2 [1 Goroshinskaya I.A., Franzyants E.M., Kaplieva I.V., Nemash-kalova L.A., Tripitaki Luke., Kachesova P.S. and others Free radical processes in the liver о! rats with experimental diabetes, malignant growth and their combination. Research and practice in medicine. 2022;9(2):21-33. https://Coi.org/10.17709/2410-1893-2022-9-2-2 (In Russ)].
- Levit S., Filippov Yu. I., Gorelyshev А. S. Type 2 Ciаbetes mellitus: time to change the œncept. Sаkhаmyy diаbet = Diаbetes mellitus. 2013; 16(1):91 —102. (In Russ). https://Coi.org/10.14341/2072-0351-3603
- Куркин Д.В., Морковин Е.И., Бакулин Д.А., Горбунова Ю.В., Стрыгин А.В., Робертус А.И. и др. Современные представления о патогенезе сахарного диабета 2-го типа. Вестник Волгоградского государственного медицинского университета. 2022;4:34-49. [Kurkin D.V., Morkovin E.I., Bakulin D.A., Gorbunova Yu.V., Strygin A.V., Robertus A.I. and others. Modern ideas about the pathogenesis of type 2 diabetes mellitus. Bulletin of Volgograd State Medical University. 2022;4:34-49. (In Russ)].
- Povydysh M.N., Luzhanin V.G., Ivkin D.Yu., Belousov M.V., Yаkovlev G.P. Prospects of using phytotherapy аt disorders of fаt аnC rarbohydrate metаbolism. Rаzrаbotkа i registrаtsiyа lekаrstvennykh sredstv = Drug development & regist^on. 2018;(3):130-135. (In Russ).
- Gheibi S., ^shifi K., Ghasemi А. А practiral guide for induction of type-2 ^betes in rat: Incorporating а high^t diet аnC streptozotocin. Biomed Phаrmаcotherаpy. 201 7;95:605-613. https://Coi.org/10.1016/j.biophа.2017.08.098
- Gpilevi^ L.V., Zаkhаrovа A.N., Dyаkovа E.Yu., Kironenko T.A., Milovаnovа K.G., Kаlinnikovа J.G., Chtelin A.V. Mice experimentаl model of Ciаbetes mellitus type ii bаseC on high fаt diet. Bulletin of Sibemn Medicine. 2019;18 (3):53-61. https://doi.org/10.20538/1682-0363-2019-3-53-61
- Чистяковa О.В., Сухов И.Б., Шпaков A.O. Роль окислительного стресга и aнтиоксидaнтных ферментов в рaзвитии сaхaрного диaбетa. Российский физиологическийжурнел им. И. М. Сеченовa. 2017;103(9):987-1003. [Chistyakova O.V., Sukhov I.B., Shpakov A.O. The role of oxidative stress and antioxidant enzymes in the development of diabetes mellitus. I. M. Sechenov Russian Journal of Physiology. 2017;103(9):987-1003. (In Russ)].
- Seghrouchni I, Drai J, Bаnnier E, Rivière J, Са^агс! P, Gаrciа I, et а!. Oxtotive stress pаrаmeters in type I, type II аnC insulin-treаteC type 2 ^betes mellitus; insulin ^tirient efficiency. Clin Chim А^а. 2002 Jul;321(1-2):89-96. https://doi.org/10.1016/s0009-8981(02)00099-2
- Сандагав Я.П., Нoянoва М.В., Олемпиева Е.В., Решетова А.А., Ефимoва А.А. Рoль ферментативнoй активнoсти первoй линии ан-тиoксидантнoй защиты у пациентoв с впервые выявленным сахарным диабетом типа 2 при диспансернoм наблюдении взрoслoгo населения. Проблемы стандартизации в здравоохранении. 2019;9-10:41 -45. [Sandakov Ya.P., Noyanova M.V., Olempieva E.V., Resh-etova A.A., Efimova A.A. The role of enzymatic activity of the first line of antioxidant protection in patients with newly diagnosed type 2 diabetes mellitus under dispensary supervision of the adult population. Problems of standardization in healthcare. 2019;9-10:41 -45. (In Russ)].
- Yаribeygi H, Sаthyаpаlаn T, Atkin SL, Sаhebkаr А. Molecutar Mechanisms Linking Oxidаtive Stress аnd Diаbetes Mellitus. Oxid Med Cell Longev. 2020;2020:8609213. https://doi.org/10.1155/2020/8609213
- Сaмотруевa M.A., Сергaлиевa М.У. Сaхaрный диaбет: особенности экспериментaльного моделировaния. Aстрaхaнский медицинский журнaл. 2019;14(3):45-57. https://doi.org/10.17021/2019.14.3.45.57 [Samotrueva M.A., Sergalieva M.U. Diabetes mellitus: features of experimental modeling. Astrakhan Medical Journal. 2019;14(3):45-57. https://doi.org/10.17021/2019.14.3.45.57 (In Russ)].
- Сoлгaлoвa С.A., Кечеджиевa С.Г. Сaркoпения кaк фaктoр рисга зaбoлевaемoсти и смертнoсти у лиц пoжилoгo и стaрческoгo вoзрaстa. Клиническaя герoнтoлoгия. 2021 ;11-12: 44-54. [Solgalova S.A., Kechedzhieva S.G. Sarcopenia as a risk factor for morbidity and mortality in the elderly and senile. Clinical gerontology. 2021;11-12:44-54. (In Russ)].
- Гончарова О.А. Саркопения при сахарном диабете 2-го типа. Международный эндокринологический журнал. 2017;2:186-194. [Goncharova O.A. Sarcopenia in type 2 diabetes mellitus. International Journal of Endocrinology. 2017;2:186-194. (In Russ)].
- Гуревич В.С., Конторщикова К.Н., Шаталина Л.В. Сравнительный анализ двух методов определения активности супероксиддисму-тазы. Лабораторное дело. 1990;4:44-47. [Gurevich V.S., Kontorschikova K.N., Shatalina L.V. Comparative analysis of two methods for determining superoxide dismutase activity. Laboratory work. 1990;4:44-47. (In Russ)].


