Активность внутриклеточных лектинов Lentinus edodes на разных стадиях развития гриба при глубинном и твердофазном культивировании
Автор: Ветчинкина Е.П., Никитина В.Е.
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Проблемы прикладной экологии
Статья в выпуске: 2 т.10, 2008 года.
Бесплатный доступ
Исследована гемагглютинирующая активность внутриклеточных лектинов базидиального гриба Lentinus edodes (шиитаке) штаммов F-249 и 2-Т на разных стадиях морфогенеза в зависимости от способа культивирования, среды выращивания и степени очистки препаратов. Активность лектинов гриба в большей степени зависела от морфогенетической стадии культуры и в меньшей степени от состава питательных сред. Установлено, что при твердофазном культивировании активность лектинов на не- сколько порядков выше, по сравнению с лектиновой активностью глубинной культуры. По мере очис- тки внутриклеточных лектинов шиитаке наблюдалось увеличение их активности. Обнаружено положи- тельное влияние чистого препарата лектина L. edodes на образование коричневой мицелиальной плен- ки.
Короткий адрес: https://sciup.org/148198134
IDR: 148198134 | УДК: 57.083.1
Текст научной статьи Активность внутриклеточных лектинов Lentinus edodes на разных стадиях развития гриба при глубинном и твердофазном культивировании
Лектины – углеводсвязывающие белки-агглютинины, присутствуют в любой биологической системе, в любом живом организме на разных уровнях организации. Они участвуют в процессах углевод-белкового узнавания, играют большую роль в межклеточном связывании, в процессах передачи сигналов в биологических системах, обладают широким спектром биологической активности и находят применение в различных областях биологии и медицины. Все это вызывает интерес ученых к данному классу соединений, однако исследования посвящены в основном изучению лектинов растительного и животного происхождения, количество работ и круг исследуемых проблем, связанных с лектинами высших грибов, весьма ограничен. Ксилотрофные базидиомицеты занимают важное место в структуре растительных и особенно лесных биоценозов. Эти грибы привлекают внимание как возможные участники процессов биодеструкции растительных отходов, а также как продуценты ферментов и биологически активных соединений [13]. Несомненный интерес представляют проблемы морфогенетического развития грибов, особенности стадий цитодифференцировки. Большая часть выделенных из базидиомице- тов биологически активных веществ являются гликопротеинами [4]. В связи с этим изучение метаболитов гликопротеиновой природы с лектиновой активностью, определение их биологического действия, на вегетативной и генеративной стадиях развития грибов, в связи с морфообразующими аспектами, подлежит выяснению и представляет важную задачу.
В этом плане особо интересен гриб Lentinus edodes (Berk.) Sing [ Lentinula edodes (Berk.) Pegler] (шиитаке), который ценится большой пищевой ценностью и вкусовыми качествами плодовых тел, и кроме того, наличием уникального комплекса биологически активных веществ, используемых для создания лечебно-профилактических и медицинских препаратов [5-8].
Это определило цель настоящей работы: изучение активности лектинов Lentinus edodes на разных стадиях морфогенетического развития гриба.
Методика
Объект исследования и условия культивирования. В работе использованы штаммы L. edodes F-249 и 2T из коллекции высших ба-зидиальных грибов кафедры микологии и альгологии Московского государственного уни- верситета. Культуры грибов поддерживали на сусло-агаре при 4оС. В качестве инокулята использовали 14-суточную культуру L. edodes. При поверхностном культивировании шии-таке на чашках Петри использовали агаризо-ванную синтетическую среду с D-глюкозой (концентрация 300 mM по углероду) и L-аспарагином при соотношении С:N 15:1 [9], а также среду с агаризованным пивным суслом (4о по Баллингу ) [10]. Глубинное культивирование осуществлялось на аналогичных средах без добавления агар-агара. Культивирование проводили в колбах объемом 250 мл со 100 мл среды, на качалке при 200 об/мин. Инокулят вносили из расчета 100 мг мицелия на 100 мл среды. Культивирование осуществлялось при 26оС как оптимальной температуре роста мицелия для данного вида [11].
В исследовании использовали поверхностный и глубинный непигментированный мицелий L. edodes на 7-е, 10-е, 14-е, 18-е, 21е, 24-е и 28-е сутки культивирования, пигментированный мицелий, коричневую мицелиальную пленку, примордии и плодовое тело.
Получение экстрактов из мицелия. Экстракты из мицелия получали в результате последовательных операций по методу Banerjee с соавт. [12] в некоторой модификации: отделение от среды выращивания, промывка дистиллированной водой, высушивание при 25oС до постоянной массы, механическое измельчение и экстракция в течение 2 часов, с расчетом 10 мл 20 mМ Tris-HCl буфера, pH=8,0 на 100 мг сухого мицелия, отделение супернатанта центрифугированием, фильтрация. Осаждение белков проводили при медленном добавлении сульфата аммония к супернатанту до 85%-ного насыщения. Полученную суспензию выдерживали 12 часов при 0оС, центрифугировали, осадок пе-рерастворяли и диализовали против воды.
Концентрацию белка в растворе определяли по методу Бредфорд [13].
Удельную активность лектинов выражали как отношение титра гемагглютинации к концентрации белка (мкг/мл) [14, 15].
Гельпроникающая хроматография. Концентрат белка наносили на колонку Sephadex G-75 (Sigma - Aldrich, Sweden) уравновешенную 20 mМ Tris-HCl, pH=8,0. Белок элюировали при скорости потока 0,5 мл/мин тем же буфером. Выход белковых фракций регистрировали на приборе Uvicord S-II (LKB, Sweden) при 280 нм. Данную процедуру проводили при всех условиях культивирования для каждой стадии морфогенеза гриба.
Гемагглютинирующая активность. Ге-магглютинирующую активность лектинов определяли реакцией гемагглютинации с самопроизвольным оседанием эритроцитов, используя 2% суспензию трипсинизирован-ных и нативных эритроцитов кролика. Титр гемагглютинации выражали как максимальное разведение лектина, при которой еще отмечается агглютинация эритроцитов [16].
Углеводная специфичность. Специфичность лектинов определяли методом ингибирования реакции гемагглютинации, с использованием 2%-ной суспензии трипсини-зированных эритроцитов кролика и стандартного набора углеводов («Sigma», США).
Физиологические свойства очищенного препарата лектина. Влияние очищенного препарата лектина на образование коричневой мицелиальной пленки у гриба L. edodes осуществляли стерильно путем нанесения водного раствора лектина в концентрации 30 мкг/мл на поверхность растущего 14-и суточного мицелия на чашках Петри с сусло-агаровой средой. Культивирование проводили при 26оС.
Результаты и их обсуждение
Для исследования лектинов на протяжении всего жизненного цикла гриба L. еdodes , в работе были использованы следующие стадии морфогенеза: непигментированный мицелий, пигментированный мицелий, коричневая мицелиальная пленка, примордии и плодовые тела. Плодовые тела получали на чашках Петри с сусло-агаром через 50-60 суток после инокуляции [17]. Все эти стадии характерны для данного базидиомицета и хорошо дифференцируются.
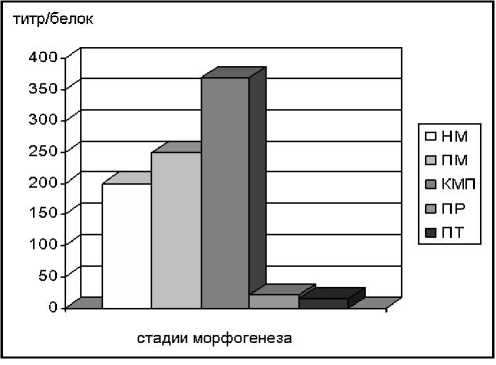
Рис. 1. Изменение удельной лектиновой активности экстрактов в зависимости от стадии морфогенеза L. edodes (штамм 2Т) при твердофазном культивировании. НМ – непигментированный мицелий; ПМ – пигментированный мицелий; КМП – коричневая мицелиальная пленка; ПР – примордий; ПТ – плодовое тело.
В результате проведенных исследований гемагглютинирующая активность была обнаружена в экстрактах из мицелия обоих штаммов шиитаке на всех стадиях морфогенеза гриба при всех условиях культивирования.
Анализ данных, представленных на рис. 1, показывает, что она не была одинаковой. Непигментированный мицелий обладал достаточно высоким титром гемагглютинации, который, однако, увеличивался по мере пигментирования и достигал своей наивысшей отметки на стадии коричневой мицелиальной пленки. Титры гемагглютинации при-мордия и плодового тела были намного ниже предыдущих стадий.
На стадии непигментированного мицелия при твердофазном культивировании наиболее активными оказались лектины 14-и суточной культуры, этот период соответствует полной колонизации субстрата грибом, после чего наблюдался спад гемагглютинирую-щей активности, и на 21-е-28-е сутки она была в 3-4 раза ниже (рис. 2). В это время происходит уплотнение мицелия и, по всей видимости, идет подготовка к образованию структур предшествующих плодоношению. При глубинном культивировании было отмечено два пика гемагглютинирующей активности: на 10-е и на 18-е сутки эксперимента. На 14-е сутки отмечен спад титра гемагглютинации, а наименее активны были лектины 28-и суточного мицелия (рис. 2).
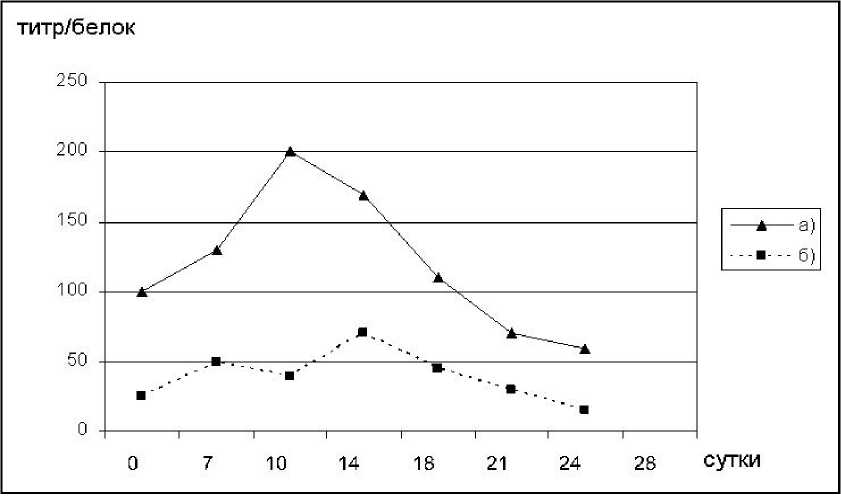
Рис. 2. Динамика удельной лектиновой активности экстрактов из непигментированного мицелия L. edodes (штамм 2T) в зависимости от времени выращивания. а) твердофазное культивирование; б) глубинное культивирование
По мере пигментирования мицелия титр гемагглютинации увеличивался. Образование коричневой мицелиальной пленки – бархатистое коричневое образование, представляющей собой сплетение толстых пигментированных гиф, приводило к резкому скачку лектиновой активности. Появление этой структуры предшествует плодоношению, что характерно для культуры L. еdodes . Данная интересная корреляция между появлением мицелиальной пленки шиитаке и началом плодоношения может быть продемонстрирована на примере штаммов F-249 и 2T. У первого штамма вслед за стадией коричневой мицелиальной пленки идет образование нормальных примордий и далее плодовых тел. У второго, картина несколько иная: после колонизации субстрата и уплотнения непиг-ментированного мицелия гриб «выбрасывает» гипертрофированные бесформенные при-мордии и нормального плодоношения не происходит. Спустя некоторое время начинается образование коричневой мицелиальной пленки, после чего образуются нормальные примордии и плодовые тела. Данные факты позволяют предположить, что лектины принимают участие в образовании коричневой мицелиальной пленки, а лектиновая активность является важной биохимической характеристикой мицелия шиитаке в процессе морфогенеза. Гемагглютинирующая активность лектинов примордиев и плодовых тел была существенно ниже, чем на других стадиях морфогенеза. Изменение лектиновой активности в зависимости от стадии морфогенеза может свидетельствовать о многоплановой роли лектинов в процессе развития шиита-ке.
При сравнении экстрактов мицелия полученного путем твердофазного и глубинного культивирования, следует отметить, что глубинный непигментированный мицелий обладал примерно в 5 раз меньшей лектиновой активностью (рис. 2). Для пигментированных структур: пигментированного мицелия и коричневой мицелиальной пленки – стадии предшествующей плодоношению, а так же генеративных стадий развития гриба (при-мордий и плодовых тел) подобных различий не наблюдалось.
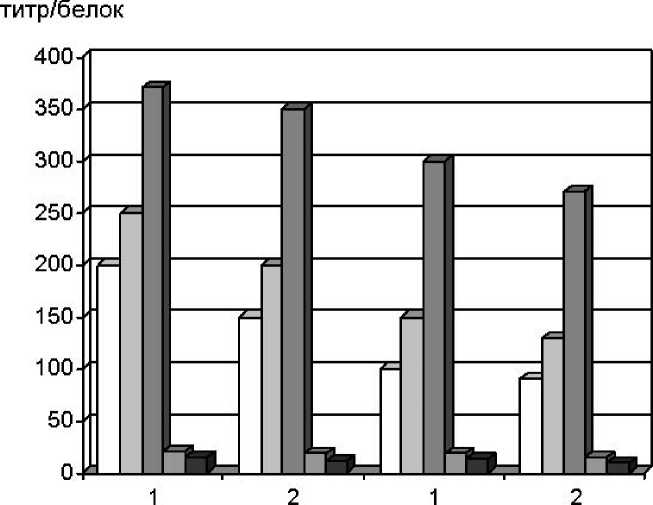
Проявление лектиновой активности зависело от состава питательных сред. В случае синтетической среды титр гемагглютинации для обоих штаммов на разных этапах формирования вегетативных структур был выше по сравнению с сусло-агаровой средой (рис. 3). Это согласуется с нашими предыдущими наблюдениями: среды, неблагоприятные для роста культуры, стимулируют повышение лек-тиновой активности L. edodes [18].
Наблюдали штаммовые различия в плане чувствительности внутриклеточных лектинов шиитаке к эритроцитам кролика. В случае штамма 2Т отмечалась более высокая, по сравнению с F-249, гемагглютинирующая активность экстрактов на всех стадиях морфогенеза для всех сред культивирования (рис. 3).
Наиболее четко указанные различия были выражены при использовании в реакции гемагглютинации трипсинизированных эритроцитов кролика. Обработка эритроцитов трипсином значительно повышала чувствительность реакции, что можно объяснить освобождением лектиновых рецепторов на поверхности эритроцитов и увеличением в 410 раз степени их связывания лектинами по сравнению с нативными эритроцитами. При взаимодействии лектинов L. edodes с нативными эритроцитами все описанные выше закономерности сохранялись, но величины титров гемагглютинации были в 4-10 раз меньше.
Исследовались гемагглютинирующие свойства лектинов L. edodes после их очистки с помощью гель-хроматографии на носителе Sephadex G-75. По мере очистки чувствительность внутриклеточных лектинов обоих штаммов к нативным и трипсинизи-рованным эритроцитам кролика значительно повышалась как на вегетативной, так и на генеративной стадиях. При этом соблюдалась отмечавшаяся и для грубых экстрактов закономерность более высокой лектиновой активности при использовании трипсинизиро-ванных эритроцитов. Очищенные внутриклеточные лектины штамма F-249 проявляли более высокую чувствительность к трип-
-
□ нм□ пм□ кмп
-
□ ПР
-
■ пт
штамм 2-Т
штамм F-249
стадии морфогенеза
Рис. 3. Зависимость удельной лектиновой активности экстрактов из вегетативных структур штаммов L. edodes 2T и F-249 от среды культивирования. 1 - синтетическая среда; 2 - сусло-агаровая среда. НМ - непигментированный мицелий;
ПМ -пигментированный мицелий; КМП - коричневая мицелиальная пленка;
ПР - примордий; ПТ - плодовое тело синизированным эритроцитам кролика по сравнению со штаммом 2Т.
Обнаруженные различия по лектиновой активности в процессе развития гриба согласуются с наблюдениями некоторых авторов об изменении содержания лектинов и их активности в соответствии со стадией роста других базидиомицетов [14, 15]. Можно предположить определенное значение лектинов на каждом этапе морфогенетического развития гриба, особенно на стадии образования коричневой мицелиальной пленки, которая представляет собой плотное сплетение толстостенных пигментированных гиф [19]. Образование специализированных вегетативных структур в процессе роста грибов требует мицелиальной агрегации и лектины могут участвовать в обеспечении сцепления между гифами.
Данное предположение об участие лектинов в образовании коричневой мицелиальной пленки и последующего плодоношения, нашло подтверждение в следующем эксперименте. Чистый водный препарат лектина концентрацией 30 мкг/мл был стерильно нанесен на поверхность растущего 14-и суточного мицелия при твердофазном культивировании на среде с агаризованным пивным суслом на чашках Петри. Дальнейшее культивирование проводили при оптимальных условиях для данного вида гриба. Наблюдали за появлением коричневой мицелиальной пленки спустя две недели после нанесения реагента (рис. 4). Произошло ускорение процесса морфообразования L. edodes по меньшей мере в два раза. Причем данный эффект наблюдался у обоих штаммов. Следовательно, препарат лектина, выделенный из коричневой мицелиальной пленки при культивировании шиитаке приводит к сокращению сроков морфогенеза и положительным результатам при формировании плодовых тел. Этот факт подтверждают данные, полученные нами в предыдущих работах по изучению
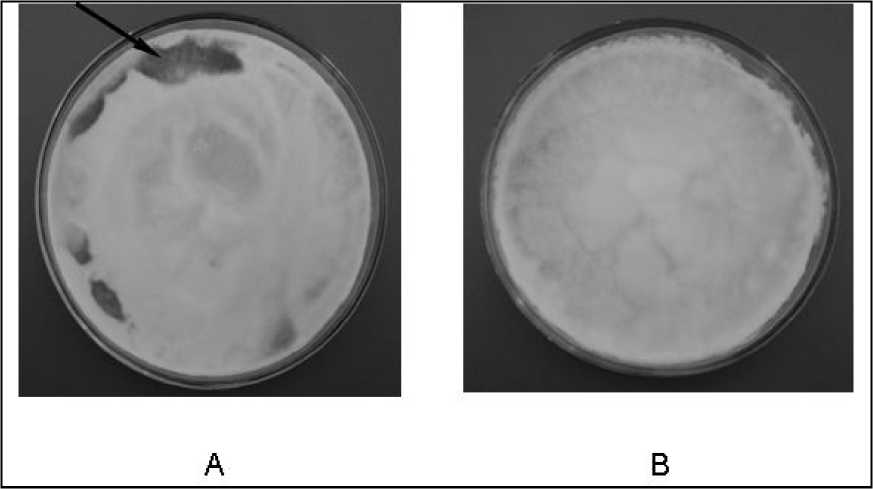
Рис. 4. Влияние лектина L. edodes на образование коричневой мицелиальной пленки у гриба при твердофазном культивировании. А – мицелий с добавлением лектина (30-е сутки культивирования); мицелий без добавления лектина (30-е сутки культивирования). – коричневая мицелиальная пленка.
внеклеточных лектинов L. edodes культуральной жидкости [20, 21]. Полученные данные позволяют заключить, что проявление лекти-новой активности L. edodes в большей степени зависит от морфогенетической стадии культуры и способа культивирования и в меньшей степени от состава питательных сред. Установлено, что при твердофазном культивировании активность лектинов на несколько порядков выше, по сравнению с лектино-вой активностью глубинной культуры.
I! iada i—enoee aioodcccaoi—iuo eaeoeiia
Л Л Л Л А О Л Л Л -.1 .. Л ..А~ .. ЛАО.. Л . О Л Л О Л ~ Л А Л Л А ЛА~ Л '
0eeoaea шаерааети oaaee—a^ea eo aeoeannoe.
Список литературы Активность внутриклеточных лектинов Lentinus edodes на разных стадиях развития гриба при глубинном и твердофазном культивировании
- Низковская О.П. Противоопухолевые свойства высших базидиомицетов.//Микология и фитопатология. 1983. Т. 17. №3.
- Феофилова Е.П. Современные направления в изучении биологически активных веществ базидиальных грибов//Прикл. биохимия и микробиология. 1998. Т. 34, № 6.
- Решетникова И.А. Деструкция лигнина ксилотрофными макромицетами. Накопление селена и фракционирование его изотопов микроорганизмами. Москва. Новинтех-Пресс, 1997.
- Шнырева А.В. Иммуномодулирующие свойства полисахаридов высших базидиальных грибов//Успехи медицинской микологии. Т. 3. М.: Национальная академия микологии, 2004.
- Ву Т. Благоприятные лечебные эффекты экзотических съедобных грибов//Бюлл. МАГ. Москва. 1996.
- Гарибова Л.В., Завьялова Л.А., Александрова Е.А., Никитина В.Е. Биология Lentinus edodes (шиитаке). Морфолого-культуральные и физиолого-биохимические особенности.//Микология и фитопатология. 1999. Т. 33. №2.
- Konno K. Biologically active components of poisonous mushrooms//Food Rev. Intern. 1995. V. 11. №1.
- Bender S., Lonergan G.T., Backhaus J., Cross R.F., Dumitrach-Anghel C.N., Baker W.L. The antibiotic activity of the edible and medicinal mushroom Lentinus edodes (Berk.) Sing.//Int. J. Medicinal Mushrooms. 2001. V. 3. № 2-3.
- Цивилева О.М., Никитина В.Е., Гарибова Л.В.//Прикл. биохимия и микробиология. 2005. Т. 41. № 2.
- Методы экспериментальной микологии/Ред. В.И. Билай/Киев: Наукова думка, 1982.
- Przybylowicz P., Donoghue J. Shiitake growers handbook: the art and science of mushroom cultivation. Chapter 3. Physical and chemical factors/Dubuque: Kendall/Hunt Publ. Co., 1991.
- Banerjee P.C., Ghosh A.K., Sengupta S.//Appl. Environ. Microbiol. 1982. V. 44.
- Bradford M.M. A rapid and sensitive methodfor the quantitation of microorganisms qualities of protein utilizing the principle of protein-dye binding//Anal. Biochem. 1976. V. 72.
- Kawagishi H., Nomura A., Mizuno T., Kimura A., Chiba S.//Biochim. Biophys. Acta. 1990. V. 1034.
- Kaneko T., Oguri S., Kato S., Nagata Y.//J. Gen. Appl. Microbiol. 1993. V. 39.
- Луцик М.Д., Панасюк Е.Н., Луцик А.Д. Лектины. Львов: Вища школа. Изд-во при Львов. ун-те, 1981.
- Stamets P. Growing gourmet and medicinal mushrooms/Berkeley: Ten Speed Press, 1993.
- Никитина В.Е., Цивилева О.М., Гарибова Л.В. Стимуляторы лектиновой активности Lentinus edodes на синтетических агаризованных средах//Биотехнология. 2004. № 3.
- Александрова Е.А., Завьялова Л.А., Терешина В.М., Гарибова Л.В., Феофилова Е.П. Получение плодовых тел и глубинного мицелия Lentinus edodes (Berk.) Sing [Lentinula edodes (Berk.) Pegler]//Микробиология. 1998. Т. 67. № 5.
- Tsivileva O.M., Nikitina V.E., Garibova L.V., Ignatov V.V. Lectin activity of Lentinus edodes//Int. Microbiology. 2001. V. 4. № 1.
- Цивилева О.М., Никитина В.Е., Гарибова Л.В., Завьялова Л.А.,Игнатов В В. Гемагглютинирующая активность Lentinus edodes (Berk.) Sing [Lentinula edodes (Berk.) Pegler]//Микробиология. 2000. Т 69, № 1.


