Алгоритм хирургического лечения пациентов с диафизарными дефектами костей предплечья после огнестрельных ранений
Автор: Давыдов Д.В., Брижань Л.К., Керимов А.А., Максимов А.А., Хоминец И.В., Лычагин А.В., Грицюк А.А., Арсомаков А.З.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 4 т.30, 2024 года.
Бесплатный доступ
Введение. В современной системе оказания помощи раненым военнослужащим наряду со сберегательной первичной хирургической обработкой и малоинвазивной внеочаговой фиксацией на первый план выходят высокотехнологические оперативные вмешательства значительной сложности с применением аддитивных и тканеинженерных технологий, которым необходимо определить место в современном алгоритме лечения дефектов костей конечностей, что и послужило обоснованием нашего исследования.Цель работы - на основании данных литературы и клинических наблюдений усовершенствовать алгоритм выбора метода лечения пациентов с ассоциированными огнестрельными дефектами предплечья.Материалы и методы. Проведен анализ научных статей в реферативно-библиографической базе данных PubMed и Научной электронной библиотеке eLIBRARY.ru, опубликованных с 2004 по 2024 г., на основании которых усовершенствован алгоритм выбора метода лечения пациентов с ассоциированными огнестрельными дефектами предплечья.Результаты. Изучение литературы позволило установить основные положения и принципы, которые применяют при реконструкции предплечья с ассоциированным дефектом. При выборе метода замещения дефекта кости большее количество авторов склоняется к выстраиванию «реконструктивной лестницы», переходя от менее тяжелых (одна кость) и протяженных дефектов (малый дефект до 2 см) к более сложным (обе кости) и массивным (более 10 см). С учетом выявленных закономерностей усовершенствовали алгоритм хирургического лечения последних, в основе которого два классификационных принципа: протяженность и локализация. Реконструкция предплечья, как динамической системы, после диафизарных переломов требует учета состояния лучелоктевых суставов. Функция последних зависит от соотношения длин лучевой и локтевой костей. С учетом этого положения обосновали выделение малых (до 2 см) дефектов костей предплечья, которые возможно заместить простыми хирургическими методами. Другим принципиальным дополнением алгоритма стало выделение группы пациентов с дефектом одной кости и наличием перелома другой кости (дефект-перелом), сочетание которых позволяет избежать применения сложных хирургических методов реконструкции путем укорочения сегмента. Разработанный алгоритм применили для лечения 178 пациентов с огнестрельными переломами предплечья.Обсуждение. Лечение ассоциированных дефектов предплечья является сложной задачей, выбор метода реконструкции остается неопределенным, а необходимый консенсус отсутствует. Доступно несколько методик реконструкции предплечья, однако отсутствуют достоверные доказательства их эффективности по срокам лечения, осложнениям, повторным операциям и функциональному восстановлению.Заключение. Предложенный алгоритм лечения обширных огнестрельных ассоциированных дефектов предплечья позволяет учесть изменение анатомии, составить план операции на основе вектора реконструкции и выбрать оптимальные хирургические методики.
Огнестрельные ранения, дефект диафиза костей предплечья, алгоритм лечения
Короткий адрес: https://sciup.org/142242615
IDR: 142242615 | УДК: 616-001.45:616.717.5/.6-004.8-089 | DOI: 10.18019/1028-4427-2024-30-4-487-501
Текст научной статьи Алгоритм хирургического лечения пациентов с диафизарными дефектами костей предплечья после огнестрельных ранений
Огнестрельные ранения конечностей остаются одной из важнейших проблем военной медицины. Актуальность этой проблемы связана с постоянным развитием огнестрельного оружия и появлением новых ранящих снарядов, которые вызывают значительное разрушение кости и мягких тканей, что требует пересмотра некоторых установившихся за последние десятилетия тактических подходов к лечению данной патологии [1–3].
Диафизарные переломы костей предплечья составляют 10–15 % в структуре всех переломов [4]. Средняя продолжительность нетрудоспособности у таких пациентов составляет 6–8 мес. [5], а в 6–17 % случаев пациенты становятся инвалидами [6]. При лечении закрытых переломов применяют накостный и реже — внутрикостный остеосинтез, а также внеочаговую фиксацию [6, 7]. Огнестрельные ранения предплечья отличаются тяжестью ранения, трудностями при лечении и значительной частотой осложнений [8].
Лечение огнестрельных ассоциированных дефектов предплечья представляет собой серьезную реконструктивную проблему, обусловленную высокой частотой гнойных осложнений, трудностями с заживлением мягких тканей, сращением костей и восстановлением функции верхней конечности [9]. Особые сложности возникают при наличии дефекта одной кости по протяженности более 5 см, дефектов обеих костей предплечья и дефектами костей, ассоциированными с дефектами мягких тканей [10].
При ранениях огнестрельного или взрывного генеза наблюдается первичное удаление костных осколков в момент воздействия ранящего снаряда. Современные классификации открытых переломов требуют учета потери костной массы. Утрату костной массы принято описывать по ее анатомической локализации: диафизарный, метафизарный или суставной дефект. Дефект диафиза принято характеризовать длиной и долей сегмента окружности пораженной кости. С точки зрения репаративной регенерации кости сегментарные (циркулярные) дефекты размером более 2 см считаются самостоятельно не восстанавливающимися, даже при условии стабильной фиксации, частичные дефекты (менее 50 % окружности) также спонтанно не восстанавливаются без дополнительного лечения [11–14]. В работах последнего времени методология определения величины костного дефекта остается прежней [15, 16].
Современные клинические методы замещения костных дефектов конечностей включают простую (неваскуляризированную) костную пластику губчатыми или кортикальными ауто- или аллотрансплантатами, мембрано-индуцированный остеогенез (техника Masquellet), микрохирургические пересадки трансплантатов подвздошной или малоберцовой кости с кровеносными сосудами и несвободную костную пластику в условиях внешней фиксации методом Илизарова [17–19]. Каждый из этих методов имеет свои преимущества и в случае применения по соответствующим показаниям обеспечивает хороший результат. Например, при размерах костных дефектов менее 5 см обычно применяют неваскуляризированную ауто- или аллогенную костную пластику. При костных дефектах более 5 см используют микрохирургические пересадки костных трансплантатов с кровеносными сосудами или технику Илизарова, однако последняя применима при удовлетворительном состоянии мягких тканей [20–22]. Острое укорочение сегмента, как метод замещения костного дефекта без последующего восстановления длины конечности, возможно без нарушения функции на нижних конечностях до 2 см и на верхних конечностях — до 4 см [23, 24]. Одноэтапная фиксация пластинами и аутологичная костная пластика могут быть эффективны при лечении дефектов костей предплечья до 5 см [25, 26], однако при замещении дефектов, превышающих 5 см, очень высока вероятность резорбции трансплантата [27]. Неваскуляризированный аутотрансплантат малоберцовой кости с остеосинтезом пластинами был успешно применен у 20 пациентов со средними костными диафизарными дефектами костей предплечья 2 см [28].
Использование на предплечье васкуляризированного аутотрансплантата малоберцовой кости или структурного аллотрансплантата с интрамедуллярной фиксацией, острого укорочения конечности и техники транспорта кости по Илизарову затруднено из-за сложности анатомо-функционального устройства этого сегмента [29–31]. Свободная васкуляризированная пластика малоберцовым трансплантатом (МБТ) рекомендуется при обширных дефектах, хотя широкое применение этой техники ограничено из-за необходимости специализированных микрососудистых ресурсов [32, 33]. Применение дистракционного остеогенеза с костным транспортом ограничено частым развитием осложнений, связанных с фиксатором, нарушением сращения в месте контакта отломков и контрактурами смежных суставов [34, 35]. Новые возможности в лечении дефектов костей открывает применение аддитивных технологий, которые позволяют максимально реализовать индивидуальный подход в выборе имплантатов-протезов или фиксаторов с возможностью остеоинтеграции [36–38]. Это направление рассматривается как перспективное в хирургии повреждений опорно-двигательной системы [39].
Учитывая значительную актуальность проблемы лечения дефектов костей, разнообразие причин, тяжесть и высокую частоту их развития при применении современного оружия, особенно для военномедицинских учреждений и больниц, находящихся в непосредственной близости от районов боевых действий, создание единого алгоритма оказания хирургической помощи является насущной необходимостью. Алгоритмы определения жизнеспособности сегмента конечности и первичного хирургического лечения разработаны [1–3], а алгоритм замещения дефектов длинных костей конечности в современных условиях требует модификации.
В современной системе оказания помощи раненым военнослужащим утвердились сберегательная первичная хирургическая обработка (ПХО) огнестрельной раны, малоинвазивная внеочаговая фиксация перелома, приближение элементов специализированной медицинской помощи (СМП) или быстрая эвакуация на этап СМП. Расширяются возможности эффективного активного лечения раны: общего (инфузионная, системная антибактериальная, противовоспалительная и иммуностимулирующая терапия) и местного (плазма, лазер, ультрафиолет, ВАК-терапия, местная антибактериальная и бактериофаг-терапия) характера. На первый план выходят высокотехнологические оперативные вмешательства с применением аддитивных и тканеинженерных технологий, которым необходимо определить место в современном алгоритме лечения дефектов костей конечностей по принципу анатомической локализации, что и явилось обоснованием нашего исследования.
Цель работы — на основании данных литературы и клинических наблюдений усовершенствовать алгоритм выбора метода лечения пациентов с ассоциированными огнестрельными дефектами предплечья.
МАТЕРИАЛЫ И МЕТОДЫ
Для анализа современного состояния оказания специализированной хирургической помощи пациентам с ассоциированными огнестрельными дефектами предплечья и последующего формирования алгоритма реконструктивного лечения проведен поиск научных статей в реферативно-библиографической базе данных PubMed и Научной электронной библиотеке eLIBRARY.ru, опубликованных с 2004 по 2024 г. Также в анализ включены статьи наиболее авторитетных ученых, опубликованные ранее. Обобщены результаты исследований механизма и структуры боевых травм конечностей, эффективности применяемых методов замещения дефектов кости и мягких тканей предплечья.
Разработанный алгоритм применили для лечения 178 пациентов с огнестрельными переломами предплечья. Все повреждения определены как ассоциированные, т.к. во всех случаях установлено наличие разрушения кости и мягкотканных структур (мышцы, сухожилия, сосуды и нервы). Изолированные переломы одной кости с интактной другой встречаются реже, на их долю приходилось около 32,6 % (58 наблюдений). Чаще всего при огнестрельных ранениях предплечья (в основном осколочных, доля которых около 90 %) имеется значительное разрушение одной из костей с «относительно простым» переломом другой кости (53,9 %, 96 наблюдений); значительное разрушение обеих костей предплечья наблюдали у 24 пациентов (13,5 %). Истинный размер костного дефекта, как правило, увеличивается, поскольку при этапных хирургических обработках удаляются нежизнеспособные осколки костей. При оценке дефектов на этапе выполнения реконструкции/остеосинтеза установлено, что наибольшее число пациентов имели дефект одной из костей предплечья протяженностью от 0 до 2 см (73 пациента, 41,0 %) и от 2,1 до 5 см (48 пациентов, 27,0 %), 42 (23,6 %) пациента имели дефект от 5,1 до 10 см; дефект более 10 см наблюдали у 15 (8,4 %) пациентов.
Пластика кости предплечья с применением малоберцового свободного лоскута была выполнена в 18 (10,1 %) случаях, применение индивидуальной 3D-конструкции при этом потребовалось в 2/3 наблюдений (12 пациентов). В остальных случаях использовали неваскуляризованные костные ауто-и аллотрансплантаты в комбинациях с различными вариантами остеосинтеза.
РЕЗУЛЬТАТЫ
В доступной литературе в большом количестве представлены методы лечения механических травм опорно-двигательной системы и, в частности, предплечья, а также их осложнений. Один из наиболее ранних актуальных алгоритмов лечения дефектов костей конечностей представлен J.F. Keating et al. [40] (рис. 1).
В данном алгоритме дефекты разделяются по протяженности (до 6 см и более 6 см) и наличию проблем с мягкими тканями. При коротких и длинных (без проблем с мягкими тканями) дефектах предлагается стабилизировать, наблюдать и затем, при заживлении раны на верхних конечностях, применять пластины, на нижних конечностях в области диафиза — штифты, в метаэпифизарных отделах кости — пластины. Десятилетние итоги применения данной стратегии подтвердили положение о тяжести и разнообразии повреждений, на основании чего C.S. Molina et al. [41] предложили формировать более узкие группы для сравнения. C. Mauffrey et al. [21] предложили изменить алгоритм с делением на дефекты до 1–3 см (возможно острое укорочение), 3–5 см (неваскуляризированная костная пластика и погружной остеосинтез), 5–10 см (укорочение в сочетании с комбинацией васкуляризированной и неваскуляризированной пластики) и более 10 см (костный трансфер по Илизарову или пересадка васкуляризированных костных аутотрансплантатов).
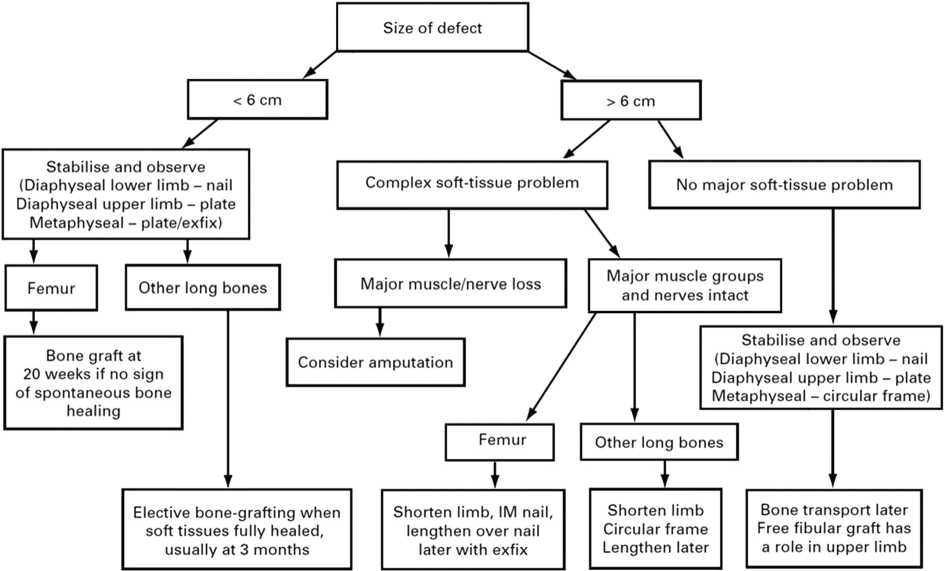
Рис. 1. Алгоритм лечения дефектов костей конечностей по J.F. Keating, A.H. Simpson, C.M. Robinson (2005) [40]
К сожалению, научных работ по лечению огнестрельных дефектов костей предплечья, в которых бы обсуждались методологические подходы к выбору оптимального метода замещения и срокам проведения операции, в литературе очень мало, в основном рассматриваются различные вопросы частоты компартмент-синдрома, антибактериальной терапии, необходимости удаления ранящих снарядов и тактики лечения единичных пострадавших с дефектами костей огнестрельной этиологии [42, 43].
Комплексный обзор литературы, посвященный вопросам стратегии лечения обширных костных дефектов костей конечностей после травм, инфекций или иссечения опухоли, приведен F. Migliorini et al., где подчеркивается, что проблема остается сложной и нерешенной, выбор метода все еще обсуждается и консенсус отсутствует. Применяется несколько равнозначных методик замещения дефектов костей. Однако недостаточное для надежной статистики количество наблюдений не позволяют получить убедительные доказательства их эффективности. Поэтому вопросы длительности лечения, количества и тяжести осложнений, частоты и сложности повторных операций остаются открытыми и требуют дальнейшего изучения [44].
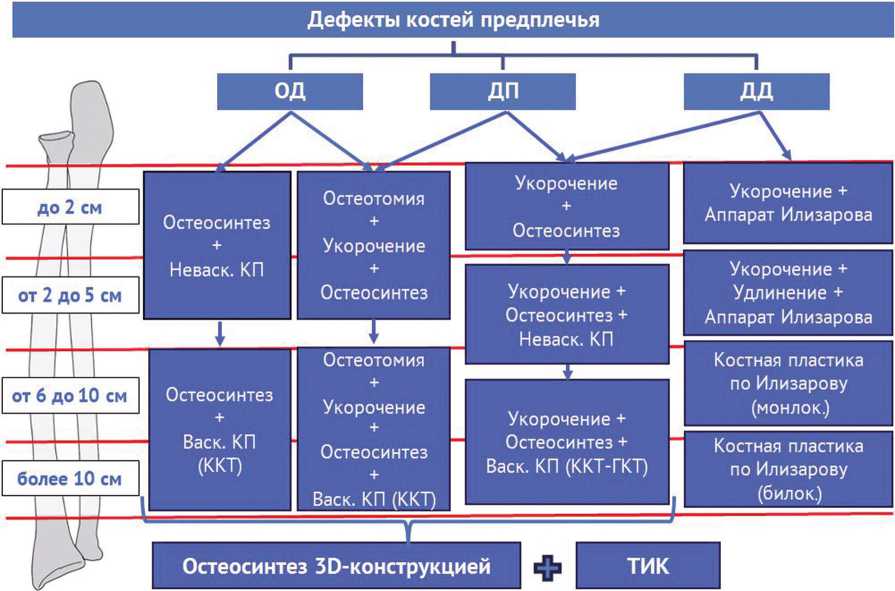
В основе предлагаемого нами алгоритма лечения раненых с дефектами предплечья лежат два принципа их классификации: по локализации и протяженности. В соответствии с положениями Ассоциации остеосинтеза (АО) при лечении диафизарных переломов костей предплечья требуется полное устранение всех видов смещения и обеспечение условий восстановления функции лучелоктевых суставов. Поэтому в случае возникновения дефектов костей предплечья необходимо обеспечить такое их восстановление, которое бы обеспечило устранение нарушения анатомо-физиологических взаимоотношений в лучелоктевых суставах, что является основой последующей реабилитации [45].
Выделяют дефекты одной или обеих костей предплечья. Считаем необходимым дополнить имеющиеся классификации выделением очень малых (до 2 см) дефектов костей предплечья, которые возможно заместить самыми простыми методами. Особой хирургической тактики требуют пациенты с дефектом одной кости и наличием перелома другой кости предплечья (дефект-перелом). Этот вид повреждения, несмотря на его тяжесть, в некотором смысле облегчает задачу хирургу: позволяет укоротить кость с простым переломом и избежать костной пластики в зоне дефекта другой кости (рис. 2).
При выборе методов замещения дефекта кости большинство хирургов использует правило «реконструктивной лестницы», применяя простые методы при менее тяжелых (одна кость) и протяженных дефектах (малый дефект до 2 см) и сложные — при более тяжелых (обе кости) и массивных (более 10 см) дефектах. Современные представления о ранжировании методов, на наш взгляд, становятся более широкими, от остеосинтеза, возможно с допустимым укорочением или неваскуляризированной костной пластикой, через комбинацию частичного укорочения с неваскуляризированной костной пластикой к микрохирургическим свободным васкуляризированным костным аутопластикам и тканеинженерным комплексным трансплантатам. Система остеосинтеза от традиционных пластин эволюциониро- вала через пластины с ограниченным контактом и угловой стабильностью винтов к 3D-конструкциям индивидуального изготовления. Последние могут выполнять только остеосинтез отломков либо дополнительно фиксировать различные трансплантаты. Применяют 3D биоинженерные конструкции в виде биологически активного протеза кости, который срастается с отломками.
до 2 см
Остеотомия
Остеосинтез
Укорочение
Неваск. КП
Остеосинтез от 2 до 5 см от 6 до 10 см более 10 см
Укорочение + Аппарат Илизарова
Укорочение
Остеосинтез
Укорочение +
Удлинение + Аппарат Илизарова
Укорочение + Остеосинтез + Неваск. КП
Костная пластика по Илизарову (монлок.)
Остеотомия
Укорочение +
Остеосинтез +
Васк. КП (ККТ)
Укорочение +
Остеосинтез + Васк. КП (ККТ-ГКТ)
Костная пластика по Илизарову (билок.)
Остеосинтез ЗО-конструкцией
ТИК
Остеосинтез
Васк. КП (ККТ)
Дефекты костей предплечья
Рис. 2. Алгоритм лечения дефектов костей предплечья. ОД — однокостный дефект костей предплечья; ДД — двукостный дефект костей предплечья; ДП — дефект одной кости и перелом другой (дефект-перелом); ГКТ — губчатый костный трансплантат; ККТ — кортикальный костный трансплантат; ТИК — тканеинженерная конструкция
более И
Укорочение
Остеосинтез
Укорочение
Укорочение
Васк. КП (ККТ)
теотсмия
Остеосинтез
Укорочен 1е
Неваск. КП
Остеотомич
Остеосинтез
Васк. КП
Кост (ая пластика по Елизарову (i юнлок.)
Укорочение + Аппарат Илизарова
7 Укорочение + я Остеоси нте_ +
Коваск КП у Укорочение +
S Удлинение +
| Аппарат Илизарова
Остеосинтез
)____ ______
Й Остеосинтез +
Васк. КП (ККТ-ГКТ;
(ККТ) I_______________,____
Костн. я пластика по И тизарову (б 1ЛОК.)
Дефекты костей предплечья
Остеосинтез ЗО-конструкцией
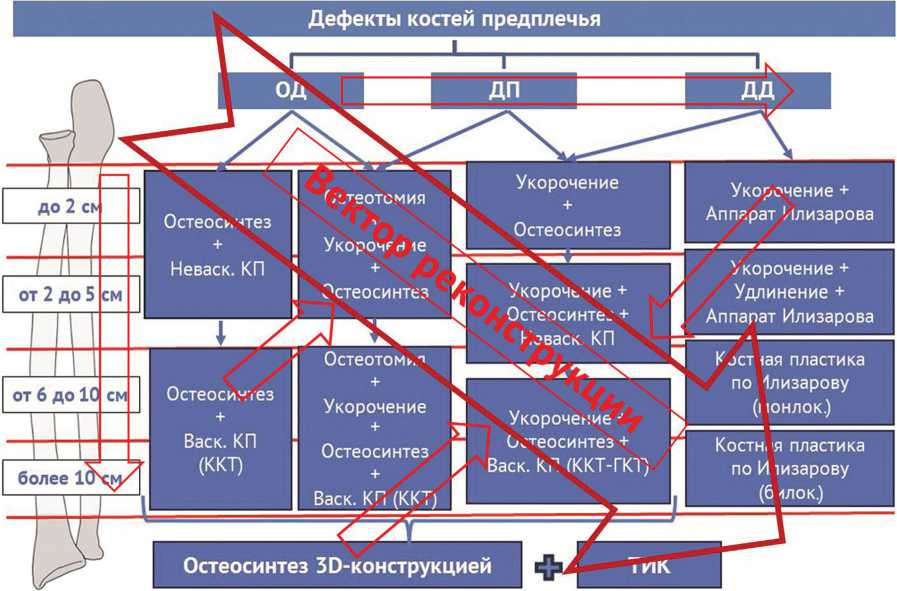
Рис. 3. Схема формирования «вектора реконструкции»
|
до 2 ск |
|
от 2 до 5 |
см |
|
от б до 10 |
см |
Остеосинтез
Мы предлагаем для оптимизации выбора метода замещения дефекта костей предплечья применять правило вектора реконструкции, которое заключается в необходимости применения более сложных методов с увеличением размера дефекта и усложнения его структуры. Таким образом, усилия хирурга направляются от простого к сложному, и обеспечивается возможность комбинирования различных хирургических методов в одной операции. Такой подход позволяет путем сложения эффективности отдельных методов получать максимальный эффект в плане анатомического и последующего функционального восстановления.
В настоящее время общей тенденцией реконструктивной хирургии является применение одномоментного и исчерпывающего метода. Это позволяет с минимальными затратами достигать максимального эффекта в виде более полного восстановления при сокращении сроков госпитализации и реабилитации. Методики Илизарова, которые применяются в нашей стране на протяжении многих лет, вполне соответствуют вышеперечисленным требованиям и позволяют решить практически все вопросы лечения данных пациентов. Но на предплечье компоновки аппарата Илизарова достаточно сложные и громоздкие, что требует постоянного врачебного контроля на протяжении всего срока восстановления.
Многие из современных одномоментных исчерпывающих методов хирургического лечения кроме технической сложности требуют применения сложных и дорогостоящих технологических решений. Однако за счет сокращения длительности стационарного лечения и количества этапных госпитализаций и операций применение таких методов позволит медицинской службе компенсировать затраты и получить результат в виде максимально полного анатомо-функционального восстановления раненых и пострадавших.
Клинические примеры
Наиболее простой способ лечения (остеосинтез и пластика неваскуляризированным губчатым трансплантатом) иллюстрирует наблюдение раненого Г., 36 лет, получившего огнестрельное ранение с дефектом локтевой кости 3,5 см в средней трети (рис. 4, а). После заживления раны выполнен остеосинтез пластиной с угловой стабильностью винтов в мостовидном варианте и замещение дефекта локтевой кости губчатым трансплантатом из гребня подвздошной кости (рис. 4, б, в). Через 6 мес. после операции на рентгенограмме визуализируются признаки перестройки трансплантата (рис. 4, г).
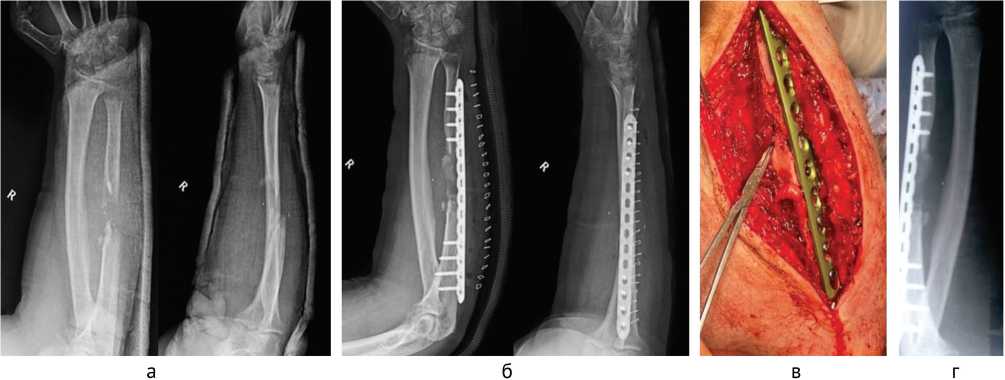
Рис. 4. Раненый Г., рентгенограммы костей предплечья: а — до операции; б — после операции; в — интраоперационный вид раны, остеосинтез и губчатый трансплантат из гребня подвздошной кости; г — через 6 мес. после операции
Комбинацию острого укорочения предплечья за счет остеотомии интактной лучевой кости, которая позволила уменьшить дефект локтевой кости и выполнить неваскуляризированную костную пластику кортикальным костным трансплантатом, иллюстрирует раненый К., 23 лет, который 02.03.2023 г. получил огнестрельное ранение левого предплечья из гладкоствольного ружья (дробью). При выполнении рентгенографии левого предплечья диагностированы: огнестрельное ранение средней трети левого предплечья, огнестрельный оскольчатый перелом средней трети локтевой с дефектом костной ткани 6 см, множественные инородные тела мягких тканей левого предплечья (рис. 5, а).
Раненый доставлен в военный госпиталь, где проведены ПХО и дренирование раны левого предплечья, далее — местное лечение раны, заживление вторичным натяжением.
26.04.2023 г. в ГВКГ им. Н.Н. Бурденко выполнена острая укорачивающая остеотомия интактной лучевой кости (2 см), замещение дефекта локтевой кости (3 см) неваскуляризированным костным кортикальным аутотрансплантатом и остеосинтез обеих костей предплечья (рис. 5, б).
Послеоперационный период протекал без особенностей, раны зажили первичным натяжением, перелом лучевой кости консолидировался (место остеотомии) через 4 мес. после операции (рис. 5, в), отмечены признаки сращения кортикального костного трансплантата малоберцовой кости через 6 мес. после операции (рис. 5, г).
После проведения реабилитационного лечения раненый был признан годным и продолжил военную службу (рис. 5, д).
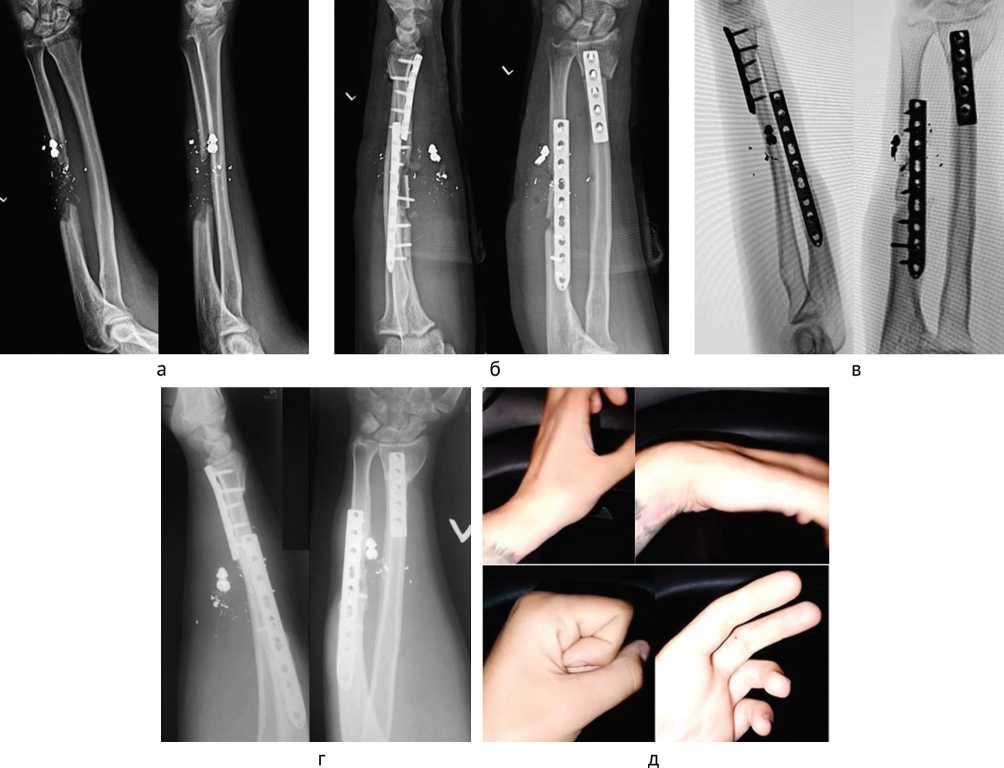
Рис. 5. Раненый К.: а — рентгенограммы костей предплечья до операции; б — рентгенограммы костей предплечья после операции; в — цифровые рентгенограммы костей предплечья через 4 мес. после операции; г — рентгенограммы костей предплечья через 6 мес. после операции; д — функция кисти через 8 мес. после операции (фото сделано камерой мобильного телефона самим пациентом в зоне специальной военной операции)
Раненый А., 27 лет, в ходе участия в боевых действиях 20.03.2022 получил огнестрельное ранение правой верхней конечности. Первая помощь оказана на месте. Далее эвакуирован в ГВКГ им Н.Н. Бурденко, где 24.03.2022 были выполнены ПХО ран правого предплечья, фиксация правой локтевой кости аппаратом наружной фиксации (АНФ) комплекта стержневого военно-полевого (КСВП) и ВАК-терапия ран (рис. 6, а–г).
28.03.2022 выполнены: повторная хирургическая обработка ран правого предплечья, кожная пластика раневого дефекта местными тканями. Раны зажили (рис. 6, д).
27.05.2022 выполнены демонтаж аппарата внешней фиксации и свободная васкуляризированная пластика дефекта локтевой кости правого предплечья МБТ (длиной 8 см) с фиксацией 3D-конструкцией (рис. 7, а).
Послеоперационный период протекал без осложнений, трансплантат прижился через 6 месяцев после пересадки, металлоконструкция удалена через 12 мес. после операции (рис. 7, б, в). Функциональный результат после реабилитационного лечения представлен на рис. 7, г.
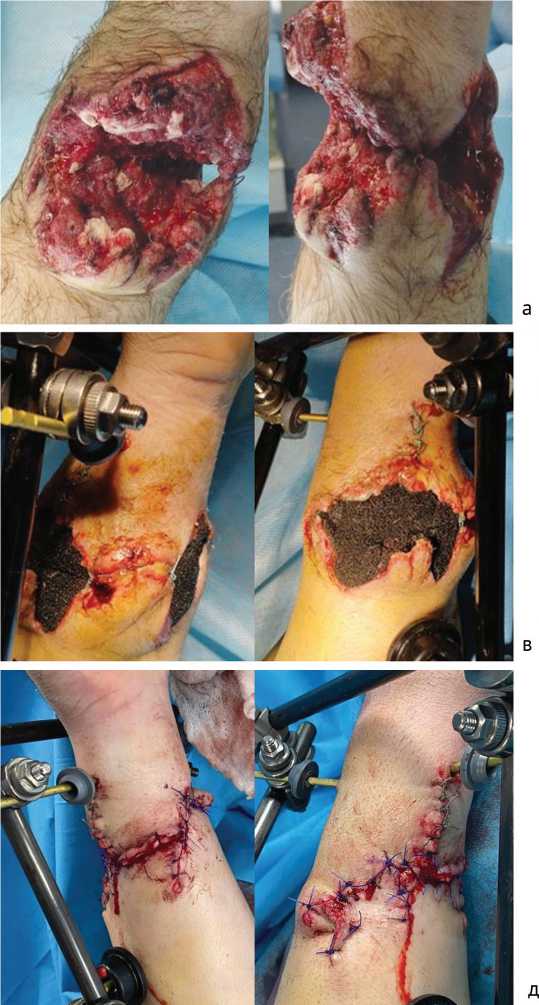
Рис. 6. Раненый А.: а — вид раны мягких тканей; б — рентгенограммы предплечья; в — вид раны мягких тканей при ВАК-терапии; г — рентгенограммы предплечья после фиксации АНФ КСВП; д — раны мягких тканей после пластики местными тканями
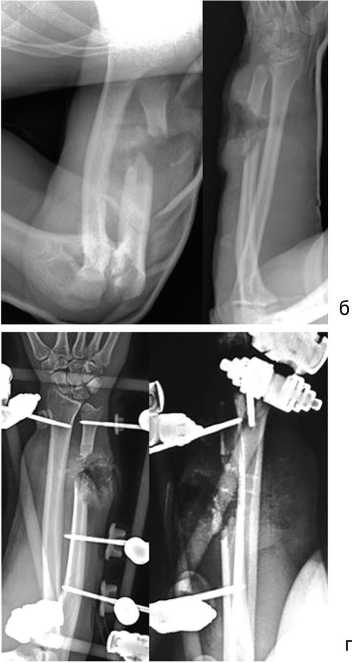
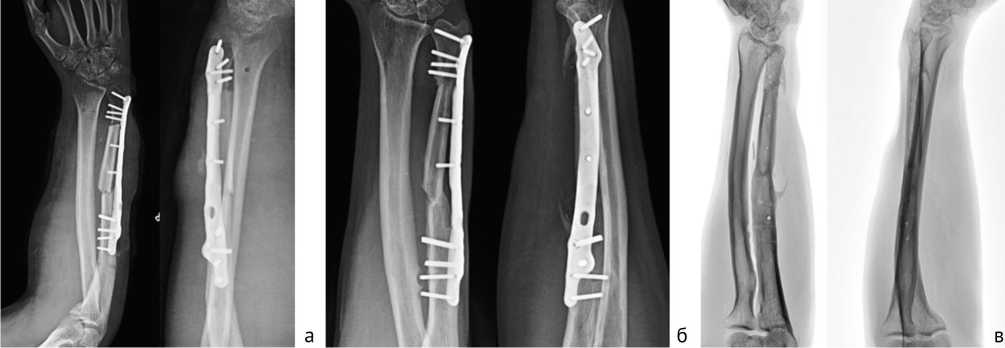
Рис. 7. Раненый А.: а — рентгенограммы предплечья после пластики и фиксации 3D-конструкцией; б — рентгенограммы предплечья через 6 мес. после операции; в — цифровые рентгенограммы предплечья после удаления металлоконструкции (через 12 мес. после реконструктивной операции)
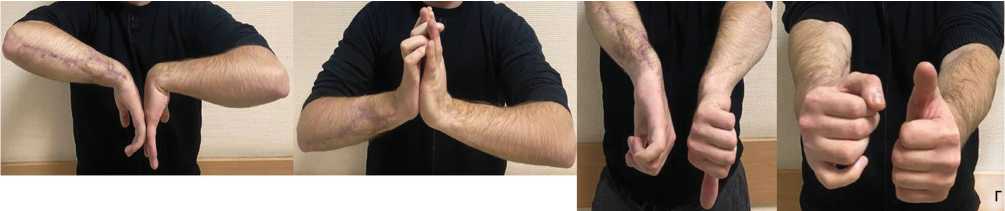
Рис. 7 (продолжение). Раненый А.: г — функция верхних конечностей после реабилитации
Раненый М., 35 лет, получил осколочное сквозное ранение левого предплечья с открытым многооскольчатым переломом в средней и верхней третях обеих костей левого предплечья, со смещением костных отломков, дефектом костей и мягких тканей. ПХО и иммобилизация АНФ выполнены на этапе квалифицированной хирургической помощи, после чего доставлен в ГВКГ им. Н.Н. Бурденко (рис. 8, а. б). Раны заживали частично вторичным натяжением с применением пластики местными тканями. После заживления ран и проведения КТ конечности выполнено 3D-планирование, изготовлены резекционный шаблон и металлоконструкция (рис. 8, в–е).
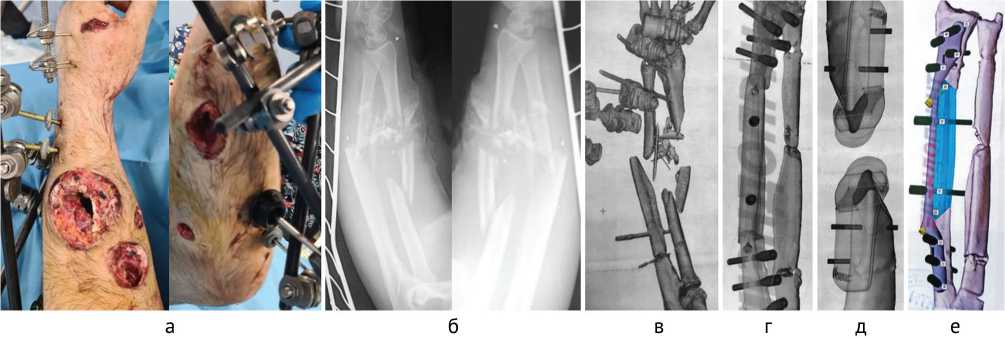
Рис. 8. Раненый М.: а — вид ран мягких тканей; б — рентгенограммы предплечья. Планирование операции: в — КТ костей предплечья; г — планирование трансплантата; д — шаблоны для резекции; е — план 3D-реконструкции
Выполнена пластика дефекта лучевой кости свободным васкуляризированным трансплантатом малоберцовой кости с кожно-фасциальным лоскутом с фиксацией 3D-металлоконструкцией (рис. 9). Применение индивидуальной конструкции в данном случае было обусловлено размерами дефекта, а также необходимостью обхода сосудистой «ножки» МБТ. Остеосинтез локтевой кости выполнен стандартной пластиной с угловой стабильностью винтов (рис. 10, а). Раны зажили, переломы срослись через 6 месяцев после операции (рис. 10, б, в).
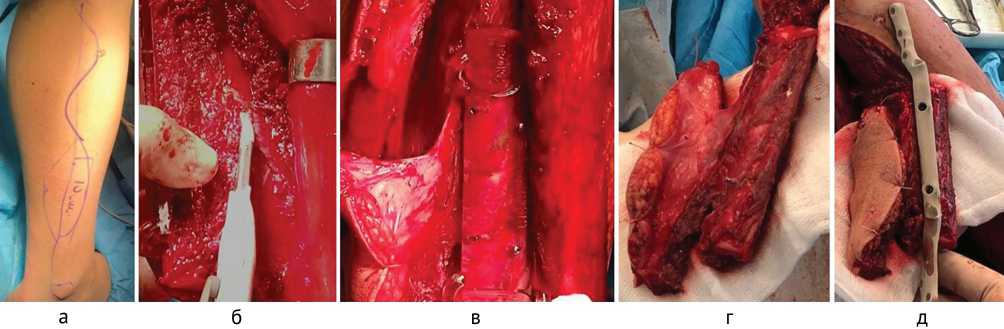
Рис. 9. Раненый М. Этапы операции: а — планирование трансплантата; б — выделение малоберцового трансплантата; в — использование резекционного шаблона; г — вид малоберцового трансплантата; д — вид 3D-конструкции
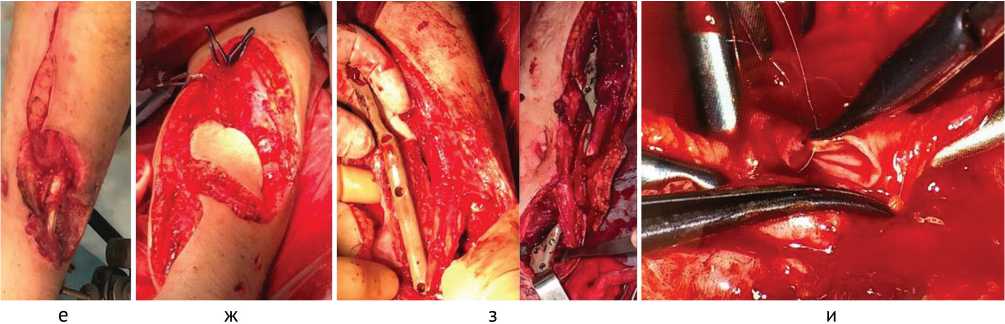
Рис. 9 (продолжение). Раненый М. Этапы операции: е — иссечение краев раны и мобилизация сосудистого пучка; ж — вид малоберцового трансплантата; з — фиксация 3D-конструкцией; и — микрососудистый этап операции (шов артерии малоберцового трансплантата)
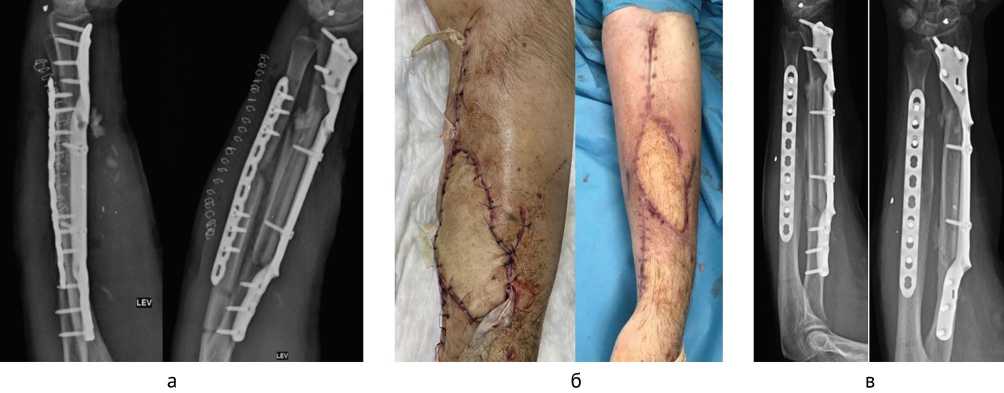
Рис. 10. Раненый М.: а — рентгенограммы после операции; б — вид раны после операции и после снятия швов; в — рентгенограммы через 6 мес. после операции
ОБСУЖДЕНИЕ
Изучение специальной литературы и анализ опыта клиники по лечению раненых с тяжелыми огнестрельными ранениями предплечья показали трудности выбора оптимальной хирургической тактики. Огнестрельные ранения отличаются от других повреждений формированием первичного дефекта. Размеры и структура последнего зависят от величины энергии ранящего снаряда. Характеристики вторичного дефекта в большой мере определяются последующим лечением. Применение проверенных временем методов лечения не всегда позволяет получить оптимальный результат в короткие сроки. Перенос опыта лечения травмы мирного времени на решение проблемы боевой травмы требует проверки и осмысления. Тем не менее, принцип предлагаемого нами «вектора реконструкции» дает хирургу методологический инструмент, основанный на логике и опыте многих поколений хирургов.
В основе предлагаемого алгоритма лежит принцип разделения дефектов костей по анатомическому признаку (одно-, двукостные и дефект-перелом) и размеру (эти показатели служат своего рода осями координат, отталкиваясь от которых следует определить направление вектора реконструкции). Конечной точкой алгоритма является точка на плоскости координат, расположенная напротив соответствующих точек на осях анатомии и размера. Изучение предшествующего опыта позволило нам расположить на плоскости выбора тактики лечения известные проверенные и предлагаемые новые методы лечения от простого к сложному. Таким образом, в направлении вектора реконструкции располагаются оптимальные методы лечения, которые возможно применять при сочетании соответствующей структуры и размеров дефекта.
В основе лечения нарушения целостности кости лежат репозиция и остеосинтез. После восстановления длины, ротационного и углового смещения требуется стабильная фиксация, которая может быть обеспечена в легких случаях штатными металлоконструкциями, в тяжелых — требует применения инди- видуальных 3D-конструкций. Все методы должны отвечать принципу минимизации травматичности, сохранения и восстановления кровоснабжения. Соблюдение этих принципов обеспечивает возможность раннего реабилитационного лечения и восстановления трудоспособности, что может служить подтверждением правильности выбранной концепции.
Смещение вектора реконструкции к одной из осей координат или его укорочение говорит об упрощении хирургической задачи. Например, при дефекте-переломе относительно простая методика острого укорочения помогает решить проблему большого дефекта путем уменьшения последнего, что позволяет применить менее травматичную неваскуляризированную костную пластику вместо сложного многочасового микрохирургического вмешательства.
Костная пластика фрагментом гребня подвздошной кости является одним из часто используемых и простых решений для восстановления костных дефектов [46, 47]. Гребень подвздошной кости как трансплантат обладает всеми преимуществами аутотрансплантатов: остеогенез, остеоиндукция, осте-окондукция и гистосовместимость [48, 49]. Костный трансплантат можно получить из передней или задней части гребня подвздошной кости, васкуляризированный или нет, а также кортикальный, губчатый или комбинированный. Однако размеры его и, особенно, механическая прочность лимитированы [50, 51].
Васкуляризированные МБТ обычно используются для реконструкции костных дефектов размером более 6 см [52], часто в сочетании с дефектами мягких тканей [53]. Разработаны три разных варианта пересадки васкуляризированного МБТ: единичный васкуляризированный МБТ (до 25 см у взрослого пациента), двухствольная техника и комбинированная реконструкция васкуляризированной малоберцовой костью и аллотрансплантатом [54–56]. Однако дефект кости, при котором можно использовать этот метод, не должен превышать 13 см в длину [57].
Сращение МБТ было достигнуто без дальнейших хирургических вмешательств у 70 % пациентов в среднем через 10 месяцев. Имели место серьезные осложнения, такие как глубокое нагноение мягких тканей, тромбоз ножки, стрессовый перелом, не связанный с нарушением фиксации, компартмент-синдром, но частота сращения составила 82 % в течение 2-х лет наблюдения и 97 % — через 5 лет [58–61]. Наши результаты по частоте и длительности сращения соответствуют работе S. Liu et al. (2018) [62], которые сообщили о долгосрочном наблюдении за МБТ: частота сращения составила 100 % и среднее время 21,3 недели. Применяемая комбинированная реконструкция васкуляризированной малоберцовой костью и аллотрансплантатом имеет преимущества обеих, ранее описанных методик [63].
При реконструкции сегментарных дефектов металлические протезы являются альтернативой массивным костным трансплантатам, они обеспечивают немедленную стабильность, быструю реабилитацию и раннюю нагрузку весом [64]. Однако частые инфекционные осложнения, механическое расшатывание и механический износ, высокий риск протезных и перипротезных переломов сделали эту технику применимой только у онкологических пациентов с ограниченной продолжительностью жизни [65–67]. Однако предложенные тканеинженерные конструкции на основе металлических каркасов с набором биологических компонентов способны встраиваться в живые ткани и могут в ближайшее время заменить ауто- и аллотрансплантацию в отдельных случаях.
Метод Илизарова долгое время служил надежным и эффективным средством решения многих проблем, связанных с повреждениями опорно-двигательной системы. Он может применяться при любом варианте дефекта, что не противоречит правилу вектора реконструкции. Но его место в системе лечения ассоциированных огнестрельных дефектов предплечья также требует уточнения.
ЗАКЛЮЧЕНИЕ
Лечение крупных костных дефектов является сложной задачей, выбор метода реконструкции остается трудоемким и неопределенным, необходимый консенсус отсутствует. Доступно несколько методик лечения дефектов костей, однако нет достаточных количественных и качественных доказательств, позволяющих сделать убедительные выводы, особенно о сроках лечения, осложнениях и повторных операциях.
Предложенный алгоритм хирургического лечения пострадавших с огнестрельными дефектами костей предплечья позволяет детально учесть анатомические особенности патологических изменений, составить вектор реконструкции в конкретных случаях и помочь сделать оптимальный выбор методики хирургического лечения раненых.
Список литературы Алгоритм хирургического лечения пациентов с диафизарными дефектами костей предплечья после огнестрельных ранений
- Тришкин Д.В., Крюков Е.В., Алексеев Д.Е. и др. Военно-полевая хирургия. Национальное руководство. М.: ГЭОТАР-Медиа; 2024:180-208. doi: 10.33029/9704-8036-6-VPX-2024-1-1056
- Тришкин Д.В., Крюков Е.В., Чуприна А.П. и др. Методические рекомендации по лечению боевой хирургической травмы. С.-Пб.: Военно-медицинская академия имени С. М. Кирова; 2022:373. Доступно по: http://xn----9sbdbejx7bdduahou3a5d.xn--p1ai/upload/metod_rek_VPH_ver-1.pdf. Ссылка активна на 26.06.2024.
- Керимов А.А., Нелин Н.И., Переходов С.Н. и др. Актуальные подходы к хирургической обработке огнестрельных травм конечностей. Медицинский вестник МВД. 2023;124(3):2-6. doi: 10.52341/20738080_2023_124_3_2
- Челноков А.Н., Лазарев А.Ю., Соломин Л.Н. и др. Восстановление функции верхней конечности при диафизар-ных переломах лучевой и локтевой костей после применения малоинвазивных способов остеосинтеза. Травматология и ортопедия России. 2016;22(1):74-84. doi: 10.21823/2311-2905-2016-0-1-74-84
- Мизиев И.А., Баксанов Х.Д., Жигунов А.К. и др. Лечение переломов костей предплечья при множественных и сочетанных повреждениях. Медицина катастроф. 2018;(4):24-27.
- Ставицкий О.Б., Пастернак Д.В., Карпушкин О.В. и др. Наш опыт применения блокирующего интрамедулляр-ного остеосинтеза при лечении больных с переломами костей предплечья в условиях Областной больницы интенсивного лечения г. Мариуполя. Травма. 2019;20(4):61-65. doi: 10.22141/1608-1706.4.20.2019.178747
- Купкенов Д.Э. Применение стержневых аппаратов с узлами репозиции при диафизарных переломах костей предплечья. Гений ортопедии. 2011;(1):13-16.
- Король С.А., Матвейчук Б.В., Доманский А.Н. Объем хирургической помощи раненым с огнестрельными переломами костей предплечья на этапах медицинской эвакуации во время антитеррористической операции. Травма. 2016;17(6):76-80. doi: 10.22141/1608-1706.6.17.2016.88621
- Walker M, Sharareh B, Mitchell SA. Masquelet Reconstruction for Posttraumatic Segmental Bone Defects in the Forearm. J Hand Surg Am. 2019;44(4):342.e1-342.e8. doi: 10.1016/j.jhsa.2018.07.003
- Wang P, Wu Y, Rui Y, et al. Masquelet technique for reconstructing bone defects in open lower limb fracture: Analysis of the relationship between bone defect and bone graft. Injury. 2021;52(4):988-995. doi: 10.1016/j.injury.2020.12.009
- Gustilo RB, Anderson JT. Prevention of infection in the treatment of one thousand and twenty-five open fractures oflong bones: retrospective and prospective analyses. J Bone Joint Surg Am. 1976;58(4):453-458.
- Gustilo RB, Mendoza RM, Williams DN. Problems in the management of type III (severe) open fractures: a new classification of type III open fractures. J Trauma. 1984;24(8):742-746. doi: 10.1097/00005373-198408000-00009
- Gustilo RB, Merkow RL, Templeman D. The management of open fractures. J Bone Joint Surg Am. 1990;72(2):299-304.
- Keating JF, Simpson AH, Robinson CM. The management of fractures with bone loss. J Bone Joint Surg Br. 2005;87(2):142-150. doi: 10.1302/0301-620x.87b2.158744
- Baldwin P, Li DJ, Auston DA, et al. Autograft, allograft, Autograft, Allograft, and Bone Graft Substitutes: Clinical Evidence and Indications for Use in the Setting of Orthopaedic Trauma Surgery. J Orthop Trauma. 2019;33(4):203-213. doi: 10.1097/B0T.0000000000001420
- Nashi N, Kagda FH. Current concepts of bone grafting in trauma surgery. J Clin Orthop Trauma. 2023;43:102231. doi: 10.1016/j.jcot.2023.102231
- Robinson CM, McLauchlan G, Christie J, et al. Tibial fractures with bone loss treated by primary reamed intramedullary nailing. J Bone Joint Surg Br. 1995;77(6):906-913.
- Harris AM, Althausen PL, Kellam J, et al. Complications following limb-threatening lower extremity trauma. J Orthop Trauma. 2009;23(1):1-6. doi: 10.1097/B0T.0b013e31818e43dd
- Ilizarov GA. Clinical application of the tension-stress effect for limb lengthening. Clin Orthop RelatRes. 1990;(250):8-26.
- Lasanianos NG, Kanakaris NK, Giannoudis PV. Current management of long bone large segmental defects. Orthop Trauma. 2010;24(2):149-163. doi: 10.1016/j.mporth.2009.10.003
- Mauffrey C, Barlow BT, Smith W. Management of segmental bone defects. J Am Acad Orthop Surg. 2015;23(3):143-153. doi: 10.5435/JAA0S-D-14-00018
- Pipitone PS, Rehman S. Management of traumatic bone loss in the lower extremity. Orthop Clin North Am. 2014;45(4):469-482. doi: 10.1016/j.ocl.2014.06.008
- El-Rosasy MA. Acute shortening and re-lengthening in the management of bone and soft-tissue loss in complicated fractures of the tibia. J Bone Joint Surg Br. 2007;89(1):80-88. doi: 10.1302/0301-620X.89B1.17595
- Eralp L, Balci HI, Kocaoglu M, et al. Is acute compression and distraction superior to segmental bone transport techniques in chronic tibial osteomyelitis ? Comparison of Distraction Osteogenesis Techniques. Acta Orthop Belg. 2016;82(3):599-609.
- Regan DK, Crespo AM, Konda SR, et al. Functional Outcomes of Compression Plating and Bone Grafting for Operative Treatment of Nonunions About the Forearm. J Hand SurgAm. 2018;43(6):564.e1-564.e9. doi: 10.1016/j.jhsa.2017.10.039
- Ring D, Allende C, Jafarnia K, et al. Ununited diaphyseal forearm fractures with segmental defects: plate fixation and autogenous cancellous bone-grafting. J Bone Joint SurgAm. 2004;86(11):2440-2445.
- Weiland AJ, Phillips TW, Randolph MA. Bone grafts: a radiologic, histologic, and biomechanical model comparing autografts, allografts, and free vascularized bone grafts. Plast Reconstr Surg. 1984;74(3):368-379.
- Faldini C, Pagkrati S, Nanni M, et al. Aseptic forearm nonunions treated by plate and opposite fibular autograft strut. Clin Orthop Relat Res. 2009;467(8):2125-2134. doi: 10.1007/s11999-009-0827-5
- Giannoudis PV, Harwood PJ, Tosounidis T, Kanakaris NK. Restoration of long bone defects treated with the induced membrane technique: protocol and outcomes. Injury. 2016;47 Suppl 6:S53-S61. doi: 10.1016/S0020-1383(16)30840-3
- Wong TM, Lau TW, Li X, et al. Masquelet technique for treatment of posttraumatic bone defects. ScientificWorldJournal. 2014;2014:710302. doi: 10.1155/2014/710302
- Davis JA, Choo A, O'Connor DP, et al. Treatment of Infected Forearm Nonunions With Large Complete Segmental Defects Using Bulk Allograft and Intramedullary Fixation. J Hand SurgAm. 2016;41(9):881-887. doi: 10.1016/j.jhsa.2016.05.021
- Wood MB, Bishop AT. Massive bone defects of the upper limb: reconstruction by vascularized bone transfer. Hand Clin. 2007;23(1):49-56. doi: 10.1016/j.hcl.2007.01.002
- Safoury Y. Free vascularized fibula for the treatment of traumatic bone defects and nonunion of the forearm bones. J Hand Surg Br. 2005;30(l):67-72. doi: 10.1016/j.jhsb.2004.09.007
- Zhang Q, Yin P, Hao M, et al. Bone transport for the treatment of infected forearm nonunion. Injury. 2014;45(12):1880-1884. doi: 10.1016/j.injury.2014.07.029
- Green SA. Skeletal defects. A comparison of bone grafting and bone transport for segmental skeletal defects. Clin OrthopRelatRes. 1994;(301):111-117.
- Коваленко А.Н., Шубняков И.И., Билык С.С., Тихилов Р.М. Современные технологии лечения тяжелых костных дефектов в области вертлужной впадины: какие проблемы решают индивидуальные имплантаты? Политравма. 2017;(1):72-81.
- Тихилов Р.М., Шубняков И.И., Коваленко А.Н. и др. Показания к ревизионному эндопротезированию тазобедренного сустава, планирование и техника ревизионной операции. В кн.: Руководство по хирургии тазобедренного сустава. Под ред. Тихилов Р.М., Шубняков И.И. СПб.: РНИИТО им. Р.Р. Вредена; 2015;2:258-355.
- Efetov SK, Lychagin AV, Zubayraeva AA, et al. 3D-printed pubic bone for pelvic ring reconstruction after exenteration for anal cancer recurrence. Br J Surg. 2020;107(11):e512-e514. doi: 10.1002/bjs.11982
- Пелешок С.А., Головко К.П. 3D-печать и медицина. Известия Российской Военно-медицинской академии. 2022;41(3):325-333. doi: 10.17816/rmmar88645
- Keating JF, Simpson AH, Robinson CM. The management of fractures with bone loss. J Bone Joint Surg Br. 2005;87(2):142-150. doi: 10.1302/0301-620x.87b2.15874
- Molina CS, Stinner DJ, Obremskey WT. Treatment of Traumatic Segmental Long-Bone Defects: A Critical Analysis Review. JBJSRev. 2014;2(4):e1. doi: 10.2106/JBJS.RVW.M.00062
- Omid R, Stone MA, Zalavras CG, Marecek GS. Gunshot Wounds to the Upper Extremity. J Am Acad Orthop Surg. 2019;27(7):e301-e310. doi: 10.5435/JAA0S-D-17-00676
- Ebrahimi A, Nejadsarvari N, Ebrahimi A, Rasouli HR. Early Reconstructions of Complex Lower Extremity Battlefield Soft Tissue Wounds. World J Plast Surg. 2017;6(3):332-342.
- Migliorini F, La Padula G, Torsiello E, et al. Strategies for large bone defect reconstruction after trauma, infections or tumour excision: a comprehensive review of the literature. Eur J Med Res. 2021;26(1):118. doi: 10.1186/s40001-021-00593-9
- Jebson PJL, Hayden RJ. AO Principles of Fracture Management. JAMA. 2008;300(20):2432-2433. doi:10.1001/ jama.2008.703
- Ebraheim NA, Elgafy H, Xu R. Bone-graft harvesting from iliac and fibular donor sites: techniques and complications. J Am Acad Orthop Surg. 2001;9(3):210-218. doi: 10.5435/00124635-200105000-00007
- Tonoli C, Bechara AH, Rossanez R, et al. Use of the vascularized iliac-crest flap in musculoskeletal lesions. BiomedRes Int. 2013;2013:237146. doi: 10.1155/2013/237146
- Roberts TT, Rosenbaum AJ. Bone grafts, bone substitutes and orthobiologics: the bridge between basic science and clinical advancements in fracture healing. Organogenesis. 2012;8(4):114-124. doi: 10.4161/org.23306
- Lei P, Du W, Liu H, et al. Free vascularized iliac bone flap based on deep circumflex iliac vessels graft for the treatment of osteonecrosis of femoral head. J Orthop Surg Res. 2019;14(1):397. doi: 10.1186/s13018-019-1440-2
- Kessler P, Thorwarth M, Bloch-Birkholz A, et al. Harvesting of bone from the iliac crest--comparison of the anterior and posterior sites. Br J Oral Maxillofac Surg. 2005;43(1):51-56. doi: 10.1016/j.bjoms.2004.08.026
- Myeroff C, Archdeacon M. Autogenous bone graft: donor sites and techniques. J Bone Joint Surg Am. 2011;93(23):2227-2236. doi: 10.2106/JBJS.J.01513
- Beris AE, Lykissas MG, Korompilias AV, et al. Vascularized fibula transfer for lower limb reconstruction. Microsurgery. 2011;31(3):205-211. doi: 10.1002/micr.20841
- Kalra GS, Goel P, Singh PK. Reconstruction of post-traumatic long bone defect with vascularised free fibula: A series of28 cases. Indian J Plast Surg. 2013;46(3):543-548. doi: 10.4103/0970-0358.122013
- Zekry KM, Yamamoto N, Hayashi K, et al. Reconstruction of intercalary bone defect after resection of malignant bone tumor. J Orthop Surg (HongKong). 2019;27(1):2309499019832970. doi: 10.1177/2309499019832970
- Bumbasirevic M, Stevanovic M, Bumbasirevic V, et al. Free vascularised fibular grafts in orthopaedics. Int Orthop. 2014;38(6):1277-82. doi: 10.1007/s00264-014-2281-6
- Muramatsu K, Ihara K, Shigetomi M, Kawai S. Femoral reconstruction by single, folded or double free vascularised fibular grafts. Br J Plast Surg. 2004;57(6):550-555. doi: 10.1016/j.bjps.2003.08.021
- Wieser K, Modaressi K, Seeli F, Fuchs B. Autologous double-barrel vascularized fibula bone graft for arthrodesis of the shoulder after tumor resection. Arch Orthop Trauma Surg. 2013;133(9):1219-1224. doi: 10.1007/s00402-013-1795-5
- Roddy E, DeBaun MR, Daoud-Gray A, et al. Treatment of critical-sized bone defects: clinical and tissue engineering perspectives. Eur J Orthop Surg Traumatol. 2018;28(3):351-362. doi: 10.1007/s00590-017-2063-0
- Estrella EP, Wang EH. A Comparison ofVascularized Free Fibular Flaps and Nonvascularized Fibular Grafts for Reconstruction of Long Bone Defects after Tumor Resection. JReconstrMicrosurg. 2017;33(3):194-205. doi: 10.1055/s-0036-1594299
- McCullough MC, Arkader A, Ariani R, et al. Surgical Outcomes, Complications, and Long-Term Functionality for Free Vascularized Fibula Grafts in the Pediatric Population: A 17-Year Experience and Systematic Review of the Literature. J Reconstr Microsurg. 2020;36(5):386-396. doi: 10.1055/s-0040-1702147
- Houdek MT, Bayne CO, Bishop AT, Shin AY. The outcome and complications of vascularised fibular grafts. Bone Joint J. 2017;99-B(1):134-138. doi: 10.1302/0301-620X.99B1.BJJ-2016-0160.R1
- Liu S, Tao S, Tan J, et al. Long-term follow-up of fibular graft for the reconstruction of bone defects. Medicine (Baltimore). 2018;97(40):e12605. doi: 10.1097/MD.0000000000012605
- Bakri K, Stans AA, Mardini S, Moran SL. Combined massive allograft and intramedullary vascularized fibula transfer: the capanna technique for lower-limb reconstruction. Semin Plast Surg. 2008;22(3):234-241. doi: 10.1055/s-2008-1081406
- Zekry KM, Yamamoto N, Hayashi K, et al. Reconstruction of intercalary bone defect after resection of malignant bone tumor. J Orthop Surg (Hong Kong). 2019;27(1):2309499019832970. doi: 10.1177/2309499019832970
- Panagopoulos GN, Mavrogenis AF, Mauffrey C, et al. Intercalary reconstructions after bone tumor resections: a review of treatments. Eur J Orthop Surg Traumatol. 2017;27(6):737-746. doi: 10.1007/s00590-017-1985-x
- Zheng K, Yu XC, Hu YC, et al. Outcome of segmental prosthesis reconstruction for diaphyseal bone tumors: a multicenter retrospective study. BMC Cancer. 2019;19(1):638. doi: 10.1186/s12885-019-5865-0
- Palumbo BT, Henderson ER, Groundland JS, et al. Advances in segmental endoprosthetic reconstruction for extremity tumors: a review of contemporary designs and techniques. Cancer Control. 2011;18(3):160-170. doi: 10.1177/107327481101800303


