Алгоритм повышения выявляемости детей с онкологическими заболеваниями на ранних стадиях
Автор: Рыков Максим Юрьевич, Манерова Ольга Александровна, Турабов Иван Александрович, Козлов Василий Владимирович, Решетников Владимир Анатольевич
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Эпидемиологические исследования
Статья в выпуске: 5 т.19, 2020 года.
Бесплатный доступ
Актуальность. В последние десятилетия продолжается неуклонный рост числа онкологических заболеваний у детей, большая часть из которых выявляется на распространенных стадиях: заболеваемость увеличилась на 12,8 % (2007 г. - 11,7, 2017 г. - 13,2 на 100 тыс.), распространенность - на 37,9 % (2007 г - 63,9, в 2017 г - 88,1 на 100 тыс.). Цель исследования - разработка мер, направленных на повышение ранней выявляемости злокачественных новообразований у детей. Материал и методы. В медицинских организациях Архангельской области в клиническую практику врачей-участковых педиатров в 2016 г. внедрен «Алгоритм определения целесообразности направления пациента на консультацию к врачу-детскому онкологу». В рамках оценки эффективности «Алгоритма» проведено сравнение двух групп пациентов с гистологически верифицированными солидными злокачественными новообразованиями: первая группа - 49 пациентов, получавших медицинскую помощь в Архангельской области в 2011-15 гг. (до проведения организационного эксперимента); вторая группа - 51 пациент, получавший медицинскую помощь в отделении детской онкологии Архангельской области в 2016-18 гг. (контрольная группа). Результаты. Введение «Алгоритма определения целесообразности направления пациента на консультацию к врачу-детскому онкологу» позволило увеличить выживаемость пациентов после установления диагноза злокачественного новообразования (при трехлетнем сроке наблюдения) с 25,04 ± 2,05 мес до 30,3 ± 1,57 мес (р=0,045). При этом значимо сократились временные параметры различных этапов, предшествовавших началу специализированного лечения: время от момента обращения к врачу-детскому онкологу до верификации диагноза сократилось с 9,0 (7,0; 14,0) до 7,0 (5,0; 9,0) дней (р function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Детская онкология, злокачественные новообразования, ранняя выявляемость
Короткий адрес: https://sciup.org/140254382
IDR: 140254382 | УДК: 616-006-053.2-07 | DOI: 10.21294/1814-4861-2020-19-5-5-14
Текст научной статьи Алгоритм повышения выявляемости детей с онкологическими заболеваниями на ранних стадиях
Актуальность
На современном этапе развития здравоохранения наиболее важными являются проблемы увеличения продолжительности жизни и снижения смертности, в том числе детской [1]. В этой связи особенно актуальными являются проблемы детской онкологии, поскольку злокачественные новообразования во всем мире лидируют в структуре смертности детей, уступая лишь внешним причинам [2–4]. В последние десятилетия продолжается неуклонный рост числа онкологических заболеваний у детей, большая часть которых выявляется на распространенных стадиях [5]. В Российской Федерации ежегодно злокачественные новообразования впервые диагностируются у менее 4 тыс. детей.
Совершенствование диагностики привело к существенному увеличению выявляемости: за последние 10 лет число ежегодно выявляемых первичных пациентов увеличилось на 25,6 %, число детей, находящихся под диспансерным наблюдением (достигших ремиссии и продолжающих лечение), – на 46,9 % (рис. 1). При этом заболеваемость (выявляемость) увеличилась на 12,8 % (2007 г. – 11,7, 2017 г. – 13,2 на 100 тыс.), распространенность – на 37,9% (2007 г. – 63,9, 2017 г. – до 88,1 на 100 тыс.) (рис. 2).
Хотя доля пациентов, выявленных активно, увеличилась за последние 10 лет на 2,2 %, она все еще остается на достаточно низком уровне – 5,8 %. При этом одногодичная летальность сократилась на 6 % – с 14,8 % в 2007 г. до 8,8 % в 2017 г. (рис. 3). Однако свыше 70 % пациентов выявляются на распространенных стадиях заболеваний. Это определяет особую актуальность выработки новых подходов, направленных на усиление роли врачей-участковых педиатров в повышении ранней диагностики злокачественных новообразований у детей.
Цель исследования – разработка мер, направленных на повышение ранней выявляемости злокачественных новообразований у детей.
Материал и методы
В медицинских организациях Архангельской области в клиническую практику участковых педиатров в 2016 г. внедрен «Алгоритм определения целесообразности направления пациента на консультацию к врачу-детскому онкологу» (табл. 1). «Алгоритм» представляет собой анкету из 20 вопросов, ответив на которые однозначно (да/нет), участковый педиатр может принять решение о дальнейшей тактике обследования и лечения пациента: при двух и более ответах «да» в пунктах
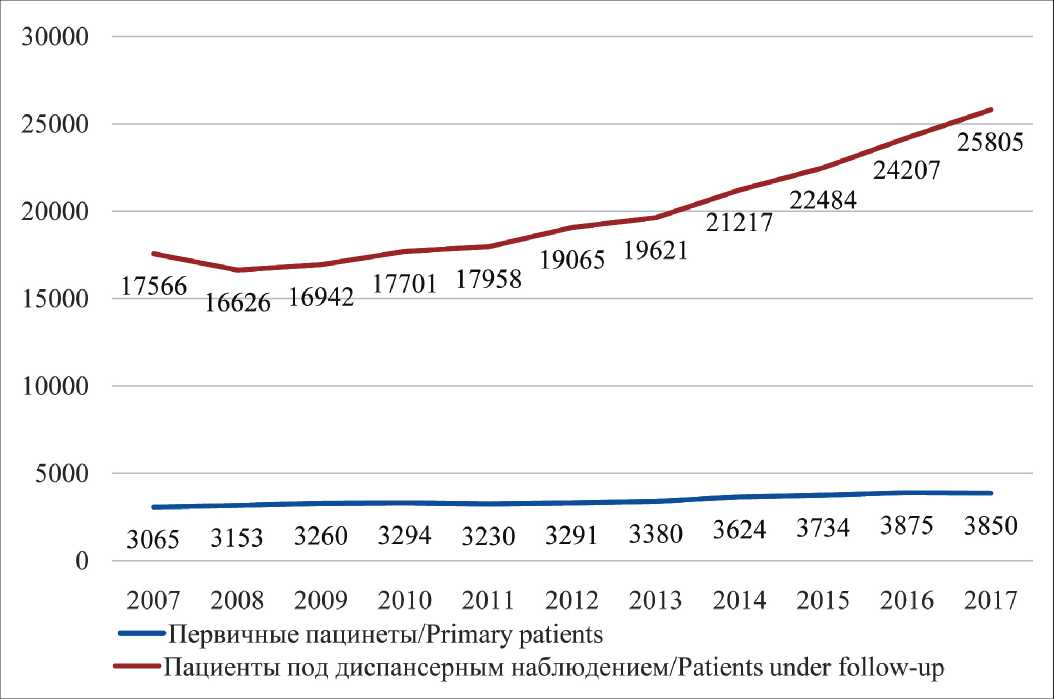
Рис. 1. Число первичных пациентов и пациентов, находящихся под диспансерным наблюдением (0–17 лет) в 2007–2017 гг., чел.
Fig. 1. The number of primary patients and patients under followup (0–17 years old) in 2007–2017
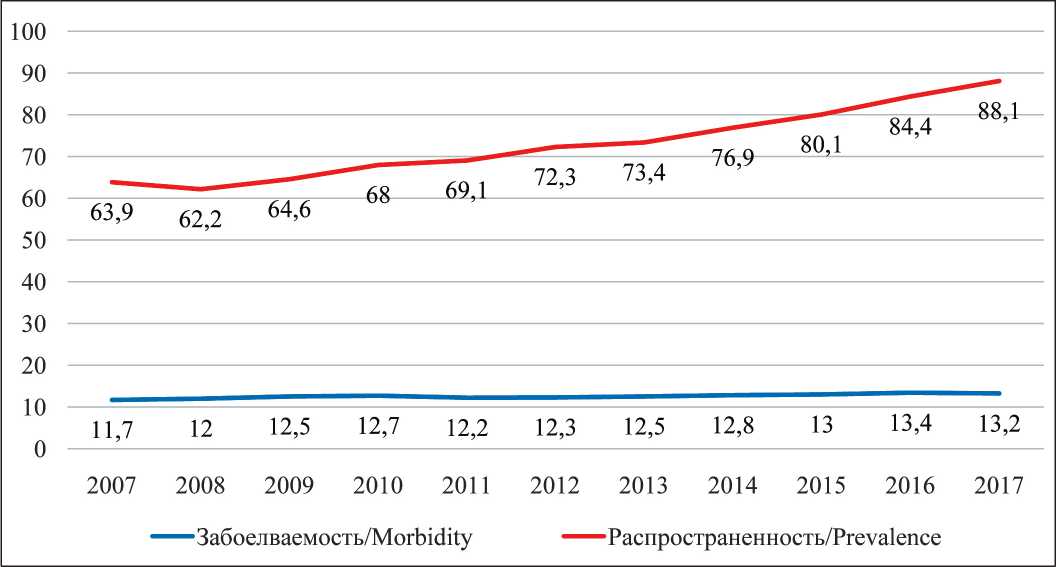
Рис. 2. Заболеваемость детского населения и распространенность злокачественных новообразований в 2007–2017 гг. (на 100 тыс. 0–17 лет) Fig. 2. The incidence of the childhood cancer per 100,000 children in 2007–2017 (017 years)
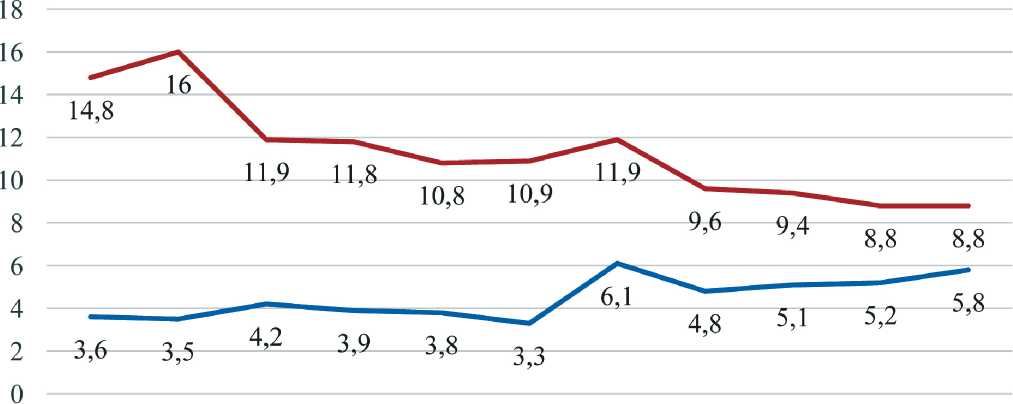
2007 2008 2009 2010 2011 2012 2013 2014 2015 2016 2017
^—Выявлено активно, %/Patients diagnosed with cancer, %
^—Одногодичная летальность, %/One-year mortality rate, %
Рис. 3. Пациенты, выявленные активно (%), и одногодичная летальность (%) в 2007–2017 гг. Fig. 3. Patients diagnosed with cancer (%) and one-year mortality rate (%) in 2007–2017
Таблица 1/table 1
Алгоритм определения целесообразности направления пациента на консультацию к врачу-детскому онкологу the algorithm for referring a patient to a consultation with a pediatric oncologist
№
Симптомы и синдромы/Symptoms and signs
Да/Нет Yes/No
-
1 Субфебрильная лихорадка более 3 дней без установленных причин/ Low-grade fever for more than 3 days with no known cause
-
2 Снижение массы тела/Weight loss
-
3 Вялость, быстрая утомляемость/Lethargy, fatigue
-
4 Врожденные пороки развития, синдромы/Congenital malformations, syndromes
-
5 Онкологические заболевания у ближайших родственников/ Cancer in close relatives
-
6 Макрогематурия/Macrohematuria
-
7 Болевой синдром/Pain syndrome
-
8 Лейкокория/Leucocoria
-
9 Увеличенные лимфатические узлы/Enlarged lymph nodes
-
10 Симптомы повышенного внутричерепного давления (головная боль, рвота, нарушения зрения)/Symp-toms of increased intracranial pressure (headache, vomiting, visual disturbances
-
11 Повышенный уровень альфа-фетопротеина в сыворотке крови/Elevated serum alpha-fetoprotein
-
12 Повышенный уровень хорионического гонадотропина в сыворотке крови/
Elevated serum chorionic gonadotropin
-
13 Повышенный уровень лактатдегидрогеназы в сыворотке крови/Elevated serum lactate dehydrogenase
-
14 Повышенный уровень щелочной фосфатазы в сыворотке крови/Elevated serum alkaline phosphatase
-
15 Повышенный уровень аспартатаминотрансферазы в сыворотке крови/
Elevated serum aspartate aminotransferase
-
16 Повышенный уровень аланинаминотрансферазы в сыворотке крови/ Elevated serum alanine aminotransferase
-
17 Анемический синдром/Anemic syndrome
-
18 Лейкоцитоз/Leukocytosis
-
19 Пальпируемое опухолевое образование/Palpable tumor
-
20 Образование, подозрительное на опухолевое по данным инструментальных методов обследования (ультразвуковых, рентгенологических)/Suspicious for cancer according to ultrasound, X-ray findings
№ 1–5 или одного и более ответа «да» в пунктах № 6–20 рекомендовано направить пациента на консультацию к детскому онкологу. При наличии одного ответа «да» в пунктах № 1–5 рекомендовано динамическое наблюдение.
Также в клиническую практику онкологического отделения химиотерапии опухолей ГБУЗ АО «Архангельская областная детская клиническая больница им. П.Г. Выжлецова» в 2017 г. внедрена электронная база данных с системой поддержки принятия врачебных решений, что позволило получать достоверные статистические данные, а также прослеживать судьбу пациентов от момента верификации диагноза на протяжении их дальнейшей жизни. Электронная база данных была дополнена сведениями о пациентах, получавших лечение в 2015–16 гг., что дало возможность оценить проведенные этапы диагностики и лечения.
В рамках оценки эффективности «Алгоритма» проведено сравнение двух групп пациентов с гистологически верифицированными со́лидными злокачественными новообразованиями: первая группа – 49 пациентов, получавших медицинскую помощь в Архангельской области в 2011–15 гг. (до проведения организационного эксперимента);
вторая группа – 51 пациент, получавший медицинскую помощь в отделении детской онкологии Архангельской области в 2016–18 гг. (контрольная группа). В рамках организационного эксперимента проанализировано 249 медицинских карт стационарного больного из первой группы и 357 – из второй группы.
Результаты
Среди пациентов группы 2011–15 гг. и группы 2016–18 гг. преобладали мальчики – 26 (53,1 %) и 29 (56,9 %) соответственно. В каждой из групп наблюдения диапазон возраста пациентов характеризовался значительным разбросом: средний возраст детей в первой группе составил 4,2 года (1,7; 11,5), во второй группе – 3,0 года (1,2; 11,3), р=0,412. В обеих группах преобладали пациенты с локализованными стадиями – 29 (59,2 %) и 37 (72,5 %) соответственно. Таким образом, по возрасту, полу и стадиям заболеваний в сравниваемых группах статистически значимых различий отмечено не было.
В группе 2011–15 гг. умерло 20 (40,8 %) пациентов, рецидивы развились у 14 (28,6 %), нарушение протоколов лечения отмечено у 16 (32,7 %), до-
Таблица 2/table 2
Заболеваемость детского населения Архангельской области со ́ лидными злокачественными новообразованиями в 2011–18 гг. (данные Министерства здравоохранения Архангельской области) the incidence of cancer in children in the arkhangelsk region for 2011–18 (data from the Ministry of Health of the arkhangelsk region)
|
Годы/ Years |
Численность детского населения (0–17 лет), чел./ Number of children (0–17 years) |
Число первичных пациентов с со ́ лидными опухолями, чел./ Number of patients with primary cancer |
Заболеваемость солидными опухолями (на 100 тыс. 0–17 лет)/ Cancer incidence per 100,000 (0–17 years) |
|
2011 |
218822 |
9 |
4,2 |
|
2012 |
220286 |
6 |
2,7 |
|
2013 |
221918 |
11 |
5 |
|
2014 |
223832 |
11 |
5 |
|
2015 |
225971 |
12 |
5,3 |
|
2016 |
227971 |
13 |
5,7 |
|
2017 |
226843 |
16 |
7 |
|
2018 |
224801 |
21 |
9,4 |
Таблица 3/table 3
Сравнительная оценка временных параметров этапов, предшествовавших началу лечения в группах наблюдения comparative assessment of the time parameters before starting treatment in the study groups
|
Показатели/Parameters |
Группы наблюдения/ Study groups |
р |
|
|
2011–15 (n=49) |
2016–18 (n=51) |
||
|
Время от момента обращения к врачу-детскому онкологу до верификации диагноза/ Time from the visit to a pediatric oncologist to verification of the diagnosis |
9,0 (7,0; 14,0) |
7,0 (5,0; 9,0) |
р˂0,001 |
|
Время от верификации диагноза до начала специализированного лечения/ Time from diagnosis verification to the start of specialized treatment |
1,0 (1,0; 5,0) |
1,0 (1,0; 2,0) |
р=0,55 |
|
Время от момента обращения к врачу-детскому онкологу до начала специализированного лечения/ Time from the visit to a pediatric oncologist to the start of specialized treatment |
12,0 (8,0; 16,0) |
8,0 (6,0; 10,0) |
р˂0,001 |
|
Время от момента обращения к врачу-участковому педиатру до направления к врачу-детскому онкологу/ Time from the visit to a local pediatrician to referral to a pediatric oncologist |
11,0 (6,0; 17,0) |
2,0 (1,0; 3,0) |
р˂0,001 |
|
Время от момента обращения к врачу-участковому педиатру до начала специализированного лечения/ Time from the visit to a local pediatrician to the start of specialized treatment |
23,0 (17,0; 32,0) |
9,0 (8,0; 12,0) |
р˂0,001 |
Таблица 4/table 4
Оценка времени дожития (в мес) пациентов в группах наблюдения по методу Каплана–Мейера после установления диагноза злокачественного новообразования в зависимости от периода наблюдения по сравнению с временем дожития пациентов, получавших лечение в 2011–15 гг. – 30,3 ± 1,57 мес против 25,04 ± 2,05 мес (р=0,045) (рис. 4).
Проведена оценка влияния временных факторов на длительность выживаемости пациентов после установления диагноза злокачественного новообразования. В качестве предполагаемых предикторов использовались: время от момента обращения к врачу-детскому онкологу до верификации диагноза, время от верификации диагноза до начала специализированного лечения, время от момента обращения к врачу-детскому онкологу до начала специализированного лечения, время от момента обращения к врачу-участковому педиатру до направления к врачу-детскому онкологу, время от момента обращения к врачу-участковому педиатру до начала специализированного лечения. Построение многофакторных моделей влияния
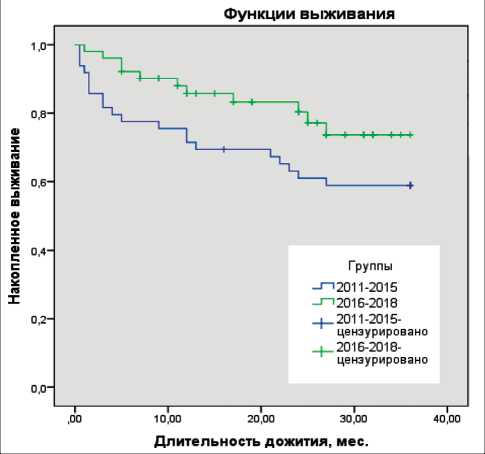
Рис. 4. Кривые Каплана–Мейера оценки функции дожития пациентов в группах наблюдения после установления диагноза злокачественного новообразования в зависимости от периода наблюдения
Fig. 4. Kaplan–Meier curves for assessing survival function in cancer patients depending on the study period
временных факторов проводилось отдельно для каждой группы наблюдения (табл. 5).
Следует отметить, что показатель «время от момента обращения к врачу-детскому онкологу до начала специализированного лечения» статистически не значим в обеих моделях, поскольку имел выраженную автокорреляцию со значимым параметром «время от момента обращения к врачу-участковому педиатру до начала специализированного лечения», являясь его составной частью.
Обращает на себя внимание, что в модели, описывающей группу 2011–15 гг., из других четырех параметров статистически значимо влиял на длительность дожития только показатель «время от момента обращения к врачу-участковому педиатру до начала специализированного лечения» (р=0,001). Параметры «время от момента обращения к врачу-детскому онкологу до верификации диагноза», «время от верификации диагноза до начала специализированного лечения», «время от момента обращения к врачу-детскому онкологу до начала специализированного лечения» вследствие выраженного разброса значений не оказывали значимого влияния на время дожития пациентов после установления диагноза. В регрессионной модели Кокса, описывающей группу пациентов 2016–18 гг., все 4 аналогичных параметра оказывали статистически значимое влияние на результаты дожития пациентов.
Для оценки прогностической значимости полученных моделей на длительность выживаемости пациентов после установления диагноза злокачественного новообразования были построены ROC-кривые (рис. 5). По данным построения ROC-кривой показатель AUC для модели 2011–15 гг. не являлся статистически значимым (табл. 6), соответственно, данная модель не имеет прогностической ценности. Для модели 2016–18 гг. показатель AUC составил 0,725 ± 0,28 (ДИ 95 % 0,498–0,952), р=0,023, что соответствует хорошему качеству прогностической модели. Введение «Алгоритма» позволило увеличить выживаемость пациентов после установления диагноза злокачественного ново-
the Kaplan–Meier estimate of survival probability (in months) in the study group patients after diagnosis of cancer depending on the study period
|
Среднее время дожития/Medial survival time |
р |
|||
|
Группы/Groups |
Оценка/ |
Стандартная ошибка/ |
95 % ДИ/ |
по Бреслау/ |
|
Estimation |
Standard error |
95 % CI |
by Breslau |
|
|
2011–15 |
25,04 |
2,05 |
21,02–29,07 |
|
|
2016–18 |
30,30 |
1,57 |
27,23–33,37 |
р=0,045 |
|
Все/ |
27,68 |
1,31 |
25,10–30,25 |
|
|
All groups |
||||
Таблица 5/table 5
Переменные регрессионных моделей Кокса оценки влияния временных факторов на длительность выживаемости пациентов групп наблюдения после установления диагноза злокачественного новообразования
Variables of cox regression models for assessing the effect of time on survival of patients after the diagnosis of cancer
|
Предикторы/Predictors |
β |
±m |
χ2 |
р |
OR |
95% ДИ для OR |
|
|
Нижняя |
Верхняя |
||||||
|
Группа 2011 – |
15 гг./2011 |
– 15 group |
|||||
|
Время от момента обращения к врачу-детскому онкологу до верификации диагноза/Time from the visit to a pediatric |
0,103 |
0,060 |
2,942 |
0,086 |
1,109 |
0,985 |
1,248 |
|
oncologist to verification of the diagnosis |
|||||||
|
Время от верификации диагноза до начала специализированного лечения/Time from diagnosis verification to the |
0,127 |
0,074 |
2,924 |
0,087 |
1,136 |
0,982 |
1,314 |
|
start of specialized treatment |
|||||||
|
Время от момента обращения к врачу-детскому онкологу до начала специализированного лечения/Time from the visit to a pediatric oncologist to the start of specialized |
0,009 |
0,040 |
0,046 |
0,831 |
1,009 |
0,933 |
1,091 |
|
treatment |
|||||||
|
Время от момента обращения к врачу-участковому педиатру до направления к врачу-детскому онкологу/Time from the visit to a local pediatrician to referral to a pediatric |
0,100 |
0,039 |
6,600 |
0,010 |
1,106 |
1,024 |
1,194 |
|
oncologist |
|||||||
|
Время от момента обращения к врачу-участковому педиатру до начала специализированного лечения/Time from the visit to a local pediatrician to the start of special- |
0,105 |
0,031 |
11,837 |
0,001 |
1,111 |
1,046 |
1,180 |
|
ized treatment |
|||||||
|
Группа 2016 – 18 гг./2016 |
– 18 group |
||||||
|
Время от момента обращения к врачу-детскому онкологу до верификации диагноза/Time from the visit to a pediatric |
3,526 |
1,505 |
5,486 |
0,019 |
33,991 |
1,778 |
649,785 |
|
oncologist to verification of the diagnosis |
|||||||
|
Время от верификации диагноза до начала специализированного лечения/Time from diagnosis verification to the |
4,692 |
1,783 |
6,924 |
0,009 |
109,042 |
3,310 |
3591,999 |
|
start of specialized treatment |
|||||||
|
Время от момента обращения к врачу-детскому онкологу до начала специализированного лечения/Time from the visit to a pediatric oncologist to the start of specialized |
0,102 |
0,186 |
0,300 |
0,584 |
1,107 |
0,770 |
1,593 |
|
treatment |
|||||||
|
Время от момента обращения к врачу-участковому педиатру до направления к врачу-детскому онкологу/Time from the visit to a local pediatrician to referral to a pediatric |
4,004 |
1,692 |
5,601 |
0,018 |
54,828 |
1,990 |
1510,754 |
|
oncologist |
|||||||
|
Время от момента обращения к врачу-участковому педиатру до начала специализированного лечения/Time from the visit to a pediatric oncologist to the start of special- |
3,660 |
1,569 |
5,443 |
0,020 |
0,026 |
0,001 |
0,557 |
|
ized treatment |
|||||||
Таблица 6/table 6
Оценка параметров Roc-кривых регрессионных моделей Кокса оценки влияния временных факторов на длительность выживаемости пациентов групп наблюдения после установления диагноза злокачественного новообразования estimation of the parameters of Roc-curves of cox regression models for assessing the effect of time on survival of patients after the diagnosis of cancer
Анализ заболеваемости детского населения со́лидными опухолями в Архангельской области в 2011–18 гг. выявил рост данного показателя после внедрения «Алгоритма» на 55,3 % (с 4,2 до 9,4 на 100 тыс. 0–17 лет) (табл. 2).
С целью оценки эффективности структурнофункциональной модели проводилось сравнение выживаемости пациентов после установления диагноза злокачественного новообразования, а также оценивалось время от момента обращения к врачу-детскому онкологу до верификации диагноза; время от момента обращения к врачу-детскому
онкологу до начала специализированного лечения; время от верификации диагноза до начала специализированного лечения; время от момента обращения к врачу-участковому педиатру до направления к врачу-детскому онкологу; время от момента обращения к врачу-участковому педиатру до начала специализированного лечения (табл. 3).
При помощи метода Каплана–Мейера произведено сравнение времени дожития 100 пациентов в зависимости от периода лечения: 2011–15 гг. и 2016–18 гг. (табл. 4). При этом доля цензурированных случаев (дожитие пациентов до 36 мес после установления диагноза) в группе 2011–15 гг. составила 59,2 %, в группе 2016–18 гг. – 78,4 %. Установлено, что имеются значимые различия выживаемости в группах наблюдения. Среднее время дожития в группе 2016–18 гг. значимо увеличилось
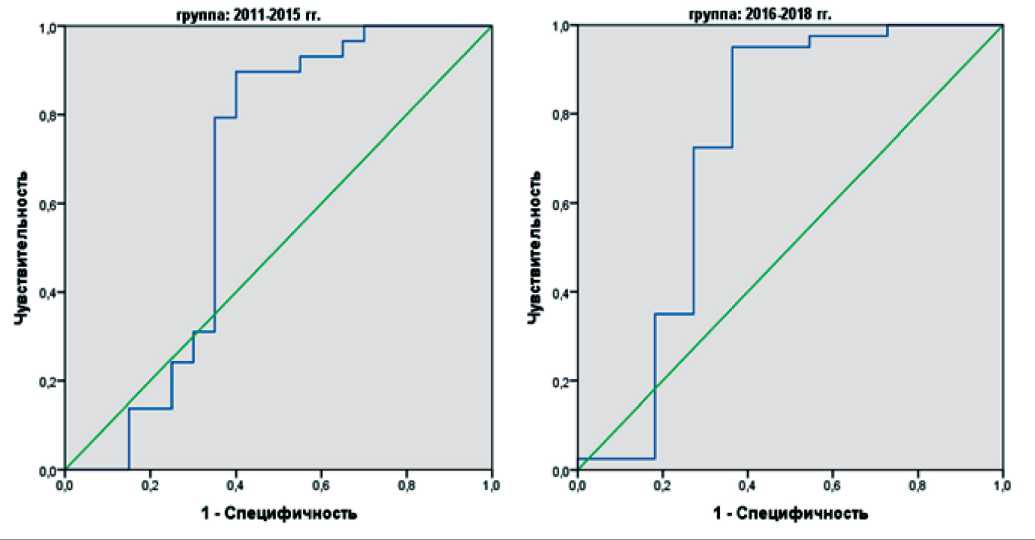
Рис. 5. ROC-кривые регрессионных моделей Кокса оценки влияния временных факторов на длительность выживаемости пациентов после установления диагноза злокачественного новообразования
(2011–15 гг. и 2016–18 гг.)
Fig. 5. ROC curves of Cox regression models for assessing the effect of time on survival of patients after the diagnosis of cancer
(2011–15 and 2016–18)
образования (при трехлетнем сроке наблюдения) с 25,04 ± 2,05 мес до 30,3 ± 1,57 мес (р=0,045).
Статистически значимо сократились временные параметры различных этапов, предшествовавших началу специализированного лечения: время от момента обращения к врачу-детскому онкологу до верификации диагноза сократилось с 9,0 (7,0; 14,0) до 7,0 (5,0; 9,0) дней (р˂0,001); время от верификации диагноза до начала специализированного лечения – с 12,0 (8,0; 16,0) до 8,0 (6,0; 10,0) дней (р˂0,001); время от момента обращения к врачу-участковому педиатру до направления к врачу-детскому онкологу – с 11,0 (6,0; 17,0) до 2,0 (1,0; 3,0) дней (р˂0,001); время от момента обращения к врачу-участковому педиатру до начала специализированного лечения – с 23,0 (17,0; 32,0) до 9,0 (8,0; 12,0) дней (р˂0,001).
С введением «Алгоритма определения целесообразности направления пациента на консультацию к врачу-детскому онкологу» перечисленные параметры начали оказывать значимое влияние на время дожития пациентов, что подтверждается построением регрессионных моделей Кокса и оценкой их прогностической значимости по методу ROC-кривых.
Обсуждение
В современных условиях развития отечественного здравоохранения особое значение имеет поиск путей совершенствования специализированной медицинской помощи, что особенно важно для таких социально значимых заболеваний, как злокачественные новообразования у детей, поскольку они занимают лидирующие позиции в структуре детской смертности [6, 7].
Специфика медицинской помощи детям с онкологическими заболеваниями предполагает мультидисциплинарный подход к диагностике и лечению пациентов [8, 9]. Совершенствование системы медицинской помощи требует интеграции клинических и организационных подходов [10]. При этом до настоящего времени врачи первичного звена (участковые педиатры) не играли никакой роли в диагностике злокачественных новообразований у детей. Как результат – доля пациентов, выявленных активно, составляет лишь 5,2 % [1, 5]. Причина изложенного не только в орфанности злокачественных новообразований у детей, но и в атипичности клинической картины, отсутствии характерных клинических признаков [11]. Представленный «Алгоритм» – это первый инструмент, направленный на повышение выявляемости злокачественных новообразований у детей на ранних стадиях с целью увеличения продолжительности жизни данной категории пациентов.
Заключение
В рамках организационного эксперимента показана результативность внедрения структурнофункциональной модели организации медицинской помощи детям с онкологическими заболеваниями в Российской Федерации.
Список литературы Алгоритм повышения выявляемости детей с онкологическими заболеваниями на ранних стадиях
- Рыков М.Ю., Байбарина Е.Н., Чумакова О.В., Купеева И.А., Караваева Л.В., Поляков В.Г. Совершенствование организационно-методических подходов к оказанию медицинской помощи детям с онкологическими заболеваниями. Онкопедиатрия. 2017; 4(2): 91-104. [Rykov M.Y., Baibarina E.N., Chumakova O.V., Kupeeva I.A., Karavaeva L.V., Polyakov V.G. Improvement of the organizational and methodological approaches to healthcare delivery for children with cancer. Oncopediatrics. 2017; 4(2): 91-104. (in Russian)]. doi: 10.15690/onco. v4i2.1703.
- Bleyer A., Barr R., Ries L., Whelan J., Ferrari A. Cancer in Adolescents and Young Adults. Springer, 2017. 825 p.
- Automated childhood cancer information system [Internet]. URL: http://accis.iarc.fr (cited: 15.01.2019).
- Аксель Е.М. Злокачественные новообразования у детей: статистика заболеваемости и смертности детей в России и странах бывшего СССР в 2015 г. Евразийский онкологический журнал. 2017; 5(2): 349-357. [Aksel E.M. Malignant tumors in children: statistics of morbidity and mortality of children in Russia and the countries of the former USSR in 2015. Eurasian Journal of Oncology. 2017; 5(2): 349-357. (in Russian)].
- Каприн А.Д., Старинский В.В., Петрова Г.В. Состояние онкологической помощи населению России в 2018 году. М., 2018. 236 с. [Kaprin A.D., Starinskii V.V., Petrova G.V. Sostoyanie onkolog-icheskoi pomoshchi naseleniyu Rossii v 2017 g. Moscow, 2017. 236 p. (in Russian)].
- Gupta S., Rivera-Luna R., Ribeiro R.C., Howard S.C. Pediatric oncology as the next global child health priority: the need for national childhood cancer strategies in low- and middle-income countries. PLoS Med. 2014 Jun 17; 11(6): e1001656. doi: 10.1371/journal.pmed.1001656.
- Lozano R., Wang H., Foreman K.J., Rajaratnam J.K., Naghavi M., Marcus J.R., Dwyer-Lindgren L., Lofgren K.T., Phillips D., Atkinson C., Lopez A.D., Murray C.J. Progress towards Millennium Development Goals 4 and 5 on maternal and child mortality: an updated systematic analysis. Lancet. 2011 Sep 24; 378(9797): 1139-65. doi: 10.1016/S0140-6736(11)61337-8.
- Gupta S., Rivera-Luna R., Ribeiro R.C., Howard S.C. Pediatric oncology as the next global child health priority: the need for national childhood cancer strategies in low- and middle-income countries. PLoS Med. 2014 Jun 17; 11(6): e1001656. doi: 10.1371/journal.pmed.1001656.
- Kellie S.J., Howard S.C. Global child health priorities: what role for paediatric oncologists? Eur J Cancer. 2008; 44(16): 2388-96. doi: 10.1016/j.ejca.2008.07.022.
- ConklinA., Morris Z., NolteE. What is the evidence base for public involvement in health-care policy: results of a systematic scoping review. Health Expect. 2015 Apr; 18(2): 153-65. doi: 10.1111/hex.12038.
- Weaver M.S., Arora R.S., Howard S.C., Salaverria C.E., Liu Y.L., RibeiroR.C., Lam C.G. A practical approach to reporting treatment abandonment in pediatric chronic conditions. Pediatr Blood Cancer. 2015 Apr; 62(4): 565-70. doi: 10.1002/pbc.25403.


