Алкалоиды Berberis исследования алкалоидов Berberis amurensis rupr
Автор: Юсупов М.М.
Журнал: Теория и практика современной науки @modern-j
Рубрика: Химия и материаловедение
Статья в выпуске: 1 (31), 2018 года.
Бесплатный доступ
В статье рассматривается результаты исследования алколоидов молодых побегов
Алкоид, барбарис, амуренин
Короткий адрес: https://sciup.org/140272363
IDR: 140272363
Текст научной статьи Алкалоиды Berberis исследования алкалоидов Berberis amurensis rupr
Из молодых побегов amurensis rupr. Кромо ранее выделенных алкалоидов, получены берберрубин, оксиакантин, псевдопальматин и новое апорфиновое основание амуренин. На основании спектральных данных и химического преврашения установленно его строение.
Berberis amurensis rupr.является кустарником высотой до 3 м, относится к семейству Berberidaceace и произрастает, в основном, на Дальнем Востоке. Плоды, листья и этого растения издавна применяются в народной медицине при лечении гипертонии, заболеваний печении, а также как кровоостанавливающее средство.В научной медицине настойка листьев применяется при маточном кровотечении[1].
Ранее из этого растения выделены берберин, ятроррицин, пальматин, магнофлорин, бербамин и бербамунин[2,3,3,4,5,6].
В настоящей работе даются результаты исследования алколоидов молодых побегов. В.amurensis произрастающих в окрестностях поселения Барабаш (Приморский край, Хасанский район). Экстракцией этанолом изолировали 0,34 % суммы алкалоидов.Хроматографированием полученной суммы на колонке с силикагелом выделили берберин,берберрубин, псевдопальматин, ятроррицини новое основание амуренин (I) в виде хлоридов. Из третичных алкалоидов выделили оксиаконтин и бербамунин. Известные алкалоиды, выделенные из этого растения, идентифацировали путем физико – химических констант, спектральных данных, а также сравнением с подлиными образцами. Среди них берберрубин, оксиакантин и псевдопальматин были выделены из данного растения впервые.
Амуренин(I) представляет собой оптически активное красталлическое основание, обладает фенольными свойствами, дает кристаллическое о-ацетилпроизводное (II). В ИКспектре I имеются полосы поглощения при 3200 см-I (от активного водорода), 1470, 1580,160 см-I (от бифенильной системы) [6]. УФ- спектр Iиммеет максимумы при λ max 265, 275, 306, lgξ 4,23; 4,25; 4,16, характерные для монозамещенных апорфиновых алкалоидов в кольце в [7].
При масс-фрагментации I, под электронным ударом, наряду с образованием ионов с m/z326(М+), 325(М -I), 309 (М - 15), 296, 268 (М- 58), образуется максимальный ион с m/z 58, что характерно для четвертичных апорфинов[8]. Данные спектра ПМР I, снятые в CD 3 OD и отнесение сигналов протонов согласно их значений по хим. cдвигам приводятся в таблице 1.
По значению хим.сдвигов трехпротонный синглет при 3,60 м.д., однопротонный сигнал при 6,82 отнесены к С1-ОСН3 и С3-Н соответственно.
Метоксильная группа 3,82 м.д. может находится при С 2 или С 10. Для определения расположения гидроксильной и метоксильной группы в кольцах А и D мы исследовали спектр ПМРо-ацетиламуренина (II).
При сравнении данных спектра ПМР I и II можно обнаружить, что синглет при 6,82 в спектре I смещается в слабое поле только на 0,06 м.д. в спектре II, дублеты при 6,65 м.д. на 0,31 м.д. 7,11 на 0,24 м.д., а дублет при 7,72 м.д. на 0, 23 м.д. смещается в слабое поле.
Следовательно, в амуренине (I) фенольный гидроксил занимает положение при С-10, а метоксильная группа – при С 2
Данные спектров ПМР I и II снятых в СD3 OD (I МДС =0, м.д.)
|
Амурении (II) |
Ацетиламуренин (II) |
|||
|
Протоны |
Величина хим.сдвига м.д. |
J (Гц) |
Величина хим.сдвига м.д. |
J (Гц) |
|
Н+ (СН 3 ) 2 |
3,30 (ЗН.с) |
- |
3,02 (ЗН. с) |
|
|
3,36 (ЗН.с) |
- |
3,38 (ЗН.с) |
||
|
С I - ОСН 3 |
3,60 (ЗН.с) |
3,60 (ЗН.с) |
||
|
С 2 - ОСН 3 |
3,82 (ЗН.с) |
3,83 (ЗН.с) |
||
|
С 3 – Н |
6,82 (IН.с) |
6,88 (IН.с) |
||
|
С 8 –Н |
7, II (III. d) |
8,5 |
7,35 (IН.d) |
8,5 |
|
С 9 –Н |
6,65(IН.d.d) |
8,55;1,5 |
6,96(IН.d.d) |
5,5;1,8 |
|
С 11 –Н |
7,72 (IН.d) |
1,5 |
7,95(IН.d) |
1,8 |
|
С 10 –ОСОСН |
- |
- |
9,23(ЗН.с) |
|
Таким образом, на основании спектральных данных и химического превращения предложено химическая структура 1
амуренина.
3 4
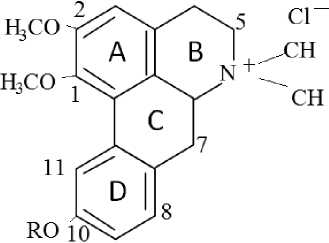
9 1.R=H 2.R=COCH 3
ЭКСПРЕМЕНТАЛЬННАЯ ЧАСТЬ
Ик – спектры снимали на спектрометре UR- 20, УФ – на спектрометре HifaеhiEPS - 3 Т (этанол),масс- спектры на спектрометре М Х – I310 с системой прямого ввода в ионный источник, при ионизирующем напряжении 60- 70 В и температуре 160 – 170 0 , ПМР – на спектрометре вs – 567 А Tesla (ЧСФР) в дейтерометаноле с добавлением дейтерохлороформа.
Химического сдвиги приведены относительновнутренного этанола ГМДС в б шкале.
Для ТСХ использовали силикагель марки LS5/40 (ЧСФР), для колоночной хроматографии - силикагель марки КСК с размерами частиц 125 -160 мм и системы растворителей: I) хлорофоррм - метанол (9:1,) (4:1) ; 2) хлороформ - метанол- конц НС1 (50:50:0,1; 3) хлороформ - этанол (4:1).
ЭКСТРАКЦИЯ МОЛОДЫХ ПОБЕГОВ В.AMURENSIS RUPR.
1240г измельченних молодых побегов трехкратно экстрагировали этанолом холодным способом. Смешанные спиртовые экстракты упарили, густой остаток растворили 5%-ным раствором соляной кислоты. Полученный раствор фильтровали, двухкратно промили эфиром. Затем подщелочили 25% - ным раствором аммиака до РН 9 и алкалоиды последовательно извлекали эфиром, хлороформом и смесью хлороформа с этанолом (4:1). После упаривания растворительей получили 0,68 г эфирной, 2,11 г хлороформной суммы и 1,34 г суммы алкалоидов полученной из смеси хлороформа с этанолом. (Сумма четвертичных алкалоидов). Общая сумма алкалоидов составляет 0,34% от веса сухого растения.
РАЗДЕЛЕНИЯ СУММЫ АЛКАЛОИДОВ
0,680 г эфирной суммы хроматографировали на колонке с силикагелем (20 г). Алкалоиды элюровали хлороформом и смесями хлороформа с метанолом в различных соотношениях. При элюировании смесью хлороформ - метанол (97:3) выделили 0,23 г оксиакантина, а при 96:4 0,34 г - бербамунина.
2,15 г хлороформной суммы хроматографировали на колонко с силикагелем аналогично эфирной суммы. При этом выделили 0,72 г берберина, 0,14 г псевдопальматина, 0,24 г берберрубина, 0,12 г ятроррицина и 0,07 г амуренеина в виде хлоридов.
Разделением четвертичной суммы, аналогично хлороформной суммы, выделили допольнительно 0,31 г берберина, 0,26 г ятроррицина и 0,12 г псевдопальматина в виде хлоридов.
Амуренин хлорид. Кристаллизуется из ацетона, т.пл.I94- 195 0
(хлорид), /α / D - 164 0( С.0, 03. СН 3 ОН).
АЦЕТИЛИРОВАНИЕ АМУРЕНИН ХЛОРИДА
К 0,04 г амуренина хлорида добавили 2 мл свежеперегнаного уксусного ангидрида и 0,5 мл абсолютного пиридина. Смесь кипятили до полного растворения основания. Затем упарили на водяной бане досуха. К остатку прибавили 5 мл ацетона и нагревали до полного растворения. При охлаждении из раствора вышли бородавчатые кристаллы 0–ацетил амуренина хлорида (II). Т.пл. 186 – 187 0
Масс:м/z 368 (М +), 367, 359, 352, 325, 58 (100%). ИК YКВr мах 1760 см-1
Список литературы Алкалоиды Berberis исследования алкалоидов Berberis amurensis rupr
- Растительные ресурсы. Наука, Ленинград, 2005, с.26.
- М. Тоmita, T/ Kugo //, L.Pharm. Soc.Japan. 75.753 (2005) C.A. 2005.49.13597.
- М. Тоmita, Т. Kugo.// L.Pharm.Soc.Japan. 77.1075 (1957) С.А.2001. 52. 5429.
- ЮсуфбековХ.Ю., ХусановаХ.М., СадыковЮ.Д., Акназаров О.А., ПорядинаТ.В. докл. АН Тадж. ССР.2005,26,712.
- Васильева В.Д., Найдович Л.П. // Фармация, 2002, 4, с. 33
- М.ТоmitaKugoТ. // PharmBull (Japan) 1956, 4 Р.121 С.А. 2007 51. Р


