Алкилирование 2-аминобензимидазола анилидами хлоруксусной кислоты
Автор: Озеров А.А., Новиков М.С.
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Рубрика: Обзорные статьи
Статья в выпуске: 2 (62), 2019 года.
Бесплатный доступ
Алкилирование 2-аминобензимидазола анилидами хлоруксусной кислоты в безводном ДМФА при температуре 20-100 °С в присутствии карбоната калия приводит к образованию N1-замещенных производных с выходом 4974 % и незначительных количеств симметричных N1,N3-дизамещенных аналогов
2-аминобензимидазол, хлорацетанилид, n-алкилирование
Короткий адрес: https://sciup.org/142224330
IDR: 142224330 | УДК: 547.781
Текст научной статьи Алкилирование 2-аминобензимидазола анилидами хлоруксусной кислоты
Замещенные производные бензимидазола демонстрируют уникально широкий спектр биологической активности и по праву относятся к классу так называемых «привилегированных молекул» [5].
Среди конденсированных азотсодержащих гетероциклических соединений, включающих тем или иным способом фрагмент бензимидазола в свою структуру, были выявлены соединения, обладающие выраженной антиоксидантной, антиагрегантной, ан-тиаритмической, спазмолитической, антисек-реторной активностью [1], гипогликемическим действием [6].
Синтез таких соединений, как правило, осуществляется путем N3-алкилирования 1-за-мещенных 2-аминобензимидазолов альфа-галогенпроизводными карбонильных соединений (например, альфа-галогенкетонами) с последующей циклизацией и формированием трициклической системы имидазо[1,2-a]бензимидазола [2, 3].
С целью расширения синтетических возможностей получения функционально замещенных производных имидазо[1,2-a]бензимидазола и его предшественников, нами была исследована реакция N-алкилирования 2-аминобензимида-зола различными хлорацетанилидами.
ЦЕЛЬ РАБОТЫ
Исследовать реакции N-алкилирования 2-аминобензимидазола хлорацетанилидом и его производными с целью получения новых фар- макологически активных соединений ряда бензимидазола.
МЕТОДИКА ИССЛЕДОВАНИЯ
Спектры ЯМР 1Н и 13С регистрировали на спектрометре «Bruker Avance 400» (400 МГц для 1H и 100 МГц для 13С) в ДМСО- d 6 , внутренний стандарт тетраметилсилан. Интерпретацию спектров осуществляли с помощью лицензионной программы ACD/HNMR Predictor Pro 3.0 (Advanced Chemistry Development, Канада). Спектры УФ регистрировали на спектрофотометре Shimadzu UVmini-1240 в 95%-м этиловом спирте. Температуры плавления измерены в стеклянных капиллярах на приборе Mel-Temp 3.0 (Laboratory Devices Inc., США).
Анилиды хлоруксусной кислоты (2a-c) были получены путем N-ацилирования триметил-силилпроизводных соответствующих анилинов хлорацетилхлоридом, как это было описано нами ранее [7].
1-(2-Фениламино-2-оксоэтил)-2-аминобен-зимидазол (3а) и 1,3-ди-(2-фениламино-2-оксоэтил)-1,3-дигидро-2Н-бензи-мидазол-2-имин (4а). Смесь 5,00 г (37,6 ммоль) 2-амино-бензимидазола (1), 6,50 г (38,3 ммоль) хлорацетанилида (2а) и 10,00 г (72,4 ммоль) безводного тонко измельченного карбоната калия перемешивают в 100 мл безводного ДМФА в течение 24 ч при комнатной температуре, затем в течение 2 ч при температуре 95–100 оС. Горячую реакционную массу фильтруют, фильтрат упаривают в вакууме, остаток охлаждают, растирают со 100 мл ледяной воды, образовавшийся осадок отфильтровывают, промывают водой и кипятят при интенсивном перемешивании в 500 мл 2%-го раствора хлористоводородной кислоты в течение 5 мин. Горячий раствор фильтруют, охлаждают и нейтрализуют гидроксидом аммония. Образовавшийся осадок отфильтровывают, промывают водой, сушат на воздухе, кристаллизуют из ДМФА и получают 7,38 г (3а) в виде светло-желтого кристаллического вещества, выход 74 %, Т. пл. 265–266 оС (разл.).
Спектр ЯМР 1Н, δ, м. д.: 4,85 с (2Н, СН 2 ); 6,48 с (2Н, NH 2 ); 6,84 т (1Н, 7,5 Гц, Н5); 6,94 т (1Н, 7,5 Гц, Н6); 7,00-7,10 м (2Н, Н7, фенил); 7,14 д (1Н, 7,5 Гц, Н4); 7,27–7,35 м (2Н, фенил); 7,56– 7,64 м (2Н, фенил) 10,37 с (1Н, NH).
Спектр ЯМР 13С, δ, м. д.: 45,09; 107,42;
114,70; 118,10; 119,06; 120,54; 123,48; 128,89; 134,85; 138,84; 142,87; 155,60; 165,60.
Не растворившийся в хлористоводородной кислоте осадок промывают водой, сушат на воздухе, кристаллизуют из ДМФА и получают 1,03 г ( 4а) в виде желтого кристаллического вещества, выход 14 %, Т. пл. 303,5–306,5 оС (разл.).
Спектр ЯМР 1Н, δ, м. д.: 5,29 с (4Н, СН 2 ); 7,02–7,11 м (2Н, фенил); 7,25–7,37 м (6Н, Н4, Н7, фенил); 7,55–7,64 м (2Н, Н5, Н6); 7,61–7,70 м (4Н, фенил); 9,41 с (1Н, = NH); 10,96 c (2H, NH).
Спектр ЯМР 13С, δ, м. д.: 45,88; 110,45; 119,09; 123,73; 123,81; 128,90; 130,06; 138,65; 151,37; 163,57.
Остальные соединения получают аналогично.
1-[2-(4-Метоксифениламино)-2-оксоэтил]-2-аминобензимидазол (3b) . Белое кристаллическое вещество, выход 59 %, Т. пл. 235–238 оС.
Спектр ЯМР 1Н, δ, м. д.: 3,70 с (3Н, СН 3 О); 4,81 с (2Н, СН 2 ); 6,58 с (2Н, NH 2 ); 6,82–6,92 м (3Н, Н5 , арил); 6,94 т (1Н, 7,5 Гц, Н6); 7,06 д (1Н, 7,6 Гц, Н7); 7,14 д (1Н, 7,6 Гц, Н4); 7,47–7,52 м (2Н, арил); 10,22 с (1Н, NH).
Спектр ЯМР 13С, δ, м. д.: 44,99; 55,16;
107,56; 113,96; 114,47; 118,30; 118,34; 120,60;
120,68; 131,94; 134,60; 155,33; 155,55; 164,97.
1,3-Ди[2-(4-метоксифениламино)-2-оксо-этил]-1,3-дигидро-2Н-бензимидазол-2-имин (4b). Светло-желтое кристаллическое вещество, выход 18 %, Т. пл. 298–300 оС (разл.).
Спектр ЯМР 1Н, δ, м. д.: 3,70 с (6Н, СН 3 О);
5,22 с (4Н, СН 2 ); 6,85–6,93 м (4Н, арил); 7,27– 7,35 м (2Н, Н4, Н7); 7,50–7,61 м (6Н, Н5, Н6, арил); 9,33 с (1Н, = NH); 10,74 c (2H, NH).
Спектр ЯМР 13С, δ, м. д.: 45,73; 55,19;
110,46; 113,99; 120,57; 123,79; 130,07; 131,77; 151,33; 155,48; 162,97.
1-[2-(4-Диметиламинофениламино)-2-оксо-этил]-2-аминобензимидазол (3с) . Светло-желтое кристаллическое вещество, выход 49 %, Т. пл. 268,5–270 оС (разл.).
Спектр ЯМР 1Н, δ, м. д.: 2,82 с (6Н, СН 3 ); 4,78 с (2Н, СН 2 ); 6,44 с (2Н, NH 2 ); 6,65–6,72 м (2Н, арил); 6,84 т (1Н, 7,5 Гц, Н5); 6,93 т (1Н, 7,5 Гц, Н6); 7,03 д (1Н, 7,6 Гц, Н7); 7,13 д (1Н, 7,6 Гц, Н4); 7,38– 7,44 м (2Н, арил); 10,06 с (1Н, NH).
Спектр ЯМР 13С, δ, м. д.: 40,47; 45,05; 107,40; 112,67; 114,69; 118,06; 120,50; 120,61; 128,57; 134,83; 142,89; 147,16; 155,60; 174,68.
1,3-Ди[2-(4-диметиламинофениламино)-2-оксоэтил]-1,3-дигидро-2Н-бензимидазол-2-имин (4с) . Желтое кристаллическое вещество, выход 16 %, Т. пл. 294–296 оС (разл.).
Спектр ЯМР 1Н, δ, м. д.: 2,84 с (12Н, СН 3 ); 4,63 с (4Н, СН 2 ); 6,65–6,72 м (4Н, арил); 6,87– 6,94 м (4Н, Н4, Н5, Н6, Н7); 7,38–7,44 м (4Н, арил); 9,97 с (1Н, =NH); 10,82 c (2H, NH).
Спектр ЯМР 13С, δ, м. д.: 40,41; 44,37; 106,36; 112,59; 120,00; 120,50; 128,54; 132,09; 147,09; 153,63; 165,02.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Алкилирование 2-аминобензимидазола (1) анилидами хлоруксусной кислоты (2а-с) легко протекает, как и в случае других азотсодержащих гетероциклов (пиримидина [4], хиназолина [8]), в среде безводного ДМФА в присутствии карбоната калия в интервале температур 20– 100 оС и с удовлетворительным выходом (49– 74 % после очистки) приводит к целевым продуктам N1-монозмещения (3а-с) . Несмотря на использование строго эквимолярных количеств субстрата (1) и алкилирующего агента (2а-с) наблюдается образование заметных количеств (14–18 %) побочных продуктов N1,N3-дизаме-щения (4а-с) , формирующих гетероциклическую систему 1,3-дигидро-2 Н -бензими-дазол-2-имина (схема).
Полученные продукты моно- (3а-с) и дизамещения (4а-с) существенное отличаются друг от друга по химическим и физико-химическим свойствам. Монозамещенные производные 2-аминобензимидазола (3а-с) сохраняют достаточно высокую основность, умеренно растворимы в водных растворах минеральных кислот, лучше растворимы в ДМФА и ледяной уксусной кислоте, что позволяет легко отделять их от ди-замещенных продуктов (4а-с) . Продукты дизамещения (4а-с) практически не растворимы в разбавленных минеральных кислотах и имеют температуру плавления, в среднем на 35–40 оС выше по сравнению с монозамещенными аналогами (3а-с) .
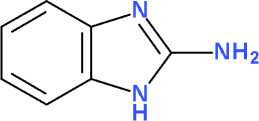
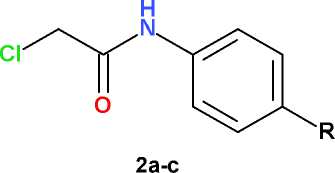
K2CO3
DMF
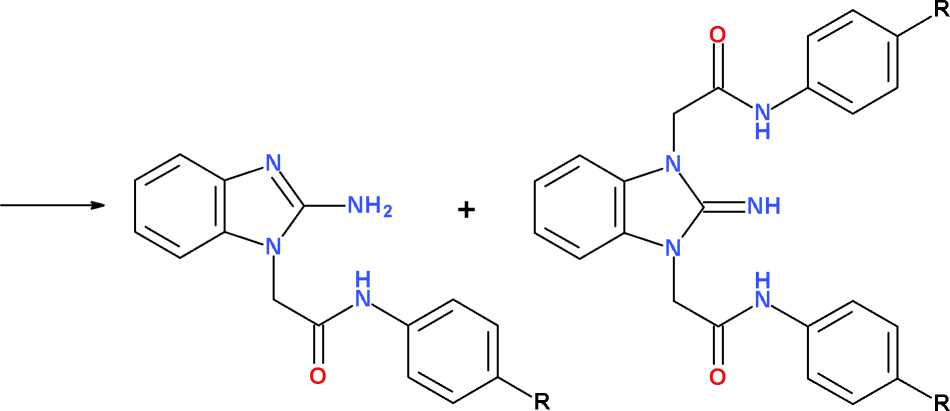
3a-c 4a-c
где: R = H (2-4a) , CH 3 O (2-4b) или (CH 3 ) 2 N (2-4c)
Схема. Алкилирование 2-аминобензимидазола анилидами хлоруксусной кислоты
Отличия в электронных и колебательных спектрах моно- и дизамещенных производных 2-аминобензимидазола крайне незначительные. В частности, в спектре УФ монозамещен-ного соединения ( 3с) наблюдаются два максимума поглощения при 207 и 280 нм с коротким плечом при 249 нм. В спектре дизамещенного соединения ( 4с) максимумы поглощения соответствуют длинам волн 203 и 280 нм, однако плечо отсутствует.
Наиболее информативными в плане подтверждения химического строения полученных веществ являются спектры ЯМР 1Н (в области 6,8–7,6 м. д., где проявляются сигналы ароматических протонов бензимидазольного фрагмента) и ЯМР 13С, хорошо отражающих симметричное строение дизамещенных продуктов (4а-с) .
Важно отметить, что ни в процессе синтеза, ни в процессе выделения, включающем кратковременное кипячение в хлористоводородной кислоте, монозамещенные продукты (3а-с) не давали продуктов дальнейшей циклизации, предположительно имеющих структуру 2-фениламинопроизводных имидазо[1,2-а]бенз-имидазола.
ЗАКЛЮЧЕНИЕ
Алкилирование 2-аминобензимидазола анилидами хлоруксусной кислоты в полярной среде в присутствии основания преимущественно протекает как N1-монозамещение и сопровождается образованием побочных симметричных N1, N3-дизамещенных продуктов.
Список литературы Алкилирование 2-аминобензимидазола анилидами хлоруксусной кислоты
- Анисимова В. А. [и др.] // Хим.-фарм. журн. - 2005. - Т. 39, № 9. - С. 26-32.
- Анисимова В. А. [и др.] // Хим.-фарм. журн. - 2010. - Т. 44, № 5. - С. 9-12.
- Анисимова В. А. [и др.] // Хим.-фарм. журн. - 2010. - Т. 44, № 7. - С. 7-13.
- Бабков Д. А. [и др.] // Acta Naturae. - 2015. - Т. 7, № 4. - С. 155-158.
- Спасов А. А. [и др.] // Хим.-фарм. журн. - 1999. - Т. 33, № 5. - С. 6-17.
- Спасов А. А. [и др.]. // Вестн. РАМН. - - 2013. - Т. 68, № 2. - С. 43-49.
- Тюренков И. Н. [и др.] // Хим.-фарм. журн. - 2013. - Т. 47, № 5. - С. 7-10.
- Тюренков И. Н. [и др.] // Хим.-фарм. журн. - 2015. - Т. 49, № 2. - С. 18-20.


