Алкилирование 6-метилурацила толуолсульфонатом 2- (2-нафтилокси) этанола
Автор: Луганченко А.И., Новиков М.С., Озеров А.А.
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Рубрика: Фармакология токсикология
Статья в выпуске: 2 (54), 2017 года.
Бесплатный доступ
1-[2-(2-Нафтилокси)этил]-6-метилурацил и 1,3-ди[2-(2-нафтилокси)этил]-6-метилурацил синтезированы с выходом 19 % и 54 % путем алкилирования калиевой соли 6-метилурацила п-толуолсульфонатом 2-(2-нафтилокси)этанола в растворе диметилсульфоксида.
6-метилурацил, толуолсульфонат, алкилирование
Короткий адрес: https://sciup.org/142149224
IDR: 142149224 | УДК: 547.854
Текст научной статьи Алкилирование 6-метилурацила толуолсульфонатом 2- (2-нафтилокси) этанола
Фармакологическая коррекция тревожнодепрессивных расстройств имеет неоспоримое значение для современной медицины [3], которая располагает большим количеством разнообразных препаратов для предупреждения и лечения нервно-психических заболеваний. В клинической практике чаще всего используют производные бензодиазепинов (диазепам, фе-назепам, лоразепам, медазепам, нитразепам и др.) [5], но большинство таких препаратов обладает неблагоприятными побочными эффектами, заключающимися в угнетении ЦНС: сонливость в дневное время, вялость, мышечная слабость, притупление эмоций, головная боль, головокружение, атаксия и др., возможно, нарушение когнитивных функций, а при длительном применении – привыкание и лекарственная зависимость [2].
В настоящее время активно ведется поиск новых препаратов с анксиолитической активностью и низким риском развития побочных эффектов среди производных пиримидина, пиразола [9–13].
Экспериментальные исследования, проведенные ранее на базе Волгоградского государственного медицинского университета, позволили выявить у производных бензимидазола различные виды активностей: противодиабети-ческую [10], антиагрегантную [4], антиоксидантную [7], противоэпилептическую [6], а также анксиолитическую [14, 15] наряду с низким риском проявления нежелательных эффектов. В связи с этим перспективным является исследование новых соединений с комбинированной структурой, содержащих диазепиновый и бен-зимидазольный фрагменты в рамках поиска и разработки потенциальных анксиолитиков.
ЦЕЛЬ РАБОТЫ
Изучение анксиолитической активности новых производных диазепинобензимидазола.
МЕТОДИКА ИССЛЕДОВАНИЯ
Эксперименты проводили на половозрелых мышах-самцах массой 18–23 г. Животные содержались в условиях вивария с естествен- ным световым режимом на стандартной диете лабораторных животных, без ограничения доступа к еде и воде (ГОСТ Р 50258-92) с соблюдением Международных рекомендаций по защите позвоночных животных, используемых при экспериментальных исследованиях (1997). Животных разделили на группы по 10 животных в каждой.
Изучаемые вещества внутрибрюшинно вводили за 30 минут до начала теста. Контрольным группам мышей вводили изотонический раствор хлорида натрия, животным группы препарата сравнения – диазепам (Реланиум, «Польфа», Польша) в дозе 2 мг/кг, а опытным группам вводили исследуемые вещества в эквимолярных препарату сравнения дозах.
Метод изучения анксиолитической активности в тесте «Приподнятый крестообразный лабиринт» (ПКЛ) был основан на естественном предпочтении грызунами темных нор, а также на страхе нахождения на открытых площадках и падения с высоты [1].
Животных помещали в приподнятый крестообразный лабиринт и в течение 3 минут регистрировали следующие показатели анксиолитической активности: латентное время выхода в открытый рукав (с), количество выходов в открытый рукав и суммарное время, проведенное в открытых рукавах лабиринта (с) [14, 15].
Статистическая обработка результатов исследования проводилась с использованием теста Вилкоксона, критерия Краскела-Уолиса с постобработкой тестом Данна.
Обсчет реализован в программе GraphPad Prism 5.0.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯИ ИХ ОБСУЖДЕНИЕ
В результате исследования было выявлено, что у животных, которым вводили соединение ДАБ-4, сохранялось чувство страха открытого пространства, поэтому латентное время выхода животных в открытый рукав ПКЛ (рис. 1) не отличается от значений контрольной группы.
В опытных группах, которым вводили соединения ДАБ-5, ДАБ-15 и ДАБ-16 снижался показатель латентного времени выхода в светлый рукав – в 2 раза относительно контрольной группы и не уступал показателю в группе диазепама, что свидетельствует о подавлении тревоги у животных.
Соединения ДАБ-7 и ДАБ-19 после введения животным приводили к достоверному снижению латентного времени выхода в светлый рукав в 5 раз относительно контроля, превосходя эффект диазепама.
Также было изучено общее количество выходов животных в светлый рукав ПКЛ.
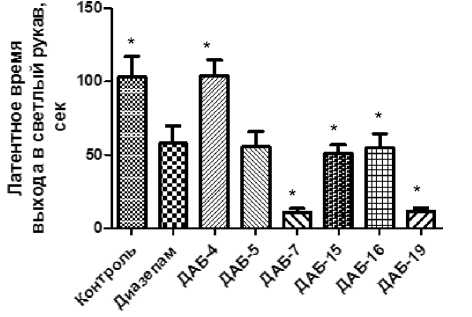
Рис. 1. Влияние диазепама, ДАБ-4, ДАБ-5, ДАБ-7, ДАБ-15, ДАБ-16 и ДАБ-19 на латентное время выхода мышей в открытый рукав в установке ПКЛ
Примечание: * – отличия статистически достоверны по отношению к группе контроля (р < 0,05, по критерию Краскела-Уолиса с посттестом Данна).
Данный параметр можно интерпретировать в как совокупный показатель двух видов активности – исследовательской (изучение нового пространства) и анксиолитической (отсутствие страха выхода из темного рукава). По полученным результатам (рис. 2) при введении соединений ДАБ-4, ДАБ-15 и ДАБ-16 количество выходов в открытый рукав не имело достоверных отличий от такового группы контроля. У животных, которым вводили соединения ДАБ-5, ДАБ-7 и ДАБ-19, достоверно в 2– 2,5 раза увеличивалось количество выходов в светлый рукав и исследуемые показатели не уступали группе препарата сравнения.
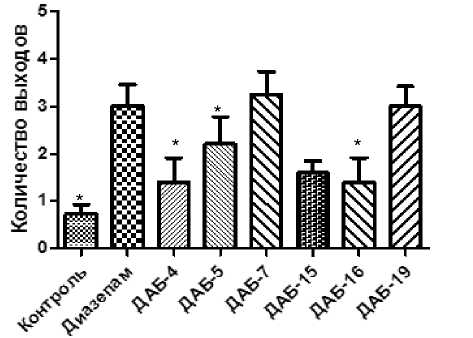
Рис. 2. Влияние диазепама, ДАБ-4, ДАБ-5, ДАБ-7, ДАБ-15, ДАБ-16 и ДАБ-19 на количество выходов в светлый рукав мышей в установке ПКЛ
Примечание: * – отличия статистически достоверны по отношению к группе контроля (р < 0,05, по критерию Краскела-Уолиса с посттестом Данна).
Одним из наиболее значимых критериев оценки при изучении анксиолитической актив- ности в установке ПКЛ является время нахождения животных в открытом рукаве, что указывает на наличие или отсутствие естественных фобий открытых и освещенных пространств у лабораторных животных [8].
Так, при введении животным соединений ДАБ-4, ДАБ-5, ДАБ-7, ДАБ-15 и ДАБ-16 показатель времени нахождения в открытом рукаве достоверно не отличался от показателей контрольных животных (рис. 3). При введении ДАБ-7 и ДАБ-19 проявление тревожности у животных снижалось. Так, время нахождения в открытом рукаве достоверно увеличивалось в 2,5 раза относительно контрольной группы, не уступая показателям группы препарата сравнения – диазепама в дозе 2 мг/кг.
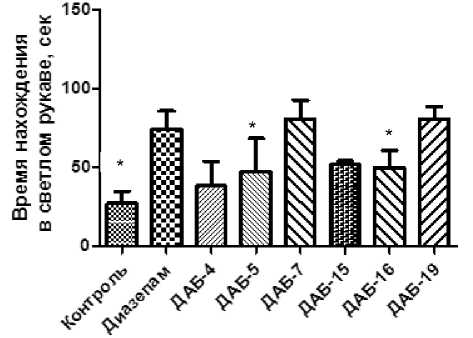
Рис. 3. Влияние диазепама, ДАБ-4, ДАБ-5, ДАБ-7, ДАБ-15, ДАБ-16 и ДАБ-19 на время нахождения мышей в светлом рукаве в установке ПКЛ
Примечание: * – отличия статистически достоверны по отношению к группе контроля (р < 0,05, по критерию Краскела-Уолиса с посттестом Данна).
Изученные производные диазепинобензи-мидазола можно разделить по анксиолитической активности на группы: неактивные, низкоактивные и высокоактивные. Для соединения ДАБ-4 анксиолитической активности не выявлено. Соединения ДАБ-5, ДАБ-15 и ДАБ-16 можно отнести к веществам, проявляющим среднюю по выраженности анксиолитическую активность, так как они снижают латентное время выхода в светлый рукав, увеличивают количество выходов, но не влияют на время нахождения в открытом рукаве. Наиболее значимые эффекты отмечались в группах животных, которым вводили соединения ДАБ-7 и ДАБ-19, достоверно снижающие ощущения страха и тревоги. Так, вещества значительно снижали латентное время выхода в открытый рукав, количество выходов и время пребывания в нём, не уступая по уровню проявления проти- вотревожного действия препарату сравнения диазепаму.
ЗАКЛЮЧЕНИЕ
Таким образом, среди новых производных диазепинобензимидазола обнаружены соединения, проявляющие анксиолитичские свойства. Для изученных соединений выявлен различный уровень антифобического действия. Наиболее активными являются соединения ДАБ-7 и ДАБ-19, которые не уступают эффектам диазепама.
Список литературы Алкилирование 6-метилурацила толуолсульфонатом 2- (2-нафтилокси) этанола
- Новиков М. С., Озеров А. А.//Хим. гетероциклич. соед. -2005. -№ 7. -С. 1071-1075.
- Martinez-Botella G., Loch J. T., Green O. M. //Bioorg. Med. Chem. Lett. -2013. -Vol. 23. -P. 169-173.
- Novikov M. S., Ozerov A. A, Brel A. K. //Chem. Heterocyclic Comp. -1996. -Vol. 32, № 3. -P. 328-332.
- Ogilvie K. K., Hamilton R. G., Gillen M. F. //Can. J. Chem. -1984. -Vol. 62. -P. 16-21.
- Ozerov A., Novikov M., Khandazhinskaya A., //Heterocycles. -2017. -Vol. 94, № 5. -P. 912-922.
- Talamas F. X., Abbot S. C, Anand S. //J. Med. Chem. -2014. -Vol. 57. -P. 1914-1931.
- Wu F., Buhendwa M. G., Weaver D. F.//J. Org. Chem. -2004. -Vol. 69. -P. 9307-9309.


