Алкилирование фенола ноненом-1 с позиций промышленных реалий
Автор: Чернышов Д.А., Нестерова Т.Н.
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Технологии добычи и переработки нефти и газа
Статья в выпуске: 4-4 т.13, 2011 года.
Бесплатный доступ
Промышленный опыт эксплуатации процесса алкилирования фенола олигомерами этилена показал сложную зависимость активности катализатора от условий процесса при отклонении их от идеальных условий. Повышение количества воды в реакционной смеси резко снижает константы скорости реакции, прямых и параллельных. В работе представлены данные по алкилированию фенола ноненом-1 на макропористом сульфокатионите Amberlist 36 Dry. Проведен анализ зависимости констант скоростей реакций от содержания воды в системе.
Алкилирование, фенол, нонен-1, о-нонилфенол, п-нонилфенол, катализатор
Короткий адрес: https://sciup.org/148200273
IDR: 148200273 | УДК: [66.046:661]
Текст научной статьи Алкилирование фенола ноненом-1 с позиций промышленных реалий
Алкилированием фенола олигомерами этилена получают синтетические алкилфенолы [ 1 , 2 ]. Они используются для получения фенолформальдегидных смол, присадок к маслам и топливам (алкилсалицилатные, сульфонатные, фенатные, аминные и др. присадки), стабилизаторов натуральных и синтетических каучуков [ 3 ], поверхностно-активных веществ и жидких кристаллов. Алкилфенолы получают преимущественно алкилированием фенола олефинами различной молекулярной массы и структуры. Алкилфенолы можно синтезировать на основе фенола и спиртов [ 4 , 5 ] или ал-килгалогенидов, однако эти процессы не получили широкого распространения из-за низкой рентабельности и ограниченности сырьевых ресурсов по алкилирующим агентам.
В настоящее время на Новокуйбышевском заводе масел и присадок работает единственный в мире комплекс по производству алкилсалицилатных присадок. Комплекс состоит из трех установок АСП-1, АСП-2 и АСП-3. Основным технологическим процессом установки АСП-1 является алкилирование фенола олигомерами этилена (С 16 -С 18 ) линейной структуры. Алкилирование проводят в реакторе вытеснения, в качестве катализатора используется ионообменная смола. Очищенный алкилфенол является полупродуктом для получения алкилсалицилатных присадок к
смазочным маслам и топливам. Основные присадки получаемые на установке АСП-3 из продуктов алкилирования фенола олигомерами этилена - «Детерсол-300», «Детерсол-140», «Детерсол-50», «Комплексал-250», «Комплек-сал-150», «Комплексал-7321 А», «Комплексал-7311», «Комплексал-130» и др. Замещение водорода в ароматическом ядре относится к реакциям электрофильного замещения. В качестве катализаторов используются сильные кислоты. Различают гомогенно и гетерогенно катализируемые реакции.
Гомогенный катализ реакций алкилирования фенолов олефинами. Серная кислота – это первый катализатор алкилирования фенолов. Она является более активной среди других доступных и дешевых кислот и широко используется в производстве. В настоящее время использование серной кислоты ограничивается с появлением новых типов катализаторов и трудоемкостью отделения ее от продуктов алкилирования. К недостаткам серной кислоты также стоит отнести катализ побочных реакций, таких как деструкция, полимеризация олефинов, сульфирование и сульфатирование фенола. Образующиеся побочные продукты снижают общий выход алкилфенолов [ 6 ].
К катализаторам гомогенного типа также относятся феноляты щелочных металлов [ 7 ], трифторид бора [ 8 ], сульфокислоты [ 5 ], ионные жидкости [ 9 ]. Все вышеперечисленные катализаторы имеют те или иные недостатки: высокая коррозионная активность, трудность утилизации отходов, большое количество сточных вод и побочных продуктов, стоимость и количество необходимого катализатора, высокая токсичность, а также в некоторых случаях низкая термостабильность катализатора.
Гетерогенный катализ алкилирования фенола олефинами. Одним из первых катализаторов гетерогенного типа был оксид алюминия, реакцию проводили при высоких температурах и давлениях. Также алкилирование проводят на алюмосиликатах, цеолитах [ 10 ], оксидах различных металлов [ 11 - 13 ]. В конце 60-х годов началось интенсивное изучение процессов алкилирования фенола в присутствии сульфокатионитов [ 14 , 15 ]. Наиболее полно особенности таких превращений изложены в работе [ 15 ]. Были разработаны технологии процесса, как в стационарном, так и во взвешенном слое катализатора. В конце 70-х годов появились разработки процесса алкилирования на более активных макропористых сульфокатионитах [ 16 , 17 ]. Активность катионитов повышают также за счет нанесения их на носители, либо за счет модификации и изменения состава самого сульфокатионита.
Установлен гомогенный характер катализа процесса алкилирования на катионите. Реагенты, в первую очередь фенол, в процессе диффузии к активным сульфогруппам, располагаются в основном внутри гранул катионита и взаимодействуют с его макромолекулой, образуя сольватные комплексы и водородные связи с ароматическими ядрами углеводородного каркаса. Это вызывает набухание и разрыхление структуры полимерного вещества катализатора. В набухшем катионите цепи сетчатого полимера раздвигаются, и он становится проницаемым для молекул большого размера. Катиониты, таким образом, дают возможность осуществлять процессы взаимодействия широкого спектра олефинов и фенолов по единой проточной схеме, в относительно узком диапазоне условий. Преимущества применения катионообменных смол для алкилирования фенолов олефинами по сравнению с применением других катализаторов [ 18 ]:
-
• более высокий выход моноалкилированных фенолов;
-
• отсутствуют процессы полимеризации и деполимеризации;
-
• большой срок службы и легкая регенерация;
-
• отделение алкилата от катализатора фильтрованием;
-
• отсутствие сточных вод без необходимости промывки алкилата.
В реальных условиях производства при алкилировании на ионообменных смолах (сульфокатионитах) периодически возникают проблемы с качеством алкилфенолов. Условия алкилирования фенола на действующей установке далеки от идеальных, и по этой причине практически невозможно обеспечить стабильность в показателях процесса – конверсии, селективности и выходе продуктов алкилирования. На установку АСП-1 фенол поступает с регламентированным содержанием воды (0,03-0,1%), однако при длительной работе установки происходит ее накопление. Вода снижает активность катализатора и способствует его десульфированию. Повышенное содержание воды в сырьевой смеси влечет за собой:
-
- образование большого количества алкилфениловых эфиров;
-
- необходимость повышения температуры алкилирования для обеспечения качества продуктов необходимого уровня;
-
- увеличение энергопотребления из-за необходимости введения сырьевой смеси в реактор алкилирования при более высокой температуре;
-
- снижение объемных скоростей в реакторе алкилирования вследствие необходимости увеличения времени контакта.
Несмотря на то, что общетеоретические вопросы алкилирования фенола олефинами на данный момент решены, фактический материал по исследованию процессов на современных катализаторах отсутствует. Это не позволяет аргументировано подходить к регламентации условий промышленного процесса. На данном этапе развития производства острейшей проблемой является решение вопроса регламентации одного из параметров процесса – предельной допустимой концентрации воды в реакционной массе и рециркулирующих потоках.
Цель работы: изучение влияния влаги на процесс путем исследования кинетики алкилирования фенола на используемом на производстве катализаторе – сульфокатионите Amberlist 36 Dry. В качестве модельного процесса избрано алкилирование фенола 1-ноненом.
Экспериментальная часть. Алкилирование проводили в реакторе идеального смешения. Реактор представляет собой сосуд с рубашкой. В рубашке реактора находится теплоноситель, кипением которого в реакторе поддерживается постоянная температура. Пары теплоносителя конденсируются в обратном холодильнике. Алкилирование фенола осуществляли 1-ноненом. В реактор алкилирования загружали фенол, далее засыпали расчетное количество катализатора Amberlist 36 Dry. Вода вводилась в реактор алкилирования в количестве 0,5%, 1%, 2%, 3% от общей массы смеси фенола и олигомеров. Масса катализатора составляла 15±1% от массы смеси фе-нол+катализатор. Катализатор Amberlist 36 Dry вводился в реактор в обезвоженном состоянии. Производитель поставляет катализатор в обезвоженном состоянии с содержанием влаги не более 1%. Для повышения качества эксперимента катализатор дополнительно осушили, промыв его бензолом и высушив в сушильном шкафу до постоянной массы. Качество фенола и нонена-1 проверялось с помощью ГЖХ хроматографа «Кристалл 2000 М» с капиллярной колонкой SE-30 длиной 50 метров. Чистота фенола составила 99,7%, нонена-1 – 99,5%.
Введенную в реактор смесь нагревали до температуры кипения теплоносителя. После начала кипения теплоносителя ее перемешивали в течение одного часа для подготовки и набухания катализатора. Далее единовременно вводили нонен-1 в реакционную смесь в мольном отношении 6:1 (фенол: олигомеры), которое является оптимальным для получения алкилфенола требуемого уровня качества. Отбор проб осуществляли с определенной периодичностью: 0, 2, 5, 10, 15, 30, 45, 60, 90, 120, 180, 240, 300 и 360 мин. Отобранные пробы анализировали методом ГЖХ.
Таблица 1. Загрузка для опыта № 1
|
Компоненты |
Масса, г |
% масс. к Е реагентов |
Моль/к г катализатора |
|
фенол |
16,0553 |
59,93 |
|
|
1-Нонен |
3,6384 |
10,12 |
|
|
Σ |
19,6937 |
||
|
Amberlist 36 Dry |
2,8468 |
14,46 |
|
|
вода |
0,6075 |
3,08 |
Обсуждение результатов. Для изучения влияния влаги на процесс избрана температура введения реагентов в промышленный реактор алкилирования равная 353 К. Структура полученных экспериментальных данных иллюстрируется на примере опыта №1. В таблице 1 представлены данные по массовым загрузкам реактора при алкилировании фенола 1-ноненом на катализаторе Amberlist 36 Dry при 353,2 К в присутствии 3,08% масс. воды.
В таблице 2 даны полученные составы реакционных масс, анализ которых приведен ниже, а результаты анализа использованы при формировании кинетической модели процесса. Из рис. 1 следует, что в условиях опыта №1 соотношения концентраций нонилфениловых эфиров (НФЭ), орто -нонилфенолов (НФ) и пара -НФ остаются практически неизменными на протяжении 6 часов алкилирования при степени конверсии ноненов, достигающей 68%. Изменения касаются только начального периода. То есть, по крайней мере, лимитирующие реакции в каждой из изомерных групп (НФЭ, о-НФ и п-НФ) относятся к параллельным превращениям. В нашем конкретном случае это, с большой вероятностью, сопряженные реакции алкилирования фенола ноненом. Рис. 2 не опровергает это предположение. В тоже время вид зависимостей для изомеров положения в алифатической цепи иной, как для НФЭ (рис. 3), так и для о -НФ (рис. 4) или для п -НФ. В образовании их явно участвуют последовательные превращения.
Исходя из приведенных сведений, при обработке экспериментальных данных, полученных в опыте №1, принята схема превращений, приведенная в табл. 3. Там же даны значения констант скоростей протекающих реакций, которые вычислены интегральным и дифференциальным методами, изложенными в [19]. Аналогичные сведения получены для всех условий, варьируемых в исследовании.
Таблица 2. Состав реакционной массы в опыте № 1, осуществленном при 353,2 К
|
Вре мя, мин |
Моль/кг катализатора |
||||||
|
нонены |
фенол |
5-НФЭ |
4-НФЭ |
3-НФЭ |
2-НФЭ |
5- о -НФ |
|
|
0 |
10,12 |
59,93 |
0,00 |
0,00 |
0,00 |
0,02 |
0,00 |
|
2 |
10,10 |
59,90 |
0,00 |
0,00 |
0,01 |
0,08 |
0,00 |
|
5 |
10,00 |
59,81 |
0,00 |
0,00 |
0,02 |
0,17 |
0,00 |
|
10 |
9,82 |
59,62 |
0,00 |
0,01 |
0,04 |
0,27 |
0,00 |
|
15 |
9,63 |
59,43 |
0,00 |
0,01 |
0,08 |
0,54 |
0,00 |
|
30 |
9,11 |
58,92 |
0,00 |
0,02 |
0,14 |
0,78 |
0,00 |
|
45 |
8,61 |
58,42 |
0,01 |
0,03 |
0,20 |
1,02 |
0,00 |
|
60 |
8,10 |
57,91 |
0,01 |
0,06 |
0,33 |
1,42 |
0,00 |
|
90 |
7,20 |
57,02 |
0,02 |
0,09 |
0,46 |
1,72 |
0,01 |
|
120 |
6,44 |
56,26 |
0,04 |
0,16 |
0,68 |
2,11 |
0,01 |
|
180 |
5,29 |
55,12 |
0,07 |
0,25 |
0,90 |
2,41 |
0,02 |
|
240 |
4,25 |
54,12 |
0,09 |
0,30 |
1,00 |
2,52 |
0,03 |
|
300 |
3,76 |
53,60 |
0,12 |
0,36 |
1,08 |
2,59 |
0,04 |
|
360 |
3,29 |
53,13 |
0,00 |
0,00 |
0,00 |
0,02 |
0,00 |
|
4- о -НФ |
3- о -НФ |
5- п -НФ |
4- п -НФ |
2- о -НФ |
3- п -НФ |
2- п -НФ |
Ди-НФ |
|
|
0 |
0,00 |
0,00 |
0,00 |
0,00 |
0,00 |
0,00 |
0,00 |
0,00 |
|
2 |
0,00 |
0,00 |
0,00 |
0,00 |
0,03 |
0,00 |
0,00 |
0,00 |
|
5 |
0,00 |
0,01 |
0,00 |
0,00 |
0,07 |
0,00 |
0,03 |
0,00 |
|
10 |
0,00 |
0,01 |
0,00 |
0,00 |
0,11 |
0,01 |
0,05 |
0,00 |
|
15 |
0,00 |
0,04 |
0,00 |
0,00 |
0,23 |
0,02 |
0,09 |
0,00 |
|
30 |
0,01 |
0,05 |
0,00 |
0.00 |
0,34 |
0,03 |
0,13 |
0,00 |
|
45 |
0,01 |
0,07 |
0,00 |
0,01 |
0,45 |
0,05 |
0,18 |
0,00 |
|
60 |
0,02 |
0,11 |
0,00 |
0,01 |
0,61 |
0,07 |
0,25 |
0,01 |
|
90 |
0,03 |
0,15 |
0,01 |
0,02 |
0,76 |
0,10 |
0,29 |
0,02 |
|
120 |
0,05 |
0,22 |
0,01 |
0,03 |
0,92 |
0,14 |
0,39 |
0,03 |
|
180 |
0,08 |
0,30 |
0,02 |
0,05 |
1,06 |
0,18 |
0,41 |
0,06 |
|
240 |
0,10 |
0,33 |
0,03 |
0,06 |
1,14 |
0,23 |
0,48 |
0,03 |
|
300 |
0,12 |
0,39 |
0,03 |
0,08 |
1,20 |
0,24 |
0,51 |
0,04 |
|
360 |
0,00 |
0,00 |
0,00 |
0,00 |
0,00 |
0,00 |
0,00 |
0,00 |
Таблица 3. Константы скорости превращений в опыте №1
|
Реакция |
k i |
Размерность ki |
Метод обработки кинетических данных |
|
|
интегральный |
диффе-ренциаль-ный |
|||
|
фенол+нонен ^ 2-НФЭ |
k 1 |
кг(кат) /(моль∙мин) |
3,03E-05± 1,4E-06 |
3,37E-05 |
|
фенол+нонен ^ 3-НФЭ |
k 2 |
кг(кат) /(моль∙мин) |
4,37E-06 |
4,31E-06 |
|
фенол+нонен ^ 4-НФЭ |
k 3 |
кг(кат) /(моль∙мин) |
5,72E-09 |
|
|
фенол+нонен ^ 5-НФЭ |
k 4 |
кг(кат) /(моль∙мин) |
3,81E-10 |
|
|
фенол+нонен ^ орто -2-НФ |
k 5 |
кг(кат) /(моль∙мин) |
1,20E-05 |
1,48E-05 |
|
фенол+нонен ^ орто -3-НФ |
k 6 |
кг(кат) /(моль∙мин) |
2,08E-06 |
1,87E-06 |
|
Реакция |
k i |
Размерность ki |
Метод обработки кинетических данных |
|
|
интегральный |
диффе-ренциаль-ный |
|||
|
фенол+нонен ^ орто -4-НФ |
k7 |
кг(кат) /(моль∙мин) |
2,82E-07 |
3,38E-08 |
|
фенол+нонен ^ орто -5-НФ |
k 8 |
кг(кат) /(моль∙мин) |
2,25E-09 |
|
|
фенол+нонен ^ пара -2-НФ |
k9 |
кг(кат) /(моль∙мин) |
4,09E-06 |
5,89E-06 |
|
фенол+нонен ^ пара -3-НФ |
k 10 |
кг(кат) /(моль∙мин) |
1,22E-06 |
1,49E-06 |
|
фенол+нонен ^ пара -4-НФ |
k 11 |
кг(кат) /(моль∙мин) |
3,22E-07 |
5,36E-08 |
|
фенол+нонен ^ пара -5-НФ |
k 12 |
кг(кат) /(моль∙мин) |
2,99E-08 |
4,72E-08 |
|
2-НФЭ ^ 3-НФЭ |
k 21 |
-1 мин |
2,58E-03 |
|
|
3-НФЭ ^ 4-НФЭ |
k 22 |
-1 мин |
5,96E-03 |
|
|
4-НФЭ ^ 5-НФЭ |
k 23 |
-1 мин |
5,94E-03 |
|
|
орто -2-НФ -> орто -3-НФ |
k 24 |
-1 мин |
2,78E-03 |
|
|
орто -3-НФ -> орто -4-НФ |
k 25 |
-1 мин |
6,60E-03 |
|
|
орто -4-НФ -> орто -5-НФ |
k 26 |
-1 мин |
1,06E-02 |
|
|
пара -2-НФ -> пара -3-НФ |
k 27 |
-1 мин |
9,79E-04 |
|
|
пара -3-НФ -> пара -4-НФ |
k 28 |
-1 мин |
1,22E-03 |
|
|
пара -4-НФ -> пара -5-НФ |
k 29 |
-1 мин |
5,24E-03 |
|
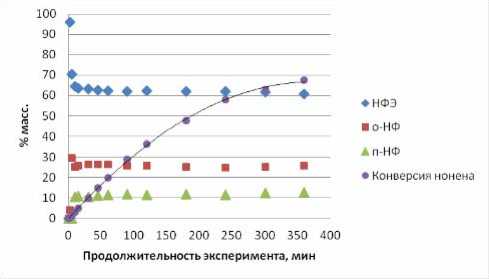
Рис. 1. Концентрация НФЭ и НФ на сумму продуктов реакции при изменении степени конверсии ноненов в опыте №1
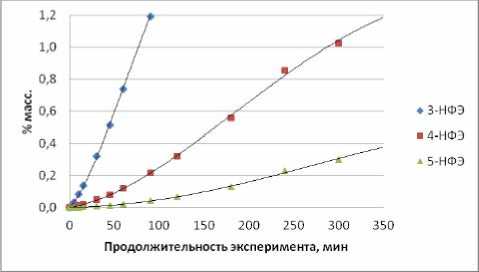
Рис. 3. Вид кинетических кривых накопления нонилфениловых эфиров в опыте №1
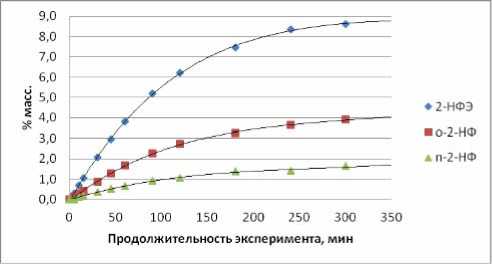
Рис. 2. Вид кинетических кривых накопления 2-НФЭ, о -2-НФ и п -2-НФ в опыте №1
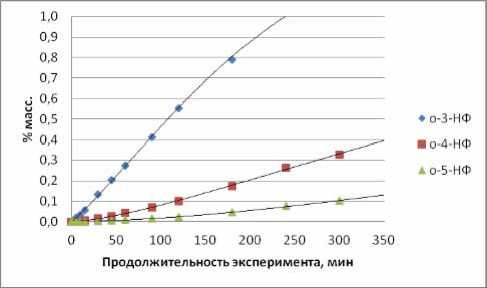
Рис. 4. Вид кинетических кривых накопления орто -нонилфенолов в опыте № 1
Результаты, полученные при 353,2 К и содержании воды в реакционной массе в количестве 3,08, 2,03, 1,00, 0,49, 0,00% масс., обработаны совместно для каждой из индивидуальных реакций и для суммарных превращений различных типов. На рис. 5 представлены сведения по суммарным константам скорости реакций алкилирования фенола ноненом-1 в нонилфениловые эфиры+нонилфенолы, откуда следует важный вывод - увеличение количества воды в реакционной массе от 0 до 2% снижает суммарную константу скорости на три порядка. Константы скорости прямого алкилирования фенола в нонилфениловые эфиры снижаются при этом на два порядка, т.е. увеличение содержания воды в реакционной массе до 3% масс. практически приостанавливает алкилирование не только в ароматическое ядро, но и по гидрокси-группе фенола. А это уже реалии действующего производства.
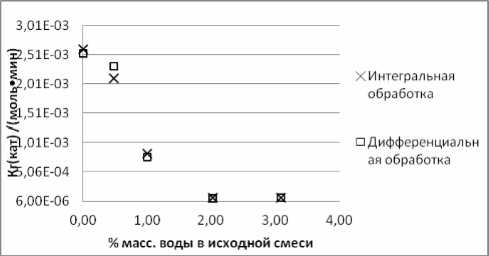
Рис. 5. Зависимость суммарной константы скорости алкилирования фенола 1-ноненом в НФЭ+НФ от содержания влаги в сырье
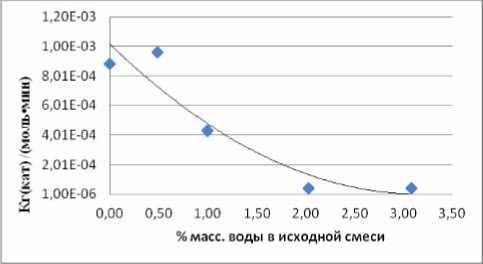
Рис. 6. Зависимость константы скорости алкилирования фенола 1-ноненом в НФЭ от содержания влаги в сырье
Важен также результат, относящийся к изомеризации НФЭ в нонилфенолы. Содержание алкилфениловых эфиров в целевом алкилфеноле строго регламентировано и не должно превышать 5,5%. Информация, приведенная на рис. 7, свидетельствует о том, что увеличение содержания воды до 2% масс. снижает константу скорости изомеризации практически на три порядка.
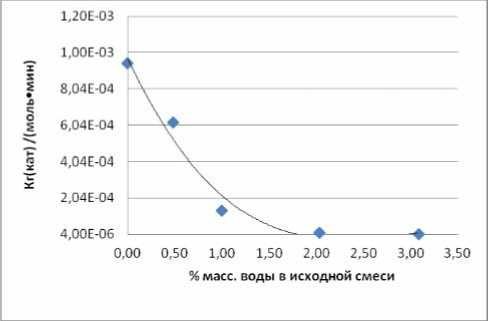
Рис. 7. Зависимость константы скорости изомеризации НФЭ в НФ от содержания влаги в сырье
Выводы: на основе кинетических исследований установлено, что увеличение содержания воды в реакционной массе от 0 до 2% масс. 9 существенно снижает эффективность процесса . алкилирования фенола линейными алкенами. При алкилировании фенола 1-ноненом на катализаторе Amberlist 36 Dry при 353,2 К константы скорости алкилирования и изомеризации эфиров 10.
в алкилфенолы снижаются на три порядка.
Список литературы Алкилирование фенола ноненом-1 с позиций промышленных реалий
- Wagholikar, S. Liquid phase alkylation of phenol with 1-octene over large pore zeolites/S. Wagholikar, S. Mayadevi, S. Sivasanker//Applied Catalysis A: General. 2006. 309. Р. 106-114.
- Sarish, S. Liquid-phase alkylation of phenol with long-chain olefins over WOx/ZrO2 solid acid catalysts/S. Sarish, B.M. Devassy, W. Bohringer et al.//Journal of Molecular Catalysis A: Chemical. 2005. 240. P. 123-131.
- Крушевский, Г.А. Влияние малых добавок п-трет-бутилфенольных и алкилфеноламинной смол на термические свойства полиэфиров на основе терефталевой кислоты/Г.А. Крушевский, Ю.М. Евтушенко, В.В. Иванов//Химическая технология. 2006. № 4. С. 16-20.
- Choi, W.Ch. Balancing acidity and basicity for highly selective and stable modified MgO catalysts in the alkylation of phenol with methanol/W.Ch.Choi, J.S. Kimb, T.H. Lee, S.I. Woo//Catalysis Today. 2000. 63. P. 229-236.
- Elavarasan, P. Kinetics of phenol alkylation with tert-butyl alcohol using sulfonic acid functional ionic liquid catalysts/P. Elavarasan, K. Kondamudi, S. Upadhya-yula//Chemical Engineering Journal. 2011. 166. P. 340-347.
- Харлампович, Г.Д. Фенолы/Г.Д. Харлампович, Ю.В. Чуркин. -М.: Химия, 1974. 220 с.
- Голубченко, И.Т. Селективное орто-алкилирование фенола олефинами. -Киев: Наукова думка, 1983. 103 с.
- Wilson, K. Comparative study of phenol alkylation mechanisms using homogeneous and silica-supported boron trifluoride catalysts/K. Wilson, D.J. Adams, G. Rothenberg, J.H. Clark//Journal of Molecular Catalysis A: Chemical. 2000. 159. P. 309-314.
- DeCastro, C. Immobilised ionic liquids as Lewis acid catalysts for the alkylation of aromatic compounds with dodecene/C. DeCastro, E. Sauvage, M. H. Valkenberg, W.F. Holderich//Journal of Catalysis. 2000. 196. P. 86-94.
- Modrogan, E. Phenol alkylation with isobutene -influence of heterogeneous Lewis and/or Brensted acid sites/E. Modrogan, M.H. Valkenberg, W.F. Hoelderich//Journal of Catalysis. 2009. 261. P. 177-187.
- Choi, W.Ch. Balancing acidity and basicity for highly selective and stable modified MgO catalysts in the alkylation of phenol with methanol/W.Ch. Choi, J.S. Kimb, T.H. Lee, S.I. Woo//Catalysis Today. 2000. 63. P. 229-236.
- Sarish, S. Liquid-phase alkylation of phenol with long-chain olefins over WOx/ZrO2 solid acid catalysts/S. Sarish, B.M. Devassy, W. Bohringer et al.//Journal of Molecular Catalysis A: Chemical. 2005. 240. P. 123-131.
- Klimkiewicz, R. Sn-Ce-Rh-O monophase system as a new type of ortho-selective catalyst for phenol alkylation/R. Klimkiewicz, H. Grabowska, H. Teterycz//Applied Catalysis A: General. 2003. 246. P. 125-136.
- Sukhoverkhov, V.D. Catalytic activity of sulpho-cation-exchange resins in alkylation of phenol/V.D. Sukhoverkhov, L.V. Sukhoverkhova, Yu.T. Gordash et al.//Petroleum Chemistry U.S.S.R. 1978. V. 18, N 4. P. 219-222.
- Полянский, Н.Г. Катализ ионитами. -М.: Химия, 1973. 216 с.
- Frisch, N.W. Catalysis kinetics of macro-reticular ion exchange resins//Chemical Engineering Science. 1962. V. 17, N. 10, October. P. 735-749.
- Chauvin, Y. Polymer supported catalysts/Y. Chauvin, D. Commereuc, F. Dawans//Progress in Polymer Science. 1977. V. 5, N 3-4. P. 95-226.
- Исагулянц, В.И. Химия нефти/В.И. Исагулянц, Г.М. Егорова. -М.: Химия, 1965. 50 с.
- Лебедев, Н.Н. Теория химических процессов основного органического и нефтехимического синтеза/Н.Н. Лебедев, М.Н. Манаков, В.Ф. Швец. -М.: Химия, 1984. 376 с.


