Алкилирование изобутана бутиленом в равновесных условиях
Автор: Шураев М.В., Крымкин Н.Ю., Шакун В.А.
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Технологии добычи и переработки нефти и газа
Статья в выпуске: 4-4 т.13, 2011 года.
Бесплатный доступ
Рассмотрена равновесная смесь октана и его изомеров. Сделаны выводы об алкилировании изобутана бутиленом в равновесных условиях. Проведены расчеты термодинамических параметров смеси октана и его изомеров. Поставлен эксперимент изомеризации изооктана. Даны рекомендации по условиям ведения процесса.
Алкилирование, октановое число, изооктан, равновесие
Короткий адрес: https://sciup.org/148200274
IDR: 148200274 | УДК: [66.046:661]
Текст научной статьи Алкилирование изобутана бутиленом в равновесных условиях
Возможность каталитического алкилирования изоалканов алкенами была впервые установлена русским ученым В.П. Ипатьевым в 1932 г. В качестве катализатора был использован безводный хлорид алюминия, промотированный хлороводородом. В 1938 г. появились сообщения Бирча с сотр., в которых была показана высокая эффективность использования концентрированной серной кислоты в качестве катализатора алкилирования изобутана олефинами С3-С4. Почти одновременно с этим способность к проведению алкилирования была обнаружена и у жидкого фтористого водорода. Начиная с этого времени и до наших дней процесс алкилирования привлекает пристальное внимание многих исследователей, побуждаемое как огромным практическим интересом, так и фундаментальным характером этого одного из самых сложных химических процесссов. Продукт алкилирования алкилат является высокооктановым (исследовательское октановое число обычно составляет не менее 9094), малосернистым, не содержащим ароматических углеводородов и алкенов, компонентом для получения высококачественных бензинов. Современные изменения в мировых спецификациях на моторные топлива увеличивают значение алкилата в качестве компонента компаундированных бензинов.
Необходимость снижения содержания общей ароматики, бензола, алкенов, серы, давления насыщенных паров, а также ограничение температуры конца кипения требует существенного увеличения объемов производства и качества алкилата. Совершенствование технологий алкилирования также становится все более актуальным в связи с ожидаемым отказом от использования метил-трет-бутилового эфира в качестве октаноповышающей добавки. При этом алкилат становится лучшим
решением улучшения качества бензинов без применения кислородсодержащих соединений.
Современное промышленное алкилирование принципиально не отличается от процессов, разработанных в начале 40-х годов XX века и основанных на использовании жидких серной и фтористоводородной кислот. Основными недостатками этих катализаторов являются:
-
1) высокий удельный расход;
-
2) токсичность;
-
3) коррозионная активность;
-
4) необходимость разделения катализаторно-про-дуктовой смеси с последующей утилизацией отработанных кислот;
-
5) олефиновые углеводороды хорошо и быстро растворяются в кислой фазе, что способствует протеканию побочных реакций;
-
6) плохая растворимость парафинов в кислотах требует высокой степени диспергирования реакционной массы с целью создания максимально большей границы раздела кислотной и углеводородной.
Несмотря на постоянное совершенствование процессов жидкокислотного алкилирования использующие их промышленные предприятия с большим трудом пытаются поддерживать эффективность и безопасность работы Действующих установок. Сегодня надежды на прогресс индустриального алкилирования прежде всего связываются с переходом от использования жидких кислот к применению твердых катализаторов, которые позволят избежать выше-пере-численных проблем и получить технологические и экономические преимущества. Активная разработка твердокислотных катализаторов алкилирования началась в конце 1960-х – начале 1970-х годов. За истекшие 30-35 лет в качестве катализаторов жидкофазного алкилирования изобутана легкими алкенами были рассмотрены самые различные твердые системы: цеолиты, гетероге-низированные жидкие кислоты, алюмохлорид-ные комплексы, ионнообменные смолы, гетерополикислоты, хлорированные и сульфатированные оксиды металлов и др. Главной сложностью на пути широкого промышленного использования подобных катализаторов процесса алкилирования оказалась их очень быстрая дезактивация, которую чаще всего связывают с побочным образованием высокомолекулярных углеводородов, блокирующих пористую структуру и поверхностные активные центры. Также реакция алкилирования с использованием твердокислотных катализаторов ведется при температурах значительно больших, чем с применением жидких кислот, а это ведет к условиям термодинамического равновесия. Чтобы выяснить, возможно ли селективное ведение процесса в данных условиях, необходимы данные о равновесных степенях превращения реакции алкилирования и изомеризации. В данной работе был проведен термодинамический расчет равновесной смеси октана и его изомеров [1].
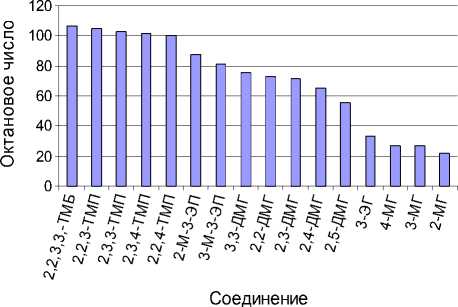
Рис. 1. Октановые числа соединений C8H18
Связь между структурой углеводородов и их антидетонационными свойствами установлена в 1921 г. Риккардо, который определил толуоловые числа для 13 индивидуальных углеводородов и отметил некоторые закономерности влияния химического строения углеводородов на их детонационную стойкость. В 1934 г. были опубликованы данные об антидетонационных свойствах 171 индивидуального углеводорода, а в 1938 г. в американском Нефтяном институте была определена детонационная стойкость 325 углеводородов различного строения. Накопленный к настоящему времени экспериментальный материал (использованы данные [2]) (рис 1) позволяет выявить некоторые закономерности.
Октан нормального строения имеет наименьшее октановое число, увеличение количества заместителей способствует возрастанию анти-детонационных показателей. Монозамещенные октаны имеют ОЧ в пределах 20-40 пунктов, ди-замещенные соединения – от 55 до 90, причем оно выше у метилэтилзамещенных. Тризамещен-ные структуры имеют антидетонационные показатели в интервале 100-103. Самое большое значение имеет тетраметилбутан – порядка 106 пунктов. В настоящее время в мире спросом пользуются бензины, у которых октановое число не менее 95 пунктов. Такое топливо имеет большую детонационную стойкость и при сжатии не самовоспламеняется. Данным требованиям соответствуют три- и тетразамещенные октаны, именно на их получение направлен процесс алкилирования изобутана.
В промышленности реакцию алкилирования изопарафинов олефинами ведут преимущественно на серной и фтороводородной кислоте. Ведутся активные разработки алкилирования на твердокислотных катализаторах в условиях, близких к критическим. Для случая образования 2,2,4-триметилпентана при атмосферном давлении из изобутана и изобутилена (для газообразных продуктов) Парксом и Тоддом было предложено выражение:
Δz0= –18350+39,1∙T;
где Δz0 – изменение свободной энергии системы при стандартных условиях, кал/моль.
Если при выбранной температуре свободная энергия системы равна нулю или отрицательной величине, то реакция в этих условиях вероятна, при положительных значениях свободной энергии реакция не может быть осуществлена в желаемом направлении. Анализ его показывает, что Δz0 становится равным нулю при температуре 470К (197оС). Это максимальная температура, при которой еще имеется минимальная вероятность осуществления реакции алкилирования. Реакция протекает в области низких температур, и вероятность ее протекания тем больше, чем ниже температура по сравнению со 197оС. Глубина превращения в продукты алкилирования для этих реакций равна 100% лишь при комнатной температуре (20-30оС). Верхний температурный предел, при котором величина изменения свободной энергии реакции алкилирования изобутана бутиленами равна нулю (т.е. максимальная температура, при которой реакция еще вероятна), при атмосферном давлении колеблется от 184 до 295оС. Исключение составляет реакция алкилирования изобутана изобутиленами с получением 2,2,3,3-тетраметил-бутана, для которой эта величина близка к 140оС.
Повышение давления способствует повышению верхнего температурного предела вероятности протекания реакций алкилирования, особенно при давлении от 1 до 10 ат. Термодинамические расчеты показывают, что алкилирование чистого изобутана изобутиленом в соотношении 4:1 может протекать со 100% превращением олефина в алкилат при температурах до 100оС. С возрастанием давления предельная температура повышается (при 10 атм. до 150оС, при 50 атм. до 200оС) [3].
Реакция алкилирования изопарафинов олефинами экзотермична. Установленное экспериментально значение теплового эффекта реакции алкилирования изобутана изобутиленом при мольном соотношении 3:1 составляет 67 кДж/моль [3]. Несмотря на то, что алкилирование н-бутана и изобутана термодинамически равновероятно, в реакцию кислотно-каталитического алкилирования вступают только изопарафины, имеющие третичный атом углерода. При сернокислотном алкилировании, которое обычно протекает при низких температурах, изменение давления не оказывает существенного влияния на реакцию. При сернокислотном алкилировании повышение температуры более 15оС сильно ускоряет реакции окисления и сульфатирования, увеличивая расход кислоты. Снижение температуры ниже 5оС сильно увеличивает вязкость кислоты, затрудняя создание эмульсии [3].
Отношение изобутан: олефин является одним из важнейших параметров в процессе алкилирования. Избыток изобутана в углеводородной фазе способствует протеканию первичных реакций с изобутаном и подавляет полимеризацию олефина и другие побочные реакции, которые ведут к снижению качества получаемого алкилата. При производстве компонента высокооктанового бензина молярное отношение изобутан: олефин поддерживают в пределах от 3:1 до 10:1, компонента авиационного бензина от 5:1 до 10:1 для достижения более высоких выходов и повышения качества компонентов [3], [4].
В программе GaussView были построены модели молекул октана и его изомеров. Затем в оболочке программы выбраны методы расчета свойств соединений. В работе использовались «Методы полного базиса» 3-21G Hartree-Fock, 6311-G Hartree-Fock, и методы теории функционала электронной плотности – DFT (density functional theory): 6311-G B3LYP DFT. «Методы полного базиса» используют набор различных методов для повышения точности расчетов. Каждый из методов применяется для расчета какой-то определенной поправки к исходной хартри-фоковской энергии. Методы DFT рассматривают зависимость свойств системы от ее электронной плотности. Как правило, больший базис означает более точные вычисления. Расчет энергии молекулы производился в программе Gaussian 03W. В выходном файле программы содержались данные по расчету энергии энтальпии молекулы, которые используются для подсчета константы равновесия. Энтропия соединений была рассчитана на базе программы Entropy 1.5 и PCModel.
Таблица 1. Данные об энтальпии и энтропии соединений октана и его изомеров
|
Т, К |
So |
ΔfHo |
ΔrHo |
ΔrSo |
Kp |
xi |
|
200,00 |
360,08 |
-209,4 |
-14,7 |
-41,9 |
44,62 |
0,0834 |
|
298,15 |
423,09 |
-224,0 |
-15,2 |
-44,3 |
2,24 |
0,0524 |
|
300,00 |
424,22 |
-224,2 |
-15,2 |
-44,3 |
2,16 |
0,0506 |
|
400,00 |
482,43 |
-236,8 |
-14,9 |
-43,4 |
0,48 |
0,0310 |
|
500,00 |
546,35 |
-246,8 |
-14,3 |
-42,1 |
0,20 |
0,0208 |
|
600,00 |
603,30 |
-254,3 |
-13,6 |
-41,0 |
0,11 |
0,0147 |
|
700,00 |
658,10 |
-259,5 |
-12,6 |
-39,4 |
0,08 |
0,0121 |
|
800,00 |
709,60 |
262,6 |
-11,4 |
-37,7 |
0,06 |
0,0099 |
|
900,00 |
759,00 |
-264,2 |
-9,7 |
-35,1 |
0,05 |
0,0096 |
|
1000,00 |
805,40 |
-263,9 |
-7,6 |
-33,1 |
0,05 |
0,0086 |
Примечание: Т - температура реакции, К; So - Энтропия индивидуального соединения, Дж/моль К; AfHo -энтальпия индивидуального соединения, кДж/моль; ΔrHo – энтальпия реакции образования соединения, кДж/моль; ΔrSo – энтропия реакции образования соединения, Дж/моль К; Kp – константа реакции образования вещества; xi – равновесная концентрация вещества
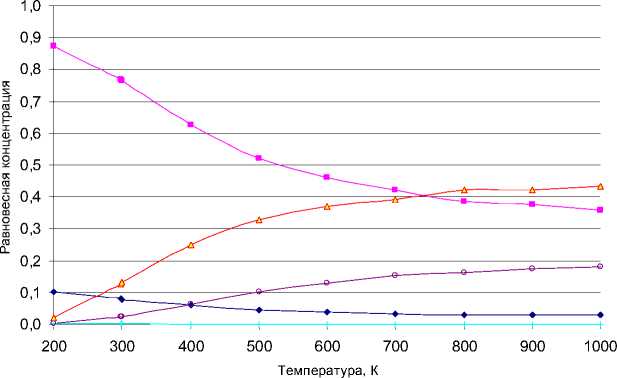
Рис. 2. Диаграмма зависимости равновесных концентраций структур С8Н18 от температуры при газофазном ведении процесса: ■ – сумма диалкан замещенных, ▲- сумма моноалкан замещенных, ♦ - сумма триалкан замещенных, ° - н-октан, + - 2,2,3,3-тетраметилбутан
В результате были получены данные об энтальпии и энтропии индивидуальных веществ, на основе которых вычисляются энтальпия, энтропия реакции изомеризации и константы равновесия соединений октана и его изомеров, например, изооктана (см. табл. 1). На основании полученных данных построен график зависимости равновесных концентраций структур С8Н18 от температуры (рис. 2).
Из графика видно, что концентрация высокооктановых компонентов в равновесных условиях при газофазном ведении процесса незначительна, но высоко содержание дизамещен-ных с меньшим октановым числом. При увеличении температуры растет число моно-замещенных и снижается концентрация ди- и тризаме-щенных, что, соответственно, понижает ОЧ смеси. Причем даже при невысоких температурах образуется смесь с низким качеством, не отвечающая современным требованиям. При увеличении температуры алкилирования наблюдается снижение октанового числа алкилата.
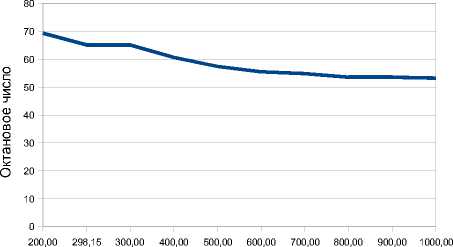
Температура,К
Рис. 3. График зависимости октанового числа равновесной смеси от температуры, К: – ИОЧ
Экспериментальная часть. Условия эксперимента. Нами были проведены 2 эксперимента изомеризации изооктана с чистотой 99,7% масс.:
-
1) катализатор AlCl 3, теплоноситель изопропиловый спирт с температурой кипения 355 К. Эксперимент проводился без инициатора продолжительностью 540 мин.
-
2) катализатор AlCl 3, теплоноситель изопропиловый спирт с температурой кипения 355 К. Эксперимент проводился с инициатором – октен-1 в концентрации 5% масс. на изооктан продолжительностью 210 мин.
Обсуждение результатов. Полученные результаты показаны на рис. 4. Видно, что за время проведения эксперимента концентрация изооктана в смеси изомеров снижается, причем тенденция понижения концентрации выше с инициатором, чем без него. Это влечет за собой снижение октанового числа и понижение качества бензина. С увеличением времени контакта увеличивается количество побочных веществ, образующихся в результате деструкции и уплотнения углеводородов смеси. Это снижает качество получаемого алкилата. Например, легкие углеводороды, выходящие за минимум температуры начала кипения смеси бензинов, уменьшают давление насыщенных паров, что влечет образование паровых пробок, а также возможные потери при хранении и опасность возгорания. Чем выше давление насыщенных паров, тем больше опасность образования паровых пробок при работе двигателя, но тем лучше пусковые свойства бензина.
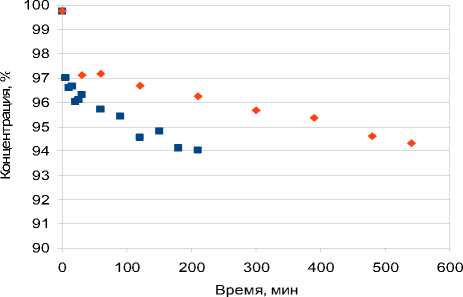
Рис. 4. Изменение концентрации изооктана в смеси изомеров: ■ – с инициатором, ♦ - без инициатора
На рис. 5 представлено изменение концентрации изооктана во всей реакционной среде. Даже без инициатора изооктан сильно снижает свои показатели: за первые 30 минут, его концентрация понижается на 10 пунктов, а через 480 минут – на 15. За 5 минут эксперимента с инициатором (октен-1) концентрация основного компонента снизилась до 84% и далее, на каждые 30 минут, понижалась от 1 до 3%. В итоге она составила 70% - качество бензина оставляет желать лучшего.
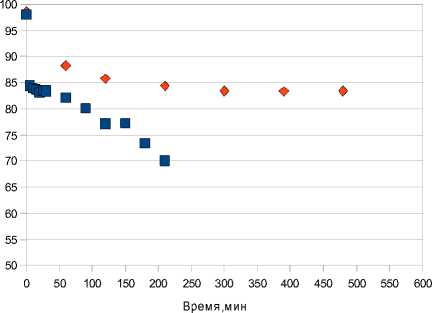
Рис. 5. Изменение концентрации изооктана в реакционной массе: ■ – с инициатором, ♦ - без инициатора
На что же расходуется изооктан? Происходит процесс не только изомеризации, но и деструкции и уплотнения углеводородов. На рис. 6 отражено накопление тяжелых углеводородов в смеси. За время эксперимента без инициатора (540 мин) концентрация тяжелых компонентов увеличилось на 7%, а с инициатором на 17% (240 мин). Из графика видно, что зависимость почти линейная. С увеличением количества смолистых компонентов повышаются энергозатраты, снижается качество бензина, катализатор процесса дезактивируется.
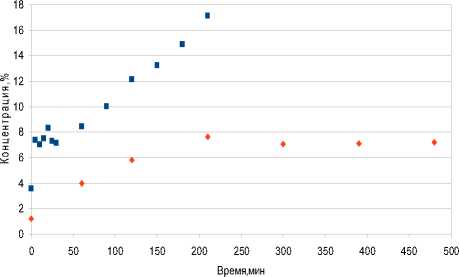
Рис. 6. Выход продуктов уплотнения углеводородов: ■ – с инициатором, ♦ - без инициатора
Выводы: расчетом установлено, что процесс алкилирования невыгодно вести вблизи равновесия, при выборе твердокислотных катализаторов нужно выбирать те, которые селективно работают в условиях далеких от равновесия. Проведенный эксперимент показал, что с увеличением времени контакта увеличивается число образующихся побочных продуктов реакции, что ведет за собой снижение концентрации целевых продуктов реакции алкилирования три-метилпентанов.
Список литературы Алкилирование изобутана бутиленом в равновесных условиях
- Группа разработчиков присадок к топливам [электронный ресурс]. www.additive. spb.ru/antidet-copm.html
- Лавренов, А.В. Алкилирование изобутана бутенами на цирконийсульфатных катализаторах -Томск: Сибирское отделение Российской академии наук, 2004. 263 с.
- Дорогочийский, А.З. Сернокислотное алкилиро вание изопарафинов олефинами/А.З. Дорогочий ский, А.В. Лютер, Е.Г. Вольпова. -М.: Наука, 1970. 216 с.
- Алкилирование. Исследования и промышленное оформление процесса./Под ред. Олбрайт Л.Ф. и Голдсби А.Р. -М.: Химия, 1982. 336 с.


