Алкилпирокатехины: подходы к синтезу и антирадикальные свойства
Автор: Ягунов Семен Евгеньевич, Хольшин Сергей Викторович, Кандалинцева Наталья Валерьевна
Журнал: Science for Education Today @sciforedu
Рубрика: Биологические, химические, медицинские науки
Статья в выпуске: 5 (15), 2013 года.
Бесплатный доступ
В настоящее время в литературе отсутствуют надежные данные о зависимости антиоксидантных свойств от строения в рядах многоатомных фенолов. В данной работе авторами c использованием различных подходов осуществлен синтез структурно-связанного ряда алкилированных производных пирокатехина. Проведена оценка антирадикальных свойств синтезированных 4-алкил- и 3,5-диалкилпирокатехинов в модельной реакции AIBN-инициированного окисления стирола при 50°С. Полученные данные с одной стороны имеют фундаментальное значение, а с другой, представляют интерес для разработки новых ингибиторов окисления.
Фенольные антиоксиданты, алкилпирокатехины, антиоксидантная активность
Короткий адрес: https://sciup.org/147137499
IDR: 147137499 | УДК: 547.56
Текст научной статьи Алкилпирокатехины: подходы к синтезу и антирадикальные свойства
Среди различных направлений исследований в области синтетических фенольных антиоксидантов наибольшее распространение получили работы, связанные с синтезом и изучением активности пространственно затрудненных одноатомных фенолов. В простых модельных системах противоокислительные свойства таких соединений различной структуры исследованы достаточно подробно, и многие исследователи полагают, что эффективность лучших из известных антиоксидантов данного класса близка к теоретическому пределу и продолжение поиска новых более эффективных ингибиторов в пределах данного класса соединений является малоперспективным.
* Статья подготовлена по результатам работы Международной научно-практической конференции «Свободные радикалы и антиоксиданты в химии, биологии и медицине» (1-4 октября 2013 г.) в рамках реализации Программы стратегического развития ФГБОУ ВПО «Новосибирский государственный педагогический университет» на 2012–2016 гг.

5(15) 2013
ISSN 2226-3365
В этой связи несомненный интерес представляют немногочисленные работы, посвященные производным других ароматических спиртов, в частности пирокатехина [1].
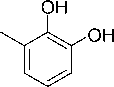
Наличие двух фенольных ОН-групп в соседних положениях в структуре пирокатехинового фрагмента приводит к образованию внутримолекулярной водородной связи, за счет которой происходит ослабление одной из связей О-Н, что приводит к резкому увеличению константы скорости взаимодействия с пероксидными радикалами в сравнении фенолом и другими двухатомными ароматическими спиртами. Было показано, что данное преимущество сохраняется для ди- трет -бутилзамещенных пирокатехинов: так, 3,5- и 3,6-ди- трет -бутилпирокатехины по константе скорости взаимодействия с пероксидными радикалами значительно превосходят ди- трет -бутилзамещенные фенолы и приближаются к токоферолам [2]. Пирокатехины также способны к образованию хелатных комплексов с катионами металлов переменной валентности. Другой особенностью пирокатехинов является низкая устойчивость орто -хиноны, образующиеся при их окислении, что обуславливает высокую активность последних в отношении алкильных радикалов, а также – дополнительную возможность регенерации активных фенольных ОН-групп по реакциям образования полиядерных полифенолов. Как следствие, пирокатехины обычно характеризуются более высокими коэффициентами ингибирования ( f = 3–4), нежели алкилзамещенные одноатомные фенолы ( f ≤ 2) [3].
Таким образом, алкилпирокатехины являются перспективным объектом для разработки на их основе новых антиоксидантных препаратов. Однако, данный класс соединений не являются доступным сырьем – особенности строения пирокатехина делают классические способы получения пространственно-затрудненных фенолов мало приемлемы для получения алкилпирокатехинов. В этой связи в настоящей работе реализованы различные подходы синтеза алкилпирокатехинов, с целью получения структурно-связанного ряда производных и изучения закономерностей изменения антиоксидантных свойств.
Алкилированием пирокатехина с высокими выходами удается получать лишь 3,5-ди- трет -бутил- и 3,5-диизопропилпи-рокатехины. В качестве алкилирующих агентов используются спирты в присутствии конц. H 2 SO 4 . С третичными спиртами реакция протекает при комнатной температуре, вторичные спирты реагируют в более жестких условиях [4].
OH
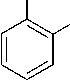
OH
OH
ROH
H 2 SO 4 rt or Δ
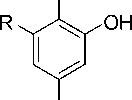
R
R= i-Pr, t-Bu
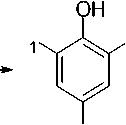
Использование данной стратегии для синтеза производных с меньшими алкильными заместителями или различными заместителями в положениях 3,5 не возможно. В этой связи для получения таких производных нами была реализована многостадийная схема синтеза предполагающая получение алкилпирокатехинов на основе соответствующим образом алкилированных фенолов введением дополнительной ОН-группы. Целевые соединения получали через промежуточный синтез 2-бром- и 2-этоксифенолов.
Все права защищены

5(15) 2013
ISSN 2226-3365
R 1
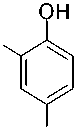
R 2
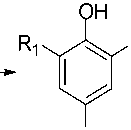
Br
R 2
1a-d
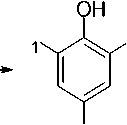
R 1
OEt
R 2
2a-d
R 1
OH
R 2
3a,b,d
R 1
R 2
|
a |
b |
c |
d |
|
H |
Me |
t-Bu |
Me |
|
Me |
Me |
Me |
t-Bu |
Бромфенолы 1a-d с высокими выходами получали взаимодействием соответствующих фенолов с бромом при комнатной температуре в среде CCl 4 . Взаимодействием бромфенолов 1a-d с этилатом натрия по Ульману с высокими выходами были получены соединения 3a-c. Данное превращение проводили в среде EtOH с добавками DMF и TMEDA для увеличения растворимости соединений CuI, что позвол-
В свою очередь изомерный этоксифенол
2d в аналогичных условиях не подвергался
де- трет -бутилированию и с высоким
выходом давал целевой 3-метил-5-трет-
бутилпирокатехин 3d .
2d
ило смягчить условия реакции и увеличить селективность ее протекания [5]. Производные 2a-d получены с выходами 93–99 %. Превращение 2-этоксифенолов в соответст-
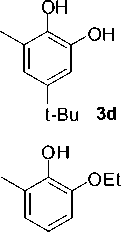

Таким образом нами был осуществлен
вующие пирокатехины осуществляли кипячением в конц. HBr. Стоит отметить, что этоксифенол 2с в используемых условиях наряду с О-дезалкилированием подвергался де-трет-бутилированию. Согласно данным ГЖХ скорости С- и О-дезалкилирования близки и промежуточные продукты
присутствуют в системе в сопоставимых
концентрациях, в системе накапливается продукт С- и О-дезалкилирования – пирокатехин 3а , таким образом данный путь
неприемлем для получения пирокатехина 3с .
2c

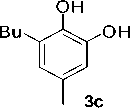
OEt
синтез структурно связанного ряда алкилпирокатехинов. Изучение антирадикальных свойств синтезированных соединений проводили в модельной реакции AIBN-инициированного окисления стирола при 50°C. В качестве реперного антиоксиданта был использован α-токоферол. Антирадикальную активность исследованных соединений характеризовали по величинам констант скоростей их взаимодействия с полипероксидными радикалами стирола (k).
. _. . • к •
ArOH + ROO ArO + ROOH
Начальные участки кинетических


OH
OH
кривых поглощения кислорода в условиях инициированного AIBN окисления стирола в
присутствии исследуемых веществ хорошо
спрямлялись в координатах уравнения
£[£2] [ДН]
-М1-Э
Все права защищены

5(15) 2013
ISSN 2226-3365
где Δ[O 2 ] – количество поглощенного кислорода, отнесенное к объему пробы; [RH] – концентрация окисляемого субстрата в пробе; k и k 1 – константы скорости реакции пероксидных радикалов с молекулами ингибитора и окисляемого субстрата соответственно; τ – период индукции; t – время.
По тангенсам углов наклона прямых в координатах Δ[O 2 ] / [RH] от –ln(1–t/τ) находили отношение k 1 /k . Абсолютные значения константы k вычисляли с использованием известного значения k 1 (107.7 л ∙ моль-1 ∙ с-1 [6]). Найденные нами значения констант k (с доверительным интервалом) приведены в таблице 1.
Таблица 1.
Значения констант скорости k взаимодействия ингибиторов с полипероксидными радикалами стирола при 50°C и число цепей обрываемых на одной молекуле ингибитора f.
|
Структура |
k ∙ 10-6 / л ∙ моль-1 ∙ с-1 |
f |
|
OH OH |
0.5±0.1 |
2.08 |
|
OH OH |
0.6±0.1 |
2.10 |
|
OH OH |
1.6±0.3 |
2.05 |
|
OH i-Pr OH i-Pr |
1.3±0.2 |
2.12 |
|
OH t-Bu OH t-Bu |
2.2±0.3 |
2.10 |
|
α-токоферол |
3.0±0.5 |
2.00 |
Установлено, что пирокатехины не имеющие алкильного заместителя в положении 3 в 2,5–3 раза уступают 3,5-диалкилпирокатехинам по величине константы k. Диметил- и диизопропилпирокатехины характеризовались близкими значениями константы k, в то время как для 3,5-ди-трет-бутилпирокатехина константа k принимала более высокие значения. Данная зависимость коренным образом отличается от закономерностей наблюдаемых для 2,6-
Все права защищены

5(15) 2013
ISSN 2226-3365
диалкилфенолов, где наибольшими значениями k характеризуются производные 2,6-диметилфенола. Так, для 2,4,6-триметилфенола величина k практически на порядок выше чем для ионола.
Таким образом, в рамках данной работы были предложены и успешно апробированы пути синтеза алкилированых производных пирокатехина на основе доступных алкилфенолов и пирокатехина. Определены кинетические параметры ингибирования AIBN-инициированного окисления стирола синтезированными соединениями. Выявлены предварительные данные о зависимости антирадикальной активности алкилпирокатехинов от структуры.
Экспериментальная часть
В работе были использованы коммерчески доступные реагенты и растворители (ABCR, Merck, Sigma-Aldrich, Reanal, Реахим). Растворители перед использованием очищали по стандартным методикам. 3,5-Ди- трет -бутилпирокатехин и 3,5-диизопропилпирокатехин получали по методикам описанным в работе [4].
Спектры ЯМР 1H записаны на приборе «Bruker AV-600», с рабочей частотой 600 МГц, растворитель CDCl 3 , стандарт CHCl 3 (δ 7.24 м.д.). ГХЖ анализ проводили на хроматографе Agilent 7820A, колонка – HP-5, 30 м х 0.32 мм, газ-носитель – азот. ВЭЖХ анализ проводили на приборе Agilent Infinity 1220, колонка – ZORBAX SB-C18, 5мкм, 4.6 мм х 150 мм. ТСХ осуществляли на пластинках Silufol (UV 254). Температуры плавления определяли в капилляре на приборе ПТП (ПО «Химлаборприбор», Россия).
В кинетических исследованиях использовали коммерческий α-токоферол («Acros Organics»). Величины k определяли в
Кинетику поглощения кислорода изучали с использованием высокочувствительного капиллярного волюмометра. Период индукции (τ) определяли как точку пересечения двух касательных проведенных к кинетической кривой, тангенсы углов наклона которых составляют 0.5 и 0.75 от тангенса угла наклона прямой неингибированной реакции.
Скорость инициирования ( W i ) определяли методом ингибиторов по времени окончания периода индукции окисления стирола в присутствии α-токоферола
Wi = 2[ArOH]о / τ где [ArOH]о – начальная концентрация ингибитора.
Эксперименты по окислению стирола проводили при W i = (1.9–2.1) ∙ 10-7 М∙с-1 и [ArOH] = (1.2-1.8) ∙ 10-4 М.
2-Бром-4-метилфенол (1a). К раствору пара -крезола (50 г, 462.36 ммоля) в 150 мл CCl 4 при перемешивании по каплям прибавляли раствор брома (77.59 г, 485.48 ммоля) в 100 мл CCl 4 (весь объем за 4 часа). Затем смесь выдержали при комнатной температуре 1 час, прибавили 100 мл 10%-ного водного раствора Na 2 SO 3 . Органический слой отделили, водную фазу обработали хлороформом (2х50 мл), органические фазы объединили, промыли водой, высушили над Na 2 SO 4 , растворитель отогнали, остаток 87.85 г (содержание основного вещества (СОВ) 86% по ГЖХ), перегнали в вакууме, получили 73.38 г (85%) продукта, т.кип. = 51-55°С (1 Торр). Найдено (%): C, 44.63; H, 3.89; C 7 H 7 BrO; Вычислено (%): C, 44.95; H, 3.77. Спектр ЯМР 1H (δ, м.д., J /Гц): 2.27 c (3 H, ArCH 3 ); 5.24 c (1 H, ArOH); 6.86 д (1 H, ArH,
Все права защищены

5(15) 2013
ISSN 2226-3365
J =7.8); 6.96 дд (1 H, ArH, J =8.4, J =1.8); 7.22 д (1 H, ArH).
Аналогично 1a получали соединения 1b-d .
2-Бром-4,6-диметилфенол (1b). Выход 93%, т.кип. = 60-65°С (1 Торр). Найдено (%): C, 47.51; H, 4.40; C 8 H 9 BrO; Вычислено (%):C, 47.79; H, 4.51. Спектр ЯМР 1H (δ, м.д., J /Гц): 2.30 c (3 H, ArCH 3 ); 2.60 c (3 H, ArCH 3 ); 5.40 c (1 H, ArOH); 6.86 д (1 H, ArH); 7.10 c (1 H, ArH).
2-Бром-4-метил-6- трет -бутилфенол (1c). Выход 92%, т.кип. = 80-83°С (1 Торр). Найдено (%): C, 54.20; H, 6.05; C 11 H 15 BrO; Вычислено (%): C, 54.34; H, 6.22. Спектр ЯМР 1H (δ, м.д., J /Гц): 1.39 c (9 H, Ar- t -Bu); 2.27 с (3 Н, ArCH 3 ); 5.58 c (1 H, ArOH); 6.95 д (1 H, ArH); 7.11 д (1 H, ArH).
2-Бром-4- трет -бутил-6-метилфенол (1d). Выход 96%, т пл. = 45-47°С, т.кип. = 88-92°С (1 Торр). Найдено (%): C, 54.52; H, 6.03; C 11 H 15 BrO; Вычислено (%):C, 54.34; H, 6.22. Спектр ЯМР 1H (δ, м.д., J /Гц): 1.28 c (9 H, Ar- t -Bu); 2.27 с (3 Н, ArCH 3 ); 5.29 c (1 H, ArOH); 7.00 д (1 H, ArH); 7.20 д (1H, ArH).
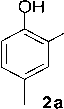
2-Этокси-4-метилфенол (2a). В 340 мл EtOH растворили Na (25.76 г, 1.12 моля), затем прибавили раствор 1a (52.37 г, 0.28 моля), CuI (11.20 г, 58.80 ммоля) и TMEDA (11.39 г, 98.00 ммоля) в 85 мл DMF. Смесь перемешивали 3.5 ч при 80 °С. Затем охладили, прибавили 1120 мл 2 М раствора NH 4 Cl, обработали толуолом (3х200 мл), органическую фазу промыли 2 М раствором NH 4 Cl, насыщенным раствором NaCl, высушили Na 2 SO 4 , растворитель отогнали. Остаток (41.95 г, СОВ 98% по ГЖХ) перегнали в вакууме, получили 36.36 г (85%) продукта в виде смолы, кристаллизующейся при охлаждении, т.пл. = 30-32°С, т.кип. = 72-80°С (1 Торр). Найдено (%): C, 71.28; H, 8.14; C 9 H 12 O 2 ; Вычислено (%): C, 71.03; H, 7.95.
Спектр ЯМР 1H (δ, м.д., J /Гц): 1.45 т (3 H, OCH 2 C H 3 , J =7.2); 2.26 c (3 H, ArCH 3 ); 4.07 к (2 H, OC H 2 CH 3 , J =6.6); 5.30 с (1 H, ArOH); 6.58 м (2 H, ArH); 6.72 д (1 H, ArH, J =7.8).
Аналогично 2a получали соединения 2b-d .
2-Этокси-4,6-диметилфенол (2b).
Выход 90%, т.пл. = 53-55°С, т.кип. = 67-75°С (1 Торр). Найдено (%): C, 71.29; H, 8.13; C 9 H 12 O 2 ; Вычислено (%): C, 71.03; H, 7.95. Спектр ЯМР 1H (δ, м.д., J /Гц): 1.46 т (3 H, OCH 2 C H 3 , J =7.2); 2.19 c (3 H, ArCH 3 ); 2.23 c (3 H, ArCH 3 ); 4.06 к (2 H, OC H 2 CH 3 , J =6.6); 5.37 с (1 H, ArOH); 6.42 д (1 H, ArH, J =8.4); 6.46 д (1H, ArH).
2-Этокси-4-метил-6- трет -бутилфенол (2c). Выход 88%, т.пл. = 45-47°С. Найдено (%): C, 74.80; H, 9.75; C 13 H 20 O 2 ; Вычислено (%): C, 74.96; H, 9.68. Спектр ЯМР 1H (δ, м.д., J /Гц): 1.37 с (9 H, Ar- t -Bu); 1.46 т (3 H, OCH 2 C H 3 , J =7.2); 2.24 c (3 H, ArCH 3 ); 4.07 к (2 H, OC H 2 CH 3 , J =7.2); 5.73 с (1 H, ArOH); 6.46 д (1 H, ArH); 6.57 д (1 H, ArH).
2-Этокси-4- трет -бутил-6-метилфенол (2d). Выход 96%, т.кип. = 85-95°С (1 Торр). Найдено (%): C, 75.10; H, 9.43; C 13 H 20 O 2 ; Вычислено (%): C, 74.96; H, 9.68. Спектр ЯМР 1H (δ, м.д., J /Гц): 1.26 с (9 H, Ar- t -Bu); 1.45 т (3 H, OCH 2 C H 3 , J =7.2); 2.21 c (3 H, ArCH 3 ); 4.09 к (2 H, OC H 2 CH 3 , J =7.2); 5.38 с (1 H, ArOH); 6.63 м (2 H, ArH).
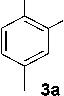
4-Метилпирокатехин (3a). 2a (3.04 г, 20.00 ммоль) кипятили с 12 мл 46 % раствора HBr (0.1 моля) 8 часов. Реакционную массу охладили, обработали толуолом (3х20 мл), органическую фазу промыли насыщенным раствором NaCl, высушили Na 2 SO 4 , растворитель отогнали, остаток перекристаллизовали из толуола, получили 1.79 г (72%) продукта с т.пл. = 67-69°С. Найдено (%): C, 67.45; H, 6.59, C 7 H 8 O 2 ; Вычислено (%): C, 67.73; H, 6.50. Спектр
Все права защищены

5(15) 2013
ISSN 2226-3365
ЯМР 1H (δ, м.д., J /Гц): 2.19 с (3 H, ArCH 3 ); 5.2 уш с (2 H, ArOH); 6.50 дд (1 H, ArH, J =7.2, J =1.8); 6.60 д (1 H, ArH, J =1.8); 6.66 д (1 H, ArH, J =7.2).
Аналогично 3a получали соединения 3b,d .
-
3,5- Диметилпирокатехин (3b). Выход 74%, т.пл. = 67.5-69°С (ср.лит. [7]: 69.5-71°С). Найдено (%): C, 69.36; H, 7.45, C 8 H 10 O 2 ; Вычислено (%): C, 69.54; H, 7.30. Спектр ЯМР 1H (δ, м.д., J /Гц): 2.19 с (6 H, ArCH 3 ); 5.09 уш с (2 H, ArOH); 6.43 д (2 H, ArH).
3-Метил-5- трет -бутилпирокатехин (3d). Выход 73%, т.пл. = 113-115°С. Найдено (%): C, 73.46; H, 8.80, C 11 H 16 O 2 ; Вычислено
(%): C, 73.30; H, 8.95. Спектр ЯМР 1H (δ, м.д., J /Гц): 1.24 с (9 H, Ar- t -Bu); 2.22 с (3 H, ArCH 3 ); 4.88 c (1 H, ArOH); 5.01 c (1 H, ArOH); 6.62 д (1 H, ArH); 6.64 д (1 H, ArH).
Взаимодействие 2-этокси-4-метил-6- трет -бутилфенола с HBr. Этоксифенол 2с (4.17 г, 20.00 ммоль) кипятили с 12 мл 46% раствора HBr (0.1 моля) 10 часов. Реакционную массу охладили, обработали серным эфиром (3х20 мл), органическую фазу промыли насыщенным раствором NaCl, высушили Na 2 SO 4 , растворитель отогнали, остаток перекристаллизовали из толуола, получили 1.16 г (70%) 3a .
Список литературы Алкилпирокатехины: подходы к синтезу и антирадикальные свойства
- Меньщикова Е. Б., Ланкин В. З., Кандалинцева Н. В. Фенольные антиоксиданты в биологии и медицине. -LAMBERT, 2012.
- Окисление, окислительный стресс, антиоксиданты: Всероссийская конференция молодых ученых и школа им. академика Н.М. Эммануэля. Доклады и тезисы. -М.: Изд-во РУДН, 2006. -С.146-147.
- Азатян Н. А., Карпухина Г. В., Белостоцкая И. С., Комиссарова Н. Л. Механизм ингибирования процессов окисления двухатомными фенолами//Нефтехимия. -1973. -№ 3. -С. 435-440.
- Масловская Л. А., Петрикевич Д. К., Тимощук В. А., Шадыро О. И. Синтез и антиокислительные свойства некоторых производных алкилированного пирокатехина//Журнал общей химии. -1996. -№ 11. -С. 1893-1898.
- Yagunov S. E., Kandalintseva N. V., Prosenko A. E. Copper-catalyzed coupling reaction in synthesis of new antioxidants/International Congress on Organic Chemistry. -Kazan, 2011. -September 18-23. -p 199.
- Поздеева Н. Н., Якущенко И. К., Александров А. Л., Денисов Е. Т. Механизм тормозящего действия гидрохинона, краун-гидрохинона и его комплексов с солями лития и магния при окислении стирола//Кинетика и катализ. -Новосибирск, 1991. -№ 6. -С. 1302-1309.
- Weller D. D., Stirchak E. P. Quassinoid Synthesis via o-Quinone Diels-Alder Reactions//J. Org. Chem. -1983. -Vol.48. -N. 25. -pp. 4873-4879.


