Аллельная вариабельность гена ингибитора амилаз AI у сортов и линий картофеля
Автор: Дьяченко Е.А., Кулакова А.В., Мелешин А.А., Кочиева Е.З.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Картофелеводство: наука и технологии
Статья в выпуске: 5 т.54, 2019 года.
Бесплатный доступ
Экономическая эффективность сорта картофеля обусловлена не только урожайностью, но и сохранностью вкусовых качеств в процессе хранения. Хранение клубней картофеля при низких температурах приводит к деградации крахмала и накоплению редуцирующих сахаров, которые при термической обработке ухудшают вкусовые качества, а также участвуют в реакции образования канцерогена акриламида. Крахмал разрушается до более простых соединений гидролитически и фосфолитически. Гидролитическое расщепление крахмала осуществляют гидролазы, в том числе a- и b-амилазы, которые могут проявлять различную активность в зависимости от ткани, типа органа, клеточной локализации, а также вида растения. Активность амилаз регулируется посттрансляционно ингибитором амилаз (AI), который, связываясь с амилазой, блокирует активный сайт фермента либо изменяет его конформацию, тем самым снижая каталитическую активность. Однако, несмотря на важность роли AI, данные о первичной последовательности как гена, так и кодируемого им белка у представителей рода Solanum крайне ограничены. В представляемой работе нами были получены и проанализированы последовательности гена ингибитора амилаз AI у 36 сортов и линий картофеля отечественной и зарубежной селекции. При этом было выявлено два типа кодирующей последовательности длиной 621 и 630 п.н. в зависимости от наличия 9-нуклеотидной вставки GGTGCAWTT в 3´-области. Анализируемый ген характеризовался крайне высоким уровнем полиморфизма: экзонные последовательности содержали 134 SNPs (singe nucleotide polymorphisms) (21,3 %), которые приводили к 69 замещениям аминокислотных остатков в кодируемом белке (33,0 %). Инсерция GAI/F202 в С-терминальной области AI соответствовала 3´-вставке в последовательности гена. Из выявленных 69 замещений аминокислотных остатков только 11 считаются радикальными и могут приводить к изменению конформации белка. Все анализируемые сорта картофеля были гетерозиготными по указанному гену, и поэтому им соответствовало несколько аллельных вариантов гена. Всего мы выявили 70 аллельных вариантов нуклеотидной последовательности и 69 вариантов - аминокислотной. Наибольшее число нуклеотидных замен между аллельными вариантами гена обнаружено у сортов Люкс (18 замен), Ирбитский (17 замен) и Гала (16 замен). При этом наибольшее число замещений аминокислотных остатков в белках, кодируемых аллельными вариантами гена, было найдено у сортов Гала (9 замен) и Горняк (8 замен).
Сорта картофеля, ингибитор амилаз, ген ai, аллельные варианты
Короткий адрес: https://sciup.org/142226265
IDR: 142226265 | УДК: 635.21:577.152.321:577.21 | DOI: 10.15389/agrobiology.2019.5.970rus
Текст научной статьи Аллельная вариабельность гена ингибитора амилаз AI у сортов и линий картофеля
Картофель ( Solanum tuberosum ) занимает одно из лидирующих мест в сельском хозяйстве многих стран как продовольственная, техническая и кормовая культура (1, 2). В Российской Федерации ареал возделывания картофеля охватывает различные климатические зоны от Заполярья до южных границ, а валовой сбор этой культуры составляет около 30 млн т, то есть почти 10 % от мирового производства (380 млн т; данные FAO-STAT за 2017 год). Картофель — один из четырех наиболее важных пищевых источников углеводов после пшеницы, риса и кукурузы, содержит большое количество витаминов и минералов (3-5).
Основная пищевая ценность картофеля определяется содержанием и качественным составом крахмала в клубне. Крахмал состоит из смеси двух гомополисахаридов — линейной амилозы и разветвленного амилопектина, различающихся по структуре и путям биосинтеза. И амилоза, и амилопектин представляют собой α-1,4-глюкановые цепи, при этом амилопектин состоит их коротких цепей, связанных между собой α-1,6-глю-козидными связями в точках ветвления (6-8). Метаболизм крахмала доста-
∗ Работа выполнена при поддержке Министерства науки и высшего образования РФ, ФНТП развития сельского хозяйства РФ на 2017-2025 годы (подпрограмма «Развитие селекции и семеноводства картофеля в Российской Федерации») и гранта РФФИ ¹ 17-29-08017.
точно хорошо изучен. Известно не менее 40 ферментов, участвующих в углеводном обмене в клубнях картофеля и определяющих содержание и состав крахмала и других углеводов (9-13).
В клубнях картофеля содержание крахмала может достигать 25 % (14). После сбора урожая клубни хранятся до нескольких месяцев при низкой температуре (2-4 °С). Воздействие низких температур может вызывать холодовое осахаривание клубней (cold-induced sweetening, CIS), что проявляется в усилении гидролиза крахмала и, как следствие, в накоплении редуцирующих сахаров (15-18). При высокотемпературной термической обработке происходит взаимодействие редуцирующих сахаров с а-ами-нокислотами и образование акриламида, являющегося канцерогеном, а также ухудшаются вкусовые качества (19-21). На процесс холодового осахаривания влияют такие факторы, как зрелость клубней, механические повреждения, биотический и абиотический стресс (20, 22).
Распад крахмала до более простых соединений достигается двумя путями: гидролитическим и фосфолитическим. В первую очередь, за расщепление крахмала отвечают гидролазы, в том числе а-амилазы (alphaamylase, AMY, EC 3.2.1.1) и р-амилазы (beta-amylase, BAM, EC 3.2.1.2) (23, 24). Амилазы представляют собой эндоамилолитические (а-амилазы) и эк-зоамилолитические (р-амилазы) ферменты, которые специфически гидролизуют а-1,4-глюкозидные связи с образованием линейных и разветвленных мальтоолигосахаридов (25, 26).
В настоящее время у растений известно пять изоформ а-амилазы и десять изоформ р-амилазы, которые могут проявлять различную активность в зависимости от ткани, типа органа, клеточной локализации, а также вида растения (26-28). В клубнях картофеля выявлена экспрессия генов девяти амилаз ( StAmy1 , StAmy23 , StBAM1 , StBAM3 , StBAM4 , StBAM5 , StBAM7 , StBAM8 и StBAM9 ), из них только три ( StAmy23 , StBAM1 и StBAM9 ) имеют высокий уровень экспрессии при низкотемпературном хранении (26, 29).
Активность амилаз регулируется посттрансляционно ингибитором амилаз (amylase inhibitor, AI), который связывается с амилазой и блокирует активный сайт фермента, либо изменяет его конформацию, тем самым снижая каталитическую активность (30, 31). У картофеля ген, кодирующий ингибитор амилаз, впервые идентифицирован у вида S. berthaultii ( SbAI ) (32), однако его последовательность не представлена в базе NCBI.
В ряде исследований H. Zhang с соавт. (29, 32, 33) показали, что при низкотемпературном хранении устойчивые к холодовому осахариванию клубни картофеля в сравнении с CIS-чувствительными характеризуются более высокой экспрессией гена SbAI , кроме того, была выявлена отрицательная корреляция между числом транскриптов SbAI и содержанием редуцирующих сахаров. Дальнейшие исследования на трансгенных растениях показали, что при низких температурах подавление гена SbAI в CIS-устойчивых линиях картофеля приводит к росту активности амилаз StAmy23, StBAM1 и StBAM9 и к увеличению количества редуцирующих сахаров в клубнях. В то же время сверхэкспрессия гена SbAI в CIS-чувствительных линиях картофеля при низких температурах вызывала подавление активности этих амилаз (32).
Несмотря на большую значимость ингибиторов амилаз в процессе холодового осахаривания картофеля, сведения о степени вариабельности указанного гена и наличии его возможных аллельных вариантов отсутствуют. Так, база данных GenBank NCBI со- держит информацию о полноразмерном гене AI (JX523608.1) и его мРНК (JX523606.1) только у одного анонимного образца S. tuberosum. Также в этой базе данных имеются последовательности AI других представителей рода So-lanum: S. lycopersicum (XM_004233967.3, CP023759.1, HG975515.1) и S. pennel-lii (HG975442.1, XM_015211800.2).
В настоящей работе мы впервые идентифицировали последовательность гена ингибитора амилаз AI у 36 отечественных и зарубежных сортов и линий картофеля и определили возможные аллельные варианты этого гена и кодируемого им белка.
Целью работы стало определение последовательностей гена ингибитора амилаз ( AI ) и кодируемых им белков у культивируемых сортов и линий картофеля, оценка их генетической вариабельности, а также определение аллельных вариантов гена AI .
Методика. Растительный материал был собран во Всероссийском НИИ картофельного хозяйства им. А.Г. Лорха (Московская обл., Россия). Для проведения сравнительной оценки полиморфизма гена AI в анализ были включены последовательности гена (JX523608.1) и мРНК (JX523606.1) у S. tuberosum , доступные в базе данных GenBank NCBI.
ДНК выделяли из молодых листьев модифицированным калий-ацетатным методом (34).
На основе доступных в GenBank NCBI последовательностей гена AI представителей рода Solanum (JX523608.1, JX523606.1, XM_004233967.3, CP023759.1, HG975515.1, HG975442.1, XM_015211800.2) была разработана система праймеров, позволяющая амплифицировать полноразмерный ген AI (SbaI_F 5´-ACTATGGCTTTTCATTACTCTA-3´; SbaI_R 5´-TTACATCA-AAGAATAGTTGTATAAC-3´) и перекрывающиеся внутренние участки гена (SbaI_in1R 5´-TCGTGAGAATAGTCTCTTGC-3´; SbaI_ex1F 5’-GTAACATG-GCTCGCGTTC-3’; SbaI_ex3F 5´-AACAGAGGCTCCAAGTGC-3´; SbaI_in3R 5´-GGATAGTTTGAGCAACATAACTT-3´). Амплификацию проводили с использованием набора реактивов ЗАО «Диалат ЛТД» (Россия). Реакционная смесь объемом 15 мкл содержала 10½ буфер, 1,5 мкМ MgCl2, 0,2 мМ каждого dNTP, по 0,5 мкМ праймеров SbaI_F и SbaI_R; 0,2 ед. BioTaq ДНК полимеразы (ЗАО «Диалат ЛТД», Россия) и 100 нг геномной ДНК. Реакцию проводили в следующем режиме: денатурация — 40 с при 95 °С; отжиг праймера — 30 с при 54 °С, элонгация ДНК — 2 мин при 72 °С (35 циклов); заключительная элонгация — 7 мин при 72 °С (термоциклер BioRad C1000, «Bio-Rad», США).
Полученные амплификаты длиной около 2 т.п.н. визуализировали в 1 % агарозном геле, вырезали и очищали с помощью набора Zymoclean™ Gel DNA Recovery Kit («Zymo Research», США). При клонировании полноразмерных последовательностей гена AI у анализируемых сортов и линий картофеля использовали набор Quick-TA Kit («Евроген», Россия). Нуклеотидные последовательности фрагментов определяли на автоматическом секвенаторе ABI 310 Сapillary DNA Analyzer («Applied Biosystems», США) (ЦКП «Биоинженерия» РАН).
Выравнивание и анализ полученных последовательностей проводили в программе MEGA 7.0 (35). Возможное влияние аминокислотных замен на структуру и функции белков оценивали с помощью web-сервиса PROVEAN (36).
Результаты. Нуклеотидный полиморфизм гена ингибитора амилаз. Мы амплифицировали и затем клонировали гены ингибитора амилаз ( AI ) у 36 сортов и линий картофеля отечественной и зарубежной 972
селекции (табл. 1). Так как современные сорта картофеля тетраплоидные, для выявления возможных аллельных вариантов гена AI были секвениро-ваны пять клонов каждого анализируемого образца.
В результате для всех анализируемых образцов картофеля была определена полная нуклеотидная последовательность гена AI . Сравнение полученных нуклеотидных последовательностей с доступными в GenBank NCBI данными по генам и мРНК AI выявило их высокую гомологию (> 90 %) у изученных нами образцов и других представителей рода Solanum .
Проведенный анализ экзон-интронной структуры показал, что, как и другие известные гены ингибиторов амилаз растений, все последовательности гена AI S. tuberosum содержали четыре экзона. Длина гена AI анализируемых сортов картофеля варьировала от 1781 п.н. (у сорта Метеор 1) (здесь и далее цифры в названии сорта обозначают номер аллельного варианта) до 1872 п.н. (у сорта Ред Скарлет 2). В изученных последовательностях был выявлен крайне высокий полиморфизм: нуклеотидные последовательности AI содержали 530 вариабельных сайтов (single nucleotide polymorphisms, SNPs), а общая степень полиморфизма составила 27,0 %.
1. Аллельные варианты нуклеотидной последовательности гена AI у изученных сортов и линий картофеля
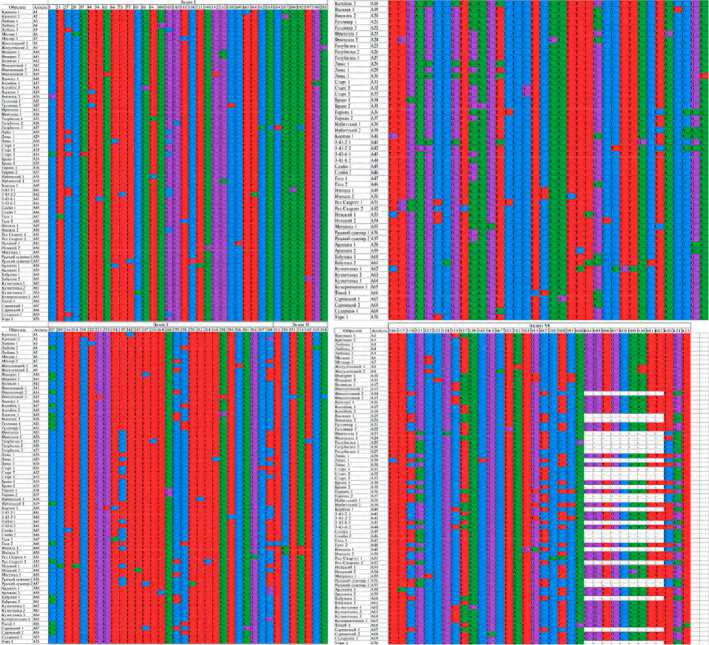
П р и м е ч е н и е. Цифры в названии сорта обозначают номер аллельного варианта. Полностью таблицу см. на сайте
Мы обнаружили два типа экзонных последовательностей с разной протяженностью — 621 и 630 п.н., что обусловлено присутствием у большинства образцов 9-нуклеотидной инсерции (GGTGCAWTT) в 3´-области гена. Следует отметить, что вариабельность последовательности экзонов у изученных нами образцов оказалась неожиданно высокой. В кодирующих последовательностях было обнаружено 134 вариабельных сайта, а степень полиморфизма составила 21,3 %, что значительно выше, чем у других известных генов углеводного обмена. Так, исследования специально выбранного полиморфного фрагмента гена кислой вакуолярной инвертазы Pain-1 (экзон V—стоп-кодон) у сортов S. tuberosum показали, что вариабельность этого участка не превышает 9 % (37, 38). У 192 линий картофеля из Новой Зеландии при анализе генов, ассоциированных с фосфорилированием крахмала, наиболее полиморфным оказался ген α-гликан-Н2О-дики-назы (GWD), вариабельность которого составила < 5 %, полиморфизм же изоформ гена крахмал-синтазы (SS I-III) не превышал 3,4 % (39).
Интроны в изученных последовательностях значительно различались по длине и вариабельности и, помимо большого числа нуклеотидных замен (всего 396), содержали инсерции и делеции. Размер интронных последовательностей гена AI варьировал в пределах от 1151 до 1251 п.н. Наибольшие различия были выявлены в интроне I, который включал протяженные (до 47 п.н.) инсерции. У некоторых сортов в положении 347400 п.н. гена был обнаружен участок, содержащий разные по длине негомологичные инсерции. Последовательности интронов II и III имели делеции, не превышающие 18 н. (например, GATATATTTCTCTY140 6 , GTAT1452), и инсерцию TATACC1298.
Как упоминалось выше, для каждого образца были секвенированы и проанализированы по пять клонов гена AI , что позволило охарактеризовать возможный гомо-/гетерозиготный статус этого гена. Вcе изученные образцы картофеля оказались гетерозиготными по указанному гену и им соответствовали несколько его аллельных вариантов (см. табл. 1)
Проведенный анализ экзонных последовательностей позволил выявить 70 вариантов для 36 сортов и линий. Ранее для полноразмерной кодирующей последовательности гена кислой вакуолярной инвертазы у 19 сортов сообщалось только об 11 аллельных вариантах (37). Примечательно, что в результате исследования мы не выявили аллельного варианта, типичного для группы сортов: все анализируемые образцы характеризовались специфичным аллельным вариантом гена AI . Следует, однако, отметить, что ряд аллельных вариантов отличались друг от друга лишь 1-2 нуклеотидными заменами. Наибольшее число различий по аллельным вариантам имели сорта Люкс (18 SNPs), Ирбитский (17 SNPs) и Гала (16 SNPs). Столь высокая вариабельность генов и большое число аллельных вариантов не совсем типичны для генов растений и в частности для картофеля.
Аминокислотный полиморфизм ингибитора амилаз. Полученные нуклеотидные последовательности гена AI были транслированы. Соответствующие аминокислотные последовательности составили 206 и 209 а.о. Выявленные различия в длине белка обусловливались наличием инсерции GAI/F202 в терминальной области, образованной в результате 3´-вставки GGTGCAWTT. Из 134 экзон-специфичных SNPs 69 приводили к замещению аминокислот, при этом аминокислотный полиморфизм составил 33,0 %. Проведенный PROVEAN-анализ определил, что 11 из 69 замещений являются радикальными и могут влиять на конформацию белка. Таким образом, в результате выполненного исследования было выявлено 69 вариантов аминокислотной последовательности AI, характеристики которых приведены в таблице 2. Наибольшее количество замещений аминокислотных остатков содержали последовательности AI у сортов Гала (9 замещений) и Горняк (8 замещений).
-
2 . Аллельные варианты аминокислотной последовательности ингибитора амилаз у изученных сортов и линий картофеля
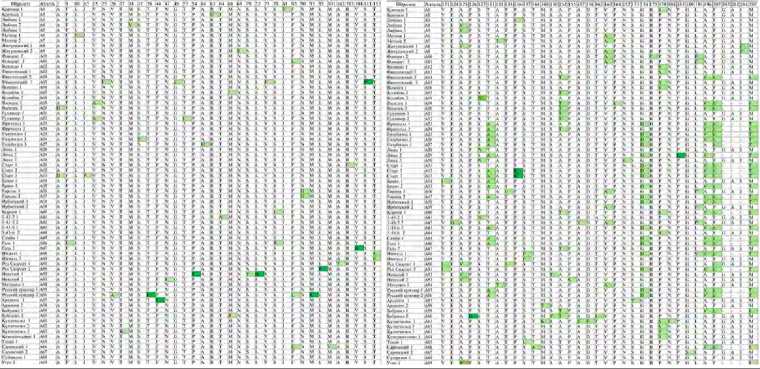
П р и м е ч а н и е. Цифры в названии сорта обозначают номер аллельного варианта. Вариабельные аминокислотные сайты выделены зеленым цветом, из которых радикальные отмечены темно-зеленым цветом. Полностью таблицу см. на сайте
Итак, в представленной работе мы впервые описали последовательность гена ингибитора амилаз AI у 36 культивируемых сортов и линий картофеля, возможные аллельные варианты этого гена и кодируемого им белка . При этом выявлен крайне высокий как нуклеотидный (21,3 %), так и аминокислотный полиморфизм (33,0 %). Однако стоит отметить, что обнаруженные замещения аминокислотных остатков в подавляющем большинстве (58 из 69) нейтральны и теоретически не должны приводить к конформационным изменениям белка. Полученные результаты позволят продолжить поиск корреляции аллельных вариантов гена AI с чувствительностью сортов и линий картофеля к холодовому осахариванию.
Список литературы Аллельная вариабельность гена ингибитора амилаз AI у сортов и линий картофеля
- Devaux A., Kromann P., Ortiz O. Potatoes for sustainable global food security. Potato Research, 2014, 57(3-4): 185-199 ( ). DOI: 10.1007/s11540-014-9265-1
- Chandrasekara A., Kumar T.J. Roots and tuber crops as functional foods: a review on phytochemical constituents and their potential health benefits. International Journal of Food Science, 2016, 2016: Article ID 3631647 ( ). DOI: 10.1155/2016/3631647
- Camire M.E., Kubow S., Donnelly D.J. Potatoes and human health. Critical Reviews in Food Science and Nutrition, 2009, 49(10): 823-840 ( ). DOI: 10.1080/10408390903041996
- Симаков Е.А. Современные тенденции развития селекции на улучшение питательной ценности картофеля. Успехи современной науки, 2017, 2(10): 44-50.
- Robertson T.R., Alzaabi A.Z., Robertson M.D., Fielding B.A. Starchy carbohydrates in a healthy diet: the role of the humble potato. Nutrients, 2018, 10(11): 1764 ( ). DOI: 10.3390/nu10111764
- Streb S., Delatte T., Umhang M., Eicke S., Schorderet M., Reinhardt D., Zeeman S.C. Starch granule biosynthesis in Arabidopsis is abolished by removal of all debranching enzymes but restored by the subsequent removal of an endoamylase. The Plant Cell, 2008, 20(12): 3448-3466 ( ).
- DOI: 10.1105/tpc.108.063487
- Mukerjea R., Sheets R.L., Gray A.N., Robyt J.F. In vitro synthesis of ten starches by potato starch-synthase and starch-branching-enzyme giving different ratios of amylopectin and amylose. Organic Chemistry Current Research, 2015, 4(3): 142 ( ).
- DOI: 10.4172/2161-0401.1000142
- Pfister B., Zeeman S.C. Formation of starch in plant cells. Cellular and Molecular Life Sciences, 2016, 73: 2781-2807 ( ).
- DOI: 10.1007/s00018-016-2250-x
- Tang H., Mitsunaga T., Kawamura Y. Molecular arrangement in blocklets and starch granule architecture. Carbohydate Polymers, 2006, 63(4): 555-560 ( ).
- DOI: 10.1016/j.carbpol.2005.10.016
- Sonnewald U., Kossmann J. Starches-from current models to genetic engineering. Plant Biotechnology Journal, 2013, 11: 223-32 ( ).
- DOI: 10.1111/pbi.12029
- Lloyd J.R., Kossmann J. Transitory and storage starch metabolism: two sides of the same coin? Current Opinion in Biotechnolgy, 2015, 32: 143-148 ( ).
- DOI: 10.1016/j.copbio.2014.11.026
- Orzechowski S. Starch metabolism in leaves. Acta Biochimica Polonica, 2008, 55(3): 435-445.
- Malinova I., Qasim H.M., Brust H., Fettke J. Parameters of starch granule genesis in chloroplasts of Arabidopsis thaliana. Frontiers in Plant Science, 2018, 9: 761 ( ).
- DOI: 10.3389/fpls.2018.00761
- Сорта картофеля российской селекции. Каталог /Под ред. Е.А. Симакова. М., 2018.
- Sowokinos J.R. Biochemical and molecular control of cold-induced sweetening in potatoes. American Journal of Potato Research, 2001, 78: 221-236 ( ).
- DOI: 10.1007/BF02883548
- Shepherd L.V.T., Bradshaw J.E., Dale M.F.B., McNicol J.W., Pont S.D.A., Mottram D.S., Davies H.V. Variation in acrylamide producing potential in potato: segregation of the trait in a breeding population. Food Chemistry, 2010, 123: 568-573 ( ).
- DOI: 10.1016/j.foodchem.2010.04.070
- Chen X., Song B., Liu J., Yang J., He T., Lin Y., Zhang H., Xie C. Modulation of gene expression in cold-induced sweetening resistant potato species Solanum berthaultii exposed to low temperature. Molecular Genetics and Genomics, 2012, 287: 411-421 ( ).
- DOI: 10.1007/s00438-012-0688-6
- Neilson J., Lagüe M., Thomson S., Aurousseau F., Murphy A.M., Bizimungu B., Deveaux V., Bègue Y., Jacobs J.M.E., Tai H.H. Gene expression profiles predictive of cold-induced sweetening in potato. Functional & Integrative Genomics, 2017, 17(4): 459-476 ( ).
- DOI: 10.1007/s10142-017-0549-9
- Tareke E., Rydberg P., Karlsson P., Eriksson S., Törnqvist M. Analysis of acrylamide, a carcinogen formed in heated foodstuffs. Journal of Agricultural and Food Chemistry, 2002, 50(17): 4998-5006 ( ).
- DOI: 10.1021/jf020302f
- Kumar D., Singh B., Kumar P. An overview of the factors affecting sugar content of potatoes. Annals of Applied Biology, 2004, 145: 247-256 ( ).
- DOI: 10.1111/j.1744-7348.2004.tb00380.x
- Halford N., Curtis T., Muttucumaru N., Postles J., Elmore J., Mottram D. The acrylamide problem: a plant and agronomic science issue. Journal of Experimental Botany, 2012, 63(8): 2841-2851 ( ).
- DOI: 10.1093/jxb/ers011
- Zommick D., Knowles L., Pavek M., Knowles N. In-season heat stress compromises postharvest quality and low-temperature sweetening resistance in potato (Solanum tuberosum L.). Planta, 2014, 239: 1243-1263 ( ).
- DOI: 10.1007/s00425-014-2048-8
- Preiss J. Regulation of the biosynthesis and degradation of starch. Annual Review of Plant Biology, 1982, 33(1): 431-454 ( ).
- DOI: 10.1146/annurev.pp.33.060182.002243
- Solomos T., Mattoo A.K. Starch-sugar metabolism in potato (Solanum tuberosum L.) tubers in response to temperature variations. In: Genetic improvement of Solanaceous crops /M.K. Razdan, A.K. Mattoo (eds.). Science Publishers, Plymouth, 2005.
- Wu A.C., Ral J-P., Morell M.K., Gilbert R.G. New perspectives on the role of a-and b-amylases in transient starch synthesis. PLoS ONE, 2014, 9(6): e100498 ( ).
- DOI: 10.1371/journal.pone.0100498
- Hou J., Zhang H., Liu J., Reid S.D., Liu T., Xu S., Tian Z., Sonnewald U., Song B., Xie C. Amylases StAmy23, StBAM1 and StBAM9 regulate cold-induced sweetening of potato tubers in distinct ways. Journal of Experimental Botany, 2017, 68(9): 2317-2331 ( ).
- DOI: 10.1093/jxb/erx076
- Kitajima A., Asatsuma S., Okada H., Hamada Y., Kaneko K., Nanjo Y., Kawagoe Y., Toyooka K., Matsuoka K., Takeuchi M., Nakano A., Mitsui T. The rice alpha-amylase glycoprotein is targeted from the Golgi apparatus through the secretory pathway to the plastids. The Plant Cell, 2009, 21(9): 2844-2858 ( ).
- DOI: 10.1105/tpc.109.068288
- Van Harsselaar J.K., Lorenz J., Senning M., Sonnewald U., Sonnewald S. Genome-wide analysis of starch metabolism genes in potato (Solanum tuberosum L.). BMC Genomics, 2017, 18(1): 37 ( ).
- DOI: 10.1186/s12864-016-3381-z
- Zhang H., Hou J., Liu J., Xie C., Song B. Amylase analysis in potato starch degradation during cold storage and sprouting. Potato Research, 2014, 57(1): 47-58 ( ).
- DOI: 10.1007/s11540-014-9252-6
- Barbosa A.E., Albuquerque E.V., Silva M.C.M., Souza D.S., Silva M.C., Oliveira-Neto O.B., Valencia A., Rocha T.L., Grossi-de-Sa M.F. Alpha-Amylase inhibitor-1 gene from Phaseolus vulgaris expressed in Coffea arabica plants inhibits alpha-amylases from the coffee berry borer pes. BMC Biotechnology, 2010, 10: 44-51 ( ).
- DOI: 10.1186/1472-6750-10-44
- Mckenzie M.J., Chen R.K., Harris J.C., Ashworth M.J., Brummell D.A. Post-translational regulation of acid invertase activity by vacuolar invertase inhibitor affects resistance to cold-induced sweetening of potato tubers. Plant Cell and Environment, 2013, 36: 176-185 ( ).
- DOI: 10.1111/j.1365-3040.2012.02565.x
- Zhang H., Liu J., Hou J., Yao Y., Lin Y., Ou Y., Song B., Xie C. The potato amylase inhibitor gene SbAI regulates cold-induced sweetening in potato tubers by modulating amylase activity. Plant Biotechnology Journal, 2014, 12(7): 984-993 ( ).
- DOI: 10.1111/pbi.12221
- Zhang H., Liu X., Liu J., Ou Y., Lin Y., Li M., Song B., Xie C. A novel RING finger gene, SbRFP1, increases resistance to cold-induced sweetening of potato tubers. FEBS Letters, 2013, 587: 749-755 ( ).
- DOI: 10.1016/j.febslet.2013.01.066
- Дьяченко Е.А., Слугина М.А. Внутривидовой полиморфизм гена сахарозосинтазы Sus1у образцов Pisum sativum L. Вавиловский журнал генетики и селекции, 2018, 22(1): 108-114 ( ).
- DOI: 10.18699/VJ18.338
- Kumar S., Stecher G., Tamura K. MEGA7: Molecular Evolutionary Genetics Analysis version 7.0 for bigger datasets. Molecular Biology and Evolution, 2016, 33(7): 1870-1874 ( ).
- DOI: 10.1093/molbev/msw054
- Choi Y., Sims G.E., Murphy S., Miller J.R., Chan A.P. Predicting the functional effect of amino acid substitutions and indels. PLoS ONE, 2012, 7(10): e46688 ( ).
- DOI: 10.1371/journal.pone.0046688
- Draffehn А., Meller S., Li L., Gebhardt C. Natural diversity of potato (Solanum tuberosum) invertases. BMC Plant Biology, 2010, 10: 271 ( ).
- DOI: 10.1186/1471-2229-10-271
- Слугина М.А., Шмелькова Е.О., Мелешин А.А., Кочиева Е.З. Аллельный полиморфизм фрагмента гена кислой вакуолярной инвертазы Pain-1 у сортов и линий картофеля Solanum tuberosum L. Сельскохозяйственная биология, 2018, 53(1): 132-139 ( ).
- DOI: 10.15389/agrobiology.2018.1.132rus
- Carpenter M.A., Joyce N.I., Genet R.A., Cooper R.D., Murray S.R., Noble A.D., Butler R.C., Timmerman-Vaughan G.M. Starch phosphorylation in potato tubers is influenced by allelic variation in the genes encoding glucan water dikinase, starch branching enzymes I and II, and starch synthase III. Frontiers in Plant Science, 2015, 6: 143 ( ).
- DOI: 10.3389/fpls.2015.00143


